杂交瘤细胞、洋葱黄矮病毒抗体及其应用、ELISA检测试剂盒和ELISA检测方法
杂交瘤细胞、洋葱黄矮病毒抗体及其应用、elisa检测试剂盒和elisa检测方法
技术领域
1.本发明涉及生物技术领域,尤其是涉及杂交瘤细胞、洋葱黄矮病毒抗体及其应用、elisa检测试剂盒和elisa检测方法。
背景技术:
2.洋葱黄矮病毒(onion yellow dwarf virus,oydv)隶属于马铃薯y病毒属,是导致大葱、洋葱、蒜、韭菜等葱属植物病害的主要病毒之一,该病毒于1929年在美国的洋葱中首次被发现。oydv基因组全长约为10.5千nt左右,核酸分子为正义单链rna,含1个大的开放阅读框,编码多聚蛋白,通过蛋白酶裂解成10个成熟蛋白,从n端到c端依次为p1、hc-pro、p3、6k1、ci、6k2、nia-vpg、nia-pro、nib和cp。其中衣壳蛋白(coat protein,cp)是唯一的结构蛋白,前人研究发现,cp主要参与病毒包装、症状表现和细胞间长距离运输,也是检验和检疫的主要靶标。
3.分蘖洋葱(allium cepa var.aggregatum),又名株葱,俗称毛葱、鬼子葱,为百合科葱属植物,是北方的1种特色经济作物,具有重要的经济意义和保健功能,年产值超20亿元。2018年在吉林省分蘖洋葱中发现叶片局部发黄、皱缩向下卷曲的症状,经鉴定该病害由oydv侵染引起,导致分蘖洋葱产量下降35%-80%,这是中国首次报道oydv侵染分蘖洋葱。oydv侵染分蘖洋葱后会出现叶片发黄、萎缩、起皱等症状,通过鳞茎母体带毒传给后代,引起种性退化,严重时甚至会毁种。目前尚无有效治疗植物病毒病的药剂,高效、精准的病毒检测技术是该病害防治的前提。
4.有鉴于此,特提出本发明。
技术实现要素:
5.本发明的第一目的在于提供杂交瘤细胞,该杂交瘤细胞能够分泌特异性识别洋葱黄矮病毒衣壳蛋白(cp)的抗体。
6.本发明的第二目的在于提供一种洋葱黄矮病毒抗体,该抗体能够特异性识别洋葱黄矮病毒衣壳蛋白(cp)。
7.本发明的第三目的在于提供上述洋葱黄矮病毒抗体在构建洋葱黄矮病毒检测方法中的应用。
8.本发明的第四目的在于提供一种抗体标记的辣根过氧化酶。
9.本发明的第五目的在于提供一种洋葱黄矮病毒的elisa检测试剂盒,以解决上述问题中的至少一种。
10.本发明的第六目的在于提供一种洋葱黄矮病毒的elisa检测方法,为葱属作物oydv病害防控及脱毒提供技术支持。
11.第一方面,本发明提供了杂交瘤细胞,所述杂交瘤细胞分泌单抗4g12、单抗6d7、单抗6e10或单抗10c8;
12.分泌单抗4g12的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10301;
13.分泌单抗6d7的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10302;
14.分泌单抗6e10的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10303;
15.分泌单抗10c8的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10304。
16.第二方面,本发明提供了一种洋葱黄矮病毒抗体,所述洋葱黄矮病毒抗体包括单抗4g12、单抗6d7、单抗6e10和单抗10c8中的至少一种;
17.分泌单抗4g12的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10301;
18.分泌单抗6d7的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10302;
19.分泌单抗6e10的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10303;
20.分泌单抗10c8的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10304。
21.作为进一步技术方案,所述洋葱黄矮病毒抗体为单抗10c8。
22.第三方面,本发明提供了一种洋葱黄矮病毒抗体在构建洋葱黄矮病毒检测方法中的应用;
23.优选地,所述检测方法包括elisa检测方法。
24.第四方面,本发明提供了一种抗体标记的辣根过氧化酶,所述抗体包括上述洋葱黄矮病毒抗体。
25.第五方面,本发明提供了一种洋葱黄矮病毒的elisa检测试剂盒,包括:上述洋葱黄矮病毒抗体、抗体标记的辣根过氧化酶、酶标板、洗涤液和显色液。
26.作为进一步技术方案,所述洋葱黄矮病毒抗体为单抗10c8;
27.优选地,所述洋葱黄矮病毒抗体的浓度为1-2μg/ml,优选为2μg/ml;
28.优选地,所述辣根过氧化酶为单抗10c8标记的辣根过氧化酶;
29.优选地,所述辣根过氧化酶的浓度为1-2μg/ml,优选为2μg/ml;
30.优选地,所述elisa检测试剂盒还包括封闭剂;
31.优选地,所述封闭剂包括5%脱脂奶粉。
32.第六方面,本发明提供了一种洋葱黄矮病毒的elisa检测方法,包括如下步骤:
33.采用上述洋葱黄矮病毒抗体包被酶标板,然后依次进行待测样本孵育、上述抗体标记的辣根过氧化酶孵育和显色。
34.作为进一步技术方案,所述洋葱黄矮病毒抗体为单抗10c8;
35.优选地,所述洋葱黄矮病毒抗体的浓度为1-2μg/ml,优选为2μg/ml;
36.优选地,所述洋葱黄矮病毒抗体包被酶标板的温度为2-37℃,优选为4℃;所述洋葱黄矮病毒抗体包被酶标板的时间为6-16h,优选为16h;
37.优选地,所述辣根过氧化酶为单抗10c8标记的辣根过氧化酶;
38.优选地,所述的浓度为1-2μg/ml,优选为2μg/ml;
39.优选地,所述辣根过氧化酶孵育的温度为25-39℃,优选为37℃;所述辣根过氧化酶孵育的时间为30-60min,优选为45min。
40.作为进一步技术方案,所述洋葱黄矮病毒抗体包被酶标板之后和待测样本孵育之前还包括封闭步骤;
41.优选地,所述封闭的封闭剂包括5%脱脂奶粉;
42.优选地,所述封闭的温度为25-39℃,优选为37℃;
43.优选地,所述封闭的时间为10min-1.2h,优选为1h。
44.与现有技术相比,本发明具有如下有益效果:
45.本发明提供的杂交瘤细胞能够分泌单抗4g12、单抗6d7、单抗6e10或单抗10c8,能够用于上述单抗的制备。
46.本发明提供的洋葱黄矮病毒抗体包括单抗6d7、单抗4g12、单抗6e10和单抗10c8中的至少一种。经发明人研究发现,单抗6d7、单抗4g12、单抗6e10和单抗10c8均能够特异性的与洋葱黄矮病毒cp蛋白结合,能够用于构建洋葱黄矮病毒的检测方法。
47.本发明提供的洋葱黄矮病毒的elisa检测方法,包括采用本发明提供的葱黄矮病毒抗体包被酶标板,然后依次进行待测样本孵育、抗体标记的辣根过氧化酶孵育和显色。该方法检测灵敏度高,特异性强,检测准确性好,方便快捷,cp蛋白最低检测限为11.71ng/ml,本发明的elisa检测方法能检测出1000倍稀释的洋葱黄矮病毒感染叶片粗提物,本发明为葱属植物病害检测、检疫、脱毒提供关键技术支持。
48.本发明提供的洋葱黄矮病毒的elisa检测试剂盒,包括:本发明提供的洋葱黄矮病毒抗体、抗体标记的辣根过氧化酶、酶标板、洗涤液和显色液,该试剂盒检测灵敏度高,检测准确性好。
附图说明
49.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
50.图1为oydv单克隆抗体的wester-blot鉴定;
51.图2为捕获抗体包被时间的优化;
52.图3为封闭时间的优化;
53.图4为检测抗体孵育时间的优化;
54.图5为单抗体夹心elisa测定oydv的标准曲线;
55.图6为单抗体夹心elisa和间接elisa的灵敏度的比较。
具体实施方式
56.下面将结合实施方式和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施方式和实施例仅用于说明本发明,而不应视为限制本发明的范
围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
57.第一方面,本发明提供了杂交瘤细胞,所述杂交瘤细胞分泌单抗4g12、单抗6d7、单抗6e10或单抗10c8;
58.分泌单抗4g12的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10301;
59.分泌单抗6d7的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10302;
60.分泌单抗6e10的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10303;
61.分泌单抗10c8的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10304。
62.本发明提供的杂交瘤细胞能够分泌单抗4g12、单抗6d7、单抗6e10或单抗10c8,能够用于上述单抗的制备。
63.第二方面,本发明提供了一种洋葱黄矮病毒抗体,所述洋葱黄矮病毒抗体包括单抗6d7、单抗4g12、单抗6e10和单抗10c8中的至少一种;
64.分泌单抗4g12的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10301;
65.分泌单抗6d7的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10302;
66.分泌单抗6e10的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10303;
67.分泌单抗10c8的杂交瘤细胞保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.10304。
68.经发明人研究发现,单抗6d7、单抗4g12、单抗6e10和单抗10c8均能够特异性的与洋葱黄矮病毒结合,能够用于洋葱黄矮病毒的检测。
69.在一些优选的实施方式中,所述洋葱黄矮病毒抗体为单抗10c8。
70.经发明人研究发现,当将单抗10c8作为捕获抗体,将单抗10c8标记的辣根过氧化酶作为检测抗体应用于洋葱黄矮病毒的elisa检测方法的构建时,检测信号普遍高于其他抗体组合,效果更好。
71.第三方面,本发明提供了上述洋葱黄矮病毒抗体在构建洋葱黄矮病毒检测方法中的应用。
72.本发明提供的洋葱黄矮病毒抗体能够特异性识别洋葱黄矮病毒,因此能够用于构建洋葱黄矮病毒的检测方法,检测方法包括但不限于elisa检测方法,或者本领域技术人员所熟知的其他应用抗体实现抗原的检测方法。
73.第四方面,本发明提供了一种抗体标记的辣根过氧化酶,所述抗体包括上述洋葱黄矮病毒抗体。该抗体标记的辣根过氧化酶能够与本发明提供的洋葱黄矮病毒抗体共同用
于elisa检测方法的构建,以实现对洋葱黄矮病毒的检测。
74.第五方面,本发明提供了一种洋葱黄矮病毒的elisa检测试剂盒,包括:上述洋葱黄矮病毒抗体、上述辣根过氧化酶、酶标板、洗涤液和显色液。
75.本发明提供的洋葱黄矮病毒的elisa检测试剂盒检测灵敏度高,检测准确性好。
76.在一些优选的实施方式中,所述洋葱黄矮病毒抗体为单抗10c8;
77.优选地,所述洋葱黄矮病毒抗体的浓度例如可以为,但不限于1μg/ml、1.2μg/ml、1.4μg/ml、1.6μg/ml、1.8μg/ml或2μg/ml,优选为2μg/ml;
78.优选地,所述辣根过氧化酶为单抗10c8标记的辣根过氧化酶;
79.优选地,所述辣根过氧化酶的浓度例如可以为,但不限于1μg/ml、1.2μg/ml、1.4μg/ml、1.6μg/ml、1.8μg/ml或2μg/ml,优选为2μg/ml;
80.优选地,所述elisa检测试剂盒还包括封闭剂;
81.优选地,所述封闭剂包括但不限于5%脱脂奶粉,或者本领域技术人员所熟知的其他封闭剂。
82.本发明中,洗涤剂例如可以为,但不限于pbst。显色液例如可以为,但不限于tmb显色液。本发明的试剂盒例如还可以包括终止液和缓冲液,终止液例如可以为,但不限于2m h2so4溶液;缓冲液例如可以为,但不限于pbs缓冲液。
83.第六方面,本发明提供了一种洋葱黄矮病毒的elisa检测方法,包括如下步骤:
84.采用上述洋葱黄矮病毒抗体包被酶标板,然后依次进行待测样本孵育、上述辣根过氧化酶孵育和显色。
85.本发明利用已制备的单克隆抗体10c8,首次建立oydv单抗体夹心elisa检测方法,提高经济效益,简化操作步骤,缩短检测时间从而提高检测效率,为今后oydv的快速诊断、高通量检测、脱毒种苗繁育及抗病育种提供技术支持。
86.在一些优选的实施方式中,所述洋葱黄矮病毒抗体为单抗10c8;
87.优选地,所述洋葱黄矮病毒抗体的浓度例如可以为,但不限于1μg/ml、1.2μg/ml、1.4μg/ml、1.6μg/ml、1.8μg/ml或2μg/ml,优选为2μg/ml;
88.优选地,所述洋葱黄矮病毒抗体包被酶标板的温度例如可以为,但不限于2℃、5℃、10℃、20℃、30℃或37℃,优选为4℃;所述洋葱黄矮病毒抗体包被酶标板的时间例如可以为,但不限于6h、8h、10h、12h、14h或16h,优选为16h;
89.优选地,所述辣根过氧化酶为单抗10c8标记的辣根过氧化酶;
90.优选地,所述辣根过氧化酶的浓度例如可以为,但不限于1μg/ml、1.2μg/ml、1.4μg/ml、1.6μg/ml、1.8μg/ml或2μg/ml,优选为2μg/ml;
91.优选地,所述辣根过氧化酶孵育的温度例如可以为,但不限于25℃、35℃、36℃、37℃、38℃或39℃,优选为37℃;所述辣根过氧化酶孵育的时间例如可以为,但不限于30min、40min、50min或60min,优选为45min。
92.本发明通过对elisa检测方法条件的进一步优化和调整,使得检测洋葱黄矮病毒的灵敏度更高,检测准确性更好。
93.在一些优选的实施方式中,所述洋葱黄矮病毒抗体包被酶标板之后和待测样本孵育之前还包括封闭步骤。
94.优选地,所述封闭的封闭剂包括但不限于5%脱脂奶粉,或者本领域技术人员所熟
知的其他封闭剂。
95.优选地,所述封闭的温度例如可以为,但不限于25℃、35℃、36℃、37℃、38℃或39℃,优选为37℃;
96.优选地,所述封闭的时间例如可以为,但不限于10min、30min、1h、1.1h或1.2h,优选为1h。
97.下面通过具体的实施例和对比例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
98.以下实施例采用的材料:
99.1.重组蛋白、细胞、病毒株及实验动物
100.oydv分蘖洋葱分离物、葱潜隐病毒(shallot latent virus,slv)、葱黄条纹病毒(shallot yellow stripe virus,sysv)、sp2/0骨髓瘤细胞为由吉林省农业科学院微生物重点实验室保存,oydy cp蛋白为本实验室前期表达,6周龄~8周龄的spf级balb/c雌鼠购自辽宁长生生物技术有限公司。酶标板购自costar公司,tmb显色液购自索莱宝公司。
101.2.主要试剂
102.抗oydv抗体3f10为本实验室保存。胎牛血清(11011-8611)购自浙江天杭生物科技股份有限公司。二氨基联苯胺(dab)显色试剂盒、兔抗鼠hrp-igg购自生工生物工程(上海)股份有限公司,辣根过氧化物酶(hrp)标记试剂盒购自北京梅科万德生物技术有限公司。dmem高糖、邻苯二胺(opd)购自gibco公司。弗氏佐剂、peg、hat、ht和8-氮鸟嘌呤(8-ag)购自sigma公司。
103.3.主要仪器
104.洗板机、酶标仪购自美国伯腾仪器有限公司;二氧化碳细胞培养箱购自日本松下;高速冷冻台式离心机(ct15re型)购自日本日立公司。
105.实施例1
106.1.balb/c小鼠的免疫
107.以纯化的重组oydv cp蛋白为免疫原,皮下注射免疫6~8周龄balb/c雌鼠5只,50μg/只,每两周免疫一次。首次免疫与等体积的弗氏完全佐剂乳化后免疫,第二次和第三次免疫与等体积的弗氏不完全佐剂乳化,第三次免疫后一周断尾采血,将血清倍比稀释,利用纯化的重组cp蛋白包被的elisa板检测血清抗体效价,选择血清效价最高的小鼠以100μg/只重组蛋白(不加佐剂)进行加强免疫。
108.2.细胞融合
109.加强免疫之后的第2天,取昆明小鼠的腹腔巨噬细胞作为饲养层细胞,取免疫小鼠脾细胞与sp2/0细胞以5∶1的比例按照常规方法使用peg进行细胞融合。
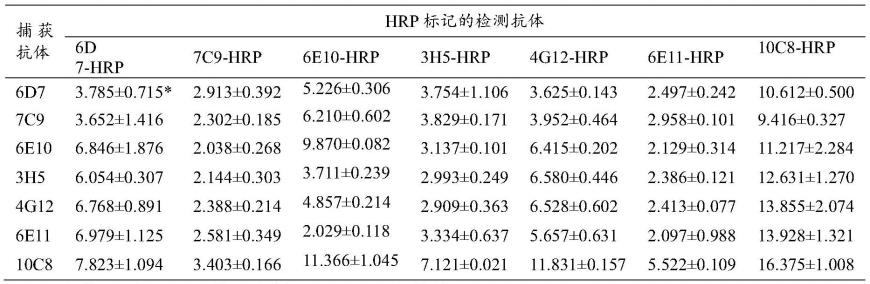
110.3.杂交瘤细胞的筛选
111.用oydv侵染的分蘖洋葱、大蒜叶片和相应的健康叶片为包被抗原,采用间接elisa法筛选阳性杂交瘤细胞,使用有限稀释法进行克隆纯化,直到筛出能够稳定分泌抗体的阳性杂交瘤细胞株。
112.4.单克隆抗体的western blot鉴定
113.将感染和未感染oydv的分蘖洋葱叶片粗提物处理后进行sds-page并转印至pvdf膜,分别以elisa阳性的mabs上清为一抗,以兔抗鼠hrp-igg(1:40000)作为二抗,dab显色试
剂盒显色,进行western blot分析。
114.结果:收集融合细胞培养上清,以oydv侵染的分蘖洋葱和大蒜叶片为阳性抗原、以健康植株叶片为阴性对照,进行抗原包被间接elisa筛选,共获得7株细胞能分泌oydv特异性单克隆抗体。取阳性细胞上清,以oydv感染的和健康的分蘖洋葱叶片粗提物为抗原,以3f10为oydv的阳性对照单克隆抗体,进行western-blot分析(如图1所示,图1中,m:蛋白质分子量标准;1.oydv感染的珠葱叶片总蛋白;2.健康的珠葱叶片总蛋白;6d7、6e10、4g12、10c8、3h5、6e11和7c9是本试验筛选到的oydv衣壳蛋白单克隆抗体;3f10是已知的oydv cp蛋白单克隆抗体),7株抗体6d7、6e10、4g12、10c8、3h5、6e11和7c9能特异性识别oydv,3f10是已知的oydv cp蛋白单克隆抗体。
115.实施例2oydv夹心elisa检测方法的建立
116.1.单克隆抗体的hrp标记和配对抗体的筛选
117.对制备的7种oydv单克隆抗体进行hrp标记,用未标记的单克隆抗体作为夹心elisa的捕获抗体,用hrp标记抗体作为检测抗体,对oydv感染的叶片组织进行elisa检测,检测步骤如下:
118.37℃条件下,以2ug/ml浓度的单克隆抗体包被检测板;5%脱脂奶封闭30min后加入oydv阳性和阴性叶片样品,孵育30分钟后洗涤3次;用hrp标记的oydv单克隆抗体孵育30分钟后洗涤3次,tmb显色液室温显色15分钟;450nm波长读数,选取p/n值最大的抗体组合。
119.elisa检测结果如表1所示,检测结果以p/n(样品od
450nm
/阴性样品od
450nm
)值表示。结果表明,以10c8为捕获抗体或检测抗体的配对组合,检测信号普遍高于其他抗体的配对组合,其中以10c8为捕获抗体及其hrp标记抗体为检测抗体的组合信号最强,其p/n达到16.375
±
1.008。因此,选择10c8及hrp标记的10c8进行oydv夹心elisa检测方法的建立。
120.表1.oydv夹心elisa配对抗体的筛选
[0121][0122]
注释:*表示p/n值,即样品od
450nm
/阴性样品od
450nm
。
[0123]
2.抗体工作浓度的确定
[0124]
运用建立的oydv单抗体夹心elisa筛选抗体的最佳工作浓度,具体步骤如下:将10c8分别稀释至2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml包被检测板,100μl/孔,4℃静置过夜;5%脱脂奶37℃封闭1h;分别将健康的分蘖洋葱叶片、感染oydv的分蘖洋葱叶片按1:10(w/v,g/ml)比例加入0.01m pbs缓冲液研磨后离心取上清,以上清液为溶剂将hrp标记过的10c8稀释至2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml,100μl/孔,37℃孵育1h;以上每一步结束后,pbst洗涤4次;加入tmb显色液100μl/孔,避光显色8-10min,以2m h2so4溶液为终止液50μl/孔终止显色;酶标仪测定450nm处吸光度值,以p/n最大值确定抗体最佳工作浓度配比。
[0125]
结果如表1所示,当捕获抗体10c8浓度为2μg/ml,检测抗体hrp-10c8浓度为2μg/ml时,p/n值最大,确定为本实验最佳抗体工作浓度。
[0126]
表2抗体最佳工作浓度确定
[0127][0128]
*:p/n值。
[0129]
3.反应条件的优化
[0130]
以健康的分蘖洋葱叶片和oydv的分蘖洋葱叶片为阴性对照和阳性对照,对建立的oydv单抗体夹心elisa检测方法的不同反应条件进行优化。通过控制变量法分析捕获抗体包被时间、封闭时间、检测抗体孵育时间,确认最佳的反应条件。
[0131]
结果如图2、图3和图4所示,以p/n最大值,确定捕获抗体最佳包被时间为4℃过夜;最佳封闭时间为37℃1h;检测抗体最佳孵育时间为37℃45min;
[0132]
4.灵敏度检测
[0133]
将重组表达的oydv cp蛋白从1000ng/ml等比稀释至7.8125ng/ml,运用建立的检测方法对其进行检测,绘制灵敏度曲线,并得出最低检测限。
[0134]
将感染oydv和健康的分蘖洋葱叶片研磨上清分别等比例稀释(5~5120倍),用抗体10c8建立的oydv单抗体夹心elisa和间接elisa分别测定oydv,分析两种方法的检测灵敏度。
[0135]
结果如图5所示,以oydv cp重组蛋白浓度为横坐标,p/n值为纵坐标建立标准曲线,得出现线性方程y=0.0211x+1.853,r2=0.9924,当p/n=2.1时,确定本方法的最低检测限为11.71ng/ml。
[0136]
如图6所示,以叶片研磨上清稀释倍数为横坐标,p/n值为纵坐标,比较oydv单抗体夹心elisa和间接elisa的灵敏度。以10c8为抗体的单抗体夹心elisa能检测出1280倍稀释叶片中的oydv,间接elisa能检测出160倍稀释叶片中的oydv,因此以10c8为抗体的单抗体夹心elisa的灵敏度比间接elisa高8倍。
[0137]
5.oydv单抗体夹心elisa的应用
[0138]
从吉林省农业科学院试验地随机采集50份疑是感染oydv的分蘖洋葱样品,运用建立的单抗体夹心elisa及rt-pcr分别进行检测,oydv特异性引物:oydv9570-s:gatgcagcagcacaatcaagcac(seq id no.1);oydv10225-a:gttaccatccaggccaaaca(seq id no.2),采用trizol法从确定感染oydv的分蘖洋葱叶片中提取总rna,根据1st strand cdna synthesis kit说明书合成cdna第一链,并以其为模板,利用合成的特异性引物进行pcr扩增,pcr扩增采用10μl反应体系:premix ex taqtm 5μl、cdna 1μl、正向引物(10μmol/l)0.5μl、反向引物(10μmol/l)0.5μl、ddh2o 3μl。pcr反应体系:94℃预变性3min,94℃变性30s,57℃退火30s,72℃延伸1min,最后72℃再延伸10min。pcr产物经2%琼脂糖凝胶电泳鉴定,对比两种方法的检测结果,验证其准确性。
[0139]
利用本研究建立的elisa检测方法对50份分蘖洋葱样品进行检测,阳性样品32份,阳性检出率为64%。利用rt-pcr方法检测出阳性样品34份,阳性检出率为68%。结果如表2所示,两种方法的一致率为96%。
[0140]
表2两种检测结果比较
[0141][0142]
本发明利用oydv cp重组蛋白免疫babl/c小鼠,通过细胞融合和筛选,获得7株分泌oydv特异性单克隆抗体的细胞株。配对抗体筛选结果表明,单克隆抗体10c8自身配对的检测效果最好,且明显优于其他抗体组合。
[0143]
抗原为天然病毒时,病毒粒子的衣壳由多个cp蛋白聚合而成,即病毒衣壳上存在多个相同的抗原表位;因此,在建立夹心elisa时,同一的抗体既作捕获抗体又作检测抗体不产生竞争关系。本研究对重组表达的oydv cp蛋白进行检测是也能得到阳性结果,可能是由于重组蛋白聚合形成病毒样颗粒(virus-like particles,vlp),或者蛋白聚合形成包涵体结构。
[0144]
本研究建立的oydv单抗体夹心elisa能够仅利用一种抗体便可完成检测,达到优于双抗体的效果,即降低了检测成本,又提高了检测质量,同时满足高通量样品的检测需求。
[0145]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1