一种筛选鉴定与植物多亚基SCFE3连接酶协同工作E2的方法
一种筛选鉴定与植物多亚基scf e3连接酶协同工作e2的方法
技术领域
1.本发明涉及生物技术领域,具体涉及一种筛选鉴定与植物多亚基scf e3连接酶协同工作e2的方法。
背景技术:
2.蛋白质的降解和合成之间的平衡,对于维持细胞内稳态及机体的正常功能具有重要作用。在真核细胞中,泛素-蛋白酶体途径是蛋白降解的最主要途径之一,该途径由底物蛋白的泛素化修饰过程和蛋白酶体依赖的降解过程组成。蛋白泛素化修饰过程需要泛素活化酶(e1)、泛素结合酶(e2)和泛素连接酶(e3)协同完成。其中,scf e3连接酶是最大的泛素连接酶亚家族之一,是由skp1、cullin1、rbx1和可置换的f-box蛋白组成。
3.体外泛素化分析体系为研究e3连接酶分子作用机理提供了有效的方法平台。目前为止,有关植物多亚基scf e3连接酶体外活性重组体系的研究仍旧空白,筛选鉴定与多亚基scf e3连接酶协同工作的e2是建立该体外重组体系的瓶颈之一。因此,建立一个筛选鉴定与植物多亚基scf e3连接酶协同工作e2的方法平台,对于推进植物多亚基e3连接酶分子作用机理的研究具有重要意义。
技术实现要素:
4.本发明的目的是提供一种筛选鉴定与植物多亚基scf e3连接酶协同工作e2的方法,并且提供一些具体的泛素结合酶e2,以及筛选鉴定待测蛋白是否具有泛素结合酶活性的方法。
5.第一方面,本发明要求保护一种鉴定待测泛素结合酶e2是否能够与植物多亚基scf e3连接酶协同工作形成多聚泛素链的方法。
6.本发明要求保护的鉴定待测泛素结合酶e2能否与植物多亚基scf e3连接酶协同工作形成多聚泛素链的方法,可包括如下步骤:
7.(a1)配制反应体系;所述反应体系中含有待测泛素结合酶e2、植物多亚基scf e3连接酶、泛素活化酶e1和泛素蛋白ubiquitin;(a2)将(a1)配制好的反应体系置于22-37℃震荡反应1-2h(如2h);
8.(a3)对(a2)反应后的体系进行检测,从而确定所述待测泛素结合酶e2能否与所述植物多亚基scf e3连接酶协同工作形成多聚泛素链。
9.进一步地,所述反应体系中还含有反应缓冲液(记为反应缓冲液1);所述反应缓冲液1中tris(如ph 7.4)、mgcl2、atp、dtt。
10.在一些案例中,所述反应体系组成如下:50mm tris(ph 7.4),10mm mgcl2,5mm atp,2mm dtt,1.67mg/l泛素活化酶e1,6.67mg/l所述待测泛素结合酶e2,66.67mg/l泛素蛋白ubiquitin,6.67mg/l所述植物多亚基scf e3连接酶(依据f-box蛋白进行定量计算)。上述各物质的浓度为在反应体系中的终浓度。
11.进一步地,所述反应体系中各个组份的加样顺序最好为:所述待测泛素结合酶e2、
box蛋白为d3蛋白。进一步地,所述d3蛋白为来源于水稻的d3蛋白。更进一步地,所述d3蛋白的氨基酸序列与数据库irgsp(http://rice.plantbiology.msu.edu/)中基因登录号为loc_os06g06050的基因编码的氨基酸序列相同。当所述植物多亚基scf e3连接酶为所述scf
gid2 e3连接酶,所述f-box蛋白为gid2蛋白。进一步地,所述gid2蛋白为来源于水稻的gid2蛋白。更进一步地,所述gid2蛋白的氨基酸序列与数据库genebank(http://www.ncbi.nlm.nih.gov/genbank)中基因登录号为ab100246.1的基因编码的氨基酸序列相同。
26.其中,所述蛋白标签包括但不限于gfp标签、flag标签、ha标签或myc标签。所述转基因植物不限于转基因愈伤组织表达系统,材料来源还可包括烟草瞬时表达系统、原生质体瞬时表达系统、小麦胚芽体外翻译系统等植物反应器。此方法也可应用于水稻以外的其他真核生物中的scf e3连接酶复合体的获取,可延展应用至拟南芥、烟草、小麦、大豆、番茄、玉米、小鼠、大鼠、线虫、果蝇、人等各种物种中。
27.在本发明的一些案例中,所述蛋白标签为gfp。相应的,获取有活性的scf e3连接酶复合体所使用的是gfp trap agarose,这个产品的优点是结合琼脂糖凝胶的抗体经过特殊的处理后,消除了抗体重链和轻链的干扰,有利于提高后续活性分析实验的特异性。
28.在本发明的一些案例中,所述待测泛素结合酶e2选自后文第三方面的(c1)中所述蛋白,或者选自hsubch5c、hsubch7或hscdc34。
29.第二方面,本发明要求保护一种植物多亚基scf e3连接酶的制备方法。
30.本发明要求保护的植物多亚基scf e3连接酶的制备方法,可包括前文的步骤(b1)-(b4)。
31.第三方面,本发明要求保护如下任一:
32.(c1)如下蛋白中的全部或部分在作为泛素结合酶中的应用:
33.osubc1蛋白、osubc4蛋白、osubc5蛋白、osubc6蛋白、osubc7蛋白、osubc8蛋白、osubc9蛋白、osubc10蛋白、osubc11蛋白、osubc13蛋白、osubc19蛋白、osubc22蛋白、osubc23蛋白、osubc26蛋白、osubc28蛋白、osubc29蛋白、osubc30蛋白、osubc31蛋白、osubc32蛋白、osubc44蛋白、osubc46蛋白、osubc47蛋白;或者上述任一蛋白经过一个或几个氨基酸残基的取代和/或缺失和/或添加且来源于水稻具有相同功能的蛋白;或者与上述任一蛋白具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且来源于水稻具有相同功能的蛋白;或者在上述任一蛋白的n端和/或c端融合蛋白标签后得到的融合蛋白。
34.上述各蛋白的氨基酸序列与表1中相应基因登录号所示基因编码的氨基酸序列相同(下同)。
35.上述蛋白质中,所述蛋白标签(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签包括但不限于flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
36.上述蛋白中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用
blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
37.上述蛋白质中,所述95%以上的同源性可为至少96%、97%、98%的同一性。所述90%以上的同源性可为至少91%、92%、93%、94%的同一性。所述85%以上的同源性可为至少86%、87%、88%、89%的同一性。所述80%以上的同源性可为至少81%、82%、83%、84%的同一性。
38.这些蛋白均具有泛素结合酶e2的功能,且都通过二硫键与活化的ubiquitin蛋白形成dtt敏感的osubc-ub结合物。
39.(c2)蛋白或核酸分子或含有所述核酸分子的表达盒、重组载体或重组菌或转基因细胞系在制备具有泛素结合酶活性的产品中的应用;
40.所述蛋白为如下中的全部或部分:osubc1蛋白、osubc4蛋白、osubc5蛋白、osubc6蛋白、osubc7蛋白、osubc8蛋白、osubc9蛋白、osubc10蛋白、osubc11蛋白、osubc13蛋白、osubc19蛋白、osubc22蛋白、osubc23蛋白、osubc26蛋白、osubc28蛋白、osubc29蛋白、osubc30蛋白、osubc31蛋白、osubc32蛋白、osubc44蛋白、osubc46蛋白、osubc47蛋白。
41.所述核酸分子为编码所述蛋白的核酸分子;所述表达盒为含有所述核酸分子的表达盒;所述重组载体为含有所述核酸分子或所述表达盒的重组载体;所述重组菌为含有所述核酸分子或所述表达盒或所述重组载体的重组菌;所述转基因细胞系为含有所述核酸分子或所述表达盒或所述重组载体的转基因细胞系。
42.编码上述各蛋白的核酸分子的基因登录号如表1所示(下同)。所述核酸分子还可以为在严格条件下与上述限定的核酸分子杂交且编码相应所述蛋白的dna分子;或者为与上述限定的核酸分子序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码相应所述蛋白的dna分子。
43.上述核酸分子中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5mna3po4和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次。
44.上述核酸分子中,同源性是指核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定核苷酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对核苷酸序列的同一性进行计算,然后即可获得同一性的值(%)。
45.上述核酸分子中,所述95%以上的同源性可为至少96%、97%、98%的同一性。所述90%以上的同源性可为至少91%、92%、93%、94%的同一性。所述85%以上的同源性可
为至少86%、87%、88%、89%的同一性。所述80%以上的同源性可为至少81%、82%、83%、84%的同一性。
46.(c3)蛋白或核酸分子或含有所述核酸分子的表达盒、重组载体或重组菌或转基因细胞系在制备用于泛素化修饰分析的产品中的应用;
47.所述蛋白为如下中的全部或部分:osubc1蛋白、osubc4蛋白、osubc5蛋白、osubc6蛋白、osubc7蛋白、osubc8蛋白、osubc9蛋白、osubc10蛋白、osubc11蛋白、osubc13蛋白、osubc19蛋白、osubc22蛋白、osubc23蛋白、osubc26蛋白、osubc28蛋白、osubc29蛋白、osubc30蛋白、osubc31蛋白、osubc32蛋白、osubc44蛋白、osubc46蛋白、osubc47蛋白。
48.所述核酸分子为编码所述蛋白的核酸分子;所述表达盒为含有所述核酸分子的表达盒;所述重组载体为含有所述核酸分子或所述表达盒的重组载体;所述重组菌为含有所述核酸分子或所述表达盒或所述重组载体的重组菌;所述转基因细胞系为含有所述核酸分子或所述表达盒或所述重组载体的转基因细胞系。
49.(c4)用于筛选与植物多亚基scf e3连接酶协同工作形成多聚泛素链的泛素结合酶e2的试剂盒,含有前文第一方面中所述植物多亚基scf e3连接酶、泛素活化酶e1、泛素蛋白ubiquitin和前文第一方面中所述的反应缓冲液(即所述反应缓冲液1)。
50.进一步地,所述试剂盒中还含有如下蛋白中的全部或部分:osubc1蛋白、osubc4蛋白、osubc5蛋白、osubc6蛋白、osubc7蛋白、osubc8蛋白、osubc9蛋白、osubc10蛋白、osubc11蛋白、osubc13蛋白、osubc19蛋白、osubc22蛋白、osubc23蛋白、osubc26蛋白、osubc28蛋白、osubc29蛋白、osubc30蛋白、osubc31蛋白、osubc32蛋白、osubc44蛋白、osubc46蛋白、osubc47蛋白。
51.(c5)(c4)所述试剂盒在筛选能够与植物多亚基scf e3连接酶协同工作形成多聚泛素链的泛素结合酶中的应用。
52.在上文中,所述表达盒是指能够在宿主细胞中表达一个或者若干个所述蛋白的dna试剂盒,该dna不但可包括启动所述核酸分子转录的启动子,还可包括终止所述核酸分子转录的终止子;进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子,和诱导型启动子。
53.在上文中,为了方便蛋白纯化,上述所有蛋白表达载体构建的时候,都可带有与目的蛋白融合表达的蛋白标签(protein tag),以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签包括但不限于gfp标签、flag标签、ha标签、myc标签、his标签、mbp标签、gst标签、strep标签和/或sumo标签等。所有表达蛋白的构建载体均需要测序确认,并确保编码序列阅读框正确,以保证整个序列的正确翻译。
54.为了方便对转基因植物材料(如转基因细胞、愈伤或者植株)进行筛选和鉴定,可对所有植物表达载体进行改造,例如加入可在植物中表达的、编码可产生颜色变化的发光化合物、酶或者蛋白质的基因(gus基因、绿色荧光蛋白gfp基因和荧光素酶基因等)、具有抗性的抗生素标记物(卡那霉素标记物、庆大霉素标记物、潮霉素标记物等)。
55.本案例中使用原核蛋白表达体系对n端融合了his标签的重组质粒进行蛋白表达。具体步骤如下:将融合his标签的泛素结合蛋白ubcs的表达质粒分别转化大肠杆菌蛋白表达菌株bl21(de3);将活化的重组菌在37℃培养至od
600
为0.8,然后加入终浓度为0.3mm iptg,在16℃,180rpm的培养条件下进行蛋白诱导表达16-20hr;通过离心收集菌体,进行细
胞破碎,离心后留取上清液用ni柱进行纯化,得到目的蛋白。
56.第四方面,本发明要求保护一种检测待测蛋白是否具有泛素结合酶活性的方法。
57.本发明要求保护的检测待测蛋白是否具有泛素结合酶活性的方法,可包括如下步骤:
58.(d1)配制反应体系;所述反应体系中含有待测蛋白、泛素活化酶e1和泛素。
59.进一步地,所述反应体系中还含有反应缓冲液(记为反应缓冲液2);所述反应缓冲液2中含有tris(如ph7.4)、mgcl2、atp;和/或,所述反应缓冲液2中还含有或不含有dtt。
60.更进一步地,当所述反应缓冲液2中不含有dtt时,所述反应体系组成如下:50mm tris(ph 7.4),10mm mgcl2,5mm atp,1.67mg/l泛素活化酶e1,6.67mg/l所述待测蛋白;当所述反应缓冲液中含有dtt时,所述反应体系组成如下:50mm tris(ph 7.4),10mm mgcl2,5mm atp,2mm dtt,1.67mg/l泛素活化酶e1,6.67mg/l所述待测蛋白;上述各物质的浓度为在反应体系中的终浓度。
61.所述反应体系的加样顺序最好为:所述待测蛋白、泛素、泛素活化酶e1、所述反应缓冲液2(如20
×
母液,配方:1m tris(ph 7.4),200mm mgcl2,100mm atp,加或者不加40mm dtt)。
62.(d2)将(d1)配制好的反应体系置于28℃反应15-30min(如30min)。
63.(d3)对(d2)反应后的体系进行检测,从而确定所述待测蛋白是否具有泛素结合酶活性。
64.在步骤(d2)中,反应结束后,还可包括加入6
×
sds sample loading buffer(含有或者不含有0.6m dtt)终止反应的步骤。
65.在步骤(d3)中,所述检测可为通过western blotting进行检测。在一些案例中,所用一抗为抗泛素抗体或者抗his标签的抗体;所用二抗为hrp标抗体。如果western blotting显影结果中没有加dtt的活性反应样品出现osubc-ub大小的条带,但是加dtt后osubc-ub大小的条带消失,则说明所述待测蛋白具有泛素结合酶活性;若western blotting显影结果无论加或者不加dtt,均没有出现osubc-ub大小的条带,则说明所述待测蛋白不具有泛素结合酶活性。
66.体外多亚基scf e3连接酶活性重组体系对于研究多亚基e3连接酶的分子作用机理具有极其重要的作用,而筛选鉴定与多亚基scf e3连接酶特异高效协同工作的e2是极其重要的且存在较大困难的科学研究领域,本发明有助于解决这一关键问题,对于植物解析多亚基scf e3连接酶的功能至关重要。本发明具有重要的理论及应用价值。
附图说明
67.图1为水稻中涵盖12个亚家族的26个泛素结合蛋白(osubc)的纯化及定量结果。a为来自水稻第i亚家族的osubc1、来自第ii亚家族的osubc4/5/6、来自第iii亚家族的osubc7/8/9、来自第iv亚家族的osubc10和来自第vii亚家族的osubc25/26蛋白纯化及考马斯亮蓝染色定量结果。b为来自第v亚家族的osubc11和来自第vi亚家族的osubc14/16/23蛋白纯化及考马斯亮蓝染色定量结果。c为来自第vi亚家族的osubc13/18/19/22蛋白纯化及考马斯亮蓝染色定量结果。d为来自第viii亚家族的osubc28/29/30/31、来自第ix亚家族的osubc32、来自第xii亚家族的osubc44、来自第xiv亚家族的osubc46和来自第xv亚家族的
osubc47蛋白纯化及考马斯亮蓝染色定量结果。图中,箭头所指为对应的osubc蛋白经过考马斯亮蓝染色后的蛋白条带。bsa梯度条带作为标定目的蛋白含量的标识。
68.图2水稻来源的osub蛋白和ose1蛋白的纯化及定量结果。a为his-osub蛋白的纯化及考马斯亮蓝染色定量结果。b为gst-osub蛋白的纯化及考马斯亮蓝染色定量结果。c为strep-ose1蛋白的纯化及考马斯亮蓝染色定量结果。图中,箭头所指为对应的osub蛋白和ose1蛋白经过考马斯亮蓝染色后的蛋白条带。bsa梯度条带作为标定目的蛋白含量的标识。
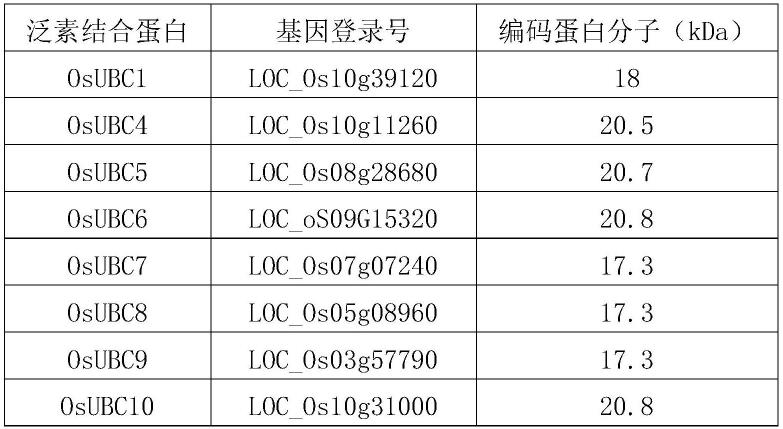
69.图3-9,通过二硫苏糖醇(dtt)敏感的硫酯键形成实验检测泛素结合酶(e2)活性的实验结果;其中,“+”表示对应的反应体系中含有该物质;
“‑”
表示对应的反应体系中不含该物质;箭头所指为e2-ubiquitin结合物和ubiquitin单体或者e2蛋白。
70.图3为来自亚家族i中osubc1(a)以及亚家族ii中osubc4(b)、osubc5(c)、osubc6(d)的e2结合活性实验结果。
71.图4为来自亚家族iii中osubc7(a)、osubc8(b)、osubc9(c)以及来自亚家族iv中osubc10(d)的e2结合活性实验结果。
72.图5为来自亚家族v中osubc11(a)以及来自亚家族vi中osubc13(b)、osubc14(c)、osubc16(d)的e2结合活性实验结果。
73.图6为来自亚家族vi中osubc18(a)、osubc19(b)、osubc22(c)和osubc23(d)的e2结合活性实验结果。
74.图7为来自亚家族vii中osubc25(a)和osubc26(b)的e2结合活性实验结果。
75.图8为来自亚家族viii中osubc28(a)、osubc29(b)、osubc30(c)和osubc31(d)的e2结合活性实验结果。
76.图9为来自亚家族ix中osubc32(a)、亚家族xii中osubc44(b)、亚家族xiv中osubc46(c)以及亚家族xv中osubc47(d)的e2结合活性实验结果。
77.综上所述,图3-9中的所有osubc蛋白均能与体系中的ub蛋白形成e2~ub结合物,这说明本发明中所包含的所有osubc蛋白均是有活性的。
78.图10为转基因愈伤来源的scf
d3-gfp e3连接酶的纯化和定量实验结果。从水稻转基因act:d3-gfp/d3愈伤组织中纯化所得scf
d3-gfp e3连接酶的检测定量。箭头所指分别是d3-gfp蛋白和gfp蛋白;bsa作为标准品来标定目的蛋白的含量。
79.图11的hsubch5c和hsubch7与scf
d3 e3连接酶特异协同工作效率的实验结果。b为检测不同温度下hsubch5c与scf
d3 e3连接酶特异协同工作的效率。
80.图12为人和水稻中e2同源蛋白的氨基酸序列比对信息。a为水稻中与hsubch5c和hsubch7高度同源的osubc14、osubc16和osubc23的氨基酸序列比对结果。b为水稻中与hscdc34高度同源的osubc11的氨基酸序列比对结果。
81.图13为鉴定水稻中与scf
d3 e3连接酶特异协同工作的e2。a为检测osubc11、osubc14和osubc16分别与scf
d3 e3连接酶协同工作的效率;b为检测osubc16和osubc23分别与scf
d3 e3连接酶协同工作的效率。
82.图14为转基因愈伤来源的scf
gid2-gfp e3连接酶的纯化和定量实验结果。从水稻转基因ubi:gid2-gfp/np愈伤组织中纯化所得的scf
gid2-gfp e3连接酶的定量检测。箭头所指分别是gid2-gfp蛋白和gfp蛋白;bsa作为标准品来标定目的蛋白的含量。
83.图15为鉴定水稻来源的e2蛋白与scf
gid2-gfp e3连接酶协同工作的效率。a为检测
osubc13、osubc14和osubc18分别与scf
gid2-gfp e3连接酶协同工作的效率;b为检测osubc16、osubc19和osubc23分别与scf
gid2-gfp e3连接酶协同工作的效率;c为检测osubc16、osubc18和osubc22分别与scf
gid2-gfp e3连接酶协同工作的效率;a、b和c的实验结果显示osubc18与scf
gid2-gfp e3连接酶协同工作的效率最高。
具体实施方式
84.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
85.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
86.实施例1、筛选鉴定与scf
d3 e3连接酶特异高效协同工作的e2
87.本发明所涉及的来源于水稻12个亚家族中的26个泛素结合蛋白包括osubc1蛋白、osubc4蛋白、osubc5蛋白、osubc6蛋白、osubc7蛋白、osubc8蛋白、osubc9蛋白、osubc10蛋白、osubc11蛋白、osubc13蛋白、osubc14蛋白、osubc16蛋白、osubc18蛋白、osubc19蛋白、osubc22蛋白、osubc23蛋白、osubc25蛋白、osubc26蛋白、osubc28蛋白、osubc29蛋白、osubc30蛋白、osubc31蛋白、osubc32蛋白、osubc44蛋白、osubc46蛋白和osubc47蛋白。其对应的编码基因登录号及其蛋白分子量信息如表1中所示(泛素蛋白结合酶基因信息和依据生物信息学进行的亚型分类记载于“bae,h.,and kim,w.t.(2014).classification and interaction modes of 40rice e2 ubiquitin-conjugating enzymes with 17rice arm-u-box e3ubiquitin ligases.biochem.biophys.res.commun.444,575-580.”)。
88.表1、本发明26个泛素结合蛋白编码基因的基因号及其蛋白分子量信息
89.dest-osubc14、pet-61-dest-osubc16、pet-61-dest-osubc18、pet-61-dest-osubc19、pet-61-dest-osubc22、pet-61-dest-osubc23、pet-61-dest-osubc25、pet-61-dest-osubc26、pet-61-dest-osubc28、pet-61-dest-osubc29、pet-61-dest-osubc30、pet-61-dest-osubc31、pet-61-dest-osubc32、pet-61-dest-osubc44、pet-61-dest-osubc46、pet-61-dest-osubc47。
96.用同样的方法克隆得到蛋白表达质粒pet-55-dest-ose1、pet-60-dest-osub和pet-61-dest-osub。其中,pet-55-dest载体(novagen,货号:71846)是n端有strep标签的、c端带有his标签的,pet-60-dest载体(novagen,货号:71851)是n端有gst标签的,pet-61-dest载体(novagen,货号:71852)是n端有his标签的。
97.各重组表达载体中所涉及的泛素结合蛋白、泛素蛋白ub或者e1的编码基因的登录号如表1所示。
98.表2、扩增本发明中蛋白编码基因的引物
99.100.[0101][0102]
2、osubc、osub和ose1蛋白的表达、纯化及活性鉴定
[0103]
(a1)将步骤1获得的融合his标签的泛素结合蛋白osubcs的表达质粒、融合his标签或gst标签的泛素蛋白osub的表达质粒和融合strep标签和his标签的泛素活化酶ose1的表达质粒分别转化大肠杆菌蛋白表达菌株bl21(de3);
[0104]
(a2)分别挑取单克隆于10ml lb液体培养基(配方:10g/l tryptone,5g/l酵母提取物,10g/l nacl)中,在37℃过夜培养进行菌体活化;
[0105]
(a3)将活化的菌体培养液按照1:50或者1:100的比例进行扩大培养,在37℃培养至od600为0.8,然后加入终浓度为0.3mm iptg(sigma,货号:i5502),在16℃,180rpm的培养条件下进行蛋白诱导表达,一般蛋白诱导表达的时间为16-20h;
[0106]
(a4)通过离心收集菌体,并使用his标签蛋白提取液(配方:50mm tris-hcl(ph 7.5),100mm nacl,10mm naf,20mm咪唑(sigma,货号:56748),10%(v/v)甘油,0.5%(v/v)nonidet p-40,使用前现加如下成分:1mm pmsf,1mm dtt)或者gst标签蛋白提取液(配方:50mm tris-hcl(ph 7.5),100mm nacl,10mm naf,2mm edta(ph 8.0),10%(v/v)甘油,0.5%(v/v)nonidet p-40,使用前现加如下成分:1mm pmsf,1mm dtt)重悬菌体;
[0107]
(a5)细胞破碎:使用高压细胞破碎仪(jnbio,型号:jn-3000plus)破碎菌体后,然后在4℃,15,000g,离心20min,留取蛋白上清液;
[0108]
(a6)蛋白上清液按照说明书步骤使用ni sepharose 6fast flow填料(ge health,货号:17-5318-01)或者glutathione sepharose resin填料(ge health,货号:17-5132-01)进行蛋白纯化;
[0109]
(a7)纯化所得的蛋白经过sds-page电泳和考马斯亮蓝染色检验纯度和定量,然后分装后冻存在-80℃待用。
[0110]
经纯化所得的osubc蛋白通过sds-page电泳和考马斯亮蓝染色进行蛋白定量,结果如图1中a、b、c和d所示,从图1可以看出:各osubc蛋白的条带相对比较单一,说明纯化所得的osubc蛋白纯度较高,依据bsa梯度条带对osubc蛋白进行定量的结果如表3中所示。经纯化所得的his-osub蛋白、gst-osub蛋白和strep-ose1-his蛋白(以下简写为strep-ose1蛋白)通过sds-page电泳和考马斯亮蓝染色进行蛋白定量,结果如图2中a、b和c所示,从图2
中可以看出:his-osub蛋白、gst-osub蛋白和strep-ose1-his蛋白的条带单一,纯度较高,并依据bsa梯度条带对其进行定量的结果展示在表3中。
[0111]
表3、osubc蛋白、osub蛋白和ose1蛋白的蛋白浓度信息
[0112]
[0113][0114]
一般有活性的泛素结合蛋白会与泛素蛋白ubiquitin分子通过二硫键形成泛素结合蛋白-泛素蛋白结合物(ubc-ubiquitin结合物)来完成泛素化修饰过程中泛素蛋白的呈递。纯化后的osubc蛋白,按照如下步骤(b1)-(b4)进行泛素结合活性分析:
[0115]
(b1)水稻泛素结合蛋白(osubcs)的活性分析实验体系为30μl,其中反应体系成分包括:50mm tris(ph 7.4),10mm mgcl2,5mm atp,50ng ose1(即strep-ose1蛋白),200ng osubc1、osubc4、osubc5、osubc6、osubc7、osubc8、osubc9、osubc10、osubc11、osubc13、osubc14、osubc16、osubc18、osubc19、osubc22、osubc23、osubc25、osubc26、osubc28、osubc29、osubc30、osubc31、osubc32、osubc44、osubc46或osubc47,2μg泛素蛋白(即his-osub或者gst-osub),加或者不加2mm dtt。
[0116]
(b2)为保证泛素结合蛋白活性分析个平行反应开始时间一致,活性分析实验的加样顺序依次为:osubc,泛素蛋白,ose1,20
×
反应缓冲液(配方:1m tris(ph 7.4),200mm mgcl2,100mm atp,加或者不加40mm dtt)。
[0117]
(b3)泛素结合蛋白活性反应的反应条件为28℃,反应时间为30min。反应结束后,加入6
×
sds sample loading buffer(配方:0.25m tris(ph 8.0),30%(v/v)glycerol,10%(w/v)sds,加或者不加0.6m dtt)终止反应。其中,该步骤使用加或不加dtt的6
×
sds sample loading buffer要与步骤(2)对应一致。
[0118]
(b4)将活性反应样品进行sds-page电泳,通过半干转膜仪转膜至nc膜,孵育anti-ubiquitin抗体(鼠源,cell signaling,货号:3936s)和anti-mouse-hrp抗体(为hrp标记二抗,ge health,货号:na931v),显影。若实验结果显示没有加dtt的活性反应样品出现osubc-ub大小的条带,但是加dtt后osubc-ub大小的条带消失,则说明所述待测蛋白具有泛素结合酶活性。
[0119]
结果显示:osubc1(图3中a)、osubc4/5/6(图3中b、c和d)、osubc7/8/9(图4中a、b和c)、osubc10(图4中d)、osubc11(图5中a)、osubc13/14/16(图5中b、c和d)、osubc18/19/22/23(图6中a、b、c和d)、osubc25/26(图7中a和b)、osubc28/29/30/31(图8中a、b、c和d)、osubc32(图9中a)、osubc44(图9中b)、osubc46(图9中c)以及osubc47(图9中d)均能通过二硫键形成泛素结合蛋白~泛素蛋白结合物(ubc~ub结合物),并且此结合物均是dtt敏感的。
[0120]
综上所述,水稻来源的26个泛素结合蛋白均具有泛素结合酶活性。
7.4),200mm mgcl2,100mm atp,40mm dtt)。
[0133]
(d3)e2-e3特异性筛选活性反应的反应条件为28℃,震荡950rpm,反应时间为2h。反应结束后,加入6
×
sds sample loading buffer终止反应。
[0134]
(d4)将活性反应样品进行sds-page电泳,通过半干转膜仪转膜至nc膜,孵育anti-ubiquitin抗体(鼠源,cell signaling,货号:3936s)和anti-mouse-hrp抗体(为hrp标记二抗,ge health,货号:na931v),显影。若实验结果显示,具有不同分子量大小的、连续的泛素信号,即为多聚泛素链信号,则说明所述待测泛素结合酶e2能够与所述植物多亚基scf e3连接酶协同工作形成多聚泛素链。
[0135]
首先检测商业化的hsubch5c蛋白(bioton biochem,货号:e2-627)和hsubch7蛋白(bioton biochem,货号:e2-642)是否能与scf
d3-gfp e3连接酶协同工作。hsubch5c和hsubch7能共同与scf
fbxl18 e3连接酶协同工作(记载于“petroski,m.d.&deshaies,r.j.(2005)in vitro reconstitution of scf substrate ubiquitination with purified proteins.method enzymol.398,143-158.”、“skowyra,d.,craig,k.l.,tyers,m.,elledge,s.j.&harper,j.w.(1997)f-box proteins are receptors that recruit phosphorylated substrates to the scf ubiquitin-ligase complex.cell91,209-219.”、“deffenbaugh,a.e.et al.(2003)release of ubiquitin-charged cdc34-s~ub from the ring domain is essential forubiquitination of the scf
cdc4-bound substrate sic1.cell114,611-622.”和“liu,y.et al.(2015).f-box protein fbxl18 mediates polyubiquitylation and proteasomal degradation of the pro-apoptotic scf subunit fbxl7.cell death dis.6,e1630”四文中)。
[0136]
实验结果显示,hsubch5c作为e2能高效的与scf
d3-gfp e3连接酶协同工作形成多聚泛素链,而hsubch7却不能与scf
d3-gfp e3连接酶协同工作(图11中a)。为了进一步确定泛素化活性体系所需的最适反应温度,本发明同时检测了22℃、28℃和37℃三个温度反应条件(对应步骤(d3)反应温度)。实验结果显示,无论是22℃、28℃还是37℃,hsubch5c均能与scf
d3 e3连接酶高效协同工作(图11中b);而在37℃温度条件下,人来源的hsubch5c与scf
d3 e3连接酶协同工作效率略高于22℃和28℃。因为28℃是最接近水稻最适生长温度的条件,因此,在之后的所有活性分析实验中,我们选择28℃作为活性分析体系的反应温度。
[0137]
3、筛选能与scf
d3 e3连接酶高效协同工作的水稻来源的e2
[0138]
本案例是以水稻独脚金内酯信号途径中的scf
d3 e3连接酶为例,展示筛选鉴定与scf
d3 e3连接酶协同工作的泛素结合酶e2的方法体系;但该方法体系的应用并不限于scf
d3 e3连接酶,还可应用于筛选鉴定与任何scf e3连接酶协同工作的泛素结合酶e2的发掘中。具体操作步骤参见步骤2中的(d1)-(d4),不同之处在于将步骤一获得的osubc11、osubc14、osubc16和osubc23作为待测e2。
[0139]
为了进一步确定体外活性重组体系中合适的水稻来源的e2,我们通过同源序列比对的方法得到了水稻中hsubch5c和hsubch7的同源蛋白是osubc14、osubc16和osubc23,编码所述水稻来源的osubc14蛋白、osubc16蛋白和osubc23蛋白的基因登录号在表1中展示。人类hsubch5c和hsubch7与水稻osubc14、osubc16和osubc23的氨基酸序列同源比对结果显示其相互之间存在高度的氨基酸序列同源性(图12中a)。人类hscdc34在水稻中的同源蛋白是osubc11,编码osubc11蛋白的基因登录号在表1中展示。人类hscdc34与水稻osubc11的氨
基酸序列同源比对结果显示其相互之间存在高度的氨基酸序列同源性(图12中b)。
[0140]
接下来将步骤一获得的osubc11、osubc14、osubc16和osubc23(图1中b)分别与步骤二1所得的scf
d3-gfp e3连接酶进行特异性活性分析研究,实验结果显示,与hsubch5c相比较,osubc14能同样高效地与scf
d3-gfp e3连接酶协同工作形成多聚泛素链(图13中a),而osubc16、osubc23能与scf
d3 e3连接酶协同工作,但是效率较低(图13中a和b);osubc11并不能与scf
d3 e3连接酶高效协同工作(图13中a)。由此可见,osubc14可作为e2,与scf
d3 e3连接酶高效协同工作。
[0141]
实施例2、筛选鉴定与scf
gid2 e3连接酶特异高效协同工作的e2
[0142]
一、获取水稻scf
gid2 e3连接酶复合体
[0143]
参照实施例1步骤一1进行,使用引物组合gwgid2f与gwgid2r(表2),以日本晴水稻幼苗茎基部cdna为模板,扩增获得编码osgid2基因序列。继而将gid2基因片段重组至中间pdonr221载体获得pdonr221-osgid2质粒,然后将gid2基因片段重组至终端载体pmhb7fm21gw-ubil(vib-ugent center for plant systems biology,货号:vector id:3_64;该载体是双元载体,带有c端gfp标签)上,得到pmhb7fm21gw-ubil-gid2质粒。将pmhb7fm21gw-ubil-gid2质粒转化进入农杆菌eha109感受态细胞菌株,然后使用含有pmhb7fm21gw-ubil-gid2质粒的农杆菌侵染转化水稻愈伤组织,从而得到ubi:gid2-gfp转基因愈伤组织材料。
[0144]
参照实施例1步骤二1进行,经过(c1)-(c4)步骤,将从水稻转基因ubi:gid2-gfp愈伤组织(其中,编码gid2蛋白的基因登录号是ab100246.1)中纯化所得的scf
gid2-gfp
复合体经过sds-page电泳进行定量分析(其中,scf
gid2-gfp
复合体的定量主要依据gid2-gfp蛋白的含量进行定量的)(图14)。
[0145]
二、筛选鉴定与水稻scf
gid2 e3连接酶高效协同工作的e2
[0146]
因为与scf
d3 e3连接酶高效协同工作的osubc14来自亚家族vi亚家族,在筛选与其他scf e3连接酶高效协同工作的e2,我们优先考虑筛选来自亚家族vi亚家族的e2蛋白;本发明实施例1步骤一克隆得到的26个osubc蛋白中包含7个第vi亚家族的osubc蛋白:osubc13、osubc14、osubc16、osubc18、osubc19、osubc22和osubc23,其编码所述osubc蛋白的基因登录号在表1中展示。
[0147]
接下来将实施例1步骤一所得的osubc13、osubc14、osubc16、osubc18、osubc19、osubc22和osubc23(图1中b和c)分别与步骤一所得的scf
gid2-gfp e3连接酶进行特异性活性分析研究,具体步骤见实施例1步骤2和3中的(d1)-(d4);实验结果显示,osubc13、osubc14、osubc16、osubc18、osubc19、osubc22和osubc23均具有与scf
gid2-gfp e3连接酶协同工作的活性(图15中a、b和c),通过进一步活性实验分析发现osubc18与scf
gid2 e3连接酶协同工作的活性最高(图15中c)。因此,osubc18可作为e2,与scf
gid2 e3连接酶高效协同工作。
[0148]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1