壮药透骨香活性成分的提取分离方法
1.本发明涉及化合物提取及分离技术领域,具体涉及壮药透骨香活性成分的提取分离方法。
背景技术:
2.透骨香为杜鹃花科白珠树属植物滇白珠的全株或根,分布于我国长江流域及其以南各省区。入药具有祛风除湿,散寒止痛,活血通络,化痰止咳的功效。对风湿痹痛、胃寒疼痛、跌打损伤、咳嗽痰多等病症有治疗作用。初步研究表明,透骨香中主含挥发油(主要为水杨酸甲酯)、木脂素苷类、二萜类、三萜类、黄酮类、有机酸类等成分。但目前,对透骨香的活性成份的相关研究报道较少,不利于对该药材的充分利用。因此研究如何从透骨香中提取和分离出这些活性成分并加以利用,对进一步提高透骨香的利用价值,造福人类有积极意义。
技术实现要素:
3.本发明的发明目的在于:针对上述存在的问题,提供壮药透骨香活性成分的提取分离方法,本发明的方法能够对壮药透骨香中多种活性成分的小分子化合物进行分离。
4.为了实现上述目的,本发明采用的技术方案如下:
5.壮药透骨香活性成分的提取分离方法,是指从透骨香的乙酸乙酯部位分离得到化合物1-4,分别为hydroxypinoresinol、syringaresinol、medioresino和pinoresinol,包括以下步骤:
6.(1)用乙醇对透骨香粉末进行提取,提取液浓缩获得透骨香总浸膏;
7.(2)透骨香总浸膏分散于水中,得分散液,分散液用石油醚、乙酸乙酯、正丁醇依次进行萃取,得到的石油醚部位、乙酸乙酯部位、正丁醇部位;
8.(3)将乙酸乙酯部位过ods反相柱分离,依次采用50v/v%的甲醇水溶液和70v/v%甲醇水溶液分别洗脱,洗脱液合并得到组分fr1;采用80v/v%甲醇水溶液洗脱,得到组分fr2;采用500ml的90v/v%甲醇水溶液洗脱,用三个样品瓶接取,每个样品瓶接三分之一的溶液,标记为10,11,12号溶液,10,11号溶液合并,得到溶液组分fr3;采用100v/v%的甲醇水溶液洗脱,洗脱液与12号溶液合并,得到组分fr4;
9.(4)用半制备液相对组分fr1,fr2,fr3,fr4进行细分;组分fr1分离时半制备液相条件:柱温30℃,流动相a-水:流动相b-甲醇的体积比为3:2,流速4ml/min,检测波长为201nm;用此条件分离得到化合物1;组分fr2分离时半制备液相的条件为:柱温30℃,流动相a-水:流动相b-甲醇的体积比为1:1,流速4ml/min,检测波长为201nm,用此条件分离得到化合物2;组分fr3分离时半制备液相条件柱温30℃,流动相a-水:流动相b-甲醇体积比为5:6,流速4ml/min,检测波长为201nm,用此条件的到化合物3;组分fr4分离时半制备液相条件柱温30℃,流动相a-水:流动相b-甲醇体积比为5:8,流速4ml/min,检测波长为201nm,用此条件的到化合物4。
10.进一步地,本发明的分离纯化方法还包括从透骨香的正丁醇部位分离得到化合物5-11,分别为medioresinol-di-o-β-d-glucopyranoside、liriodendrin、hydroxypinoresinol4'-o-β-d-glucopyranoside、5-methoxy-guaiacylglycerol、3,5-dimethoxy-benzylalcohol-4-o-β-d-glucopyranoside、1,2-propanediol,1-(4-hydroxy-3,5-dimethoxyphenyl),(1r,2r)和(-)-(7r,8s)-dihydrodehydrodiconiferyl alcohol,所述提取分离方法包括步骤(5)-(7),具体提为:
11.(5)将正丁醇部位过ods反相柱,采用5v/v%的甲醇水溶液洗脱,洗脱液合并得到组分a;
12.(6)组分a用lh-20凝胶柱进行分离,用二氯甲烷与甲醇体积比为1:1的洗脱液等度洗脱,得到纯化后的6个组分fr5,fr6,fr7,fr8 fr9,fr10;
13.(7)用半制备液相对组分fr5,fr6,fr7,fr8 fr9,fr10进行细分;组分fr5分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为4:1,流速4ml/min,检测波长为210nm,用此条件分离得到化合物9和化合物11;组分fr6分离时半制备液相的条件为:柱温27℃,流动相a-水:流动相b-甲醇为3:1,流速4ml/min,检测波长为210nm,用此条件分离得到化合物10;组分fr7分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为7:3,流速4ml/min,检测波长为205nm,用此条件的到化合物5;组分fr8分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为2:1,流速4ml/min,检测波长为205nm;用此条件的到化合物6;组分fr9分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为2:1,流速4ml/min,检测波长为205nm,用此条件的到化合物7和化合物8。
14.优选地,步骤(1)的具体操作为:
15.润湿:将壮药透骨香药粉用95v/v%的乙醇充分润湿,透骨香粉末与乙醇量质量比为1:1;
16.装筒:将充分浸润的透骨香粉末均匀装到渗漉桶中;
17.排气:在壮药透骨香装入渗漉筒后,加入95v/v%的乙醇,并将壮药透骨香间的空气排出;
18.浸渍:将装入渗漉桶中的药粉静置24小时,使溶剂在透骨香粉末之间充分渗透扩散;
19.渗漉:向渗漉装置中不断加入95%的乙醇,流速控制在3ml/min,待渗漉液的颜色变浅,气味变淡之后停止渗漉;
20.浸膏:将渗漉液收集,旋转蒸发至干,得到透骨香总浸膏。
21.综上所述,由于采用了上述技术方案,本发明的有益效果是:
22.1、本发明首次从壮药透骨香中分离出了11种化合物,对壮药透骨香的进一步深入研究和利用具有积极的意义。
23.2、本发明的采用溶剂萃取后再用ods反相柱分离、lh-20凝胶柱分离和半制备液相分离提取活性物质,分离方法合理,操作简单,对透骨香活性物质分离提取率高,适合工业化生产。
附图说明
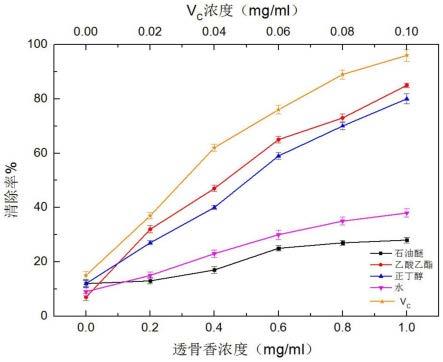
24.图1为本发明中透骨香极性部位清除dpph自由基实验结果;
25.图2为本发明中透骨香极性部位清除abts自由基实验结果。
具体实施方式
26.为了更清楚地表达本发明,以下通过具体实施例对本发明作进一步说明。
27.步骤1:总浸膏的制备
28.润湿:将透骨香药粉先放入大烧杯中用95%的乙醇润湿,拌匀后,密闭放置3小时,使其充分吸收溶液,以免直接装入渗漉筒中因膨胀而造成堵塞,影响后续渗漉的结果。浸润过程中透骨香粉末与乙醇量为1:1。
29.装筒:将透骨香粉末均匀的装到渗漉桶中,松紧适中。
30.排气:在壮药透骨香装入渗漉筒后,加入95%的乙醇,并将壮药透骨香间的空气排出。
31.浸渍:将装入渗漉桶中的药粉静置24小时,使溶剂在透骨香粉末之间充分渗透扩散。
32.渗漉:向渗漉装置中不断加入95%的乙醇,流速控制在3ml/min。待渗漉液的颜色变浅,气味变淡之后停止渗漉。
33.浸膏:将渗漉液收集,旋转蒸发至干,得到浸膏。
34.注意:在渗漉的过程中乙醇要始终没过透骨香粉末的表面,以免药粉出现干裂的情况,这会影响有物质的浸出。
35.步骤2:总浸膏的提取
36.将透骨香总浸膏分散于水中,得分散液,分散液用石油醚、乙酸乙酯、正丁醇依次进行萃取,得到的石油醚部位、乙酸乙酯部位、正丁醇部位;具体操作如下:
37.将上透骨香总浸膏用蒸馏水溶解,然后用石油醚和水溶解液进行萃取,石油醚与水溶解液比例为1:3,同样的比例萃取三次。萃取上层为石油醚层,下层为水层a。从上口将石油醚层倒出,得到石油醚部位,从下口将水层倒出,得到水层a。而后用乙酸乙酯和水层a进行萃取,萃取比例为1:3,反复萃取三次,萃取上层为乙酸乙酯层,下层为水层b。从上口将醋酸乙酯层倒出,得到醋酸乙酯部位,从下口将水层倒出,得到水层b。最后用正丁醇和水层b进行萃取,萃取比例为1:3,反复萃取三次,萃取上层为正丁醇层,下层为水层c。从上口倒出正丁醇层,得到正丁醇部位,从下口放出水层c,得到水部。将上述萃取所得到的四个不同极性部位的溶液旋转蒸发至干,得到石油醚部位浸膏40g,醋酸乙酯部位浸膏20g,正丁醇部位30g,水部位浸膏50g。
38.不同极性部位抗氧化活性实验
39.(1)溶液配置
40.样品配置:称取从壮药透骨香不同极性部位各10mg,向其中加入10ml的去离子水溶液,将其配成浓度为1mg/ml的母液。从母液中分别吸取200μl、400μl、600μl、800μl、1000μl再向其中加入800μl、600μl、400μl、200μl、0μl的水溶液,配置成浓度为0.2mg/ml、0.4mg/ml、0.6mg/ml、0.8mg/ml、1mg/ml的样品溶液。
41.vc配置:称取10mg的vc,向其中加入10ml的水溶液,配置成1mg/ml的母液,再从其中吸取20μl、40μl、60μl、80μl、100μl的溶液,再向其中加入980μl、960μl、940μl、920μl、900μl的水溶液,配置成浓度为浓度为0.02mg/ml、0.04mg/ml、0.06mg/ml、0.08mg/ml、0.1mg/ml
的vc溶液,作为阳性对照。
42.dpph溶液的配置:称取0.01g的dpph,向其中加入250ml的无水乙醇溶液,配置成浓度为0.1mmol/l的dpph溶液溶液。
43.abts溶液的配置:称取0.768g的abts,向其中加入200ml的去离子溶液,配置成浓度为7mmol/l的abts溶液。
44.过硫酸钾溶液的配置:称取0.1324g的过硫酸钾,向其中加入200ml的去离子水溶解,配置成浓度为2.45mmol/l的过硫酸钾溶液
45.工作液配置:取50mlabts溶液和50ml过硫酸钾溶液,将它们混合在一起,在避光的条件下静置12小时,温度控制在4℃。将上述混合溶液中加入蒸馏水,使其波长在734nm时吸光度达到0.7左右
46.(2)清除dpph自由基的能力测定
47.实验方法:空白组是将150μl的dpph溶液和50μl的蒸馏水混合在一起(a
空白
),样品组是将150μl的dpph溶液和50μl的不同浓度样品混合(a
样品
),阴性对照组是将150μl的蒸馏水溶液和50μl不同浓度的样品混合(a
阴性对照
),阳性对照是取150μl的dpph溶液和50μl的不同浓度vc(a阳性对照)。将上述的空白组,阴性对照组,样品组,阳性对照组都放在黑暗的地方反应30分钟,最后用波长517nm的酶标仪测其吸光度。清除率公式如下:
48.清除率=[a
空白-(a
样品-a
阴性对照
)]/a空白
×
100%
[0049]
样品的清除率越高,证明其抗氧化效果越好。
[0050]
(3)清除abts自由基的能力测定
[0051]
实验方法:空白组是将150μl工作液和50μl去离子水进行混合(a
空白
),样品组是将150μl工作液和50μl不同浓度的样品进行混合(a
样品
),对照组是用150μl去离子水和不同浓度的样品进行混合,每个浓度的样品都取50μl(a
阴性对照
),阳性对照是将150μl工作液和50μl不同浓度的vc进行混合(a
阳性对照
)。最后将空白组,对照组,样品组,阳性对照组放在黑暗处反应6min,最后在734nm下用酶标仪测其吸光度。清除率计算公式为:
[0052]
清除率=[a
空白-(a
样品-a
阴性对照
)]/a空白
×
100%
[0053]
样品的清除率越高,证明其抗氧化效果越好。
[0054]
(4)清除dpph自由基实验结果
[0055]
在本实验中可以通过测量dpph自由基的清除率来判断壮药透骨香的抗氧化能力。清除dpph自由基的能力越强,说明它的抗氧化能力越强。根据实验可以看出,乙酸乙酯部位和正丁醇部位清除dpph自由基的能力相比石油醚部位和水部位强一些。在浓度达到1mg/ml时乙酸乙酯部位和正丁醇部位对dpph的清除率达到85%和80%(见图1)。一般酚类化合物越多,其抗氧化活性越强,乙酸乙酯部位和正丁醇部位活性较好,说明其中可能含有大量的酚类化合物。
[0056]
(5)清除abts自由基实验结果
[0057]
在本实验中可以通过测量abts自由基的清除率来判断壮药透骨香的抗氧化能力。清除abts自由基的能力越强,说明它的抗氧化能力越强。从图2可以看出,乙酸乙酯部位和正丁醇部位清除abts自由基的能力相比石油醚部位和水部位强一些。在浓度达到1mg/ml时乙酸乙酯部位和正丁醇部位对abts的清除率达到90%和80%。
[0058]
因此,透骨香中的乙酸乙酯部位和正丁醇部位可以应用在抗氧化产品的制备中。
[0059]
步骤3:乙酸乙酯部位ods反相柱分离
[0060]
将乙酸乙酯部位过ods反相柱分离,依次采用50v/v%的甲醇水溶液和70v/v%甲醇水溶液分别洗脱,洗脱液合并得到组分fr1;采用80v/v%甲醇水溶液洗脱,得到组分fr2;采用500ml的90v/v%甲醇水溶液洗脱,用三个样品瓶接取,每个样品瓶接三分之一的溶液,标记为10,11,12号溶液,10,11号溶液合并,得到溶液组分fr3;采用100v/v%的甲醇水溶液洗脱,洗脱液与12号溶液合并,得到组分fr4;
[0061]
具体操作为:ods反相柱装柱,将乙酸乙酯部位样品用少量的甲醇溶解,将溶解液倒入干的ods反相柱的粉末中,搅拌均匀后倒入茄形瓶中,旋转蒸发至干,得到含有乙酸乙酯部位样品的ods反相柱粉末。将层析柱下端塞上棉花,松紧适中,然后向层析柱中倒入50%的甲醇水溶液至层析柱体积的三分之一处停止,加入拌有乙酸乙酯部位样品的ods反相柱粉末。再向层析柱中倒入500ml的50%的甲醇水溶液。准备三个锥形瓶,打开层析柱的开关,每个样品瓶接三分之一的溶液,标记为1,2,3。待接完后,向层析柱中加入500ml的70%甲醇水溶液,用三个锥形瓶接取,每个样品瓶接三分之一的溶液,标记为4,5,6。接完后,再向层析柱中加入500ml的80%甲醇水溶液,用三个锥形瓶接取,每个样品瓶接三分之一的溶液,标记为7,8,9。接取完成后,向层析柱中加入90%的甲醇水溶液,用三个锥形瓶接取,每个样品瓶接三分之一的溶液,标记为10,11,12。接取完成后,向层析柱中加入100%的甲醇水溶液,用三个锥形瓶接取,每个样品瓶接三分之一的溶液,标记为13,14,15。接取完成后用100%的甲醇冲洗柱子,直到冲洗干净为止。对所接取的1-15号溶液进行点板,将点板结果一样的溶液合并。根据点板结果,最终将1,2,3,4,5,6号溶液合并得到组分fr1;7,8,9号溶液合并,得到组分fr2;10,11号溶液合并,得到溶液组分fr3;12,13,14,15号溶液合并,得到组分fr4。
[0062]
步骤4:用半制备液相对组分fr1,fr2,fr3,fr4进行细分。
[0063]
组分fr1分离时半制备液相条件:柱温30℃,流动相a-水:流动相b-甲醇的体积比为3:2,流速4ml/min,检测波长为201nm;用此条件分离得到化合物1(12mg);组分fr2分离时半制备液相的条件为:柱温30℃,流动相a-水:流动相b-甲醇的体积比为1:1,流速4ml/min,检测波长为201nm,用此条件分离得到化合物2(9mg);组分fr3分离时半制备液相条件柱温30℃,流动相a-水:流动相b-甲醇体积比为5:6,流速4ml/min,检测波长为201nm,用此条件的到化合物3(13mg);组分fr4分离时半制备液相条件柱温30℃,流动相a-水:流动相b-甲醇体积比为5:8,流速4ml/min,检测波长为201nm,用此条件的到化合物4(10mg)。
[0064]
步骤5:正丁醇部位过ods反相柱
[0065]
采用5v/v%的甲醇水溶液洗脱,洗脱液合并得到组分a。具体步骤为:ods反相柱装柱:将正丁醇部位样品用少量的甲醇溶解,将溶解液倒入干的ods反相柱的粉末中,搅拌均匀后倒入茄形瓶中,旋转蒸发至干,得到含有正丁醇部位样品的ods反相柱粉末。将层析柱下端塞上棉花,松紧适中,然后向层析柱中倒入5%的甲醇水溶液至层析柱体积的三分之一处停止,加入拌有正丁醇部位样品的ods反相柱粉末。再向层析柱中倒入500ml的5%的甲醇水溶液。准备三个锥形瓶,打开层析柱的开关,每个样品瓶接三分之一的溶液,标记为1,2,3。将1,2,3号溶液合并得到组分a。
[0066]
步骤6:组分a凝胶柱分离
[0067]
上述所得组分a成分较为复杂,所以先用lh-20凝胶柱进行分离。凝胶柱装柱:先用
二氯甲烷与甲醇体积比为1:1的溶液浸泡lh-20凝胶柱材料12小时。在层析柱底部塞上棉花后,将浸泡好的凝胶柱材料和二氯甲烷-甲醇(1:1)倒入层析柱中。再将组分a用二氯甲烷与甲醇体积比为1:1的溶液溶解后倒入层析柱中。用二氯甲烷与甲醇体积比为1:1的稀土业等度洗脱,得到纯化后的6个组分fr5,fr6,fr7,fr8 fr9,fr10。
[0068]
步骤7:用半制备液相对组分fr5,fr6,fr7,fr8 fr9,fr10进行细分。
[0069]
组分fr5分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为4:1,流速4ml/min,检测波长为210nm,用此条件分离得到化合物9(12mg)和化合物11(11mg);组分fr6分离时半制备液相的条件为:柱温27℃,流动相a-水:流动相b-甲醇为3:1,流速4ml/min,检测波长为210nm,用此条件分离得到化合物10(11mg);组分fr7分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为7:3,流速4ml/min,检测波长为205nm,用此条件的到化合物5(25mg);组分fr8分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为2:1,流速4ml/min,检测波长为205nm;用此条件的到化合物6(18mg);组分fr9分离时半制备液相条件:柱温27℃,流动相a-水:流动相b-甲醇为2:1,流速4ml/min,检测波长为205nm,用此条件的到化合物7(10mg)和化合物8(13mg)。
[0070]
化合物的鉴定
[0071]
(1)化合物1为hydroxypinoresinol:无定型粉末,esi-ms m/z:375[m+h]
+
,分子式:c
20h22
o7。
[0072]
13
c-nmr(dmso-d6,100mhz)δ:90.93(c-1),87.06(c-2),70.15(c-4),60.67(c-5),85.26(c-6),74.45(c-8),127.86(c-1’),132.18(c-1”),112.08(c-2’),110.50(c-2”),146.74(c-3’),147.33(c-3”),145.77(c-4’,c-4”),114.40(c-5’),114.98(c-5”),120.08(c-6’),118.74(c-6”),55.44(och3)。
[0073]1h-nmr(dmso-d6,400mhz)δ:2.86-2.91(1h,m,h-5),3.71(2h,d,h-4),3.76(6h,s,3’,3
”‑
och3),4.06(2h,s,h-8),4.51(1h,s,h-2),4.74(1h,d,j=5.2hz,h-6),6.69-6.81(4h,m,h-2’,2”,5’,5
”‑
h),6.96(2h,dd,j=6.8,1.6hz,h-6’,6”),8.85(1h,s,4
”‑
oh),8.96(1h,s,4
’‑
oh)。
[0074]
以上nmr与文献报道基本一致,故鉴定化合物1为hydroxypinoresinol,结构式如下,该化合物为该植物首分化合物。
[0075]
[0076]
(2)化合物2为syringaresinol:无定型粉末,esi-ms m/z:419[m+h]
+
,分子式:c
22h25
o8。
[0077]
13
c-nmr(dmso-d6,100mhz)δ:54.13(c-1,5),56.45(ome),71.52(c-4,8),85.81(c-2,6),104.04(c-2’,2”,6’,6”),131.89(c-1’,1”),135.27(c-4’,4”),148.35(c-3’,3”,5’,5”)。
[0078]
.1
h-nmr(dmso-d6,400mhz)δ:8.27(2h,s,4’,4”oh),6.60(4h,arom.h),4.62(2h,d,j=3.6hz,h-2,h-6),3.75(12h,s,h-och3),3.05(2h,m,h-1,h-5)。
[0079]
以上nmr与文献报道基本一致,故鉴定化合物2为syringaresinol,结构式如下,该化合物为该植物首分化合物。
[0080][0081]
(3)化合物3为medioresino:无定型粉末,esi-ms m/z:389[m+h]
+
,分子式:c
21h24
o7,
[0082]
13
c-nmr(dmso-d6,100mhz)δ:53.98(c-1),54.16(c-5),56.03(3
”‑
ome),56.44(3’,5
’‑
ome),71.36(c-4),71.49(c-8),85.61(c-2),85.82(c-6),104.02(c-2’,c-6’),110.84(c-2”),115.58(c-5”),119.07(c-6”),131.84(c-1”),132.61(c-1’),135.23(c-4’),146.40(c-4”),147.97(c-3”),148.33(c-3’,5’)。
[0083]1h-nmr(dmso-d6,400mhz)δ:3.04(2h,m,h-1,h-5),3.75(6h,s,3’,5
’‑
och3),3.76(3h,s,3
”‑
och3),4.61(2h,d,j=3.2hz,h-2,h-6),6.60-6.89(5h,arom.h)。
[0084]
以上nmr与文献报道基本一致,故鉴定化合物3为medioresino,结构式如下,该化合物为该植物首分化合物。
2’,6’),110.95(c-6”),115.56(c-3”),118.60(c-2”),134.08(c-1’),135.55(c-1”),137.56(c-4’),146.27(c-5”),149.35(c-4”),153.06(c-3’,5’);
[0093]1h-nmr(dmso-d6,400mhz)δ:3.03(2h,m,h-1,5),3.75(9h,m,ome),,4.94(1h,d,j=3.2,h-6),5.03(1h,d,j=3.7,h-2),4.88(2h,m,glu-1,1’),7.04(1h,d,h-5”),6.95(1h,d,j=1.2,h-2”),6.86(1h,d,j=8.4,h-2”),6.66(2h,s,h-2’,6’)。
[0094]
以上nmr与文献报道基本一致,故鉴定化合物8为medioresinol-di-o-β-d-glucopyranoside,结构式如下,该化合物为该植物首分化合物。
[0095][0096][0097]
(6)化合物6为liriodendrin无定型粉末esi-ms m/z:743[m+h]
+
.分子式:c
34h46o18
)。
[0098]
13
c-nmr(dmso-d6,100mhz)δ:54.06(c-1,c-5),56.85(ome),61.34(glu-6,glu-6’),70.35(glu-4,glu-4’),71.80(c-4,c-8),74.59(glu-2,glu-2’),76.95(glu-3,glu-3’),77.67(glu-5,glu-5’),85.52(c-2,c-6),103.07(glu-1,glu-1’),104.63(c-2’,c-2”,c-6’,c-6”),134.10(c-1’,c-1”),137.53(c-4’,c-4”),153.07(c-3’,c-3”,c-5’,c-5”。
[0099]1h-nmr(dmso-d6,400mhz)δ:3.02(2h,m,h-1,5),3.76(12h,s,h-3’,5’,3”,5”),4.67(2h,d,j=3.6,h-2,6),6.66(4h,s,h-2’,6’,2”,6”)。以上nmr与文献报道基本一致,故鉴定化合物9为liriodendrin,结构式如下,该化合物为该植物首分化合物。
[0100][0101]
(7)化合物7为hydroxypinoresinol 4'-o-β-d-glucopyranoside无定型粉末,esi-ms m/z:521[m+h]
+
.分子式:c
26h32o11
。
[0102]
13
c-nmr(dmso-d6,100mhz)δ:56.02(ome),56.08(ome),61.09(glu-6),61.29(c-5),70.08(glu-4),70.84(c-4),73.66(glu-2),75.03(c-8),77.32(glu-3),77.44(glu-5),85.82(c-6),87.40(c-2),91.66(c-1),100.64(glu-1),111.08(c-6’),112.78(c-6”),114.95(c-3”),115.58(c-3’),119.33(c-2’),120.21(c-2”),131.46(c-1”),132.72(c-1’),146.36(c-4”),146.4(c-4’),147.93(c-5”),148.69(c-5’)。
[0103]1h-nmr(dmso-d6,100mhz)δ:6.73-7.04(6h,arom.h),2.90(1h,m,h-5),3.76(6h,s,5’,5
”‑
ome),4.58(1h,s,h-2),4.75(1h,d,j=5.2,h-6),4.87(1h,d,j=7.2,glc-1),2.90(1h,m,h-5),8.97(1h,s,oh)。
[0104]
以上nmr与文献报道基本一致,故鉴定化合物10为hydroxypinoresinol4'-o-β-d-glucopyranoside,结构式如下,该化合物为该植物首分化合物。
[0105][0106]
(8)化合物8为5-methoxy-guaiacylglycerol:amorphous powder,esi-ms m/z:245[m+h]
+
.molecular formula:c
11h16
o6。
[0107]
13
c-nmr(dmso-d6,100mhz)δ:56.37(6,8-ome),63.51(c-1),74.65(c-3),75.86(c-2),105.09(c-5,9),133.99(c-7),134.70(c-4),147.81(c-6,8)。
[0108]1h-nmr(dmso-d6,400mhz)δ:3.73(6h,s,6,8-ome),5.41(1h,s,7-oh),5.09(1h,d,j=4.4,h-3),6.59(2h,s,h-5,9)。
[0109]
以上nmr与文献报道基本一致,故鉴定化合物11为5-methoxy-guaiacylglycerol,结构式如下,该化合物为该植物首分化合物。
[0110][0111]
(9)化合物9为3,5-dimethoxy-benzyl alcohol-4-o-β-d-glucopyranoside,无定型粉末,esi-ms m/z:347[m+h]
+
.分子式:c
15h22
o9。
[0112]
13
c-nmr(dmso-d6,400mhz)δ:56.75(1,6-ome),61.38(c-6’),63.40(c-4’),70.42(c-3’),74.62(c-4),76.99(c-5’),77.64(c-2’),103.15(c-1’),104.98(c-2,5),133.53(c-7),138.67(c-3),152.94(c-1,6)。
[0113]1h-nmr(dmso-d6,400mhz)δ:3.73(6h,s,1,6-ome),4.87(1h,d,j=3.2,glu-1
′
),6.63(2h,s,2,5-h)。
[0114]
以上nmr与文献报道基本一致,故鉴定化合物12为3,5-dimethoxy-benzyl alcohol-4-o-β-d-glucopyranoside,结构式如下,该化合物为该植物首分化合物。
[0115][0116]
(10)化合物10为1,2-propanediol,1-(4-hydroxy-3,5-dimethoxyphenyl),(1r,2r):无定型粉末,esi-ms m/z:229[m+h]
+
.分子式:c
11h16
o5。
[0117]
13
c-nmr(dmso-d6,100mhz)δ:18.85(c-1),56.36(ome),71.11(c-2),77.48(c-3),104.69(c-5,9),134.17(c-7),134.56(c-4),147.85(c-6,8);
[0118]1h-nmr(dmso-d6,400mhz)δ:0.98(3h,d,h-1),1.24(2h,s,2,3-oh),3.73(6h,s,6,8-och3),4.24(1h,m,h-2),4.99(1h,d,j=3.6,h-3),6.56(2h,s,h-5,9),8.08(1h,s,7-oh)。
[0119]
以上nmr与文献报道基本一致,故鉴定化合物13为1,2-propanediol,1-(4-hydroxy-3,5-dimethoxyphenyl),(1r,2r),结构式如下,该化合物为该植物首分化合物。
[0120][0121][0122]
(11)化合物11为(-)-(7r,8s)-dihydrodehydrodiconiferyl alcohol.无定型粉末,esi-ms m/z:215[m+h]
+
.分子式:c
10h14
o5。
[0123]
13
c-nmr(dmso-d6,100mhz)δ:55.98(ome),63.08(c-9),73.30(c-7),76.40(c-8),111.39(c-6),115.18(c-2),119.51(c-4),134.82(c-3),145.71(c-5),147.45(c-1)。
[0124]1h-nmr(dmso-d6,400mhz)δ:3.74(3h,s,6-ome),4.37(2h,d,h-1),4.40(1h,m,h-2),4.90(1h,d,j=4.8,h-3),6.67-6.89(3h,m,h-5,7,9),8.74(1h,s,8-oh)。
[0125]
以上nmr与文献报道基本一致,故鉴定化合物14为(-)-(7r,8s)-dihydrodehydrodiconiferyl alcohol,结构式如下,该化合物为该植物首分化合物。
[0126][0127]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1