一种类器官培养方法与流程
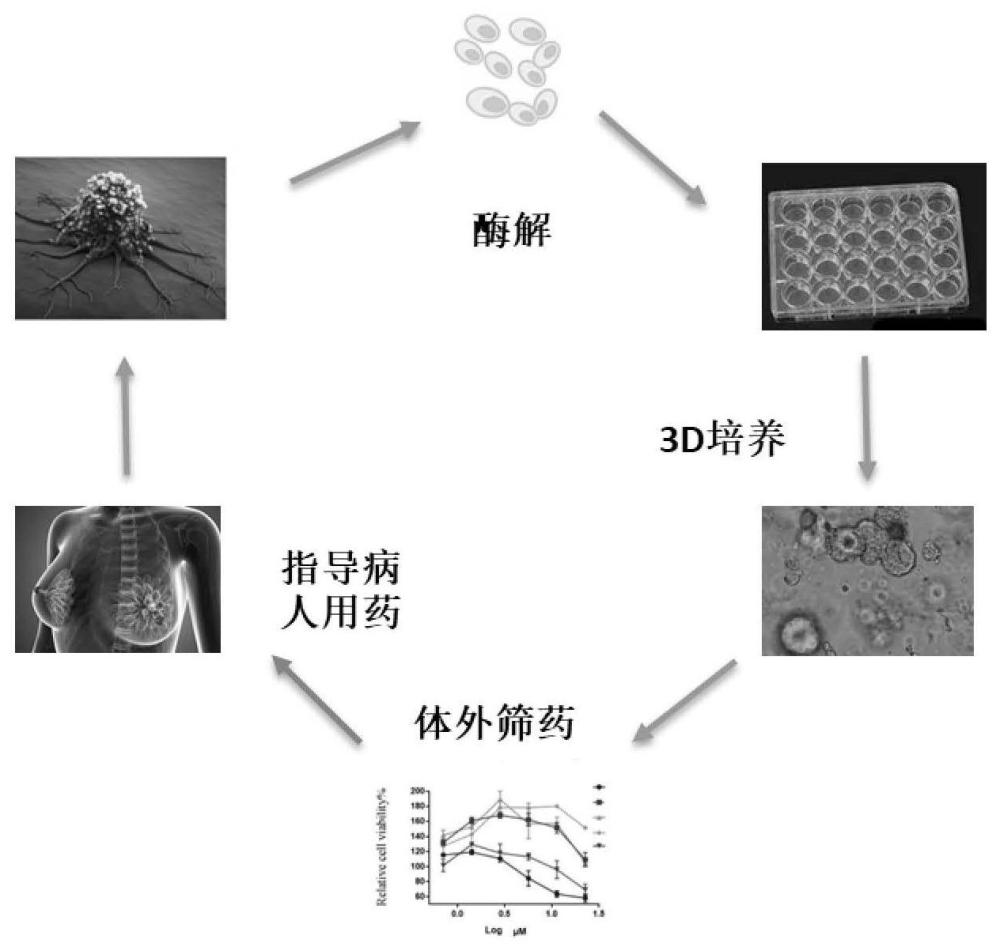
本发明属于药敏检测,具体地涉及一种基于类器官的药敏检测技术。
背景技术:
1、对于乳腺癌的发生和发展机制,以及药物筛选大多利用体外和动物模型中的癌细胞株来研究的,但细胞系的平面培养特点不能真实反应肿瘤微环境,并且缺乏基因突变的复杂性,用于疾病研究和药效鉴定存在严重的局限性;并且,原代肿瘤细胞的平面培养成功率低,不能快速增殖,难以进行高通量的药敏检测;且平面培养不能有效的模拟药物在实体肿瘤组织中的作用效果。现有技术多利用肿瘤细胞系、原代肿瘤细胞和人源性组织异种移植模型来进行药物筛选。现有技术多利用体外培养癌细胞株来进行乳腺癌的药物筛选;例如用乳腺癌的原代细胞检测阿霉素、紫杉醇、氟尿嘧啶、丝裂霉素和长春新碱等的毒性,但是原代细胞培养成功率低,药敏检测结果与临床相关性低。
2、cn112760289b公开了一种乳腺癌肿瘤类器官培养基以及3d培养方法,然而该专利并未公开特定的清洗方式,无法保证细胞的活性;并且培养基成分有一定缺陷,例如缺少能够抑制细胞凋亡,促进干细胞的分裂和分化的rock-i和rock-ii抑制剂,因此培养基优化存在一定不足。
3、cn110777116b公开了肿瘤组织预处理的清洗方法,但仅限于清洗和初步处理,并未公开针对特定肿瘤组织的立体培养方法。
技术实现思路
1、本发明涉及一种类器官培养方法,进一步的,涉及肿瘤类器官培养,更进一步的,涉及乳腺癌肿瘤类器官的培养方法。
2、样本的获得
3、一般而言,样本来自与医院合作,通过肿瘤手术样本或者穿刺样本中分离,以更加贴近患者的患病实际以及微环境,而并非选择体外细胞系。从医院收取肿瘤手术样本,使用样本储存液进行转移。
4、肿瘤组织并没有特别限定,但基于取样的难度,优选实体瘤,例如胃癌、肺癌、结肠癌、乳腺癌、食道癌等,但更有选可以是乳腺癌。对于样本储存,并不限于具体的储存液,其目的在于能够更好的保存细胞组织,例如可以选择dmem/f12+1%三抗+1%hepes作为更优。
5、样本的处理
6、获得样本之后,样本进行通过特定成分的washbuffer进行清洗,以下5步处理:
7、采用第一清洗处理:washbuffer4—washbuffer2——washbuffer3中顺序清洗
8、第一清洗处理后的样本优选进行剔除处理,以便去除脂肪、血液、坏死以及间质质量分数大于18~22%的组织
9、进一步的,所述第一清洗步骤包括(1)wash buffer 4,清洗2遍,每遍4-6分钟,优选5min(2)wash buffer 2清洗2-4分钟,优选3min。(3)wash buffer 3清洗3min。
10、将清洗后或者剔除处理后的组织进行第二清洗处理
11、第二清洗处理步骤,包括
12、washbuffer1——washbuffer2——washbuffer3——washbuffer4——washbuffer5中顺序清洗
13、washbuffer1中清洗5或6遍,每遍4~6分钟;
14、在washbuffer2中清洗2~4分钟;
15、在washbuffer3中清洗3分钟;
16、在washbuffer4中、在4℃的条件下浸泡28~32分钟;
17、以及将经过washbuffer4浸泡的组织在washbuffer5中清洗5或6遍,每遍4~6分钟。
18、所述wash buffer成分优选以下组分:
19、
20、以上样本处理过程中采用的5种wash buffer分别通过不同的原理去除微生物,降低样本培养污染的概率,同时通过剪刀剔除相关组织部位,一方面可以去除部分污染,使清洗过程更加彻底有效,另一方面剔除间质较多的部位可以缩短酶解时间,提高酶解效率,以获得活性更高的肿瘤细胞。
21、其中washbuffer4清洗新鲜肿瘤组织,可以去除和抑制肿瘤样本表面携带的各种细菌和真菌,现有技术中使用的添加了100单位/ml的青霉素和100μg/ml链霉素的双抗的细胞清洗液,用在类器官的培养中导致真菌污染的概率较高,而本技术的方法采用的washbuffer4,增加了两性霉素b来进行抗真菌的处理,同时使用10倍浓度的青霉素以及链霉素,对存在的细菌真菌污染进行冲击法处理,在保证组织细胞活性的前提下,最大限度地降低了类器官的污染概率,尤其适合培养类器官组织的前处理。
22、本技术的方法中,发明人创造性的采用了含有乙醇体积分数为75%的hbss缓冲液2进行组织样本的清洗,有效杀灭了样本携带的细菌真菌,本领域技术人员常规所了解的是,75%乙醇会对细胞的产生伤害作用,因此75%乙醇不会用来处理原代组织,而本技术的发明人发现,采用清洗缓冲液2短时间(2~4分钟)处理肿瘤样本,不仅可以有效的杀灭样本表面的细菌和真菌,同时仍可以保留细胞活性,实现后续的培养。
23、含有乙酸体积分数为3%的hbss的washbuffer3现有技术中主要用于处理尖锐湿疣、尖锐湿疣亚临床表现或hpv潜伏感染的试验方法。而本技术的发明人发现了该清洗缓冲液的新用途,使用washbuffer3处理原代肿瘤样本,可以一定程度地抑制真菌的生长,降低样本后续培养发生真菌污染的概率。
24、剪碎组织。将按照上述步骤清洗好的肿瘤组织放入培养皿中,加入5-6ml hbss,眼科剪剔除脂肪,血液,坏死以及间质较多的部位,然后使用眼科剪和镊子将组织剪成小于1-2mm3的小块。
25、酶解
26、将上述全部溶液转移到容器中,加入消化酶配置成样本酶溶液,37℃条件下消化上述组织块,同时每隔一段时间在镜下观察酶解状态,及时收集并更换新的酶解液,防止过度消化,维持收集后的细胞活力,当观察到有较多的细胞解离出,且多为细胞团时即可停止酶解,之后使用滤网过滤得到滤液。
27、所述容器优选50ml离心管中;所述酶溶液优选约10ml样本酶解液;酶解过程可以是,将离心管放置在摇床中,37℃,300r/min酶解时间为60-120min较好;
28、间隔的观察时间可根据需要选择,一般10-30min为宜。作为优选,消化酶可以选择多种,只要能够实现分离效果即可,但优选是胶原酶,更优选胶原酶type i,其浓度优选1-3mg/ml,更优选1mg/ml;,述滤网孔径为100μm较好。
29、进一步的,还可以包括二次酶解的步骤,所述步骤为,将滤网上部的组织块重新转移至新的容器(例如离心管)中,加入一定量的样本酶解液(例如10ml),在一定条件下进行酶解,例如37℃,300r/min酶解60min-120min,酶解后再次过滤,例如使用100μm滤网过滤得到滤液。
30、作为优选,所述二次酶解采用和一次酶解相同或不同的酶;但为了充分酶解,并且避免第一次酶解时间过长,导致已经分离的细胞受到损伤,优选采用和第一次酶解相同的酶。
31、清洗
32、一次,或者两次、或者更多次酶解得到的滤液,通过离心重悬清洗后获得细胞沉淀。例如1000r/min,离心5min。离心后弃上清,使用1ⅹhbss缓冲液重悬沉淀,清洗1次,离心后得到细胞沉淀。
33、破碎红细胞
34、将细胞沉淀用无菌水重悬,吹打混匀后,立即加入同体积的氯化钠水溶液,使其终浓度达到0.9%的生理盐水浓度,之后离心得到去除红细胞的细胞沉淀。
35、所述吹打步骤大约30s,所述氯化钠水溶液优选1.8%,
36、立体培养
37、将收集的细胞使用合适体积的基质胶混悬均匀,使用枪头点板,放置在37℃培养箱中,一定时间后,加入相应的培养基com-1001 350ul。该培养基是在基础培养基的基础上添加了多种营养成分,多种生长因子以及相关小分子化合物等优化配方,可实现乳腺癌类器官的快速生长,以及传代,冻存,复苏等过程,建立相关生物样本库。
38、作为优选,基质胶和枪头4℃预冷,培养基37℃预热。
39、作为优选,基质胶加入后,在培养箱中孵育20-40min,优选30min。
40、作为优选,基质胶可以选择现有技术中已知基质胶,包括但不限于matrigelmatrix。
41、培养基com-1001成分如下:
42、烟酰胺谷氨酰胺乙酰半胱氨酸
43、缓冲液:hepes、tirs-hcl,优选hepes
44、基础培养基:包括但不限于b27、dmem、mem、1640,优选b27
45、生长因子、调节因子:fgf-10,egf,neuregulin 1,fgf7/kgf
46、抗菌物质:normocin
47、wnt激动剂:r-spondin 1
48、骨形态发生蛋白(bmps)拮抗剂:noggin
49、rho相关的线圈激酶(rock)抑制剂:y-27632
50、tgfβ信号通路抑制剂:a8301
51、p38 mapk抑制剂:sb202190
52、具体的,可以优选以下培养基组分:
53、
54、
55、种板将除清上清的细胞沉淀,加入一定量的基质胶重悬混匀后,接入孔板。
56、具体的,基质胶和枪头4℃预冷,培养基37℃预热。得到的细胞沉淀,应将上清尽量除尽。根据细胞沉淀的多少,加入40-200μl不等的基质胶重悬细胞沉淀(注意不要产生气泡)。重悬混匀后,将基质胶与细胞的混悬液种到二十四孔板(孔板需放置于细胞培养箱中过夜预热,便于基质胶的成型)的板孔中,每孔1滴,约50μl/well。
57、凝胶。将带有基质胶的孔板放入培养箱种凝固,添加特定的培养基。
58、具体的,将孔板平放于37℃细胞培养箱中,凝固约30min。取出,每孔添加350μl37℃预热的培养基(com-1001),放入培养箱中培养。
59、优选的可以添加换液步骤,可跟踪细胞的生长情况,培养2-3天,根据需要更换新鲜的培养基。
60、优选的,一定时间后可进行传代步骤:并每间隔一段时间,对类器官的生长状态拍照记录。
61、药物模型筛选
62、一种药物模型筛选方法,取类器官3d培养的类器官组织和对照细胞,分别加入抗肿瘤药,消化后,对得到单细胞通过流式细胞检测阳性细胞的比例。
63、所述对照细胞可以是mcf-7细胞,加入的抗肿瘤药物可以是doxorubicin。
64、肿瘤组织染色分别取患者来源的肿瘤组织及患者来源肿瘤组织建立的样本,经4%多聚甲醛固定后,制作石蜡切片,进行免疫组织化学染色,观察患者来源的肿瘤组织及其来源的pdo样本间遗传特性的相关性。
65、所述患者来源组织建立的样本为上述类器官培养得到的类器官组织样本。
66、乳腺癌肿瘤类器官的药物筛选及鉴定
67、使用基质胶与培养基的混合液重悬细胞,将细胞接种在孔板中,每孔种一基质胶球,孔板倒扣放入培养箱中,使胶凝固;添加预热的培养基,放入培养箱中培养,三天后进行加药处理;药物处理3天后,重新进行新鲜药液的更换;药物处理6天后,使用atp检测试剂进行各个药物处理的化学发光强度值的检测。根据数据,计算相应药物对类器官的ic50值。所述基质胶与培养基的比例为1:1。
68、所述细胞接种密度优选0.4万cells/well;
69、所述药物可以为cisplatin、epirubicin、hydrochloride之一。
70、有益效果
71、1本发明采用特定的培养基,在基础培养基的基础上添加了多种营养成分,多种生长因子以及相关小分子化合物等优化配方,可实现肿瘤类器官特别是乳腺癌类器官的快速生长,配合特定的清洗缓冲液的清洗步骤,有效提高细胞活性,配合传代,冻存,复苏等过程,便于建立相关生物样本库。
72、2本发明采用的培养技术成功建立了乳腺癌肿瘤类器官体外模型;为体内外实验的需要及建立生物样本库提供保障。
73、3.肿瘤类器官的三维培养模式能更准确地模拟患者体内的肿瘤微环境,如实施例2显示,药物进入类器官的效率与平面细胞系存在显著性差异,体现了其在用于疾病研究和药物筛选方面的显著优势。
74、4.患者来源的肿瘤组织建立的pdo样本保留了患者肿瘤组织表型和遗传特性(实施例3),在进行药物筛选时,不同的乳腺癌病人样本药物筛选存在明显的个体化差异,如实施例4中所示,患者p3、p4、p6对药物epirubicin hydrochloride更为敏感,而患者p5对药物cisplatin更为敏感,能更真实反应患者对药物方案的敏感性,可以指导医生有目的性地用药,达到个性化辅助治疗的目的。
75、对于乳腺癌患者来说,可以通过肿瘤手术样本或者穿刺样本中分离出的细胞来培养类器官,通过体外培养乳腺癌肿瘤组织的类器官样本(pdo)的多种药物方案的筛选,来预测患者对相应药物方案的敏感性,可以指导医生有目的性地用药,达到个性化辅助治疗的目的。
- 还没有人留言评论。精彩留言会获得点赞!