具有良好抗氧化抗炎效果的表皮葡萄球菌及其应用的制作方法
1.本发明属于微生物技术领域,尤其是涉及具有良好抗氧化抗炎效果的表皮葡萄球菌及其应用。
背景技术:
2.皮肤是人体最大的器官,作为机体的屏障保护机体免受外来微生物、抗原或有毒物质的侵害。在人体皮肤表层或毛囊中栖息着大量的微生物,构成了人体皮肤菌群,其在维持皮肤健康中发挥着重要的作用,被称为皮肤的微生物屏障。皮肤微生物群、宿主皮肤及环境构成皮肤微生态系统,它们之间相互作用、相互制约,保持协调的、生理的、动态的平衡。平衡的皮肤微生态,有利于皮肤健康。在日常生活中,化妆品的频繁使用、过度清洁、过度护理、化学品、药品、过度的紫外线暴露、不良生活方式、环境污染等因素可导致皮肤微生态失调。皮肤微生态失调,皮肤生物屏障就会被削弱或者破坏,影响皮肤正常的生理机能,乃至被感染,促进皮肤的老化。
3.近年来,由于空气污染、紫外线辐射、化妆品频繁使用、精神压力增大、不良生活习惯、健康护肤意识增强及疫情常戴口罩捂脸等因素影响,皮肤出现敏感、特应性皮炎(ad)和痤疮等的发生率逐年上升。研究已表明,敏感肌肤、特应性皮炎和痤疮等皮肤问题都存在皮肤微生态失调等问题。通过调整皮肤微生态正在成为治疗各种皮肤问题的新途径。
4.机体自身代谢过程中以及受到外界污染、太阳照射等,会不断在人体内产生自由基,而过量自由基的产生会导致机体出现各种疾病和皮肤的衰老。研究表明在光老化的皮肤中,uv辐照后会使皮肤细胞内的ros增多,诱发mmps水平增高,导致皮肤的胶原蛋白和弹性蛋白被降解,皮肤变得粗糙、松弛和起皱。皮肤上的表皮葡萄球菌、痤疮丙酸杆菌等对uv引起的皮肤损伤有保护作用,能显著降低紫外辐射诱导的ros水平之外,还能通过影响多个信号通路直接调节皮肤细胞mmps的表达水平,减少uv辐照后胶原蛋白和弹性蛋白的降解,维持皮肤的健康。
5.目前借助于高通量测序、宏基因组学、代谢组学和生物信息学等分析技术,我们对人体皮肤微生物组成、结构和功能有了更深入的认识。作为皮肤微生态中重要角色的皮肤菌群,在维护皮肤健康中发挥着重要的作用。在健康皮肤上存在大量潜在的有益菌,大量的研究表明:以表皮葡萄球菌为代表的凝固酶阴性葡萄球菌等分泌抗菌肽、分解皮脂生成短链脂肪酸(scfas)、核苷等代谢物,具有抗菌、抗炎、免疫调节、增强皮肤屏障功能、抗癌等多种生理功能,是潜在的皮肤有益菌(stacy a,belkaid y.microbial guardians of skin health[j].science,2019,363(6424):227-228.)。
[0006]
基于表皮葡萄球菌在维护皮肤健康中重要的作用,将来表皮葡萄球菌以及代谢产物可能用于皮肤健康的护理中,2015年已有研究从自体皮肤中分离出微生物,将其与凝胶混合制成新型化妆品,显著改善了皮肤的保湿性(yuichi nodakea,saki matsumotoa,b.pilot study on novel skin care method by augmentation with staphylococcus epidermidis,an autologous skin microbe-ablinded randomized clinical trial[j]
.journal of dermatological science 79,2015,119-126)。基于已经报道过的表皮葡萄球菌的种种益处,将表皮葡萄球菌应用到化妆品中具有广阔的应用前景。但是目前国内缺乏健康人群来源的皮肤菌以及功能菌株的筛选报道。
技术实现要素:
[0007]
针对上述问题,本发明提供了具有良好抗氧化抗炎效果的表皮葡萄球菌及其应用。本发明首先从从健康皮肤上分离菌株,进行功效菌株筛选和验证,发现了表皮葡萄球菌(staphylococcus epidermidis)ccsm0287和ccsm0285的发酵液上清对dpph自由基具有良好的清除活性,能降低维生素k3引起的人角质形成细胞ros含量,ccsm0287的发酵液上清对透明质酸酶具有良好的抑制作用,且能降低lps刺激巨噬细胞产生的il-6水平,因此可以为抗氧化、抗衰老、抗炎的皮肤有益菌的开发和微生态护肤品的开发奠定基础。
[0008]
本发明首先自健康皮肤上分离到表皮葡萄球菌(staphylococcus epidermidis)ccsm0287和ccsm0285,上述菌株已于2022年6月1日保藏于中国典型培养物保藏中心(简称cctcc),其保藏编号分别为cctcc no.m 2022779和cctcc no.m 2022780。上述菌株均具有如下微生物学特征:在tsa血平板上菌落为白而小,形成圆形凸起,边缘整齐,菌落直径大约为0.5~1mm,表面光滑,湿润,不透明,挑取能拉丝,无溶血圈。革兰氏染色阳性。菌体特征呈球形,直径0.9~1.0μm左右,排列成葡萄状,也有单个排列,无鞭毛,不能运动,不产芽孢。其最低生长温度为15℃,最高生长温度为40℃,在30~40℃生长温度最佳;表皮葡萄球菌在tsb液体培养基中生长迅速,在2h左右进入对数期,14h左右进入稳定期。
[0009]
本发明还提供了上述的表皮葡萄球菌ccsm0287以及tsb发酵上清在皮肤抗氧化、抗炎方面的应用,可以制备对抗自由基和炎症因子对皮肤的损伤,抗氧化、抗衰老和缓解炎症的护肤品。上述抗炎包括抑制透明质酸酶和降低lps引起的巨噬细胞il-6的表达。上述抗氧化包括清除dpph自由基和降低由维生素k3诱导人角质形成细胞产生的ros。
[0010]
本发明还提供了上述的表皮葡萄球菌ccsm0285菌株以及tsb发酵上清在皮肤抗氧化方面的应用,可以制备对抗自由基对皮肤的损伤,抗氧化、抗衰老的护肤品。上述抗氧化包括清除dpph自由基和降低由维生素k3诱导人角质形成细胞产生的ros。
[0011]
本发明还提供了上述表皮葡萄球菌ccsm0287和ccsm0285的tsb发酵上清的制备方法,其特征是,表皮葡萄球菌ccsm0287和ccsm0285在tsb液体培养基(胰酪大豆胨液体培养基)中30~40℃好养发酵培养,发酵液离心,获得tsb发酵上清。
[0012]
制备方法具体包括以下步骤:将活化后的ccsm0287、ccsm0285的菌株挑取单菌落接种于tsb液体培养基中,置于30~40℃摇床中,振荡培养16~20h,测定发酵液的od
600
值,调整菌体od600值为0.9~1.1,作为种子液;以体积比1%~3%的接种量将种子液接种tsb液体培养基中,30~40℃摇床中,振荡培养10~15h,得到表皮葡萄球菌的发酵液;将发酵液离心,获得tsb发酵上清。
[0013]
本发明的技术效果是:
[0014]
1、与现有技术(未见有关表皮葡萄球菌筛选的报道)相比,本发明提供了健康人源(分离自健康人皮肤上)的表皮葡萄球菌ccsm0287和ccsm0285。
[0015]
2、经试验证明,该表皮葡萄球菌ccsm0287具有良好的抗氧化效果,所述表皮葡萄球菌具有高dpph自由基清除率,可以降低维生素k3引起的人角质形成细胞ros含量。其中,
所述表皮葡萄球菌发酵上清dpph自由基清除率为96.8%,ros清除率为19.77%;同时表皮葡萄球菌具有高抑制透明质酸酶和降低lps引起的巨噬细胞炎症因子il-6的能力,其中,所述表皮葡萄球菌发酵上清对透明质酸酶抑制率达90.42%,il-6表达方面与阳性对照lps相比,可显著降低lps引起的巨噬细胞il-6表达(下降26.6%)。该菌株在对抗自由基对皮肤损伤,在对抗炎症因子对皮肤损伤,在抗氧化、抗衰老、抗炎护肤品开发方面具有良好的应用前景,填充了表皮葡萄球菌在抗氧化抗炎功效筛选中的空白。
[0016]
3、经试验证明,该表皮葡萄球菌ccsm0285具有良好的抗氧化效果,所述表皮葡萄球菌具有高dpph自由基清除率,可以降低维生素k3引起的人角质形成细胞ros含量。其中,所述表皮葡萄球菌发酵上清dpph自由基清除率为80.47%,ros清除率为21.36%。该菌株在对抗自由基对皮肤损伤,在抗氧化、抗衰老护肤品开发方面具有良好的应用前景,填充了表皮葡萄球菌在抗氧化功效筛选中的空白。
[0017]
4、经试验证明,表皮葡萄球菌ccsm0287、ccsm0285在tsb液体培养基中生长迅速,在2h左右进入对数期,14h左右进入稳定期,便于大规模生产应用。
附图说明
[0018]
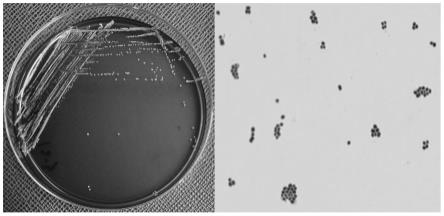
图1为表皮葡萄球菌ccsm0287的菌落形态(左)及显微镜照片(右);
[0019]
图2为表皮葡萄球菌ccsm0287的生长曲线;
[0020]
图3为表皮葡萄球菌ccsm0287发酵上清液对人角质形成细胞的细胞毒性影响;
[0021]
图4为表皮葡萄球菌ccsm0287对人角质形成细胞活性氧ros的清除效果;
[0022]
图5为表皮葡萄球菌ccsm0287发酵上清液对巨噬细胞raw264.7的细胞毒性影响;
[0023]
图6为表皮葡萄球菌ccsm0287发酵上清液对lps引起的巨噬细胞raw264.7表达il-6的影响;
[0024]
图7为表皮葡萄球菌ccsm0285的菌落形态(左)及显微镜照片(右);
[0025]
图8为表皮葡萄球菌ccsm0285的生长曲线;
[0026]
图9为表皮葡萄球菌ccsm0285发酵上清对人皮肤角质形成细胞的细胞毒性;
[0027]
图10为表皮葡萄球菌ccsm0285对人角质形成细胞活性氧ros的清除效果。
具体实施方式
[0028]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。应当理解,此处所描述的具体实施例仅用以解释本发明,而不构成对本发明的限制。
[0029]
以下实施例中所用的菌种培养基如下:
[0030]
胰酪大豆胨琼脂血培养基(tsa):胰蛋白胨15.0g/l,大豆胨5.0g/l,氯化钠5.0g/l,琼脂15.0g/l,121℃高压灭菌15min,冷却50℃左右时,加入5%无菌脱纤维羊血,混匀,倒平板。
[0031]
胰酪大豆胨液体培养基(tsb):胰蛋白胨17.0g/l,大豆木瓜蛋白酶消化物3.0g/l,氯化钠5.0g/l,磷酸二氢钾2.5g/l,葡萄糖2.5g/l,121℃高压灭菌15min,备用。
[0032]
保藏培养基:120g脱脂乳粉,880ml蒸馏水,118℃高压灭菌15min,备用。
[0033]
实施例1、菌株ccsm0287、ccsm0285的分离、筛选与纯化
[0034]
(1)招募完美肌肤志愿者
[0035]
要求皮肤健康,素颜状态下,皮肤细腻、毛孔小,无痤疮、脓疱、无炎症、无脱屑等情况,有斑者可参加,近3个月未擦拭药膏;年龄18~30岁,性别不限。
[0036]
(2)样品采集
[0037]
要求志愿者采样前一晚洗脸后可做基础护肤(涂水、乳等),第二天早上不能洗脸,一般中午或下午取样。在采样皮肤部位处选取一块大约4cm
×
4cm区域,将聚合纤维材料的无菌棉签在润湿液(0.9%氯化钠和0.1%吐温-20)中润湿,在选取区域内来回涂擦50次(擦拭棉拭子要有一定的力度),用无菌镊子将无菌棉签放置在取样管中,并用封口膜封口。将收集的样品放入冰盒里冷藏,带回实验室并放置于4℃冰箱内,尽快进行菌株的分离。
[0038]
(3)样品预处理
[0039]
在超净工作台中用无菌剪刀将带有样品的无菌棉签头剪下,放置于5ml离心管(ep管)中,吸取5ml无菌水于离心管中,充分混匀。
[0040]
(4)平板筛选
[0041]
取上述样品液0.5ml加入4.5ml无菌水进行梯度稀释,选择合适的稀释度,吸取0.1ml稀释液涂布于tsa固体血平板,每个稀释度涂布2个平板,分别置于37℃培养箱中好氧培养24h。
[0042]
(5)划线分纯和保藏
[0043]
根据凝固酶阴性葡萄球菌菌株在血平板上的菌落特点,不产溶血圈、菌落大小、颜色、湿润、光泽等差异,挑取单菌落分别划线tsa血平板,置于37℃恒温培养箱里培养16h,待多次划线分纯后,采用保藏培养基(脱脂乳粉作为保护剂)保藏于保存管,冷冻干燥后保藏于-85℃深冷冰箱中。
[0044]
通过上述筛选方法,筛选获得菌株ccsm0285和ccsm0287。
[0045]
实施例2菌株的微生物学鉴定
[0046]
将实施例1获得的菌株ccsm0287、ccsm0285进行微生物学鉴定
[0047]
(1)菌落特征:
[0048]
菌株在tsa血琼脂平板上划线,37℃培养16h后,观察菌株在平板上的菌落形态特征。结果如图1左图(ccsm0287)和图7左图(ccsm0285)所示,从图1可以看出,表皮葡萄球菌在tsa血平板上菌落为白而小,形成圆形凸起,边缘整齐,菌落直径大约为0.5~1mm,表面光滑,湿润,不透明,挑取能拉丝,无溶血圈。
[0049]
(2)菌体特征:
[0050]
将步骤(1)中得到的表皮葡萄球菌挑取少量菌体于载玻片上进行涂片,进行革兰氏染色,在显微镜下观察菌体形态特征。如图1右图(ccsm0287)和图7右图(ccsm0285)所示,从图中可以看出,革兰氏染色阳性。菌体特征呈球形,直径0.9~1.0μm左右,排列成葡萄状,也有单个排列,无鞭毛,不能运动,不产芽孢。
[0051]
(3)培养学特征:
[0052]
将菌株ccsm0287、ccsm0285分别接种到tsb液体培养基中,置于不同温度下培养,研究表明,ccsm0287、ccsm0285的最低生长温度均为15℃,最高生长温度均为45℃,在30~40℃生长温度最佳;接种到不同ph的tsb液体培养基中,37℃恒温培养,ccsm0287、ccsm0285
菌株的最高生长ph均为9.0、最低生长ph均为4.0,最适生长ph为6.0。
[0053]
(4)遗传学特性:
[0054]
菌株ccsm0287、ccsm0285基因组dna提取方法:分别挑取纯化的ccsm0287、ccsm0285单菌落接种到10ml tsb液体培养基中,37℃培养14-16h后将菌液离心(8000r/min,15min)收集菌体。
[0055]
采用基因组dna抽提试剂盒(生工生物工程(上海)股份有限公司)提取。pcr扩增采用两种合成的通用引物(16s 27f:gagagtttgatcctggctcag,16s1492r:cggctaccttgttacgactt),pcr产物采用柱式pcr产物纯化试剂盒(生工生物工程(上海)股份有限公司)回收,纯化后送美吉生物工程(上海)股份有限公司测序。所得ccsm0287、ccsm0285的16s rdna核苷酸序列分别见序列表seq no.1和seq no.2,序列长度均为:1382bp。
[0056]
送genbank做blast分析。菌株ccsm0287、ccsm0285同源性最高菌株的是mt604781.1,同源性分别为99%和100%。
[0057]
根据goodfellow和o’donnell所说的dna的g+c(mol%)≤10%~12%及16s rrna的序列同源性≥95%的种可归为一个属,并且embley和stackebrangdt认为当16s rrna的序列同源性≥97%时可以认为是一个种。由此可以推断:菌株ccsm0287、ccsm0285与staphylococcus epidermidis属于同一个种。因此菌株ccsm0287、ccsm0285鉴定为表皮葡萄球菌(staphylococcus epidermidis)。
[0058]
依据上述的菌落、菌体形态、培养学、生理生化鉴定等微生物学特性及其遗传特性16srdna对菌株ccsm0287、ccsm0285鉴定为表皮葡萄球菌(staphylococcus epidermidis),该菌株已于2022年6月1日保藏于中国典型培养物保藏中心(简称cctcc),其保藏编号分别为:cctcc no.m 2022779和cctcc no.m 2022780。
[0059]
实施例3:表皮葡萄球菌ccsm0287、ccsm0285的生长曲线的绘制
[0060]
分别将活化好的表皮葡萄球菌(staphylococcus epidermidis)ccsm0287、ccsm0285按2%(v/v)接种量接入tsb液体培养基中,37℃恒温振荡培养24h,每隔2h在600nm处测定培养液的od值,以od
600
值对时间作图得到表皮葡萄球菌(staphylococcus epidermidis)ccsm0287、ccsm0285在tsb液体培养基中的生长曲线,其结果分别如图2和图8所示,从图2中可以看出,表皮葡萄球菌(staphylococcus epidermidis)ccsm0287在tsb液体培养基中生长迅速,在2h左右进入对数期,14h左右进入稳定期,从图8中可以看出,表皮葡萄球菌(staphylococcus epidermidis)ccsm0285在tsb液体培养基中生长迅速,在2h左右进入对数期,14h左右进入稳定期。
[0061]
实施例4:表皮葡萄球菌ccsm0287、ccsm0285发酵上清的dpph自由基清除率的测定
[0062]
(1)表皮葡萄球菌ccsm0287、ccsm0285发酵上清的培养
[0063]
将表皮葡萄球菌ccsm00287菌株划线于tsa平板,37℃恒温培养16~20h,活化2次。将活化好的表皮葡萄球菌ccsm0287接种到tsb液体培养基中,37℃摇床振荡培养16~20h,调整菌体od
600
在0.9~1.1范围,作为种子液。以2%接种量将种子液接种到250ml三角瓶中,37℃,160r/min恒温培养12h,得到表皮葡萄球菌的发酵液;将上述发酵液以10000r/min的速度离心15min,获得的离心上清液即为发酵上清。
[0064]
表皮葡萄球菌ccsm0285发酵上清的培养方法同上。
[0065]
(2)用dpph清除自由基法测表皮葡萄球菌ccsm0287、ccsm0285的代谢产物中的dpph自由基清除率,步骤如下:
[0066]
①
用无水乙醇配制dpph浓度为0.1mm/l母液,避光低温保存。
[0067]
取100μl样品溶液(发酵上清)和100μldpph溶液加入96孔板中,记为溶液s;
[0068]
取100μl样品溶液和100μl无水乙醇溶液置于96孔板中,记为溶液b;
[0069]
取100μl 50%乙醇溶液和100μl dpph溶液置于96孔板中,记为溶液c;
[0070]
混匀,恒温37℃黑暗环境下反应30min;
[0071]
②
用酶标仪在517nm处分别测as,ab,ac孔中所得的反应液的od值,as,ab,ac孔中所得的反应液,每样至少做3次平行,取其平均值,根据dpph自由基清除率公式:
[0072]
清除率=100%
×
[a
c-(a
s-ab)]/ac
[0073]
计算表皮葡萄球菌ccsm0287、ccsm0285的代谢产物中的dpph自由基清除率分别为96.8
±
1.87%和80.47
±
2.15%。
[0074]
实施例5:表皮葡萄球菌ccsm0287、ccsm0285发酵上清清除人角质形成细胞的ros测定
[0075]
(1)表皮葡萄球菌ccsm0287、ccsm0285发酵上清的制备
[0076]
发酵上清液的制备方法同实施例4步骤(1),将发酵上清浓缩到原体积的1/4,即为表皮葡萄球菌的浓缩发酵上清。
[0077]
(2)细胞培养
[0078]
人原代皮肤角质细胞(neks)分离自正常皮肤组织,用promocell专用完全培养基(keratinocyte growth medium 2,c-20011)在37℃,5%co2条件下常规培养,待细胞生长至近融合状态,以胰蛋白酶消化传代,每5d传代1次。
[0079]
(3)细胞活力检测
[0080]
取处于最佳生长状态的neks细胞,常规处理,细胞悬浮液密度调整到8
×
10
4-1
×
105个/ml,以每孔100μl细胞悬液接种于96孔板中,置于37℃、5%co2培养箱培养。分别加入0.1%、0.5%、1%、5%和10%ccsm0287(ccsm0285)发酵上清的浓缩液培养24h,设置阴性对照组(10%tsb培养基)和空白对照组(nt),每个实验组设置3个平行孔。培养24h后,每孔加10μl cck-8试剂(日本同仁ck-04),常规孵育2h。使用酶标仪测定450nm处测定吸光值,参比波长为600nm或以上。
[0081]
(4)ros检测
[0082]
取处于最佳生长状态的neks细胞,用promocell专用培养基培养,常细胞悬浮液密度调整到8
×
10
4-1
×
105个/ml,以每孔100μl细胞悬液接种于96孔板中,置于37℃、5%co2培养箱培养。在各反应孔中加入10μmol/l维生素k3,实验组加入5%ccsm0287发酵上清浓缩液,以200μmol/l维生素e为阳性对照,培养24h后,每孔加1μl ros荧光显色试剂(cellrox,thermo),常规孵育4h。使用酶标仪测定荧光值,激发光波长为485nm,发射光为520nm。
[0083]
从图3可以看出,与空白对照组(nt)相比,表皮葡萄球菌ccsm0287发酵上清的浓缩液的添加量低于5%时,未显示细胞毒性,而且能显著促进人原代皮肤角质细胞的生长。在此选择5%ccsm0287发酵上清的浓缩液进行ros实验。实验结果表明(图4),维生素k3处理(诱导组)后角质细胞分泌大量的ros,加入表皮葡萄球菌ccsm0287发酵上清浓缩液(发酵上清组),可显著降低ros的量,ros清除率为19.77%。可见,表皮葡萄球菌ccsm0287发酵上清
可显著降低维生素k3引起的ros的表达,显示出良好的抗氧化效果。
[0084]
从图9可以看出,与空白对照组(nt)相比,表皮葡萄球菌ccsm0285发酵上清的浓缩液的添加量低于5%时,未显示细胞毒性,而且能显著促进人原代皮肤角质细胞的生长。在此选择5%ccsm0285发酵上清的浓缩液进行ros实验。实验结果表明(图10),维生素k3处理后(诱导组)角质细胞分泌大量的ros,加入表皮葡萄球菌ccsm0285发酵上清浓缩液(发酵上清组),可显著降低ros的量,ros清除率为21.36%。可见,表皮葡萄球菌ccsm0285发酵上清可显著降低维生素k3引起的ros的表达,显示出良好的抗氧化效果。
[0085]
实施例6表皮葡萄球菌ccsm0287发酵上清的透明质酸酶抑制率测定
[0086]
(1)表皮葡萄球菌ccsm0287发酵上清的制备方法同实施例4步骤(1)。
[0087]
(2)用透明质酸酶抑制法测表皮葡萄球菌ccsm0287的代谢产物中的透明质酸酶抑制率,步骤如下:
[0088]
①
用0.1m醋酸缓冲溶液配制12.5mm的氯化钙溶液,4000u/ml的透明质酸酶溶液和2mg/ml的透明质酸钠溶液;
[0089]
②
将1ml乙酰丙酮和10ml 0.5m碳酸钠溶液混合均匀备用,临用现配;
[0090]
③
将对二甲氨基苯甲醛1.5g溶于冰醋酸43.75ml中,混合均匀后加10m盐酸6.25ml,临用现配;
[0091]
(3)取步骤(1)中的发酵上清液作为样品按照表1添加步骤(2)中的试剂进行反应。
[0092]
表1实验设计
[0093][0094][0095]
按照上述公式计算得出抑制率。表皮葡萄球菌ccsm0287发酵上清的透明质酸酶抑制率为90.42
±
5.56%。
[0096]
实施例7表皮葡萄球菌ccsm0287发酵上清对巨噬细胞il-6的测试
[0097]
(1)表皮葡萄球菌ccsm0287发酵上清的制备
[0098]
制备方法同实施例4步骤(1)。
[0099]
(2)细胞活力测试
[0100]
巨噬细胞raw264.7在5%co2、37℃的培养条件下,利用含10%胎牛血清的高糖dmem培养基正常培养。当细胞生长至80-90%汇合时,用胰酶将其消化并按照8
×
105cells/ml的密度接种于96孔板。细胞贴壁24h后,分别加入0.1%、0.5%、1%、5%和10%ccsm0287发酵上清的浓缩液培养24h,设置阴性对照组(10%tsb培养基)和空白对照组(nt),每个实验组设置3个平行孔。处理完成后,按照说明书加入cck-8试剂孵育1h,在450nm处测量吸光度,计算相对细胞活性。
[0101]
相对细胞活性(%)=(样品组od值/对照组od值)
×
100%
[0102]
(3)经lps诱导的巨噬细胞raw264.7的il-6测试
[0103]
巨噬细胞raw264.7在含5%co2、37℃的培养条件下,利用含10%胎牛血清的高糖
dmem培养基正常培养。当细胞生长至80-90%汇合时,用胰酶将其消化并按照8
×
105cells/ml的密度接种于96孔板。细胞贴壁24h后,将lps、lps和5%ccsm0244发酵上清的浓缩液加入反应孔中,以地塞米松(dex)为阳性对照,设置空白对照组(nt),每组设3个平行孔。培养24h后取上清液,用elisa试剂盒进行il-6炎症因子的检测。
[0104]
从图5可以看出,与空白对照组(nt)相比,表皮葡萄球菌ccsm0287发酵上清的浓缩液的添加量低于5%时,未显示细胞毒性,而且能显著促进巨噬细胞raw264.7细胞的生长。在此选择5%ccsm0287发酵上清的浓缩液进行炎症因子的实验。实验结果表明(图6),正常细胞产生少量的il-6细胞因子,而lps处理后,细胞分泌大量的炎症因子il-6,加入表皮葡萄球菌ccsm0287发酵上清浓缩液,可显著降低炎症细胞因子il-6的量,降低率26.6%。可见,表皮葡萄球菌ccsm0287发酵上清可显著降低lps引起的炎症细胞因子il-6的表达,显示出良好的抗炎效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1