长链非编码RNACRCAL-3作为乳腺癌放疗抵抗标志物的应用
长链非编码rna crcal-3作为乳腺癌放疗抵抗标志物的应用
技术领域
1.本发明涉及肿瘤分子生物学领域,更具体地,涉及长链非编码rna crcal-3作为乳腺癌放疗抵抗标志物的应用。
背景技术:
2.乳腺癌是女性最常见的恶性肿瘤。2021年癌症统计报告显示乳腺癌的发病率高居各种癌症的首位。放射治疗是目前乳腺癌综合治疗不可或缺的部分。针对早期乳腺癌患者保乳术后的放射治疗,目前已成为早期乳腺癌标准治疗模式,并在临床上得到广泛应用,这种治疗方式能最大程度地保护乳腺癌患者的器官功能;而对于接受乳房全切术的患者,只要有1个以上的腋窝淋巴结转移或者原发肿瘤>5cm,术后均推荐进行胸壁
±
淋巴结引流区的放疗,研究表明术后放疗可以显著改善患者的无病生存及总生存情况。然而,尽管放射治疗能够提高乳腺癌的局部控制率,但放疗后局部区域的复发仍然不可避免。对于乳腺癌患者放疗后仍然出现局部或区域复发的现象,提示放疗抵抗现象的存在。
3.目前,针对乳腺癌放疗抵抗性的研究仍较为缺乏,其具体的作用机理还存在诸多不清楚的部分。现有技术中,对于乳腺癌是否存在放疗抵抗的情况,往往只能在长时间放疗后根据治疗效果才能确定,即只能在放疗抵抗已经明显干扰到治疗效果时才能发现。对于具有放疗抵抗性的乳腺癌,在不清楚其有放疗抵抗性的前提下,持续的采用放疗方式进行治疗,效果可能无法达到预期治疗效果,一方面,会增加患者的身体负担,使患者承受不必要的放疗副作用;更重要的是,另一方面,还可能导致错过其他有效的治疗策略,对患者生存期不利。所以,及时确认乳腺癌的放疗抵抗性显得至关重要。因此,现有技术亟需一种乳腺癌放疗抵抗标志物及相关产品、应用,以便及时确认乳腺癌的放疗抵抗性。
技术实现要素:
4.本发明旨在克服上述现有技术的至少一种不足,提供一种长链非编码rna crcal-3作为乳腺癌放疗抵抗标志物的应用,通过放疗抵抗标志物有利于及时在乳腺癌放疗过程中进行放疗抵抗的诊断,以便及时改变治疗策略,延长患者生存期。
5.本发明的一个目的在于提供一种长链非编码rnacrcal-3,其核苷酸序列如seq idno.1所示。具体地,核苷酸序列如下所示: 5
’‑
gtttacctaatcaagcctgggcaatggcgggtgcccctcctccagcctcgctgccgccttgcagtttgatctcagactgctgtgctagcaatc agcgagactccgtgggcgtaggaccctctgagccaggtgtgggatataatctcgtggtgcgccgttttttaagcccgtcggaaaagcacagtat tcgggtgggagtgacccgattttccagtttcaaacatcttcaaggcagaaacgtgttgtatttgcatgctgtttagaaggcagtgtactgaatagtac cagttttttcagagacaaatatggtgtacttatttgaaaagaaaggatgatacacatacatagccatccaaaaaatcctgcaaccagtagcaaatta tattacacattggacacatcctaaatgatgcaaggttgctaattctctctgttggtaatatcttttgatgctgttgtgtccagaattgattcattcctgtgg gttcttggtctcactgacttcaagaataaagctgcggaccctagtgtttcctgaggcctcactagaagcaaatgctggtgccgtacttct-3’。
6.本发明的一个目的在于提供长链非编码rna crcal-3作为乳腺癌细胞放疗抵抗标志物的应用。在本发明的一个以上实施例中,本发明人采用剂量递增方式反复照射乳腺癌细胞株,建立起具有稳定地放疗抵抗表现型的乳腺癌细胞株。包括针对三阴性乳腺癌细胞株 mda-mb-231和er阳性乳腺癌细胞株mcf-7建立了放疗抵抗表现型细胞株。在构建放疗抵抗表现型乳腺癌细胞株后,并提取放疗抵抗表现型乳腺癌细胞株的总rna进行长链非编码rna检测,通过与放疗抵抗性细胞株的亲本细胞株的长链非编码rna构进行生物信息学分析得到差异表达的长链非编码rna。进一步,采用q-pcr验证差异表达的长链非编码rna 在正常乳腺上皮细胞核的表达量,更详细的检测验证发现长链非编码rna crcal-3在两种放疗抵抗表现型乳腺癌细胞株中较亲本细胞株显著高表达。针对长链非编码rna crcal-3 在两种放疗抵抗表现型乳腺癌细胞株显著高表达的特点,表明crcal-3作为乳腺癌细胞放疗抵抗性标志物的应用。且在本发明一个以上实施例中,进一步通过抑制crcal-3以研究对放疗抵抗性的变化,发现单独抑制长非编码rnacrcal-3后,乳腺癌细胞恢复对放疗的敏感性。更进一步地验证了长非编码rnacrcal-3作为乳腺癌放疗抵抗性标志物的有效性。进一步地,所述长链非编码rna crcal-3的核苷酸序列如seq id no.1所示。
7.本发明的一个目的在于提供一种乳腺癌细胞放疗抵抗标志物,为长链非编码rnacrcal-3。通过确定长链非编码rnacrcal-3的表达状况,实现对乳腺癌细胞放疗抵抗性的诊断。
8.本发明的一个目的在于提供长链非编码rna crcal-3检测试剂在制备预测、诊断乳腺癌细胞放疗抵抗性和/或预后乳腺癌细胞放疗疗效的产品中的应用。通过长期跟踪并检测乳腺癌细胞的长链非编码rnacrcal-3表达,可预测其放疗抵抗性的可能性;如在治疗过程中,发现乳腺癌细胞得crcal-3表达逐渐上调,实际即能预测其放疗抵抗性。同样的,对于已经被放疗的乳腺癌细胞,通过对长链非编码rnacrcal-3的检测,同样能对其后续实际放疗疗效预测,如,放疗治疗中、后crcal-3未高表达,其放疗疗效预后应是积极的。所以,通过长链非编码rnacrcal-3的检测试剂,有利于预测、诊断乳腺癌细胞放疗抵抗性和/或预后乳腺癌细胞放疗疗效,并应用至相应的产品中。
9.进一步地,产品包括实时荧光定量pcr检测试剂。对于长链非编码rna的检测方法可包括步骤:(1)样品rna的提取:采用rna提取试剂盒进行样本细胞总rna的提取; (2)样品cdna的制备:基于逆转录酶和步骤(1)获取的总rna进行逆转录以获取cdna; (3)荧光定量pcr:基于包括步骤(2)获取的cdna和用于克隆长链非编码rna crcal-3 序列的引物及荧光定量pcr体系进行荧光定量pcr反应,并获取样本中长链非编码rnacrcal-3表达的分析结果。
10.进一步地,乳腺癌细胞包括三阴性乳腺癌细胞、er阳性乳腺癌细胞。在本发明一个以上实施例中,本发明人具体采用三阴性乳腺癌细胞株mda-mb-231和er阳性乳腺癌细胞株 mcf-7为基础建立了放疗抵抗表现型细胞株并进行了乳腺癌放疗抵抗标志物的筛选、确定。
11.进一步地,产品包括检测乳腺癌样本长链非编码rna crcal-3表达的测序平台和/或实时荧光定量pcr仪。
12.进一步地,长链非编码rnacrcal-3检测试剂包含检测乳腺癌样本长链非编码rnacrcal-3表达的引物和/或探针。进一步地,引物包括:正向引物forward: 5
’‑
aaggatgatacacatacatagcc-3’;反向引物reverse:5
’‑
tgagaccaagaacccaca
ꢀ‑3’
。
13.本发明的又一目的在于提供长链非编码rna crcal-3在制备预测、诊断乳腺癌细胞放疗抵抗性和/或预后乳腺癌细胞放疗疗效的产品中的应用。
14.进一步地,产品包括长链非编码rna crcal-3检测试剂盒。
15.本发明的再一目的在于提供一种预测、诊断乳腺癌细胞放疗抵抗性和/或预后乳腺癌细胞放疗疗效的试剂盒,试剂盒包含检测乳腺癌样本长链非编码rna crcal-3表达的引物和/ 或探针。
16.本发明的再一目的在于提供一种载体或重组子,载体或重组子中包含长链非编码rnacrcal-3基因序列、长链非编码rnacrcal-3sirna和/或长链非编码rnacrcal-3lna。在本发明一个以上的实施例中,验证了长链非编码rnacrcal-3引发的放疗抵抗性机制,而除了将crcal-3作为标志物进行诊断或通过抑制crcal-3以逆转乳腺癌放疗抵抗性外,还可将crcal-3协同载体或重组子构建放疗抵抗细胞模型,以便在相关实验中对放疗抵抗进行更多的研究,促进乳腺癌治疗策略发展。同样的,除了促进crcal-3表达以构建放疗抵抗细胞外,在本发明一个以上实施例中,表明了抑制crcal-3表达能起到逆转放疗抵抗效果,所以,结合sirna、lna形成相应的载体或重组子能实现crcal-3的敲低并起到积极的疗效。
17.与现有技术相比,本发明的有益效果为:基于长链非编码rna crcal-3在正常乳腺癌细胞、放疗抵抗乳腺癌细胞中的差异表达,长链非编码rna crcal-3可以作为一种标志物而应用于乳腺癌放疗抵抗性的预测、诊断和/或乳腺癌放疗疗效预后中,有助于及时判断病患的乳腺癌细胞是否有潜在放疗抵抗性或已存在放疗抵抗性,提供放疗治疗方式有效程度的参考依据,以便及时调整、给予适合的治疗策略,避免无效、低效果的放疗治疗以及不必要的放疗副作用,减少患者治疗的不适。利于及时的调整、采用其他有效治疗策略,延长患者生存期。
附图说明
18.图1显示:a、b、c:mda-mb-231细胞株放疗抵抗表型的验证:mda-mb-231-resistant 细胞相对于其亲本细胞mda-mb-231-parental在不同剂量照射下具有更高的存活分数以及更高的d0、dq值;d、e、f:mcf-7细胞株放疗抵抗表型的验证:mcf-7-resistant细胞相对于其亲本细胞mcf-7-parental在不同剂量照射下具有更高的存活分数以及更高的d0、dq值。
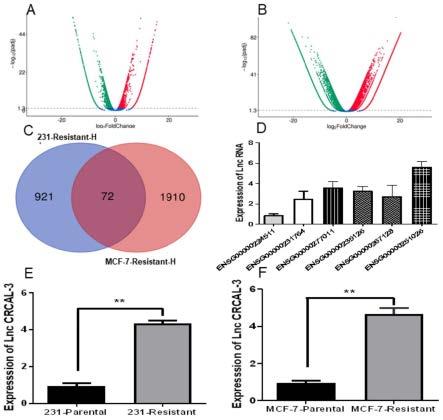
19.图2显示:a:mda-mb-231细胞系放疗抵抗细胞株与亲本细胞株测序的散点图;b: mcf-7细胞系放疗抵抗细胞株与亲本细胞株测序的散点图;c:在测序数据的基础上,筛选出在两种放疗抵抗细胞株中表达量均高于其亲本细胞株的3倍及以上的长链非编码rna 72 条;d:在mda-mb-231-resistant细胞中验证6条长链非编码rna的表达量;e:验证 crcal-3在mda-mb-231放疗抵抗细胞株及其亲本细胞株的表达量;f:验证crcal-3在 mcf-7放疗抵抗细胞株及其亲本细胞株的表达量。(**p《0.01)。
20.图3显示:crcal-3的细胞内定位;a:fish实验结果图;b:核浆分离实验结果图。
21.图4显示:a:lna-crcal-3、si-crcal-3在mda-mb-231-resistant中敲低crcal-3 的效率验证;b:lna-crcal-3、si-crcal-3在mcf-7-resistant中敲低crcal-3的效率验证。
22.图5显示:a、b:在mda-mb-231-resistant与mcf-7-resistant中敲低crcal-3后,乳腺癌细胞的增殖能力减弱(mts方法检测);c、d:在mda-mb-231-resistant与mcf-7-resistant中敲低crcal-3后,乳腺癌细胞的克隆形成能力减弱。(**p《0.01)。
parental与mcf-7-parental中过表达crcal-3后,ubr5 mrna的降解减慢。 (**p《0.01)。
35.图18显示:igf2bp2可以调节ubr5 mrna的稳定性;a:rip实验表明igf2bp2能够结合ubr5 mrna;b、c:敲低igf2bp2后,ubr5 mrna稳定性下降。(***p《0.001)。
36.图19显示:crcal-3通过igf2bp2来调节ubr5 mrna的稳定性;a、b:在 mda-mb-231-parental与mcf-7-parental中过表达crcal-3的同时敲低igf2bp2,ubr5 mrna的降解可以被回复。(**p《0.01,***p《0.001)。
37.图20显示:crcal-3促进igf2bp2结合ubr5 mrna;a、b:在mda-mb-231-resistant 与mcf-7-resistant细胞中敲低crcal-3后,rip实验显示igf2bp2结合ubr5 mrna的能力减弱。(*p《0.05,**p《0.01)。
38.图21显示:crcal-3能够以碱基互补配对的方式结合ubr5 mrna;a、b:freiburg rnatolls软件预测crcal-3正义链、反义链与ubr5 mrna碱基互补配对的情况;c、d:体外 rna-rna互作实验证明crcal-3-sense链结合ubr5 mrna的能力高于crcal-3-antisense 链;e、f:体外rna-rna互作实验证明crcal-3-sense链结合ubr5 mrna的能力高于 crcal-3-mutant链(mutant链为将sense链中与ubr5 mrna碱基互补配对区域进行部分突变)。(*p《0.05,**p《0.01,***p《0.001)。
39.图22显示:igf2bp2结合crcal-3第401-574nt。
40.图23显示:ubr5-mrna 5’utr与crcal-3第1-200nt结合;a、b:freiburg rna tolls 软件预测的ubr5 mrna与crcal-3的碱基互补配对的位置;c、d:体外rna-rna互作实验提示crcal-3的5’端1-200nt是与ubr5-mrna 5’utr结合的位置。(**p《0.01,***p 《0.001)。
41.图24显示:crcal-3、igf2bp2及ubr5 mrna相互结合的部位;a:将ubr5 mrna 截成3段,其中ubr5 mrna的3’utr能够显著拉倒igf2bp2蛋白;b:igf2bp2结构图包含2个rrm和4个kh结构域;从5
’‑3’
方向将igf2bp2截成3段带flag标签的截短蛋白:f1段包含2个rrm结构域,f2段包括第1-2个kh结构域,f3段包含第3-4个kh结构域。c、d:将带flag标签的f1、f2、f3进行rip实验,结果提示f2结合crcal-3,f3 结合ubr5 mrna。三次独立重复实验的结果用means
±
sd表示(**p《0.01,***p《0.001)。
具体实施方式
42.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
43.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
44.现结合具体实例对本发明作进一步的说明,以下实施例仅是为了解释本发明,但不构成对本发明的限制。在以下实施例中所用到的试验样本及试验过程包括以下内容(如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到)。实施例1
45.长链非编码rna crcal-3的获取和分析
46.一、构建乳腺癌放疗抵抗细胞株
47.为解决乳腺癌放疗抵抗的临床问题,本发明人采用剂量递增方式反复照射乳腺癌细胞株直至细胞具有稳定的放疗抵抗表型。具体地,采用直线加速器照射,2gy/次,每周约放疗2-3 次。进一步的,对构建的乳腺癌放疗抵抗细胞株进行放疗抵抗表型的验证,即将放疗抵抗细胞株与其对应的亲本细胞株分别给予0gy、2gy、4gy、6gy、8gy的剂量进行放射治疗,放疗后按照平板克隆形成实验完成最终的克隆计数,并计算细胞存活分数。进一步的,本发明人还采用单击多靶模型拟合剂量存活曲线,计算平均致死剂量(d0)、准域剂量(dq)等放射生物学参数。具体结果如图1所示,显示mda-mb-231-resistant细胞和mcf-7-resistant 细胞分别相对于其亲本细胞mda-mb-231-parental以及mcf-7-parental在不同剂量照射下均具有更高的存活分数以及更高的d0、dq值。
48.二、筛选长链非编码rna crcal-3
49.将mda-mb-231、mcf-7放疗抵抗细胞株和其对应的亲本细胞株进行长链非编码rna 测序。在mda-mb-231细胞系中筛选在放疗抵抗细胞株中表达量高于其亲本细胞株3倍及以上的长链非编码rna构成数据集mda-mb-231-resistant-h;同样,在mcf-7细胞系中选择放疗抵抗细胞株中表达量高于其亲本细胞株3倍及以上的长链非编码rna构成数据集 mcf-7-resistant-h。所述数据集mda-mb-231-resistant-h和所述数据集 mda-mb-231-resistant-h的散点图如图2(上)所示。将两个数据集中取交集,获得在两种细胞系放疗抵抗细胞株中均高表达的长链非编码rna。统计结果如图2(中左)所示,显示在两种细胞系放疗抵抗细胞株中均高表达的长链非编码rna共72条。进一步的,针对所述72条长链非编码rna进行筛选。
50.具体包含以下步骤:
51.(a)采用q-pcr验证所述72条长链非编码rna在乳腺上皮细胞(mcf-10a、hmec)、 mda-mb-231-parental与mcf-7-parental中的表达量,挑选在两种放疗亲本细胞株中表达量高于乳腺癌正常细胞系3倍及以上的长链非编码rna。
52.(b)在12对乳腺癌组织以及癌旁正常组织中验证(a)中筛选出来的长链非编码rna,进一步挑选在乳腺癌癌组织中显著高表达的长链非编码rna。结果如图2(中右)所示,显示总共有6条显著高表达的长链非编码rna。
53.(c)针对上述6条显著高表达的长链非编码rna,进一步采用q-pcr技术验证所述6 条长链非编码rna在放疗抵抗细胞株中的表达。最终筛选获得在两种放疗抵抗细胞株表达量均较高的crcal-3。如图2(下)所示,crcal-3在两种放疗抵抗细胞株 (mda-mb-231-resistant、mcf-7-resistant)中的表达量显著高于亲本细胞株。实施例2
54.设计敲降crcal-3的特异性lna并验证其效率
55.一、如图3所示,crcal-3定位于细胞核,普通sirna难以入核敲低crcal-3;
56.二、采用lna技术设计合成敲低crcal-3的lna-crcal-3
57.lna序列为:5
’‑
t*a*c*t*g*g*t*t*g*c*a*g*g*a*t*t-3’(lna gapmer);如图4 所示,lna-crcal-3敲低crcal-3的效率达到80-90%;普通的sirna仅有50-55%, lna-crcal-3具有更为高效稳定的敲降效果。
实施例3
58.细胞实验
59.一、评估lna-crcal-3对乳腺癌细胞增殖能力的影响
60.采用mts细胞增殖检测、平板克隆形成实验评估lna-crcal-3对乳腺癌细胞增殖能力的影响,实验结果表明:lna-crcal-3能够减弱乳腺癌细胞的增殖和克隆形成能力。如图5所示,a与b为在mda-mb-231-resistant与mcf-7-resistant中敲低crcal-3后,乳腺癌细胞的增殖能力减弱(mts方法检测);c与d为在mda-mb-231-resistant与 mcf-7-resistant中敲低crcal-3后,乳腺癌细胞的克隆形成能力减弱。(**p《0.01)。
61.二、评估lna-crcal-3对乳腺癌细胞放疗抵抗的影响
62.(1)标记5个六孔板分别0gy、2gy、4gy、6gy、8gy;收集转染lna-crcal-3 48 小时后的乳腺癌细胞;
63.(2)六孔板中依据照射剂量的不同分别接种相应的细胞数量(剂量越高,接种的细胞数目越多以保证克隆的形成),并每种放射剂量照射的细胞均分为未处理组和转染 lna-crcal-3组。然后分别接受0gy、2gy、4gy、6gy、8gy放射线照射。放疗后当天细胞予以换液。
64.(3)将六孔板放置于37℃培养箱中培养约14天,定期观察六孔板中克隆的形成。后续步骤同平板克隆形成实验,直至计数六孔板中的克隆数目。
65.(4)将计数好的克隆数量除以接种的细胞总数量得到克隆形成率。最后将各剂量点的克隆形成率分别以0gy照射时的数值作归一化处理。
66.(5)使用单击多靶模型制作生存曲线,同时统计放射生物学参数(d0与dq值)比较加入lna-crcal-3后对乳腺癌细胞的放疗抵抗性的影响。
67.如图6所示,结果表明,使用lna-crcal-3敲低crcal-3的表达后,乳腺癌细胞的放疗抵抗性明显减弱。a与b为在mda-mb-231-resistant与mcf-7-resistant中敲低crcal-3后,乳腺癌细胞放疗后的存活率显著下降;c与d为敲低crcal-3后, mda-mb-231-resistant与mcf-7-resistant细胞株的d0降低;e与f为敲低crcal-3后, mda-mb-231-resistant与mcf-7-resistant细胞株的dq降低。(*p《0.05,**p《0.01,***p《 0.001)。实施例4
68.lna-crcal-3影响乳腺癌放疗抵抗和增殖的动物实验
69.一、裸鼠皮下注射:
70.(1)将乳腺癌细胞培养至超大细胞培养皿中,收集细胞前保证乳腺癌细胞处于对数生长期且形态良好。
71.(2)首先用无菌pbs清洗一遍细胞,然后加入胰酶消化细胞,收集细胞并离心,将细胞沉淀再用pbs清洗两遍。
72.(3)加入适量的无菌pbs重悬细胞沉淀,使得细胞密度为1
×
107/ml,接种体积为0.1ml。
73.(4)接种肿瘤细胞的裸鼠一般在4-6周龄,体重18-20g左右,种植部位选择裸鼠乳腺脂肪垫处。
74.(5)用注射器将离心管中的细胞沉淀充分的吹散,要尽量避免细胞团的存在。
75.(6)肿瘤细胞接种时,先保证针尖已进入皮下,并推进针尖至适当深度,然后缓慢注入细胞悬液,要尽量避免细胞悬液从针孔的溢出而影响皮下成瘤的效果。
76.二、实验分组:
77.组1:空白对照且未行放疗组(nc);
78.组2:加入lna-crcal-3且无放疗组(lna-crcal-3);
79.组3:空白对照且行放疗组(nc+ir);
80.组4:加入lna-crcal-3且行放疗组。(lna-crcal-3+ir)。
81.三、操作技术:
82.待小鼠移植瘤体积达到50mm3,组2和组4分别向瘤体内注射lna-crcal-3;接受放疗的实验分组,当小鼠皮下移植瘤达到适当体积(150-200mm3)时给与直线加速器放疗,每次10gy,共2次(两次放疗间隔1周)。
83.四、每隔3天记录各个分组肿瘤的体积,制作肿瘤体积增长曲线;评估lna-crcal-3 对小鼠移植瘤放疗抵抗和增殖的影响。如图7所示,实验结果表明,注射lna-crcal-3敲低crcal-3的表达后,小鼠移植瘤的增殖明显减弱且对放疗的敏感性增加。实施例5
84.lna-crcal-3靶向分子crcal-3介导放疗抵抗的机制
85.一、crcal-3通过结合igf2bp2介导乳腺癌放疗抵抗与增殖
86.我们进行了rna pull down实验,寻找能够与crcal-3互作的蛋白分子。如图8所示,质谱结果提示crcal-3可能结合的蛋白有:igf2bp2、igf2bp3、ptbp1。采用rna免疫共沉淀(rip)验证。如图9所示,rip实验结果显示:igf2bp2相比igg能够显著富集crcal-3;而igf2bp3与ptbp1富集crcal-3的能力与igg无显著差异。其次,我们将crcal-3下拉的蛋白进行western blot验证。最终,我们确定crcal-3与igf2bp2蛋白相互结合。
87.然后,我们评估crcal-3介导的乳腺癌放疗抵抗表型是否需要igf2bp2参与。如图10 所示,在过表达crcal-3的细胞株中敲除igf2bp2,我们发现乳腺癌细胞放疗抵抗的表型可以部分回复。这表明igf2bp2参与了crcal-3对乳腺癌放疗抵抗的调控。
88.前面实验证明了crcal-3通过igf2bp2来介导乳腺放疗抵抗的表型,但并不清楚 crcal-3通过igf2bp2调节乳腺癌放疗抵抗与增殖的具体机制,为此,本发明就此展开进一步地研究。igf2bp2作为rna结合蛋白,它能够促进多种肿瘤的恶性进展。它发挥的功能主要是调节mrna的稳定、翻译以及降解等。我们首先探索crcal-3是否通过影响与它结合的蛋白(igf2bp2)的表达来介导放疗抵抗等表型。如图11所示,我们敲低crcal-3 后,发现igf2bp2的mrna与蛋白水平均无显著影响。这提示crcal-3并不是通过影响 igf2bp2的表达来发挥功能。
89.二、ubr5是crcal-3介导乳腺癌放疗抵抗与增殖表型的关键下游分子
90.排除了crcal-3对igf2bp2表达的影响,本发明人推测是否crcal-3与igf2bp2的结合会影响igf2bp2发挥功能。调节rna稳定性是igf2bp2蛋白的重要功能之一。本发明推测:crcal-3与igf2bp2的结合是否会干扰igf2bp2稳定下游某个关键基因的mrna,并进行验证。为了寻找下游的关键分子。如图12所示,我们进行了mrna-seq,即敲低 crcal-3后,进行mrna转录组测序。在下调的基因中,发现ubr5差异明显。同时我们将下调的基因做了kegg功能富集,发现泛素化通路显著富集。泛素化通路广泛参与细胞生命活动的调节,包含dna损伤修复、细胞周期等。在泛素化通路中,我们采用q-pcr方法验证富集到该通路中的相关基因。研究结果提示:ubr5是泛素化通路中差异变化最为显著的基因。研究报道ubr5可参与
dna损伤修复的过程,它能促进肿瘤细胞放疗后atm信号通路的激活。将ubr5敲低后,肿瘤细胞的放射敏感性增加。综上所述,我们初步选择了ubr5作为crcal-3的下游关键分子并进行后续实验。如图13所示,我们进一步验证了测序结果,发现敲低crcal-3后,ubr5的mrna与蛋白水平均下降。以上实验表明crcal-3 正向调节ubr5的表达。明确ubr5作为crcal-3下游的分子之后,我们进行相关功能实验。如图14所示,在mda-mb-231-resistant和mcf-7-resistant中敲低ubr5后,乳腺癌细胞的放疗抵抗减弱;如图15与图16所示,在过表达crcal-3的同时敲低ubr5可以逆转乳腺癌细胞放疗抵抗与增殖的表型。这提示crcal-3是通过ubr5介导乳腺癌的放疗抵抗与增殖。进一步地,在本实施例中通过sirna分子si-ubr5敲低ubr5,所述si-ubr5包括:正义链:5
’‑
cccacucuauuccucuaaatt-3’;反义链: 5
’‑
uuuagaggaauagagugggtt-3’。
91.三、crcal-3在转录后水平调节ubr5 mrna的稳定性
92.前面已证明crcal-3正向调节了ubr5的表达并通过下游分子ubr5介导了乳腺癌的放疗抵抗与增殖。接下来,我们探索crcal-3调节ubr5表达的具体机制。考虑到crcal-3 在mrna与蛋白水平均影响了ubr5的表达,可能的原因有两方面:(1)crcal-3在转录水平调节ubr5的转录;(2)crcal-3在转录后水平调节了ubr5的mrna稳定性。结合 rna pull down结果:crcal-3并未发现与转录因子结合而是与调节rna稳定的igf2bp2 蛋白结合,我们则从crcal-3调节ubr5 mrna稳定性探索。如图17所示,敲低crcal-3 后,ubr5 mrna的降解加快;而过表达crcal-3后,ubr5 mrna的降解减慢。上述实验结果表明:crcal-3在转录后水平调节ubr5的表达,具体是通过调节ubr5 mrna的稳定性。
93.四、crcal-3是通过igf2bp2来调节ubr5 mrna的稳定性
94.既然crcal-3可以调节了ubr5 mrna稳定性。那么,我们接下来分析crcal-3调节 ubr5 mrna稳定性的具体机制。目前我们已经知道:
95.(1)crcal-3与igf2bp2结合而igf2bp2具有稳定mrna的功能;
96.(2)ubr5是crcal-3介导放疗抵抗等表型的下游分子。
97.我们推测crcal-3是通过igf2bp2来调节ubr5 mrna的稳定性。因此,我们进行了以下实验:
98.(1)如图18-a所示,rip实验验证了igf2bp2可以结合ubr5 mrna;
99.(2)如图18-b与图18-c所示,敲低ifg2bp2可以影响ubr5 mrna的稳定性;
100.(3)如图19所示,过表达crcal-3的同时敲低igf2bp2,ubr5 mrna的降解可以被回复。
101.以上实验提示crcal-3通过igf2bp2来调节ubr5 mrna的稳定性。
102.五、crcal-3能够促进igf2bp2结合ubr5 mrna
103.继续探讨crcal-3通过igf2bp2稳定ubr5 mrna的具体机制。如图20所示,敲低 crcal-3后,通过rip实验发现igf2bp2结合(富集)ubr5 mrna的能力减弱。上述实验提示:crcal-3是通过增强igf2bp2结合ubr5 mrna的能力来促进ubr5 mrna的稳定。
104.六、crcal-3能够同时募集igf2bp2与ubr5 mrna
105.进一步地,本发明人就crcal-3为何能促进igf2bp2结合ubr5 mrna展开进一步研究。本发明人结合前文内容提出如下假设:crcal-3能同时结合igf2bp2和ubr5 mrna,进而将igf2bp2与ubr5 mrna募集到一起并形成三聚体,从而促进了igf2bp2结合并稳定ubr5的
mrna。然后,为了验证以上假说,借助freiburg rna tools软件分析。如图21-a 与图21-b所示,发现crcal-3与ubr5 mrna的5’utr存在碱基互补配对区域,两者结合能为-27.89kcal/mol;而crcal-3-as与ubr5 mrna的5’utr结合能为-19.92kcal/mol。然后,我们进行体外rna-rna互相作用实验。如图21-c与图21-d所示,我们发现crcal-3 正义链富集ubr5 mrna的能力显著高于crcal-3反义链。其次,我们将正义链上能与 ubr5 mrna 5’utr碱基互补配对的区域进行部分突变(crcal-3-mutant与ubr5 mrna 的5’utr的结合能为-10kcal/mol)。如图21-e与图21-f所示,我们再次进行rna-rna互作实验。发现突变的crcal-3富集ubr5 mrna的能力显著减弱。
106.综合上述实验结果,可以明确crcal-3能够同时与igf2bp2、ubr5-mrna相结合。我们拟进一步探索igf2bp2与ubr5-mrna在crcal-3上结合的具体位置。我们将 crcal-3截短成4段。第1段:1-200nt;第二段:1-400nt;第三段:201-574nt;第4段: 401-574nt。如图22所示,通过rna pull down实验表明igf2bp2与crcal-3的第4段结合;类似的,如图23所示,通过体外rna-rna互作实验显示:ubr5-mrna 5’utr与crcal-3 的第1段(1-200nt)结合。如图24-a所示,ubr5-mrna的3’utr与igf2bp2蛋白结合。进一步地,如图24-b、图24-c和图24-d所示,crcal-3、igf2bp2、ubr5 mrna形成了一个复合体,igf2bp2通过kh1-2结构域结合crcal-3,通过kh3-4结构域结合ubr5 mrna。
107.机制总结:crcal-3能够同时与igf2bp2蛋白、ubr5 mrna结合。具体为crcal-3 通过3'端与igf2bp2结合,通过5'端与ubr5 mrna结合,进而形成支架将两者(igf2bp2 与ubr5 mrna)募集在一起,从而促进了igf2bp2结合并稳定ubr5 mrna。具体地,结合现有技术中ubr5的研究,本发明揭示了导致放疗抵抗性的机制,即肿瘤细胞接受放疗后, ubr5可以泛素化降解atmin蛋白,而atmin可以抑制atm的磷酸化激活;因此ubr5 高表达可以促进atm信号通路的激活,进而促进dna损伤修复并增强肿瘤细胞的放疗抵抗性。实施例6
108.本实施例公开了一种用于预测、诊断乳腺癌细胞放疗抵抗以及预后乳腺癌细胞放疗疗效的试剂盒,该试剂盒含有检测乳腺癌样本长链非编码rna crcal-3表达的引物;更具体地,试剂盒也可包含检测乳腺癌样本长链非编码rna crcal-3表达的探针;试剂盒也可为同时包含检测乳腺癌样本长链非编码rna crcal-3表达的引物和探针。实施例7
109.本实施例公开了一种可作为重组子,该重组子也可作为载体,重组子包含长链非编码 rna crcal-3基因序列、长链非编码rnacrcal-3 sirna和长链非编码rnacrcal-3lna。除此之外,重组子也可单独包含长链非编码rna crcal-3基因序列、长链非编码 rnacrcal-3 sirna或长链非编码rnacrcal-3 lna。
110.显然,本发明的上述实施例仅仅是为清楚地说明本发明技术方案所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1