传感平台
传感平台
1.本技术是国际申请号pct/ep2020/066648,国际申请日2020年6月16日,中国申请号202080054513.4,发明名称为“传感平台”的专利申请的分案申请。
技术领域
2.本发明涉及新型传感器,特别是用于检测生物分析物的传感器。
背景技术:
3.生物传感器是将生物反应转化为可测量的电信号的分析装置。例如,生物传感器可用于确定生物材料中物质的浓度或其他参数。生物传感器可用于一系列行业,主要是医疗保健行业,但也可用于其他领域,例如食品质量监测、环境监测等。
4.特别关注的领域是在医疗保健行业使用生物传感器来分析生物样品以协助临床管理。例如,根据世界卫生组织,2014年全球18岁以上成人糖尿病患病率为8.5%,对快速、准确和简单的葡萄糖监测生物传感器的大量医疗需求未得到满足。
5.理想情况下,生物传感器应具有以下部分或全部属性:准确、精确、可重复、特异性、稳定和便宜。对于实现部分或所有这些目标的生物传感器,仍然存在大量未满足的需求。
技术实现要素:
6.在本发明的第一方面,提供了传感器b-l-s;其中:b是包含一个或多个表面暴露的硫醇部分的生物分子,l是包含硫醇反应基团的接头,和s是基板;其中l通过一个或多个表面暴露的硫醇部分与b共价连接。
7.通过将生物分子通过表面暴露的硫醇部分连接到连接基团,可能选择性地和精确地控制缀合,从而产生具有增强特性的传感器。本发明利用硫醇反应性化合物:暴露在生物分子和接头上的表面以使得生物分子和接头能够选择性缀合。
8.在本发明的进一步的方面,提供了一种传感器,其包含固定在基板上的生物分子;其中生物分子通过接头固定在基板上;并且其中生物分子具有一个或多个表面可及的硫醇部分并且通过所述一个或多个表面可及的硫醇部分连接至接头。
9.优选地,生物分子是修饰的生物分子并且该修饰引入了所述表面可及的硫醇部分。例如,预修饰,生物分子可能不包含任何表面可及的硫醇部分,但修饰引入可连接的表面可及的硫醇部分。修饰可以是突变。
10.同样地,在本发明的进一步的方面中,提供了一种传感器,其包含固定在基板上的突变的生物分子;其中生物分子通过接头固定在基板上;其中生物分子被突变以引入一个或多个表面可及的硫醇部分;并且其中生物分子通过所述一个或多个表面可及的硫醇部分连接至接头。
11.在本发明的进一步的方面,提供了一种传感器,其包含通过接头固定在基板上的生物分子,其中接头通过硫醇键连接至生物分子,并且其中基板是具有光学或电荷承载特
性的材料。在实施方案中,硫醇键位于生物分子上的一个或多个表面可及的硫醇部分与接头上的一个或多个硫醇反应基团之间。
12.在本发明的进一步的方面,提供了一种传感器,其包含通过接头固定到碳纳米材料上的生物分子,其中接头通过硫醇键连接到生物分子。
13.在本发明的又一进一步的方面,提供了一种控制固定在碳纳米材料基板上的生物分子的方法,所述方法包括:修饰所述生物分子以产生具有表面可及的硫醇部分的生物分子,以及使用具有硫醇反应基团的接头将所述修饰的生物分子固定到所述基板上,其中生物分子通过表面可及的硫醇部分和硫醇反应基团连接到接头。
14.该方法通过控制接头附接到生物分子的位置来实现受控固定。这反过来又控制了生物分子如何固定在基板上,因为它是附着在基板表面上的接头。优选地,生物分子具有一个表面可及的硫醇部分并因此具有一个接头,但如果需要,生物分子可能具有一个以上的表面可及的硫醇部分。
15.通过使用基于硫醇的连接策略,可能控制连接基团附接到生物分子的位置。硫醇基团在蛋白质表面并不常见,因此提供表面暴露的硫醇部分允许将连接基团一致放置在蛋白质表面上。例如,这可以确保将接头放置在这样的区域中,从而它不会对生物分子的反应性结合位点产生不利影响。例如,接头可以定位成促进电荷流过传感器以提高灵敏度。受控放置还有助于确保传感器上一致的蛋白质折叠。受控放置可以实现传感器装置的更大稳定性。
16.传感器可以包含多个附着到基板表面的生物分子。通过控制生物分子上的连接位点,可能确保生物分子在表面上更一致的定向。这种方法可以提高生物分子附着的密度。提高生物分子密度和/或定向一致性可以提高传感器的灵敏度和/或可靠性。
17.与将生物分子直接附着到基板上相比,由于连接策略,根据本发明的生物分子可以更稳定地固定到基板上。胸腺嘧啶(thy)也可以以更高的密度应用。它们还可以使生物分子更好地符合其天然结构(例如更好的蛋白质折叠)。与通过生物分子上的酰胺或羧酸基团连接的生物分子相比,可能存在许多相同的优点。虽然这些连接是可能的,但它们比硫醇连接策略更不受控制,因为生物分子表面上有更多的酰胺位点。这会导致对连接策略的控制较少,并且会出现许多上述相同的问题。
18.在本发明的又一进一步的方面,提供了:包含一个或多个突变的葡萄糖氧化酶(gox)多肽、包含一个或多个突变的葡萄糖结合蛋白(gbp)、包含一个或多个突变的伴刀豆球蛋白a(cona)、包含一个或多个突变的胆固醇氧化酶、包含一个或多个突变的碳水化合物氧化酶多肽或包含一个或多个突变的乳酸氧化酶多肽;其中所述一个或多个突变引入了位点选择性硫醇缀合位点,所述位点选择性硫醇缀合位点经选择以允许所述多肽缀合至包含硫醇反应基团的接头。这种修饰的多肽使传感器具有增强的特性。
19.在本发明的又一进一步的方面,提供了编码本发明的葡萄糖氧化酶多肽、碳水化合物氧化酶多肽或乳酸氧化酶多肽的多核苷酸。
20.在本发明的又一进一步的方面,提供了一种核酸构建体,其包含与调控序列可操作地连接的本发明的多核苷酸。
21.在本发明的又一进一步的方面,提供了一种生产传感器的方法,其包括:
22.a)提供包含一个或多个表面暴露的硫醇部分的生物分子;
sciences.112,e3095-e3103(2015);micsonai,a.,等人bestsel:a web server for accurate protein secondary structure prediction and fold recognition from the circular dichroism spectra.nucleic acids research.46,w315-w322(2018))。
37.图7显示了gox变体中bestsel预测的结构特征百分比(α-螺旋和β-链)的分布。这些变体与来自pdb 1cf3代码的晶体结构进行了比较。星号表示由商购的从黑曲霉获得的gox制成的样品。
38.图8显示了通过abts比色测定测量的gox对葡萄糖的相对活性率。对照样品中省略了酶。误差棒表示技术三次重复之间的标准偏差。
39.图9显示了在1、8、30、60和120分钟时间点测量的将spdp添加到gox溶液后的紫外可见吸收光谱。在pbs(对照)中测量spdp的自发降解。每次测量都减去在加入spdp之前测量的吸收光谱。
40.图10显示了在添加spdp之前和之后测量的gox变体在343nm处的吸光度变化。对照样品包含不含gox的反应混合物。
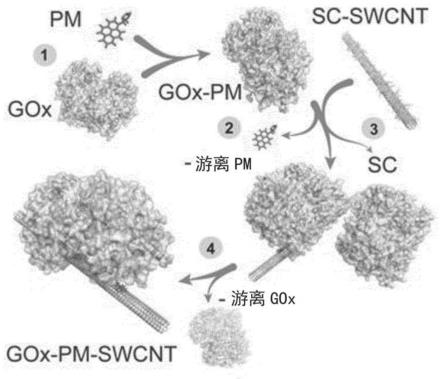
41.图11是gox-pm-swcnt制备步骤的说明。(1)还原gox突变体及其与pm缀合;(2)从未反应的pm中纯化gox-pm;(3)用pm-gox包裹sc-悬浮的swcnt并透析sc;(4)在最后的透析步骤中去除游离的gox。
42.图12显示了gox(绿线)、pm(蓝线)和gox-pm(橙线)的紫外可见吸收光谱。在280nm处观察到了蛋白质的芳香族氨基酸的吸收。450nm处的宽峰对应于fad吸收。pm交联剂的光谱在268、278、315、329和345nm处显示峰。蛋白质样品中的gox浓度为0.5mg ml-1
。虚线代表345nm处的pm吸收峰最大值。
43.图13显示了gox(wt)(绿线)和gox(70c)-pm(橙线)在345nm pm激发下的发射光谱。样品中的gox浓度为0.5mg ml-1
。虚线代表芘在376和396nm处的gox-pm荧光峰最大值,以及在480和495nm处紧密靠近的两种芘。
44.图14显示了gox-pm-swcnt(红线)与用非特异性吸附的gox(wt)-swcnt(紫线)和sc-swcnt(蓝线)获得的悬浮液相比的紫外可见近红外吸收光谱。将光谱归一化为739nm处的swcnt吸光度。小图(insert)显示了620和700nm之间合并的e
22
(7,5)、e
22
(7,6)swcnt峰和1080和1190nm之间的e
11
(7,6)swcnt峰的吸收光谱。345nm处的虚线表示pm吸收峰的位置。
45.图15显示了gox-pm-swcnt(红线)和gox(wt)-swcnt(紫线)的归一化近红外荧光光谱。在660
±
5nm激发。虚线分别代表e
11
(7,5)和e
11
(7,6)swcnt在1050和1153nm处的gox-pm-swcnt荧光峰值最大值。
46.图16a显示了在abts比色测定中测量的gox对葡萄糖的相对活性率。初始gox/sc-swcnt悬浮液(红色)以及在300kda mwco装置中透析24小时(绿色)和48小时(蓝色)后的活性率。在(0)样品中省略了酶。样品(i)、(ii)和(iii)的gox初始浓度为0.3、0.9和2.8mg ml-1
。在最后的透析步骤后获得样品(+)gox-pm-swcnt(初始蛋白质浓度为1.4mg ml-1
)。
47.图16b显示了透析前后采集的悬浮液图像。透析后,将样品离心以沉淀聚集的swcnt。
48.图17a显示了初始浓度为0.3、0.9和2.8mg ml-1
的gox-swcnt在abts比色活性测定中测量的吸光度(在414nm处)。用线性函数拟合数据并获得图例中列出的斜率值。
49.图17b显示了光谱测量的gox浓度与确定的相对gox活性率。
50.图18显示了gox-pm-swcnt(蓝线)和sc-swcnt(紫线)在添加20nm葡萄糖之前(虚线)和2分钟之后(实线)的近红外荧光光谱。在添加葡萄糖溶液之前,将e
11
(7,6)峰归一化为其荧光强度的最大值。在660
±
5nm激发。
51.图19显示了在具有葡萄糖渗透膜的装置中gox-pm-swcnt的e
11
(7,6)峰强度监测。将溶于pbs的20mm葡萄糖添加到膜的顶部,并在荧光达到稳定后用pbs洗涤。将荧光(i)归一化为0分钟(i0)时的强度为(i-i0)/i0。在660
±
5nm激发。
52.发明详述
53.以下实施方案适用于本发明的所有方面。
[0054]“生物分子”(b)可以是用于结合靶标分析物的任何肽、多肽、蛋白质、抗体等。合适的生物分子包括但不限于葡萄糖氧化酶、伴刀豆球蛋白a、葡萄糖结合蛋白、胆固醇氧化酶、乳酸氧化酶等。优选的生物分子是葡萄糖氧化酶(gox)。
[0055]
生物分子包含一个或多个表面暴露的硫醇部分。
[0056]“表面暴露的”是指硫醇部分对于硫醇反应性连接基团是可及的,使得接头可通过暴露的硫醇基团附接至生物分子。因此硫醇部分是表面可及的。
[0057]“硫醇部分”是指含有硫醇基团的部分。合适的硫醇部分是半胱氨酸残基。其他合适的硫醇部分包括含有硫醇基团的非天然氨基酸。含有硫醇基团的非天然氨基酸的例子是硒代半胱氨酸。由于蛋白质中的硫醇基团对通常在同一生物分子内或生物分子之间形成二硫键,因此可能需要还原生物分子以形成适合连接的游离硫醇基团。
[0058]
在优选的实施方案中,生物分子包含单个表面可及的硫醇部分。在备选实施方案中,生物分子包含多个表面可及的硫醇部分。
[0059]
具有单一表面可及部分可确保每个生物分子在同一方向上定向。然而,在一些实施方案中,具有多于一个的连接点可能是有利的。具有多个接头可以增加生物分子与基板的结合强度,这可以例如提高装置的弹性。此外,通过具有多个系链点(tether point)可能更好地控制生物分子在表面上的定向。例如,它可以确保特定的蛋白质呈现或折叠构象。
[0060]
在优选的实施方案中,生物分子被修饰以提供表面暴露的硫醇部分。通过这种方法,可能完全控制连接位置。然而,在一些情况下,生物分子可天然包含一个或多个适合作为接头的连接位置的表面暴露的硫醇部分。因此,在一些实施方案中,不必修饰用于本发明的生物分子。然而,在优选的实施方案中,生物分子被修饰。
[0061]“接头”或“连接基团”是指与生物分子附接并使生物分子-接头能够附着到基板上的基团。合适的接头包括能够与生物分子附接的基团和能够与基板附接的基团。接头优选通过硫醇反应基团与生物分子共价附接。接头优选非共价地附着到生物分子的表面。因此,接头包含硫醇反应基团和基板附着基团。在实施方案中,接头是疏水接头。在实施方案中,接头不包含dna。在实施方案中,接头包含单体分子。在优选的实施方案中,接头是具有一个或多个硫醇反应基团的疏水接头而不是dna。
[0062]“硫醇反应基团”是指可以与硫醇基团形成键的基团。合适的基团包括马来酰亚胺、氮丙啶、丙烯酰基衍生物、芳基化剂、吡啶基二硫化物(dusulfide)、二硫化物试剂、乙烯砜衍生物、卤代乙酰基和烷基卤衍生物(包括碘乙酰基和溴乙酰基等)。优选的硫醇反应基团是马来酰亚胺。
[0063]“基板附着基团”是指被配置为附着到基板上的基团。这可能是通过非共价键,例
如π-π堆积。合适的基板附着基团包括但不限于芘基、卟啉、三亚苯、蒽、二苯并环辛炔、并五苯、萘。在实施方案中,基板附着基团包含至少一个芳环。在进一步的实施方案中,基板附着基团包含至少两个、至少三个或至少四个芳环。
[0064]
因此,接头包含可以与生物分子上的硫醇基团形成键的部分,以及能够附着到基板的部分。根据本发明的特定接头包含马来酰亚胺基团作为硫醇反应基团和芘基团作为基板附着基团。特定的接头是n-(1-芘基)-马来酰亚胺(pm)。
[0065]
接头的大小将取决于传感器的要求。在实施方案中,将选择接头长度以允许生物分子在基板表面上采用正确的构象结构。在进一步的实施方案中,将选择接头长度以促进电荷从生物分子上的反应位点转移到基板。
[0066]
在实施方案中,选择接头长度以将生物分子固定在距基板表面约50埃以内,优选低于约25埃、低于约15埃、低于约10埃、低于约7埃或低于约5埃。特别优选低于约15埃以促进直接电子转移。在实施方案中,选择接头长度以将生物分子的反应位点固定在距基板表面的上述距离内。
[0067]
接头可以包含直接连接到基板附着基团的硫醇反应基团。或者,接头可在硫醇反应基团和基板附着基团之间包括间隔物。合适的间隔物包括烷基、烯基或炔基基团、环烷基、环烯基或杂环基团,它们可以任选地被一个或多个合适的取代基取代。合适的间隔物还包括聚合物链,例如聚乙二醇、聚丙二醇、聚丁二醇(polytetramethylene glycol)等。优选短聚合物链。
[0068]“基板”是指生物分子固定在其上的材料。合适的基板包括碳纳米材料,包括纳米载体、单壁碳纳米管(swcnt)、多壁碳纳米管(mwcnt)、单壁碳纳米角、富勒烯、石墨烯、氧化石墨烯等。
[0069]
在实施方案中,基板是具有光学特性的材料。这种基板可用在光学传感器中。具有光学特性的材料的例子是发荧光的swcnt。
[0070]
在实施方案中,基板是具有电荷承载特性的材料。这种材料可以允许电子转移到材料上。具有电荷承载特性的材料可用在电化学传感器中。具有电荷承载特性的材料的例子是mwcnt。
[0071]“传感器”是指能够检测靶标条件(例如分析物的存在)并提供可检测信号的装置,该可检测信号可用于确定条件是否存在(例如以确定分析物的存在或浓度)。在实施方案中,传感器是光学传感器。在进一步的实施方案中,传感器是电化学传感器。在优选实施方案中,传感器是光学传感器。
[0072]
本发明提供固定在基板上的生物分子。在优选的实施方案中,由于连接基团的定位,生物分子在基板上对齐。这种一致性可以增加包装密度和/或灵敏度。对齐的程度将取决于基板和连接策略。
[0073]
本发明提供了一种突变的生物分子;其中所述突变引入一个或多个位点选择性硫醇缀合位点,该位点选择性硫醇缀合位点经选择以允许多肽缀合至包含硫醇反应基团的接头。优选地,一个或多个突变不在多肽的分析物结合腔中。根据本发明,术语“突变”或“突变的”不包括对生物分子的c-末端修饰。换言之,包括引入硫醇反应基团的c-末端修饰的生物分子将不落入本发明的范围内。
[0074]
本发明提供:包含一个或多个突变的葡萄糖氧化酶多肽、包含一个或多个突变的
碳水化合物氧化酶多肽或包含一个或多个突变的乳酸氧化酶多肽;其中所述一个或多个突变引入位点选择性硫醇缀合位点,所述位点选择性硫醇缀合位点经选择以允许所述多肽缀合至包含硫醇反应基团的接头。优选地,一个或多个突变不在多肽的分析物结合腔中。
[0075]
在确定合适的突变位置时,可以考虑许多因素。首先,突变的残基必须是表面暴露的。其次,为了促进电荷转移,如果生物分子是酶,则蛋白质的突变的残基和活性位点之间的距离应该短,以促进电荷转移到基板上。第三,突变的残基不应不利地干扰生物分子的活性位点。第四,如果蛋白质活性基于变构效应,例如生物分子(例如葡萄糖结合蛋白)的构象变化,那么理想地应该在柔性结构域(或多个柔性结构域)实施突变。
[0076]
优选地,突变是置换。优选地,置换是适合缀合的残基置换野生型残基。优选地,所述残基是半胱氨酸,但备选地,所述残基是包括硫醇或硒醇基团的非天然氨基酸。备选氨基酸的例子是硒代半胱氨酸。
[0077]
在一个实施方案中,多肽是葡萄糖氧化酶(gox)。在实施方案中,gox的野生型(即非突变)序列包含或由seq id no:1或其功能变体组成。本发明涉及野生型序列中的一个或多个置换。在一个实施方案中,置换位于seq id no:1中的以下位置中的一个或多个:13、70、418和446或其任何组合。在进一步优选的实施方案中,置换是以下中的一个或多个:k13c、d70c、a418c和h446c或其任何组合。
[0078]
在一个实施方案中,gox多肽的序列选自seq id no:2、3、4、5或6或其功能变体,其中x选自半胱氨酸或包括硫醇或硒醇基团的氨基酸,例如硒代半胱氨酸。
[0079]
如本文关于seq id no:1至6中的任一项所使用的术语“功能变体”是指保留完整非变体序列的生物学功能的变体序列或序列的一部分。在seq id no 1至6的上下文中,这可能意味着变体序列能够催化葡萄糖氧化成过氧化氢和d-葡萄糖酸-δ-内酯。功能变体还包括例如在非保守残基中具有不影响功能的序列改变的变体。还包括与本文所示的野生型序列相比基本上相同的变体,即例如在非保守残基中,仅具有一些序列变异,并且具有生物学活性。每个提议的修饰都在本领域的常规技术范围内,编码产物的生物学活性的保留的确定也是如此。
[0080]
如在本文所述的本发明的任何方面中使用的,“变体”或“功能变体”与非变体氨基酸序列具有至少25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%的整体序列同一性。
[0081]
如果两个序列中的氨基酸序列在如下所述的最大对应性比对时相同,则称两个核酸序列是“相同的”。在两个或多个氨基酸的上下文中,术语“相同”或百分比“同一性”是指在比较窗口比较和比对最大对应性时相同或具有特定百分比的相同氨基酸的两个或多个序列或子序列,如使用以下序列比较算法之一或通过手动比对和目视检查测量的。对于序列比较,通常一个序列作为参考序列,测试序列与其进行比较。当使用序列比较算法时,将测试和参考序列输入计算机,必要时指定子序列坐标,并指定序列算法程序参数。可以使用默认程序参数,也可以指定备选参数。然后,序列比较算法基于程序参数计算测试序列相对
for protein structure-function studies.bmc biotechnol.9,1-8(2009))。使用添加sapi限制性位点的表1中的引物对扩增合成gox基因的野生型和变体,并将该基因连接到sapi消化的表达载体pbsya3s1z。连接将编码序列与α-因子分泌信号融合。将所得载体亚克隆到大肠杆菌(e.coli)中并通过测序验证(gatc,德国)。pcr在0.2ml microamp反应管(applied biosystems,life technologies)中在simpliamp热循环仪(thermo fisher scientific)中进行。简而言之,50μl反应混合物包括5μl40pm引物、4μl(或500ng)质粒dna、2μl0.2mm dntp、1μl(或1.5u)q5聚合酶、10μl来自克隆试剂盒(m0491s,new england biolabs)的5x q5缓冲液和28μl ddh2o水。pcr方案包括在98℃下变性15秒,在60℃下退火15秒,在72℃下延伸2小时30分钟。这个过程重复了33个循环。接下来,将40μl带有正向和反向引物的两个单引物pcr产物在pcr管中合并,并在98℃下变性5分钟以将合成的dna与质粒模板dna分离。管子从98℃逐渐冷却到16℃。未突变的dna在2.5μl fd缓冲液中用1μl 20u dpni在37℃下消化3小时,然后在10℃下孵育过夜。消化的pcr产物通过琼脂糖凝胶电泳进行分析(图2),并使用qiaex ii凝胶提取试剂盒从凝胶中纯化。最后,我们获得了~140ngμl-1
表达质粒,如用nanodrop 2000光谱仪(thermo fisher scientific)测量的。质粒在20℃保存。
[0098][0099][0100]
表1用于制备突变的gox表达质粒的合成双链dna引物
[0101]
毕赤酵母转化
[0102]
在转化之前,根据j.lin-cereghino等人(lin-cereghino,j.等人condensed protocol for competent cell preparation and transformation of the methylotrophic yeast p.pastoris.biotechniques 38,44-48(2005))报告的方案制备了毕赤酵母bg11感受态细胞。将100μl感受态毕赤酵母细胞与3μg的pbsya3-gox-k13c、pbsya3-gox-d70c、pbsya3-gox-a418c、pbsya3-gox-h446c质粒和野生型pbsya3-gox质粒混
合。骨架质粒pbsya3s1z获自bisy e.u。
[0103]
通过在1.25kv(eppendorfeporator)下电穿孔,用3μg质粒dna转化感受态毕赤酵母bg11细胞,并在含有100μg ml-1
博来霉素(zeocin)的ypd琼脂平板上选择转化菌落。将来自每个菌株的12个随机选择的克隆转移接种到在覆盖有透气的114μm rayon膜(vwr international)的无菌96深孔板中250μl的bmd 1%生长培养基中,在30℃下,同时以300rpm振荡。三天后,将250μl bmm2培养基加入孔中。再过12小时后,加入50μl bmm10培养基,再培养12小时和24小时后,重复此步骤两次。培养基制备方案如表2所示。四天后,在600nm处测量培养物的光密度,并将培养物以3220x g离心10分钟。收集上清液以测试gox活性,并将细胞沉淀储存在4℃。
[0104][0105][0106]
表2:用于大肠杆菌和毕赤酵母培养的细胞培养基
[0107]
比色gox酶活性测定
[0108]
使用abts(biochemica,itw reagents)比色测量酶活性(bateman,r.c.,等人using the glucose oxidase/peroxidase system in enzyme kinetics.j.chem.educ.72,240-241(1995))。简而言之,将ph 5.75的119.8μl 50mm柠檬酸钠缓冲液与80μl 1m葡萄糖(β-d-葡萄糖,ab 136302,abcr gmbh&co.kg)混合。此外,在柠檬酸钠缓冲液中制备40μl 20mm abts。在将混合物转移至15μl细胞培养上清液之前,加入0.2μl 2mg ml-1 vi型辣根过氧化物酶(p6782,sigma)。在酶标仪(plate reader)varioskan lux中连续测量414nm处的吸光度。吸光度的变化被归一化为原始表达培养物的光密度。
[0109]
gox在毕赤酵母中的表达
[0110]
重组gox是在毕赤酵母中生产的。选定的gox克隆(k13c、d70c、a418c、h446c)和野生型gox用于在带有棉组织塞的2l锥形瓶中进行蛋白质表达。将细胞加入烧瓶中,加入75ml的bmd 1%培养基,在30℃下孵育,同时以300rpm振荡两天。第三天加入75ml bmm2培养基以诱导蛋白表达。12小时后,向烧瓶中加入15ml bmm10培养基,该步骤重复两次。然后将细胞培养物以3220x g离心10分钟,并通过0.2μm多孔过滤器过滤上清液。将上清液保存在冰上并使用vivaflow 50r 30kda mwco错流透析装置(sartorius)浓缩至约30ml。将溶液在具有10kda mwco的amicon超离心过滤装置(merck millipore)中进一步浓缩,并将缓冲液更换为pbs(ph 7.4)。最后,每种溶液约6ml通过0.2μm多孔过滤器过滤并储存在4℃。
[0111]
gox纯化
[0112]
使用akta起始设置(ge healthcare)在5℃下从蛋白质混合物中纯化和提取gox。hiprep 16/60sephacryl s-300高分辨率柱(ge healthcare)用于尺寸排阻蛋白纯化。将5.5ml的蛋白质混合物加样到柱子上,并使用含有140mm nacl的ph 7.4的10mm pbs洗脱。使用比色gox酶活性测定确认每个收集管中的蛋白质存在,收集含有gox的级分并在10kda mwco amicon超离心装置中浓缩至1-1.5ml。在浓缩期间,将缓冲液更换为含有10mm edta(sigma)和150mm nacl的10mm pbs(ph 7.0)。在nanodrop 2000中测量储备溶液中gox的浓度(450nm处的黄素消光系数为1.4x104m-1
cm-1
)(bateman,r.c.,等人purification and properties of the glucose oxidase from aspergillus niger.j.biol.chem.240,2209-2215(1965)),并调整为3mg ml-1
(在sds-page分析中确定gox的分子量为约85kda)。最终的蛋白质产量介于8到15mg l-1
的细胞培养基之间。gox溶液在4℃下储存在pbs(ph 7.0)中,并添加了edta作为抗微生物剂。
[0113]
sds-page分析
[0114]
将1μl的每种蛋白质溶液稀释在9μl的pbs(ph 7.4)中,并将合并的溶液添加到10μl的2x bluejuice加样缓冲液(invitrogen)中,该缓冲液含有sds和20mm 1,4-二硫苏糖醇(dtt,carl roth gmbh)。在pbs(ph 7.4)中制备商购野生型gox溶液,商购来自黑曲霉的gox(ii型,19 440u g-1
,sigma aldrich)。该溶液还与加样缓冲液混合。将蛋白质加热至95℃6分钟,同时在1.5ml试管中以500rpm振荡。之后,将15μl的每种溶液加样到凝胶中。凝胶电泳在mini-protean tetra细胞系统(bio-rad laboratories)中以100v进行10分钟和以250v进行50分钟。凝胶用0.25%考马斯亮蓝r-250(itw试剂)的40%乙醇和10%乙酸溶液在室温下染色2小时。然后将凝胶在以4∶1∶5比例制备的乙醇∶乙酸∶水溶液中染色(distain)4小时。凝胶在fusion solo s凝胶成像仪(vilber loumat)中成像。
[0115]
圆二色性(cd)光谱
[0116]
使用j-810cd分光偏振计(jasco)在195和250nm之间测量gox的uv-cd光谱。参考比色杯中装有含有edta的pbs(ph 7.0)。使用来自“卷曲(convolve)”函数的卷积滤波器内核(convolution filter kernel)对光谱进行平滑处理。使用bestsel软件分析光谱以识别蛋白质折叠的差异(micsonai,a.,等人accurate secondary structure prediction and fold recognition for circular dichroism spectroscopy.proceedings of the national academy of sciences.112,e3095-e3103(2015);micsonai,a.,等人bestsel:a web server for accurate protein secondary structure prediction and fold recognition from the circular dichroism spectra.nucleic acids research.46,
w315-w322(2018))。
[0117]
硫醇反应测定
[0118]
野生型和突变型gox在5℃下用10mm三(2-羧乙基)膦(tcep,abcr)还原1小时,同时以500rpm振荡。使用pd miditrap g-25脱盐柱(ge healthcare)去除tcep,并用含有edta的pbs(ph 7.0)洗脱,以尽量减少gox低聚物的形成。使用nanodrop 2000光谱仪将gox的浓度调整为0.87
±
0.04mg ml-1
。将195μl的每种蛋白质溶液转移到96孔板中,并在酶标仪中测量吸收光谱。接下来,将5μl新鲜制备的20mm(spdp)(abcam)的二甲亚砜(dmso,sigma)的溶液与溶液混合。在加入spdp后1、8、30、60和120分钟重复测量吸收光谱。比较蛋白质和不存在蛋白质的对照之间在343nm处最终吸光度和添加spdp之前的吸光度之间的差异。根据等式(δax mw)/(c
gox xε
343nm
)计算每摩尔gox的spdp摩尔数。其中δa是343nm处的吸光度差异,mw是gox的分子量,c
gox
是gox的浓度(mg ml-1
),吡啶-2-硫酮在343nm处的消光系数为ε
343nm
=8.08x103m-1
cm-1
(hermanson,g.t.bioconjugate techniques第三版elsevier inc.(2013))。
[0119]
gox与pm交联
[0120]
gox d70c储备溶液用tcep(如前所述)还原并使用脱盐柱去除。接下来,将5μl新鲜制备的30mm pm的dmso(abcr)溶液添加到995μl新鲜还原的蛋白质溶液(~1mg ml-1
)中,添加大约10倍过量的pm。该反应在ph 7.0下进行,这使得马来酰亚胺主要与游离硫醇反应(mukhortava,a.,等人efficient formation of site-specific protein-dna hybrids using copper-free click chemistry.bioconjugate chemistry.27,1559-1563(2016))。样品在4℃下孵育过夜并以500rpm振荡。使用含有pbs(ph 7.4)(gibco,life technologies)的pd miditrap g-25脱盐柱从pm-gox溶液中去除游离pm。样品保存在4℃。
[0121]
荧光光谱法
[0122]
gox和gox-pm荧光光谱在varioskan lux酶标仪(thermofisher scientific)中以底部扫描读板模式测量。样品在345
±
2.5nm处激发。
[0123]
gox-pm-swcnt的制备
[0124]
将50mg swcnt(富含(7,6)的碳纳米管,sigma aldrich)与50ml 2wt%胆酸钠(sc)(sigma aldrich)混合,并使用尖端超声仪(1/4in.尖端,qsonica q700)在冰浴中以1%的振幅超声。sc-swcnt悬浮液以164 000x g超速离心3小时(beckman optima xpn-80)。收集大约80%的上清液并在室温下储存。0.5ml的25mg l-1 sc-swcnt储备溶液与0.5ml的约3mg ml-1 gox-pm(或gox)混合。随后将悬浮液在14kda mwco透析管(d9777,sigmaaldrich)中于2l pbs(ph 7.4)中在5℃下透析4小时。将透析过的混合物转移到300kda mwco透析装置(spectra/por float-a-lyzer,spectrum laboratories)中,并在5℃下对2l pbs缓冲液透析两天(在此期间,缓冲液更换四次)。gox-pm-swcnt储存在4℃。
[0125]
透析中的gox去除
[0126]
使用商购来自黑曲霉的酶(ii型,19 440u g-1
,sigma aldrich)和光谱测量的蛋白质浓度0.69、1.9和5.6mg ml-1
(ε
450nm
=1.4x104m-1
cm-1
,gox摩尔质量80kda)(bateman,r.,等人using the glucose oxidase/peroxidase system in enzyme kinetics.journal of chemical education.12,a240-a241(1995))制备gox的pbs溶液。接下来,将0.5ml溶液与sc-swcnt(25mg l-1
)以1∶1的比例混合,这样样品稀释了一半。将混合物在300kda mwco透析
管(spectrum laboratories)中的单独烧杯中对2l pbs透析,并且每4小时更换一次烧杯中的缓冲液。在透析的第二天使用新鲜的透析管,因为在透析24小时后,在一些样品中可以看到swcnt聚集在膜上。根据上述方案在透析24和48小时后进行比色abts gox活性测定(15μl的每种悬浮液用于测定)。使用1ml的12mg l-1
sc-swcnt进行对照透析实验,并将gox-swcnt酶活性与gox-pm-swcnt样品进行比较。
[0127]
吸收光谱
[0128]
使用紫外可见近红外分光光度计(uv-3600plus,shimadzu)在200和1350nm之间获取光谱。所有测量均在石英比色杯(10mm,quartz suprasil,hellma analytics)中进行。swcnt浓度使用739nm处的消光系数计算(ε
739nm
=25.3ml mg-1
cm-1
)(yang,j.,等人quantitative analysis of the(n,m)abundance of single-walled carbon nanotubes dispersed in ionic liquids by optical absorption spectra.materials chemistry and physics.139,233-240(2013))。
[0129]
近红外荧光光谱
[0130]
在96孔板(costar 3590,croning incorporated)中加入49μl的gox-pm-swcnt和gox-swcnt的pbs悬浮液。使用6前面描述的近红外微型光谱仪在950和1400nm(751mm-1
光栅)之间获取近红外荧光光谱。样品用660
±
5nm激光(superk extreme exr-15和superk varia,nkt photonics)照射。在向孔中加入1μl 1m葡萄糖的pbs(ph 7.4)溶液时,连续采集荧光光谱。gox-pm-swcnt传感器响应于20mm葡萄糖的pbs溶液的添加和去除而发出的荧光是在顶部带有14kda mwco纤维素膜(sigma aldrich)的玻璃底装置中进行的,如在6中所述。
[0131]
实施例1:gox的诱变
[0132]
设计了具有半胱氨酸残基的gox变体,可用于将交联剂附接到特定表面区域。
[0133]
为了鉴定非保守的表面暴露的氨基酸,分析了gox同源物(homologue),并将序列保守性映射到来自黑曲霉的gox的晶体结构(pdb:3qvp(kommoju,p.,et al.probing oxygen activation sites in two flavoprotein oxidases.biochemistry 50,5521-5534(2011)))。
[0134]
从易于诱变为半胱氨酸的所有残基中,选择距酶的葡萄糖结合腔不同距离的四个位置(d70、h446、a418和k13)。图1显示了结构代表,显示了氨基酸残基k13、d70、a418和h446(蓝色)以及具有fad辅因子的内部葡萄糖结合腔(红色)。图示显示了黄素环(三环异咯嗪)的si-面上方的葡萄糖结合腔之间的距离(kommoju,p.-r.,等人probing oxygen activation sites in two flavoprotein oxidases.biochemistry.50,5521-5534(2011)),显示为红色球体,并且残基突变为半胱氨酸。fad和葡萄糖捕获氨基酸(his559和his516)以红色显示。从pdb代码3qvp获得晶体结构。
[0135]
不希望受理论束缚,选择突变点以提供活性位点到传感器表面之间的最短距离以促进从gox的活性位点到基板的直接电子转移。
[0136]
实施例2:gox表达
[0137]
野生型gox和k13c、d70c、a418c、h446c变体在优化的毕赤酵母生产酵母菌株中表达(looser,v.,等人cultivation strategies to enhance productivity of pichia pastoris:a review.biotechnology advances.33,1177-1193(2014)),其包含类似于人类
细胞中发现的蛋白质n-糖基化途径(brooks,s.a.appropriate glycosylation of recombinant proteins for human use:implications of choice of expression system.molecular biotechnology.28,241-256(2004))。使用尺寸排阻色谱纯化蛋白质,并储存在加入edta的pbs(ph 7.0)中。图4中显示的sds-page结果证实了预期的蛋白质大小(~85kda)。与商购的来自黑曲霉的gox(约80kda)(泳道1)相比,来自毕赤酵母的重组gox在表观分子方面略有增加。这种差异归因于更大程度的糖基化。
[0138]
表达的gox变体通过尺寸排阻色谱进行浓缩和纯化,并且获得了8至15mg l-1
的细胞培养基产量。色谱结果见图3。
[0139]
gox溶液储存在ph 7.0的磷酸钠缓冲盐水(pbs)中,并添加了抗菌剂(乙二胺四乙酸,edta)(finnegan,s.等人edta:an antimicrobial and antibiofilm agent for use in wound care.advances in wound care.4,415-412(2015))。
[0140]
实施例3:野生型gox和突变体k13c、d70c、a418c和h446c的表征
[0141]
sds-page分析
[0142]
通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析蛋白质,如图4所示。sds-page显示,与商购的来自黑曲霉的gox(泳道1)相比,毕赤酵母表达的gox的表观分子量增加,约85kda,这可能是由于更大程度的糖基化。来自黑曲霉的gox糖基化率为10-16%,分子量约为80kda。见参考文献28。在变体中,d70c(泳道5)的分子量稍小。
[0143]
圆二色性(cd)光谱
[0144]
酶的二级结构用图5所示的圆二色性(cd)测量值和图6所示的拟合理论光谱表征。所有结构,包括表达的野生型、商购野生型和突变体,都具有相似的cd光谱。使用二级结构预测软件bestsel拟合gox变体的cd谱。结果如图6和图7所示。图6显示了使用二级结构预测软件bestsel拟合的gox变体的cd谱。图7显示了gox变体中bestsel预测的结构特征百分比(α-螺旋和β-链)的分布。这些变体与来自pdb 1cf3代码的晶体结构进行了比较。星号表示由商购的从黑曲霉获得的gox制成的样品。表达的蛋白质包含17-28%α-螺旋和16-22%β-链,图7,根据商购gox报告的值(α-螺旋和β-链分别为24%和17%)。见参考文献15。结果证实突变没有显著减少蛋白质折叠。
[0145]
abts测定中的酶活性
[0146]
通过比较比色abts测定测量的活性也证实了酶活性的保持(图8)。如图所示,对葡萄糖的酶活性在野生型gox和突变体之间没有差异,包括突变对活性没有显著影响。
[0147]
实施例4:gox与硫醇反应性交联剂的生物缀合
[0148]
基于它们对琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯(spdp)的反应性比较了靶标残基的可及性,spdp释放了在343nm处吸收的缀合反应产物吡啶-2-硫酮。吸收光谱通过使用三(2-cra)还原硫醇制备用于交联的蛋白质,在120分钟内进行了测量(图9),并通过343nm处吸收的增加来监测游离硫醇的反应性(图10)。可以看出,所有突变的gox在343nm处表现出增加的吸光度,表明突变的蛋白质中存在可及的表面硫醇。相比之下,wt gox(也被还原)不与spdp反应,因为其在343nm处的吸光度增加与对照相似(spdp在水溶液中自发降解)(kavimandan,n.,等人synthesis and characterization of insulin-transferrin conjugates.biocojugate chemistry.17,1376-1384(2006))。
[0149]
a418c被鉴定为最具反应性的半胱氨酸突变体,每摩尔gox反应了约0.4摩尔spdp,
其次是d70c(每摩尔gox反应了约0.3摩尔spdp)。正如预期的那样,还原的野生型gox不与spdp反应。
[0150]
选择d70c变体来展示硫醇-马来酰亚胺“点击(click)”化学反应,使用pm交联剂将蛋白质固定在swcnt上。
[0151]
实施例5:蛋白质固定在swcnt上
[0152]
选择d70c变体用于使用图11中所示的缀合策略固定在swcnt上。图12中显示的吸光度测量结果证实了纯化的缀合蛋白质级分中存在pm。pm接头与gox的缀合也通过图13中所示的pm荧光测量值得到证实。与先前的观察一致,当pm马来酰亚胺和蛋白质硫醇之间形成共价键时,pm接头在345nm激发后在376和396nm发出荧光(wu,c.,等人n-(1-pyrene)maleimide:a fluorescent cross-linking reagent.biochemistry.15,2863-2868(1976))。由于两个芘彼此靠近(约),也会出现480和495nm的宽发射峰(bains,g.等人.pyrene:a probe to study protein conformation and conformational changes.molecules.16,7909-7935(2011)),表明pm-gox单体被折叠成具有酶活性的二聚体。
[0153]
通过吸光度和近红外荧光光谱两者证实了蛋白质与swcnt表面的缀合(图14和15)。与sc-swcnt相比,非特异性吸附的gox(wt)-swcnt和gox-pm-swcnt均显示出swcnt的(7,5)和(7,6)手性的红移吸收峰。e
22
(7,5)和e
22
(7,6)swcnt的合并峰从657nm位移至660nm。e
11
(7,5)和e
11
(7,6)swcnt峰分别从1045位移至1047nm和从1135位移至1138mm。这归因于蛋白质电晕引起的溶剂化变化。与gox(wt)-swcnt相比,gox-pm-swcnt样品显示出对应于pm接头的吸收的额外的吸收峰。图15中所示的swcnt荧光的比较类似地显示了gox(wt)-swcnt和gox-pm-swcnt样品的不同光谱。对于gox-pm-swcnt在660nm激发下,分别在1050
±
1nm和1153
±
1nm处观察到(7,5)和(7,6)手性的e
11
发射。对于gox(wt)-swcnt,对于(7,5)和(7,6)手性,这些发射峰分别红移了2
±
1nm和4
±
1nm。这种红移表明与gox-swcnt相比,gox-pm-swcnt的表面覆盖率增加(choi,j.,等人solvatochromism in single-walled carbon nanotubes.applied physics letters.90,1-3(2007);jeng,e.,et al.detection of dna hybridization using the near-infrared band-gap fluorescence of single-walled carbon nanotubes.nano letters.6,371-375(2006))。
[0154]
因此,已经表明根据本发明的硫醇连接的修饰的生物分子可以比现有技术更密集地覆盖swcnt表面。为gox-pm-swcnt悬浮液实现更紧密的swcnt表面覆盖可能会对传感器稳定性和/或分析物灵敏度产生积极影响。对于传感器来说,这两种效果都是有价值的。
[0155]
本发明能够使蛋白质在swcnt表面上定向。本发明还显著提高了swcnt表面覆盖率,蛋白质通过本发明的接头,例如pm接头附着。更高的蛋白质覆盖密度增强了传感器对分析物的光学响应。本方法还具有比其他方法更显著的优势。本工作中报道的蛋白质固定方法将生物分子与接头(例如pm)位点特异性交联,然后将生物分子固定在基板上(例如swcnt)。这比例如在将具有合适官能团的蛋白质连接到dna分子末端之前将dna包裹在swcnt周围的方法(例如通过“点击”化学)具有优势。众所周知,当试剂可移动时,“点击”化学反应在溶液中的产率低于70-90%(kim,y.,等人efficient site-specific labeling of proteins via cysteines.bioconjugate chemistry.19,786-791(2008))。当dna吸附在基板表面时,反应产率可能会显著降低。本发明中描述的方法的优点是缀合发生在溶液
swcnt的近红外荧光光谱中swcnt峰的蓝移表明gox-pm比非特异性吸附的gox具有更密集的swcnt表面覆盖。该传感器对葡萄糖的变化表现出可逆的响应,这可适用于连续的葡萄糖监测。
[0163]
然而,应该理解,其他酶也可以用于开发其他分析物的传感器。例如,胆固醇氧化酶或乳酸氧化酶可用于形成用于胆固醇和乳酸检测的传感器。
[0164]
毫无疑问,技术人员会想到许多其他有效的备选方案。应当理解,本发明不限于所描述的实施方案并且包括对本领域技术人员显而易见的并且落在所附权利要求的精神和范围内的修改。
[0165]
现在将关于以下条款描述本发明:
[0166]
1.传感器b-l-s,其中b是包含一个或多个表面暴露的硫醇部分的生物分子,l是包含硫醇反应基团的接头,和s是基板;其中l通过一个或多个表面暴露的硫醇部分与b共价连接。
[0167]
2.传感器,其包含固定在基板上的生物分子;其中生物分子通过接头固定在基板上;并且其中生物分子具有一个或多个表面可及的硫醇部分并且通过所述一个或多个表面可及的硫醇部分连接至接头。
[0168]
3.传感器,其包含固定在基板上的突变的生物分子;其中生物分子通过接头固定在基板上;其中生物分子被突变以引入一个或多个表面可及的硫醇部分;并且其中生物分子通过所述一个或多个表面可及的硫醇部分连接至接头。
[0169]
4.传感器,其包含通过接头固定在基板上的生物分子,其中接头通过硫醇键连接至生物分子,并且其中基板是具有光学或电荷承载特性的材料。
[0170]
5.根据条款4所述的传感器,其中硫醇键位于生物分子上的一个或多个表面可及的硫醇部分与接头上的一个或多个硫醇反应基团之间。
[0171]
6.传感器,其包含通过接头固定到碳纳米材料基板上的生物分子,其中接头通过硫醇键连接到生物分子。
[0172]
7.根据前述条款中任一项所述的传感器,其中所述生物分子是葡萄糖氧化酶、伴刀豆球蛋白a、葡萄糖结合蛋白、胆固醇氧化酶或乳酸氧化酶。
[0173]
8.根据前述条款中任一项所述的传感器,其中所述生物分子包含一个或多个突变,其中所述一个或多个突变引入所述一个或多个表面暴露的硫醇部分。
[0174]
9.根据条款5所述的传感器,其中所述突变是置换,其中优选地,置换的残基选自半胱氨酸、硒代半胱氨酸或包括硫醇基团的非天然氨基酸。
[0175]
10.根据前述条款中任一项所述的传感器,其中所述基板是碳纳米材料,优选碳纳米载体、单壁碳纳米管(swcnt)、石墨烯、富勒烯、多壁碳纳米管(mwcnt)或单壁碳纳米角,更优选单壁碳纳米管(swcnt)。
[0176]
11.根据前述条款中任一项所述的传感器,其中所述接头包含硫醇反应基团,优选地其中所述硫醇反应基团选自马来酰亚胺、吡啶基二硫化物、氮丙啶、丙烯酰基衍生物、芳基化剂、二硫化物试剂、乙烯砜衍生物、卤代乙酰基,包括碘乙酰基和溴乙酰基,更优选地,其中硫醇反应基团是马来酰亚胺。
[0177]
12.根据前述条款中任一项所述的传感器,其中所述接头包含基板附着基团,优选地其中所述基板附着基团非共价地附着至所述基板的表面,更优选地其中所述基板附着基
团选自芘基、卟啉、三亚苯基、蒽、二苯并环辛炔、并五苯。
[0178]
13.根据前述条款中任一项所述的传感器,其中所述基板包括固定在其表面上的多个生物分子,并且其中所述生物分子以有序方式固定。
[0179]
14.控制固定在碳纳米材料基板上的生物分子的方法,所述方法包括:修饰所述生物分子以产生具有表面可及的硫醇部分的生物分子,以及使用具有硫醇反应基团的接头将所述修饰的生物分子固定到所述基板上,其中所述生物分子通过表面可及的硫醇部分和硫醇反应基团连接到接头。
[0180]
15.将生物分子附接到碳纳米材料基板的方法,其包括:修饰生物分子以引入一个或多个表面暴露的硫醇部分;将接头附接至生物分子,其中接头包含硫醇反应基团和基板附着基团;其中接头通过硫醇基团和硫醇反应基团与生物分子附接;并且其中生物分子-接头通过基板附着基团附着到基板上。
[0181]
16.获得生物分子在基板上结构化固定的方法,其包括修饰生物分子以包含一个或多个表面暴露的硫醇部分;通过表面暴露的硫醇部分和连接基团上的硫醇反应基团将连接基团连接到生物分子上;并通过连接基团将生物分子附着到基板上。
[0182]
17.根据条款14至16的方法,其中所述生物分子具有一个表面可及的硫醇部分。
[0183]
18.包含一个或多个突变的葡萄糖氧化酶多肽、包含一个或多个突变的碳水化合物氧化酶多肽或包含一个或多个突变的乳酸氧化酶多肽;其中所述一个或多个突变引入位点选择性硫醇缀合位点,所述位点选择性硫醇缀合位点经选择以允许所述多肽缀合至包含硫醇反应基团的接头。
[0184]
19.根据条款18所述的多肽,其中所述突变是置换,其中优选地,置换的残基选自半胱氨酸或含有硫醇基团的非天然氨基酸。
[0185]
20.根据条款19所述的多肽,其中置换的残基是半胱氨酸。
[0186]
21.根据条款18至20中任一项的多肽,其中葡萄糖氧化酶的序列包含在seq d no:1中定义的序列或其功能变体,并且其中所述序列进一步包含在seq d no:1中的位置13、70、418和446中的一个或多个的突变。
[0187]
22.根据条款21所述的葡萄糖氧化酶多肽,其中葡萄糖氧化酶的序列选自seq d no:2、3、4或5或其功能变体,其中x选自半胱氨酸或含有硫醇基团的非天然氨基酸。
[0188]
23.多核苷酸,其编码根据条款18至22中任一项所述的多肽。
[0189]
24.核酸构建体,其包含与调控序列可操作地连接的根据条款23所述的多核苷酸。
[0190]
25.生产传感器的方法,其包括:
[0191]
a)提供包含一个或多个表面暴露的硫醇部分的生物分子;
[0192]
b)使生物分子与包含硫醇反应基团的接头接触,使得接头通过硫醇反应基团与生物分子共价连接;
[0193]
c)将生物分子-接头附着到基板上,其中生物分子-接头通过接头附着。
[0194]
26.根据本发明的传感器在样品中分析物的检测和/或定量中的用途。
[0195]
27.检测和/或定量样品中分析物的方法,包括使用根据本发明的传感器。
[0196]
参考文献:
[0197]
1.kim,j.,campbell,a.s.&wang,j.wearable non-invasive epidermal glucose sensors:a review.talanta 177,163-170(2018).
additives.j.biol.chem.278,24324-24333(2003).
[0213]
17.filla,n.,ramasamy,r.&wang,x.forces,energetics,and dynamics of conjugatedcarbon ring tethers adhered to cnts:a computational investigation.phys.chem.chem.phys.20,11327-11335(2018).
[0214]
18.yang,z.,wang,z.,tian,x.,xiu,p.&zhou,r.amino acid analoguea bind to carbon nanotube viaππ-interactiohs:comparison of molecular mechanical and quantum mechanical calculations.j.chem.phys.136,1-10(2012).
[0215]
19.he,z.&zhou,j.probing carbon nanotube-amino acid interactions in aqueous solution with molecular dynamics simulations.carbon n.y.78,500-509(2014).
[0216]
20.kommoju,p.,chen,z.,bruckner,r.c.,mathews,f.s.&jorns,m.s.probing oxygen activation sites in two flavoprotein oxidases.biochemistry 50,5521-5534(2011).
[0217]
21.looser,v.et al.cultivation strategies to enhance productivity of pichia pastoris:a review.biotechnol.adv.33,1177-1193(2014).
[0218]
22.witt,s.,singh,m.&kalisz,h.m.structural and kinetic properties of nonglycosylated recombinant penicillium amagasakiense glucose oxidase expressed in escherichia coli.appl.environ.microbiol.64,1405-1411(1998).
[0219]
23.brooks,s.a.appropriate glycosylation of recombinant proteins for human use: implications of choice of expression system.mol.biotechnol.28,241-256(2004).
[0220]
24.hamilton,s.r.&gerngross,t.u.glycosylation engineering in yeast:the advent of fully humanized yeast.curr.opin.biotechnol.18,387-392(2007).
[0221]
25.krainer,f.w.et al.knockout of an endogenous mannosyltransferase increases the homogeneity of glycoproteins produced in pichia pastoris.sci.rep.3,1-13(2013).
[0222]
26.gu,l.,zhang,j.,liu,b.,du,g.&chen,j.high-level extracellular production of glucose oxidase by recombinant pichia pastoris using a combined strategy.appl.biochem.biotechnol.175,1429-47(2015).
[0223]
27.finnegan,s.&percival,s.l.edta:an antimicrobial and antibiofilm agent for use in wound care.adv.wound care 4,415-421(2015).
[0224]
28.leskovac,v.,s.,wohlfahrt,g.,j.&d.glucose oxidase from aspergillus niger:the mechanism of action with molecular oxygen,quinones,and oneelectron acceptors.int.j.biochem.cell biol.37,731-750(2005).
[0225]
29.bateman,r.c.&evans,j.a.using the glucose oxidase/peroxidase system in enzyme kinetics.j.chem.educ.72,240-241(1995).
[0226]
30.kavimandan,n.j.,losix,e.,wilson,j.j.,brodbelt,j.s.&peppas,n.a.synthesis and characterization of insulin-transferrin conjugates.biocojugate chem.17,1376-1384(2006).
[0227]
31.hermanson,g.t.bioconjugate techniques.(elsevier inc.,2013).
[0228]
32.wu,c.w.,yarbrough,l.r.&wu,f.y.h.n-(1-pyrene)maleimide:a fluorescent cross-linking reagent.biochemistry15,2863-2868(1976).
[0229]
33.bains,g.,patel,a.b.&narayanaswami,v.pyrene:a probe to study protein conformation and conformational changes.molecules 16,7909-7935(2011).
[0230]
34.jeng,e.s.,moll,a.e.,roy,a.c.,gastala,j.b.&strano,m.s.detection of dna hybridization using the near-infrared band-gap fluorescence of single-walled carbon nanotubes.nano lett.6,371-375(2006).
[0231]
35.choi,j.h.&strano,m.s.solvatochromism in single-walled carbon nanotubes.appl.phys.lett.90,9-12(2007).
[0232]
36.karajanagi,s.s.,vertegel,a.a.,kane,r.s.&dordick,j.s.structure and function of enzymes adsorbed onto single-walled carbon nanotubes.langmuir 20,11594-11599(2004).
[0233]
37.saifuddin,n.,raziah,a.z.&junizah,a.r.carbon nanotubes:a review on structure and their interaction with proteins.j.chem.676815,1-18(2013).
[0234]
38.karajanagi,s.s.et al.protein-assisted s0lubilization of single-walled carbon nanotubes.langmuir 22,1392-1395(2006).
[0235]
39.zubkovs,v.et al.spinning-disc confocal microscopy in the second near-infrared window(nir-ii).sci.rep.8,1-10(2018).
[0236]
40.barone,p.w.,baik,s.,heller,d.a.&strano,m.s.near-infrared optical sensors based on single-walled carbon nanotubes.nat.mater.4,86-92(2004).
[0237]
41.ashkenazy,h.,erez,e.,martz,e.,pupko,t.&ben-tal,n.consurf2010:calculating evolutionary conservation in sequence and structure of proteins and nucleic acids.nucleic acids res.38,529-533(2010).
[0238]
42.edelheit,o.,hanukoglu,a.&hanukoglu,i.simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies.bmc biotechnol.9,1-8(2009).
[0239]
43.lin-cereghino,j.et al.condensed protocol for competent cell preparation and transformation of the methylotrophic yeast pichia pastoris.biotechniques 38,44-48(2005).
[0240]
44.swoboda,b.e.p.&massey,v.purification and properties of the glucose oxidase from aspergillus niger.j.biol.chem.240,2209-2215(1965).
[0241]
45.micsonai,a.et al.bestsel:a web server for accurate protein secondary structure prediction and fold recognition from the circular dichroism spectra.nucleic acids res.46,w315-w322(2018).
[0242]
46.micsonai,a.et al.accurate secondary structure prediction and foldrecognition for circular dichroism spectroscopy.proc.natl.acad.sci.112,e3095-e3103(2015).
[0243]
47.mukhortava,a.&schlierf,m.efficient formation of site-specific protein-dna hybrids using copper-free click chemistry.bioconjug.chem.27,1559-1563(2016).
[0244]
48.yang,j.,zhang,z.,zhang,d.&li,y.quantitative analysis of the (n,m)abundance of single-walled carbon nanotubes dispersed in ionic liquids by optical absorption spectra.mater.chem.phys.139,233-240(2013).
[0245]
49.noncovalent interaction of single-walled nanotubes with 1-pyrenebutanoic acid auceimide ester and glucoseoxidase(2011)j.of physical chemistry c).
[0246]
50.carbon nanomaterials for biological imaging and nanomedical therapy”g.hong,s.diao,a.l.antaris,h.dai(2015)chemical reviews
[0247]
51.williams,r.,et al.noninvasive ovarian cancer biomarker detection via an optical nanosensor implant.science advances.4,1-11(2018)
[0248]
52.florian,a.,et al.nanobody conjugated nanotubes for targeted near-infrared in vivo imaging and sensing.angewandte chemie int.ed.10.1002/ange.201904167(2019)
[0249]
序列表
[0250]
seq id no:1(野生型gox)
[0251][0252]
seq id no:2(在位置13的突变)
[0253][0254]
其中x选自半胱氨酸或包括硫醇或硒醇基团的氨基酸,例如硒代半胱氨酸
[0255]
seq id no:3(在位置70的突变)
[0256][0257][0258]
其中x选自半胱氨酸或包括硫醇或硒醇基团的氨基酸,例如硒代半胱氨酸
[0259]
seq id no:4(在位置418的突变)
[0260][0261]
其中x选自半胱氨酸或包括硫醇或硒醇基团的氨基酸,例如硒代半胱氨酸
[0262]
seq id no:5(在位置446的突变)
[0263][0264]
其中x选自半胱氨酸或包括硫醇或硒醇基团的氨基酸,例如硒代半胱氨酸
[0265]
seq id no:6(来自genbank的黑曲霉野生型gox基因。信号序列以粗体表示)
[0266]
》gi|2357|emb|caa34197.1|来自黑曲霉的葡萄糖氧化酶
[0267]
[0268][0269]
seq id no:7(野生型gox)基因组dna序列
[0270][0271]
seq id no:8(k13c gox)基因组dna序列
[0272]
[0273][0274]
seq id no:9(d70c gox)基因组dna序列
[0275]
[0276][0277]
seq id no:10(a418c gox)基因组dna序列
[0278][0279]
seq id no:11(h446c gox)基因组dna序列
[0280]
[0281]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1