一种真核细胞启动子CF1及其在细胞基因表达中的应用的制作方法
一种真核细胞启动子cf1及其在细胞基因表达中的应用
技术领域
1.本发明涉及生物基因表达调控技术领域,尤其涉及一种真核细胞启动子cf1及其在细胞基因表达中的应用。
背景技术:
2.基因一般由编码区和表达调控区(即启动子)组成。启动子决定了基因的表达的时空特点和表达强度。生命科学和医学研究,工业化生产,都需要用到各种不同的启动子,以实现在各种体系中表达目标基因的蛋白产物。不同的启动子可能具有物种特异性,细胞类型偏好性,驱动基因表的能力也各有不同。真核细胞,尤其是哺乳动物细胞,是蛋白表达、生产及其功能验证的重要体系。真核细胞,尤其是哺乳动物细胞的蛋白表达产物,比如生长因子、酶、抗体等,往往具有原核表达所不具备的活性。但是真核细胞,尤其是哺乳动物表达系统的表达强度比原核细胞弱很多。因此,提升真核细胞目标基因的表达量是真核细胞表达系统的重要问题。而真核细胞的基因表达强度,除了与培养条件、细胞类型等因素有关外,所选择的启动子的强度是最重要的因素。在常见的能够驱动目标基因强表达的启动子中,cmv启动子和cag启动子比较常用。
3.cmv是人类巨细胞病毒来源的哺乳动物强表达启动子,但其表达量随宿主细胞的不同而有较大波动,也容易被沉默。cag启动子则由cmv启动子的增强子区、鸡β-actin启动子和内含子区、以及一段兔β-globin的内含子片段。cag启动子是目前常用的强启动子,其活性高于cmv、ef1(elongation factor-1a)、pgk等其他启动子,被广泛用于包括抗体在内的重组蛋白的表达。但是,cag启动子序列太长,达到1.7kb。这一特点使得cag启动子在很多依赖病毒感染的体系中不太适用,因为病毒颗粒所能包装的遗传物质的长度有限,过长的启动子往往导致所能表达的目标基因的长度受到限制。为此,有必要开发新的序列长度更短的能够在哺乳动物细胞中更高效的驱动外源基因表达的启动子。cag启动子通过将几种启动子元件组合达到提高启动子活性的策略,提示我们不同启动子之间的组合,可能是一种获得更高效能启动子的途径。
技术实现要素:
4.本发明提供了一种真核细胞启动子cf1及其在细胞基因表达中的应用,以解决现有技术的上述问题。
5.本发明的方案是:
6.一种真核细胞启动子cf1,包括具有如seq id no.1所示的核苷酸序列。
7.seq id no.1:
[0008][0009]
作为优选的技术方案,所述启动子cf1含位于5
’‑
端的cmv强启动子与一个位于3
’‑
端的ef1中等强度启动子,还包括连接区。
[0010]
作为优选的技术方案,所述cf1启动子直接驱动目标基因表达的质粒或者载体。
[0011]
作为优选的技术方案,所述质粒制备表达蛋白产物的细胞或细胞系用途;所述载体制备表达蛋白产物的细胞或细胞系用途。
[0012]
本发明还公开了一种cf1启动子所驱动的外源基因的表达应用,包括生长因子、抗体应用。
[0013]
本发明还公开了一种pcf1重组质粒,所述质粒的骨架为pcaggs质粒,所述pcaggs质粒的cag启动子替换为所述cf1启动子,并在启动子后引入nhei与bsrgi作为多克隆位点。
[0014]
由于采用了上述技术方案一种真核细胞启动子cf1及其在细胞基因表达中的应用,包括具有如seq id no.1所示的核苷酸序列。
[0015]
本发明的优点:
[0016]
1.cf1启动子有超过普通cmv和ef1数倍的基因表达调控能力,尤其是能够显著提高分子量较大的蛋白的表达。
[0017]
2.cf1启动子驱动外源基因表达的能力与被广泛采用的cag启动子相当,但长度更短,更适合依赖病毒的基因递送系统。各种病毒载体中容纳外源基因片段的长度有限,采用更短的cf1启动子,可以允许通过病毒递送系统表达分子量更大的蛋白。
[0018]
3.本发明设计的cf1启动子可以作为外源基因表达调控元件,用来插入到各种真
核细胞表达载体,或者重组入宿主细胞的基因组中,从而驱动其下游目标基因的高效表达;
[0019]
使用包含本发明所述的启动子控制的具有期望性状或特征的宿主细胞和有机体也是本发明的一部分。相比于其他启动子,本发明设计的启动子具有序列长度更短,具有更强的驱动位于其下游的目标基因表达的能力,在各种真核细胞表达体系中,可以用来提高目标蛋白的表达水平。该发明可应用于对包括单克隆抗体、细胞因子在内的各种蛋白的表达工艺的提升。
附图说明
[0020]
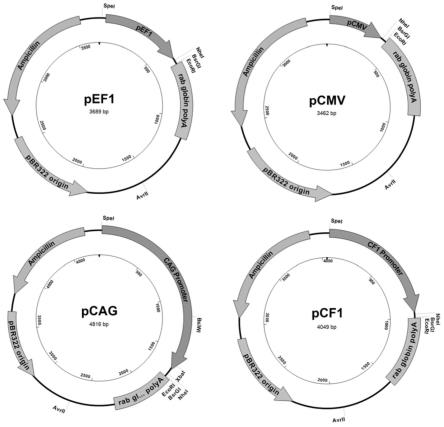
图1.cf1启动子驱动的egfp表达与其他启动子效果比较图;
[0021]
图2.western blot显示的cf1启动子驱动的myrf-n、myrf-fl表达与其他启动子效果比较图;
[0022]
图3.经改造后的含cf1、ef1、cmv、cag启动子的各质粒图谱。
具体实施方式
[0023]
为了弥补以上不足,本发明提供了一种真核细胞启动子cf1及其在细胞基因表达中的应用以解决上述背景技术中的问题。
[0024]
一种真核细胞启动子cf1,包括具有如seq id no.1所示的核苷酸序列。
[0025]
seq id no.1:
[0026]
所述启动子cf1含位于5
’‑
端的cmv强启动子与一个位于3
’‑
端的ef1中等强度启动子,还包括连接区。
[0027]
所述cf1启动子直接驱动目标基因表达的质粒或者载体。
[0028]
所述质粒制备表达蛋白产物的细胞或细胞系用途;所述载体制备表达蛋白产物的细胞或细胞系用途。
[0029]
本发明还公开了一种cf1启动子所驱动的外源基因的表达应用,包括生长因子、抗体应用。
[0030]
本发明还公开了一种pcf1重组质粒,所述质粒的骨架为pcaggs质粒,所述pcaggs质粒的cag启动子替换为所述cf1启动子,并在启动子后引入nhei与bsrgi作为多克隆位点。
[0031]
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐述本发明。
[0032]
实施例1:载体构建方法
[0033]
1.cf1启动子片段的获取:
[0034]
cf1启动子由cmv启动子和ef1a启动子组合而成,通过重叠延伸pcr的技术将两个dna片段拼接在一起。其中,cmv启动子片段来自pcdh-cmv质粒,ef1a启动子片段来自pcdh-ef1s质粒。其中cmv启动子dna序列如seq id no.2所示;ef1启动子dna序列如seq id no.3所示;
[0035]
引物设计如下:
[0036]
cmv-f:5-ggactagtattatgcccagtacatgac-3
[0037]
cf1-f:
[0038]
5-ctagtcatcattgatgtcacatcaacgcaggtacgaaggatctgcgatcgctccggtgc-3
[0039]
cf1-r:5-gttgatgtgacatcaatgatgactagaatcttctatggaggtcaaaacagcg-3
[0040]
ef-r:
[0041]
5-gcgaattctgtacaggacatctggatgatggctagctggcgtctagcgtaggcgccggtcacagcttggat-3
[0042]
用引物cmv-f和cf1-r做pcr,模板为质粒pcdh-cmv(addgene,#72265),进行pcr-1#扩增,目标产物约390bp。用引物cf1-f和ef-r为引物,模板为质粒pcdh-ef1s(addgene,#72484),进行pcr-2#扩增,目标产物约630bp。2次pcr均为30ul体系,5个循环。酶采用takara公司的primestar gxl dna polymerase,扩增体系参考dna聚合酶说明书。pcr-1#,pcr-2#结束之后,以这两份pcr产物作为模板(用量为1ul/30ul体系),以cmv-f和ef1-r为引物,进行第三轮pcr反应,即为pcr-3#。pcr反应体系同上,但扩大为60ul,循环数设定为30,目标片段大小约980bp。扩增结束后,pcr-3#产物进行1%琼脂糖凝胶电泳,之后通过胶回收试剂盒纯化目标片段(50ul水洗脱产物)。该目的片段即为cmv和ef1启动子串联拼接而成的cf1启动子dna片段。目标片段经spei和ecori双酶切(酶购自thermo,#fd1254,#fd0274),体系50ul,胶回收产物43ul,buffer 5ul,两种内切酶各1ul,37℃孵育过夜。dna clean-up试剂盒回收酶切后的pcr产物至30ul去离子水,备用。
[0043]
2.pcf1质粒的构建:
[0044]
spei和ecori双酶切pcaggs质粒5ug,50ul体系,内切酶每种2.5ul,37℃孵育过夜。1%琼脂糖凝胶电泳,丢弃1.7kb cag启动子片段,通过胶回收试剂盒纯化约3.1kb的目标片段(50ul水洗脱产物)。将该片段与前述cf1片段进行连接:3.1kb双酶切片段1ul,cf1双酶切片段5ul,去离子水2.5ul,ligase buffer 1ul,t4 ligase 0.5ul。室温连接30min,转化大肠杆菌dh5a感受态细胞。次日,挑单克隆菌落测序。测序正确的克隆可接种培养后提取质粒。即获取pcf1质粒,pcf1质粒的dna序列如seq id no.5所示,该质粒将pcaggs的cag启动子替换为新的cf1启动子,并在其后引入多克隆位点,包含nhei和bsrgi限制性内切酶识别位点,可供后续外源基因片段的插入。其中cag启动子dna序列如seq id no.4所示。
[0045]
3.pcmv、pef1、pcag质粒的构建
[0046]
为了比较几种不同的启动子表达外源基因的能力,我们使用大致相同的方法,将cmv启动子、ef1启动子、cag启动子的dna片段pcr出来之后,经spei、ecori双酶切、回收后,分别连接到上述spei、ecori双酶切之后的3.1kb的质粒骨架上,得到pcmv、pef1和pcag这3种质粒。这些质粒都具有前述pcf1质粒相同的nhei、bsrgi多克隆位点,可供外源基因片段插入。cag启动子pcr的模板为质粒pcaggs。各启动子片段pcr所需引物如下:
[0047]
cmv-f:5-ggactagtattatgcccagtacatgac-3
[0048]
cmv-r:
[0049]
5-gcgaattctgtacaggacatctggatgatggctagcactagaatcttctatggaggtcaaaacag-3
[0050]
ef1-f:5-ggactagttgtcacatcaacgcaggtacgaaggatctgcgatcgctccggtgc-3
[0051]
ef-r:
[0052]
5-gcgaattcgtacgggacatctggatgatgtctagatggcgtctagcgtaggcgccggtcacagcttggat-3
[0053]
cag-f:5-ggactagttattaatagtaatcaattacggggtc-3
[0054]
cag-r:
[0055]
5-gcgaattctgtacaggacatctggatgatggctagctttgccaaaatgatgagacagcacaataacc-3。
[0056]
实施例二:
[0057]
为了验证cf1启动子驱动外源基因的表达能力,我们将egfp基因片段分别克隆到pef1、pcmv、pcag、pcf1质粒中。质粒纯化后转染hek293t细胞(用量为12孔板的一个孔转染1ug质粒),24小时后拍照查看egfp的表达情况。结果表明,cmv的活性略高于ef1启动子,而cag和cf1启动子驱动的egfp的表达水平明显高于ef1和cmv启动子(约2.5倍)(如附图1所示)。
[0058]
egfp的pcr引物如下(xbai、acc65i双酶切,分别与nhei、bsrgi为同尾酶):
[0059]
egfp-f-xbai:5-gctctagagccaccatggtgagcaagggcgaggagctg-3
[0060]
egfp-r-acc65i:5-gcgctggtaccttacttgtagagctcgtccatgccgag-3
[0061]
由于egfp蛋白分子量较小,我们进一步测试了cf1、cmv启动子驱动的分子量更大的蛋白的表达情况。为此,我们将小鼠myrf基因及其部分片段克隆到pcf1质粒中,获取两个质粒pcf1-myrf-n和pcf1-myrf-fl。其中pcf1-myrf-fl质粒表达myrf的全长(ncbi id:xp_006526992.1,含k592r突变),含1138个氨基酸残基,属于分子量较大的蛋白;pcf1-myrf-n表达myrf的包含n端587个氨基酸残基的片段,属于中等分子量蛋白。myrf-fl和myrf-n的n端都融合了flag标签用来检测验证其表达。同样的片段也连接到pcmv载体上。质粒纯化后转染hek293t细胞,36小时后,裂解细胞做western blot分析(以flag标签抗体检测结果代表目标蛋白的表达量)。结果表明,对于约80kda的myrf-n蛋白,利用cf1启动子驱动的蛋白表达可以获得单独cmv启动子3倍以上的表达产物。而相较于cmv启动子,对于分子量达到160kda的myrf-fl蛋白,cf1启动子同样能够将蛋白的表达量提升至3倍,其表达水平与cag启动子相近(如附图2)。
[0062]
myrf-n和myrf-fl对应的pcr引物分别为:
[0063]
myrf-f:
[0064]
5-gctctagagccaccatggactacaaagacgacgatgacaagatggaggtggtggacgagaccgaag-3
[0065]
myrf-n-r:5-gcgctggtaccttaagggtgcataagagaacccatgac-3
[0066]
myrf-fl-r:5-gcgctggtaccttagtcacacaggcggtagaagtggaag-3
[0067]
pcr所用模板为成年小鼠脑提取的总rna经逆转录后得到的cdna。引物myrf-f与myrf-n-r用来获取myrf-n片段,引物myrf-f和myrf-fl-r组合用来获取myrf-fl片段。全长myrf蛋白的dna序列如seq id no.6所示。
[0068]
以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1