一种成年大、小鼠心脏成纤维细胞提取方法
1.本发明属于生物技术领域,具体涉及一种高效、经济的成年大、小鼠心脏成纤维细胞提取方法。
背景技术:
2.细胞培养技术在生物、医学科学研究中的应用越来越广泛。原代培养是指通过组织块直接长出单层细胞或者用酶或机械方法将组织分散成单个细胞开始培养,在首次传代前的培养可认为是原代培养。原代细胞可广泛应用于分子、细胞生物学和生物医学基础研究,如蛋白质组学、基因组学、细胞株研究等,还可应用于药物筛选、药物代谢和毒理研究等。除此以外,原代培养也是建立各种细胞系(株)必经的阶段。
3.心肌成纤维细胞约占心肌组织细胞总数的60~70%,是心脏中非心肌细胞的主要组成部分。该细胞通过产生细胞外基质,如胶原蛋白和纤维连接蛋白,构成了心肌细胞的机械框架;另一方面,心肌成纤维细胞还可以产生心室重构过程中所需的金属蛋白酶、各种生长因子和细胞因子。因此,对心肌功能正常运作起着重要作用。临床上,心肌成纤维细胞的增殖参与了高血压左心室肥厚、缺血性心脏病、扩张型心肌病及充血性心力衰竭等多种心血管疾病的病理过程,研究心肌成纤维细胞对于现代心血管疾病的研究具有重要意义。
4.中国专利申请cn105238738a公开了一种猪心肌成纤维细胞分离方法,包括:1)1~3日龄仔猪心脏组织采集,取心室组织剪碎,预冷pbs漂洗多次。2)心肌组织消化,0.25%胰蛋白酶和0.1%ⅱ型胶原酶1:1混合37℃多次消化,加入dna酶(0.02mg/ml)减少细胞悬液粘稠度,提高细胞获得率,并加入红细胞裂解液减少红细胞数量。3)仔猪心肌成纤维细胞培养,用含10~15%胎牛血清的dmem高糖培养液重悬细胞,差速贴壁得到心肌成纤维细胞。本发明简单易掌握,节约时间,成功率高,获得的猪心肌成纤维细胞形态稳定、活性好、数量足。为以后以猪心肌成纤维细胞建立细胞模型研究心脏肥大等相关疾病奠定一定基础。
5.中国授权专利cn105505863b公开了一种裸鼹鼠心肌细胞的培养方法,包括以下步骤:(a)向裸鼹鼠心肌组织中加入胰蛋白酶进行消化1-2次,弃去上清液;所述的胰蛋白酶浓度为0.08%(w/v),采用0.25%(w/v)胰蛋白酶和d-hank’s溶液按照体积比1:2混合均匀配制而成;(b)在步骤(a)中所得的细胞沉淀中,加入混合消化液,轻轻吹打心肌组织悬液进行消化后,静置;所述的混合消化液为0.125%(w/v)胰蛋白酶和0.3%(w/v)ⅱ型胶原酶按照体积比2:1混合均匀配制而成,混合消化液中胰蛋白酶终浓度为0.08%(w/v),ⅱ型胶原酶终浓度为0.1%(w/v);(c)收集步骤(b)中的上清液,用200目细胞筛过滤后,立即加入等量终止液终止消化,并于冷冻离心机中4℃、1000rpm、离心5min;(d)步骤(c)中所得的细胞沉淀,依次重复操作步骤b、步骤c,重复消化次数为6~10次;(e)收集所有细胞于同一离心管中,用终止液重悬细胞,并于冷冻离心机中4℃、1000rpm、离心5min,弃去上清液,于细胞沉淀中加入终止液重悬细胞,再次于冷冻离心机中4℃、1000rpm、离心5min,弃去上清液,于细胞沉淀中加入终止液重悬、混匀细胞;(f)将步骤(e)中所得细胞悬液接种于培养容器中,置于培养箱内培养,通过差速贴壁法分离心脏成纤维细胞与心肌细胞;(g)收集步骤(f)中未
贴壁的心肌细胞悬液,于冷冻离心机中4℃、1000rpm、离心5min,所得细胞沉淀用培养基混悬后,置于培养箱内培养。
6.然而,虽然从成年大、小鼠中提取心脏成纤维细胞可以采用常规的方法进行,但是,如何提高提取效率、降低经济成本,仍然是本领域技术人员亟待解决的技术问题。例如,1、现有方法中混合消化液消化组织块后,破裂细胞中dna释放,导致组织细胞粘连,不利于消化过程的快速进行,也不利于消化上清的吸取。此外,现有的消化环境为37℃水浴并震荡,这在实际操作中不易实现,若手持消化瓶持续震荡,则费时、费力。最后,现有方法用反复清洗法去除红细胞,则需用大量pbs缓冲液,并大幅度延长了消化总时长,很可能会降低细胞活性,从而降低细胞得率。
技术实现要素:
7.基于上述原因,本发明提出一种高效、经济的成年大、小鼠心脏成纤维细胞提取方法。具体而言,为了实现本发明的目的,本发明拟采用如下的技术方案:
8.本发明一方面涉及一种成年大、小鼠心脏成纤维细胞提取方法,所述方法包括如下步骤:
9.取大鼠或小鼠心脏后,剪碎清洗,加入消化液,进入组织解离器程序,吸取消化上清并中和酶反应,裂解红细胞并清洗,加入培养基培养;其特征在于所述消化液包括:胰蛋白酶、ⅱ型胶原酶和dnase i脱氧核糖核酸酶,所述胰蛋白酶的浓度为0.5-7.0g/l,所述ⅱ型胶原酶的0.8-10.0g/l,所述dnase i脱氧核糖核酸酶的浓度为0.15-2.0g/l。
10.在本发明的一个优选实施方式中,所述胰蛋白酶的浓度为0.7-0.9g/l,所述ⅱ型胶原酶的1.0-1.4g/l,所述dnase i脱氧核糖核酸酶的浓度为0.15-0.25g/l。在该优选的浓度范围内,本发明能够提高细胞融合度的同时还能显著降低酶成本。
11.在本发明的一个优选实施方式中,所述细胞培养三天之后的融合度为65%以上,优选为70%以上。
12.在本发明的一个优选实施方式中,所述加入消化液,进入组织解离器程序,吸取消化上清并中和酶反应的步骤重复3-4次。
13.在本发明的一个优选实施方式中,所述加入消化液,进入组织解离器程序,吸取消化上清并中和酶反应的步骤中不进行过滤操作。本发明即使不进行过滤操作,也不影响消化的进行,因为成纤维细胞会从残余的组织块中爬出。
14.在本发明的一个优选实施方式中,每次加入消化液之后进入组织解离器程序进行消化的时长为5-7分钟。
15.在本发明的一个优选实施方式中,所述剪碎是指用眼科剪剪碎,剪成0.5-1mm3的组织。
16.在本发明的一个优选实施方式中,所述红细胞裂解液中含有氯化铵。
17.本发明至少具有如下有益的效果:
18.1.本发明的发明人发现因组织消化过程中,有破裂细胞释放dna后,组织细胞发生粘连,不利消化细胞释放,本方法加入dnase i脱氧核糖核酸酶,从而切断dna,防止粘连发生,大大缩短了消化时长,减少消化对细胞的损伤,提高细胞得率。
19.2.本发明的方法依托组织解离器,设计合适程序,实现消化过程机械化,释放人
力。
20.3.本发明采用合适配比及浓度的消化酶,缩短了消化时长、提高了细胞活性及得率。
21.4.获取细胞悬液后,用红细胞裂解液去除红细胞,大大节省了时间和试剂,提高了细胞得率。
附图说明
22.图1为浓度a组处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
23.图2为浓度b组处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
24.图3为浓度c组处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
25.图4为浓度d组处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
26.图5为浓度e组处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
27.图6为f组(无红细胞裂解)处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
28.图7为g组(无dnaseⅰ)处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
29.图8为h组(无ⅱ型胶原酶)处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
30.图9为i组(无胰蛋白酶)处理时细胞在培养第一天及第三天时的显微镜下照片,左图为第一天,右图为第三天时的显微镜下照片;
具体实施方式
31.为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
32.如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。
33.实施例1:
34.步骤:
35.1.小鼠断颈处死,浸入75%酒精1min,无菌条件下取小鼠心脏;
36.2.用无菌pbs清洗2次;
37.3.把心脏装入直径3cm培养皿中,加入少量pbs,用眼科剪剪碎,越碎越好,剪成约1mm3的组织块,将剪好的组织块移入无菌50ml离心管中,加入10ml pbs,重悬,组织块自然
沉降后,弃上清。
38.4.将3ml消化酶加入组织中,重悬,用巴氏管将组织转移到与美天妮牌的组织解离c管中,其中消化酶:0.08%(m/v)胰酶+0.12%(m/v)ⅱ型胶原酶+0.2mg/ml(m/v)dna酶(活力浓度为200ku/ml),用无血清高糖dmem配。
39.5.利用带有加热功能的美天妮组织解离器(gentlemacs octo dissociator with heaters)设置程序:
40.a)37℃on
41.b)ramp 0rmp 5min
42.c)loop
×243.d)ramp 200rmp 2s
44.e)ramp-200rmp 2s
45.f)endloop
46.g)loop
×347.h)spin ramp-500rpm 2s
48.i)spin ramp 500rpm 3s
49.j)endloop
50.k)loop
×351.l)ramp-200rpm 2s
52.m)ramp 200rpm 3s
53.n)endloop
54.o)end
55.6.将步骤4中组织解离管插入美天妮组织解离器,并运行步骤5中程序,约6min。
56.7.吸取上清,将其移入提前备好的10%fbs-dmem培养基中。
57.8.向残余组织中加入新的消化酶再进入第二个循环。
58.9.重复6、7、8步骤,直至组织消化完全(不过滤,因为成纤维细胞会从残余的组织块中爬出),总消化时间取决于组织量。
59.10.1000rpm 5min离心,弃上清。
60.11.把细胞沉淀弹起,加入3ml经过滤除菌的红细胞裂解液(主要成分未氯化铵),裂解3min,加入10ml的pbs,1000rpm离心5min,弃上清
61.12.加入培养基,转移至细胞培养皿中培养,24小时后换液观察,换下的培养上清加入新的培养皿中,隔天仍可见有细胞贴壁。
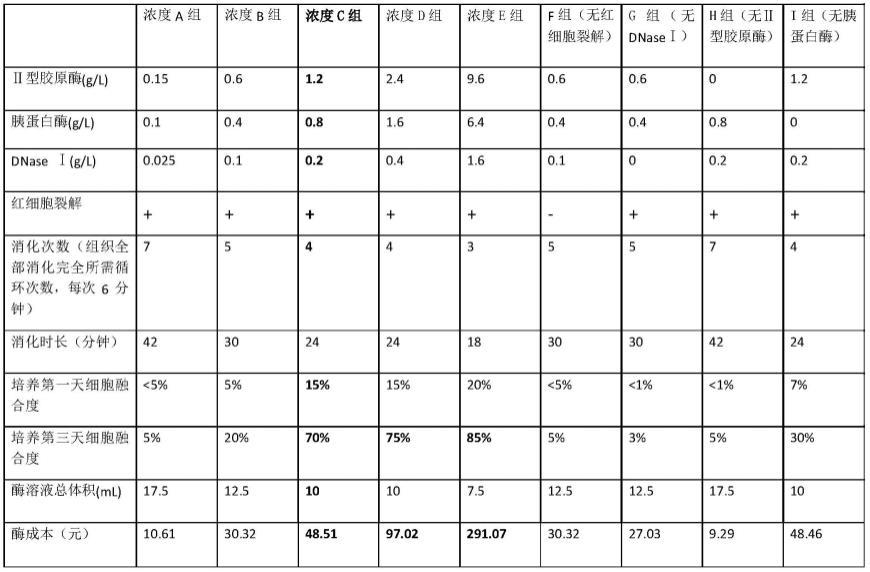
62.以提取4周龄c57bl/6n小鼠的心脏成纤维细胞为例,在采用不同消化酶浓度或处理条件时,比较消化时长、细胞得率及经济成本。其中,每组消化1只小鼠心脏。细胞提取后接种到直径为6cm培养皿中。细胞得率参照细胞融合度。详细结果如下表1所示:
63.表1,采用不同消化酶浓度或处理条件时,每组消化时长、细胞得率及经济成本
[0064][0065]
从上述表1的实验结果可知,c、d、e组细胞融合度最高,其中c组酶成本最低,由此说明本发明将胰酶、ⅱ型胶原酶、dna酶以特定浓度使用,并配合红细胞裂解液,有助于提高心脏成纤维细胞的融合度,并降低成本。
[0066]
以上描述了本发明优选实施方式,然其并非用以限定本发明。本领域技术人员对在此公开的实施方案可进行并不偏离本发明范畴和精神的改进和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1