用于早期肝癌检测的DNA甲基化生物标记物、应用及试剂盒的制作方法
用于早期肝癌检测的dna甲基化生物标记物、应用及试剂盒
技术领域
1.本发明属于生物检测技术领域,具体涉及一种用于早期肝癌检测的dna甲基化生物标记物、应用及试剂盒。
背景技术:
2.肝癌是全球发病率第六和死亡率第三的恶性肿瘤疾病,在2020年超过83万人死于肝癌。根据世界卫生组织国际癌症研究机构2020年发布的数据,肝癌次于肺癌、结直肠癌、胃癌及乳腺癌为中国发病率第五的癌症,死亡率位于肺癌之后,排名第二。肝癌对个人带来了无尽的痛苦,给个人和社会也带来了沉重的经济负担。
3.众所周知的是,癌症的早发现早治疗可以极大的提高患者的成活率。肝癌5年相对生存率仅为12.1%,但是,如果早期诊断经过有效治疗,可达到相对较好的预后,尤其是5公分以内的小肝癌,5年生存率可达到80%以上。目前,肝癌筛查效果不理想,检出率和早期诊断率相对偏低,如何早期发现癌症,已经成为医学界的关注重点,因此开发出一种新的便捷的早期癌症筛查方法对于个人,对于社会都有非常重要的意义。
4.dna甲基化与肿瘤的发生及紧密相关,在肿瘤细胞普遍着dna甲基化状态的改变,特点是总体甲基化水平降低和局部甲基化水平的升高。而且对于早期肿瘤的发生,甲基化的修饰也起着至关重要的作用。同时相对于其他血液肿瘤标记物来说,血液cfdna甲基化稳定性更好,可以被稳定检出。因此,检测特定位点血液cfdna甲基化,可以用于推测身体内肝癌是否存在癌变,从而实现对肝癌早筛早诊的目标。
技术实现要素:
5.为了解决现有技术存在的上述问题,本发明目的在于提供一种用于早期肝癌检测的dna甲基化生物标记物、应用及试剂盒。
6.本发明所采用的技术方案为:一种用于早期肝癌检测的dna甲基化生物标记物,所述甲基化生物标记物包括人类基因组中的cg24504194和/或cg20170223;
7.所述cg24504194的dna甲基化标记物是指人类基因组中chr6:31527895-31527945之间的cpg位点;
8.所述cg20170223的dna甲基化标记物是指人类基因组中chr20:34356175-34356225之间的cpg位点。
9.作为优选地,所述人类基因组为hg19人类基因组。
10.一种所述的用于早期肝癌检测的dna甲基化生物标记物在肝癌检测产品中的应用。
11.一种用于早期肝癌检测的试剂盒,所述试剂盒包括所述的dna甲基化生物标记物;
12.以及还包括甲基化生物标记物的探针。
13.作为优选地,所述探针为杂交捕获含有所述甲基化生物标记物的dna序列片段。
14.作为优选地,所述试剂盒采用如下平台进行检测:pcr扩增法,数字pcr,荧光定量
pcr,甲基化芯片法,液相芯片法,重亚硫酸盐测序,一代测序法,二代测序法,三代测序法或者它们的组合。
15.作为优选地,所述试剂盒采用二代测序法。
16.试剂盒检测流程包括以下步骤:
17.步骤1,提取检测样本的cfdna,neb em-seq试剂盒酶转化处理,甲基化dna建库;
18.步骤2,使用肝癌预测panel进行靶向杂交捕获文库;
19.步骤3,靶向杂交捕获文库定量后进行二代测序;
20.步骤4,数据下机,对测序数据进行质量控制以及预处理后,得到真实数据。
21.步骤5,对所述的甲基化生物标记物及组合进行数据分析。
22.本发明的有益效果为:
23.本发明提供了一种用于早期肝癌检测的试剂盒,该试剂盒是通过研究血浆cfdna特定cpg位点上的dna甲基化修饰在不同时期肝癌患者疾病的人群中的甲基化差异,得知dna甲基化标记物能够作为早期肝癌诊断标记物。
24.本发明公开了两个与肝癌发生相关的特异性甲基化标志物,能够显著提高早期肝癌的检出率,并鉴于血浆检测的无创性,适于大规模推广应用。
附图说明
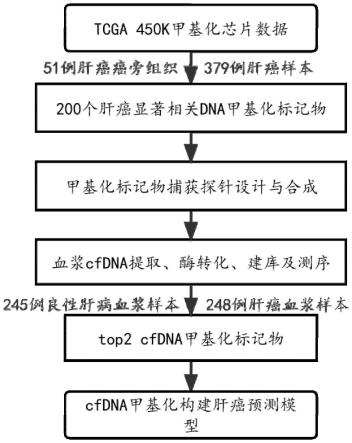
25.图1是两个检测肝癌的甲基化标记物的研发流程图;
26.图2是甲基化生物标记物cg24504194在血浆样本中独立预测的roauc示意图;
27.图3甲基化生物标记物cg20170223在tcga血浆样本中独立预测的roauc示意图;
28.图4是两个甲基化标记物组合在血浆样本中组合预测的roauc示意图。
具体实施方式
29.下面结合具体实施例对本发明做进一步阐释。本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。所用试剂均为可以通过市售购买获得的常规产品。
30.本发明下述实施例中未详细说明的实验方法通常采用常规实验条件,或按照制造厂商指定的标准条件完成。实施例中所用到的各种常用试剂,均为市售产品。
31.本发明中使用的技术科学术语与本发明所属的技术领域的技术人员的通常理解相同。本发明的说明书中使用到的术语其目的是描述具体实施例,并非用于限制本发明。
32.本发明的一个实施例公开了用于肝癌检测的血浆cfdna基因甲基化标记物两种的至少一种或者组合及应用。具体包含以下肝癌患者血浆中具有显著差异甲基化的基因片段:cg24504194,cg20170223。
33.为了解决血浆游离cfdna含量较低以及重亚硫酸盐对dna的损伤问题,该发明采用nebnext enzymatic methyl-seq kit进行胞嘧啶到尿嘧啶的转化。
34.肝癌根据ajcc tnm国际标准分期系统分为i-iv期,所述肝癌早期包括i期。
35.本发明的一个实施例中,cfdna甲基化肝癌标记物的筛选以及肝癌的检测包含以下步骤:如图1所示:
36.步骤1,根据tcga公共数据库挖掘肝癌特异性的dna甲基化标记物;
37.步骤2,肝癌特异性甲基化标记物的捕获探针的设计以及合成;
38.步骤3,血浆cfdna的提取,酶转化以及甲基化dna建库;
39.步骤4,肝癌特异性panel靶向捕获甲基化dna文库;
40.步骤5,文库定量后进行二代测序;
41.步骤6,测序数据进行质量控制以及预处理后,计算目标位点的甲基化水平;
42.步骤7,分析筛选出在肝癌的组织与血浆中具有一致性甲基化差异的甲基化标记物并用于构建肝癌检测的算法模型并验证。
43.实验例1用于肝癌检测的血浆cfdna甲基化标记物的检测方法
44.1、血液cf dna提取:血液cf dna提取具体操作步骤按照“游离dna提取试剂盒(抽滤法)操作说明书”结合真空抽滤泵进行:将血液用蛋白酶k和裂解液裂解,使用真空抽滤泵和dna结合柱结合dna,并用洗涤液和无水乙醇洗涤,最后用洗脱缓冲液洗脱。
45.2、使用磁珠对cfdna进行片段筛选:
46.①
往cfdna中加入0.75倍于cfdna产物的spriselect磁珠,涡旋混匀,室温孵育5分钟;置于磁力架上,待溶液澄清后,吸取上清液到新的1.5ml离心管中,备用;
47.②
往上一步的上清液中加入1.05倍于cfdna产物的spriselect磁珠,吹打混匀,室温孵育5分钟,置于磁力架上,待溶液澄清后,弃上清液;
48.③
用新配制的80%乙醇洗涤,并弃上清液,重复该步骤一次;晾干,用洗脱缓冲液洗脱。
49.3、质控品准备:每个样本中需加入10μl的0.1ng/μl cpg甲基化的puc19和10μl的2ng/μl非甲基化的λdna;两种质控品需提前使用covaris m220超声波打断仪打断并片段筛选至200bp左右。
50.4、cfdna的文库构建:使用nebnext enzymatic methyl-seq试剂盒进行建库。
51.4.1末端修复和3
′
端加“a”52.4.1.1取50ng待测样本,用nf水稀释至50μl,然后加入以下试剂进行反应。
53.组分体积(μl)control dna工作液20末端修复反应液5末端修复酶混合液5
54.4.1.2置于pcr仪中按以下程序进行反应
[0055][0056]
4.2接头连接
[0057]
4.2.1往末端修复产物中加入以下试剂进行反应
[0058]
组分体积(μl)
em-seq连接接头溶液5连接增强液5连接混合液50
[0059]
4.2.2置于pcr仪中,按下表条件设置pcr反应程序:
[0060]
60℃,60min,热盖关闭。
[0061]
4.2.3接头连接产物纯化
[0062]
a、将纯化磁珠室温平衡30min,涡旋仪上充分混匀纯化磁珠。
[0063]
b、按照无水乙醇:无核酸酶水=8:2比例,配制80%乙醇,备用。
[0064]
c、分别向连接产物中加入55μl纯化磁珠吹打混匀,室温孵育5分钟,置于磁力架上,待溶液澄清后,弃上清;用新配制的80%乙醇洗涤,并弃上清,重复该步骤一次;晾干,用15μl洗脱缓冲液洗脱,吸取14μl上清进行下一步反应。
[0065]
4.3甲基化:氧化反应
[0066]
4.3.1配制buffer:
[0067]
a.往100ul e1反应缓冲液补充液中加入400ul e1反应缓冲液振荡混匀,标记配制日期。
[0068]
b取10μl 500mm的fe(ⅱ)加入到1249μl的无核酸酶水中,稀释后的溶液立即使用,现配现用,不可保存。
[0069]
c使用无核酸酶水按1:10的比例稀释终止缓冲液。
[0070]
4.3.2往14μl纯化后的连接产物中加入以下试剂并混匀,然后再往已加入氧化酶的纯化后连接产物中加入10μl稀释后的fe(ⅱ)并混匀离心。
[0071][0072][0073]
4.3.3置于pcr仪上,按照以下条件反应:37℃,1h,热盖温度≧45℃。
[0074]
4.3.4反应完成后往产物中加入1μl稀释后的反应终止液,并置于pcr仪上,按以下条件反应:37℃,30min,热盖温度≧45℃。
[0075]
4.3.5氧化反应产物纯化
[0076]
a、将纯化磁珠室温平衡30min,涡旋仪上充分混匀纯化磁珠;
[0077]
b、按照无水乙醇:无核酸酶水=8:2比例,配制80%乙醇,备用;
[0078]
c、分别向连接产物中加入45μl neb next sample纯化磁珠吹打混匀,室温孵育5分钟,置于磁力架上,待溶液澄清后,弃上清;用新配制的80%乙醇洗涤,并弃上清,重复该步骤一次;晾干,用9.5μl洗脱缓冲液洗脱,吸取8μl上清进行下一步反应。
[0079]
4.4甲基化:胞嘧啶脱氨基
[0080]
4.4.1变性:
[0081]
a pcr仪提前预热至85℃,热盖开启;
[0082]
b向8μl纯化后的氧化反应产物中加入2μl甲酰胺,涡旋振荡混匀,瞬时离心。
[0083]
4.4.2往变性后产物中加入以下试剂进行反应
[0084]
组分体积(μl)无核酸酶水34e2反应液5牛血清蛋白0.5e20.5
[0085]
4.4.3置于pcr仪上,按以下条件反应:37℃,3h,热盖温度≧45℃。
[0086]
4.4.4胞嘧啶脱氨基反应产物纯化
[0087]
a将纯化磁珠室温平衡30min,涡旋仪上充分混匀纯化磁珠;
[0088]
b按照无水乙醇:无核酸酶水=8:2比例,配制80%乙醇,备用;
[0089]
c分别向连接产物中加入50μl neb next sample纯化磁珠吹打混匀,室温孵育5分钟,置于磁力架上,待溶液澄清后,弃上清;用新配制的80%乙醇洗涤,并弃上清,重复该步骤一次;晾干,用11μl洗脱缓冲液洗脱,吸取10μl上清进行下一步反应。
[0090]
4.5pcr扩增及纯化
[0091]
4.5.1向以上纯化产物中加入以下试剂进行反应
[0092]
组分体积(μl)引物2.5酶混合液12.5
[0093]
4.5.2置于pcr仪上,按以下条件反应
[0094][0095]
4.5.3 pcr扩增产物纯化
[0096]
a将纯化磁珠室温平衡30min,涡旋仪上充分混匀纯化磁珠;
[0097]
b按照无水乙醇:无核酸酶水=8:2比例配制80%乙醇,备用;
[0098]
c分别向连接产物中加入22.5μl neb纯化磁珠吹打混匀,室温孵育5分钟,置于磁力架上,待溶液澄清后,弃上清;用新配制的80%乙醇洗涤,并弃上清,重复该步骤一次;晾干,用15μl洗脱缓冲液洗脱,吸取14μl上清,进行质检。
[0099]
5、杂交洗脱
[0100]
5.1杂交:
[0101]
a每个待杂交文库取10ng,计算合并杂交所需的文库体积,并将12个文库混在一起;
[0102]
b向文库混合液中加入以下试剂进行反应;
[0103]
c打开真空浓缩仪,设置v-aq模式,常温下浓缩成干粉;
[0104]
d立即取20μl杂交混合液加入到浓缩完成的干粉中,混匀并室温静置5分钟后,加入30μl杂交增强液混匀离心;
[0105]
e置于pcr仪上,按以下条件进行反应。
[0106]
表1试剂组分表
[0107]
组分体积(μl)肝癌探针2内参探针2通用封闭液8封闭反应液5
[0108]
表2 pcr反应条件表
[0109][0110]
5.2捕获洗脱
[0111]
5.2.1 buffer预热:
[0112]
将快速结合液、快速洗涤液2在48℃预热至沉淀溶解,快速洗涤液1在63℃预热至沉淀溶解,链霉亲和素磁珠室温平衡至少30min。
[0113]
5.2.2磁珠捕获
[0114]
a涡旋振荡混匀已平衡至室温的链霉亲和素磁珠;
[0115]
b取70μl链霉亲和素磁珠加入到1.5ml离心管中;
[0116]
c加入20μl结合缓冲液,吹打混匀,瞬时离心后置于磁力架上,静置1min,弃上清液;
[0117]
d重复b和c步骤两次,共进行三次链霉亲和素磁珠清洗;
[0118]
e加入20μl结合缓冲液重悬链霉亲和素磁珠;
[0119]
f转移20μl重悬的链霉亲和素磁珠到杂交反应管中,然后全部液体转移到1.5ml离心管中。
[0120]
g室温条件下,在混匀仪上混匀30分钟,不可涡旋;
[0121]
h混匀完成后,瞬时离心,置于磁力架上,静置1分钟,弃上清。
[0122]
5.2.3洗脱
[0123]
a加入200μl 54℃预热的快速清洗缓冲液1,吹打混匀,置于恒温金属浴中54℃孵育5min;
[0124]
b孵育完成后,瞬时离心,转移所有液体至新的1.5ml离心管中,去除结合在离心管表面的非特异性捕获片段;
[0125]
c置于磁力架上,静置1分钟,弃上清;
[0126]
d加入200μl 63℃预热的清洗缓冲液1,吹打混匀,置于恒温金属浴中54℃孵育5分钟;
[0127]
e孵育完成后,瞬时离心,置于磁力架上,静置1min,弃上清;
[0128]
f加入200μl 54℃预热的清洗缓冲液2,吹打混匀,置于恒温金属浴中54℃孵育5分钟;
[0129]
g孵育完成后,瞬时离心,置于磁力架上,静置1分钟,弃上清;
[0130]
h重复a到g步骤两次,共进行三次清洗;
[0131]
i瞬时离心,用10μl吸头弃掉残留的上清,立即加入45μl无核酸酶水,吹打混匀,冰上孵育。
[0132]
5.3捕获产物pcr富集
[0133]
5.3.1取22.5μl捕获产物(链霉亲和素磁珠悬浮液)加入以下试剂,进行反应。
[0134]
组分体积(μl)扩增引物2.5taq u+酶反应液25
[0135]
置于pcr仪上,按以下条件进行反应
[0136][0137][0138]
5.3.2 pcr产物纯化
[0139]
a将dna纯化磁珠室温平衡30min,涡旋仪上充分混匀;
[0140]
b按照无水乙醇:无核酸酶水=8:2比例配制80%乙醇,备用;
[0141]
c分别向连接产物中加入90μl dna纯化磁珠吹打混匀,室温孵育5分钟,置于磁力架上,待溶液澄清后,弃上清;用新配制的80%乙醇洗涤,并弃上清,重复该步骤一次;晾干,用32μl洗脱缓冲液洗脱,吸取30μl上清进行质控,并上机测序。
[0142]
6测序数据的分析:
[0143]
下机的原始数据首先使用fastqc过滤低质量的序列(phred33 score《=20)以及read中的接头序列和polya/t序列。过滤后的高质量reads使用bsmap回帖到hg19人类基因组,并筛选出回帖质量较高的reads。使用picard去除pcr重复后再通过samtools选择回帖到目标基因组区域(dna甲基化标记物所对应的区域)的reads并计算各个dna甲基化标记物的甲基化水平。
[0144]
cfdna片段化标记物计算的是每个探针覆盖的基因区域内长度在80bp-150bp的cfdna片段数目与长度范围在150bp-200bp的cfdna片段数目的比值。
[0145]
实验例2:
[0146]
本实施例基于245例良性肝病血浆和248例肝癌血浆样本,验证本发明公开的用于肝癌检测的两个dna甲基化标记物。
[0147]
如图2和3所示,两个甲基化标记物独立区分肝癌血浆的auc值。
[0148]
如图2所示,使用甲基化标记物cg24504194构建出的模型区分良性肝疾病血浆和肝癌血浆的auc值为0.862。
[0149]
如图3所示,使用甲基化标记物cg24504194构建出的模型区分良性肝疾病血浆和肝癌血浆的auc值为0.854。
[0150]
上述说明两个甲基化标记物都具有一定预测肝癌的效力。
[0151]
进一步地,如图4所示,将两个甲基化标记物结合在一起所构建的模型则具有最好的预测性能,auc值为0.947。
[0152]
综上所述,本发明公开了两个与肝癌发生相关的特异性甲基化标志物,能够显著提高早期肝癌的检出率,并鉴于血浆检测的无创性,适于大规模推广应用。
[0153]
本发明不局限于上述可选的实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,均属于本发明的保护范围。上述具体实施方式不应理解成对本发明的保护范围的限制,本领域的普通技术人员应当理解,在不背离本发明的范围下,可对前述各实施例所记载的技术方案进行修改,或对其中部分或者全部技术特征进行等同替换,与此同时这些修改或者替换,并不会使相应的技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1