一种具有去除Hg
一种具有去除hg
2+
性能的好氧反硝化菌株及其应用
技术领域
1.本发明涉及微生物技术领域,具体涉及一种具有去除hg
2+
性能的好氧反硝化菌株及其应用。
背景技术:
2.氮氧化物(nox)是主要的大气污染物之一,主要包括no、no2、n2o3、n2o4等物质。其中烟气中nox的主要成分是no和no2,同时也是导致大气污染的主要成分。目前,对于烟气中nox的处理方法主要有选择性催化还原法(scr)、选择性非催化还原法(sncr)、吸收法、生物法等,而生物法具有投资运行成本低和无二次污染等优点,已成为国内外nox脱除研究的热点和重点。
3.生物法脱除nox废气的研究历史可以追溯到上世纪90年代。1993年美国爱达荷国家工程实验室研究人员apel等进行了厌氧反硝化菌还原烟气中nox的重要研究,并最早提出脱氮菌还原脱除烟气中nox的传统生物滤器(biofilter)工艺,该还原法是在传统厌氧反硝化的基础上建立的,能够将no最终还原生成无污染的n2,但厌氧条件难以实现,严重制约着该方法的实际应用。
4.好氧反硝化的出现为生物脱硝提供了全新的途径,也为解决传统生物脱硝工艺中的氧抑制问题提供了新的方法。近年来研究者将好氧反硝化菌应用于不同的脱硝处理工艺,取得了一定的成效。我们课题组将好氧反硝化菌应用于氧化吸收-生物滴虑塔中,展现出了优秀的nox处理效果(journal of hazardous materials, 2021, 404: 124109.)。
5.然而,对于烟气中伴随的以汞为代表的重金属而言,是否会对生物滤塔里的好氧反硝化菌群产生影响将是一个值得探讨的问题,考虑到大部分微生物都具有一定的耐毒区间,甚至有的可以对汞进行生物吸附或者是吸收降解,我们可以对好氧反硝化菌群进行耐汞驯化,筛选出既具有高效脱氮性能又能一定限度耐汞甚至于脱汞的菌群,这样就可以为燃煤电厂的生物滤塔脱氮除汞联合处理工艺提供宝贵的微生物菌种。
6.虽然研究思路来自本课题组关于火电厂燃煤烟气的研究,但最终实验部分考察的是液相中的hg
2+
对好氧反硝化菌株反硝化性能的影响。因此该研究结果不仅适用于同时含nox和汞的火电厂燃煤烟气、硝酸厂及焦化烟气,同时也适用于某些同时含硝态氮和汞的工业废水、制革废水、生活废水等的处理。同时我国的水体污染现状表明,该研究结果也适用于富营养化及重金属污染的江湖、水库、河流等。因此如能筛选驯化出一株既能消耗有机污染物和含氮类污染物、又能兼具耐汞甚至脱汞性能的微生物菌群,这将为烟气处理及水体修复带来巨大的变革和信心。
技术实现要素:
7.本发明的目的是提供一种具有去除hg
2+
性能的好氧反硝化菌株。该菌株能够在无汞和含汞的环境中以硝态氮或亚硝态氮为唯一氮源进行好氧反硝化脱氮,且在反硝化过程中能够耐受和完全去除浓度不高于6mg/l的hg
2+
,这对于烟气生物脱硝及含汞、含氮废水的
处理具有重要意义。
8.为解决上述技术问题,本发明所采用的技术方案为:一种具有去除hg
2+
性能的好氧反硝化菌株,分类命名为不动杆菌属(acinetobacter sp.)细菌lv3,于2022年6月10日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;保藏编号为cgmcc no. 25044。
9.所述的具有去除hg
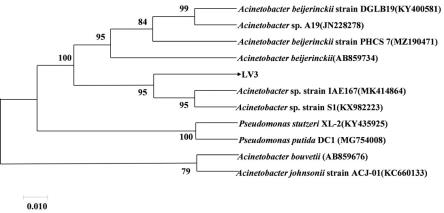
2+
性能的好氧反硝化菌株lv3的筛选方法,如下:(1)、取1g富汞区域的土壤,首先在hg
2+
浓度为5mg/l的富集培养基中富集培养,30℃和120rpm摇床培养2d。
10.(2)、然后将1 ml的富集菌液继续接入hg
2+
浓度为5mg/l的富集培养基中,在30℃和120rpm条件下驯化培养2d,这一过程需重复3次。
11.(3)、将步骤(2)中的混合菌液进行10
−1~10
−9梯度稀释,取稀释液分别涂布在btb固体培养基上,在恒温培养箱中培养至形成可见菌落,选取具有不同形态的具有蓝色晕圈的菌株,在超净台中用接种环将其在dm培养基中划线,分离纯化三次。
12.(4)、挑取分离纯化后的菌株分别接种至hg
2+
浓度为4mg/l的dm培养基中进行培养,综合考察菌株的生长、硝态氮降解、耐汞及hg
2+
去除情况,筛选获得一株具有hg
2+
去除性能的好氧反硝化菌株,将其命名为lv3。
13.菌株lv3在btb固体培养基上具有以下表型特征:菌落具有透明晕圈的乳白色不透明圆点,表面光滑湿润易被挑起,边缘规则,在菌株的反硝化作用下,btb固体平板颜色变蓝。通过革兰氏染色后在显微镜下呈阴性。
14.菌株lv3的16s rdna基因序列为seq id no:1,碱基序列长度为1427bp。
15.根据其形态及ncbi网站的genbank数据库分析,通过blast同源性分析表明,菌株lv3与不动杆菌属关系密切,且与菌株acinetobacter sp. strain iae167和acinetobacter sp. strain s1序列同源性高达100%,因此确定菌株lv3为不动杆菌(acinetobacter sp.)。
16.另外,本发明还提供一种含有具有去除hg
2+
性能的好氧反硝化菌株的工作液的制备方法,包括以下步骤:保藏编号为cgmcc no. 25044的不动杆菌属(acinetobacter sp.)细菌lv3接种到反硝化培养基中进行活化,于30℃和120rpm恒温摇床中培养至菌株生长的对数期od
600
≈1.3,所述反硝化培养基配方为丁二酸钠5.0625g/l、nano
3 0.607g/l、kh2po
4 0.4g/l、mnso4•
h2o 0.01g/l、mgso4•
7h2o 0.05g/l、feso4•
7h2o 0.01g/l,用naoh或hcl将培养基ph调至7.0。
17.本发明还提供上述具有去除hg
2+
性能的好氧反硝化菌株lv3或含有具有去除hg
2+
性能的好氧反硝化菌株的工作液在含汞含氮废水处理中的应用。
18.进一步的,所述废水含汞浓度范围为1mg/l~6mg/l。
19.进一步的,所述废水含汞浓度范围为4mg/l。
20.进一步的,动杆菌属(acinetobacter sp.)细菌lv3在含汞环境中以硝态氮或亚硝态氮为唯一氮源进行生长,且能够利用有机碳源进行好氧反硝化脱氮。菌株lv3在hg
2+
浓度为4mg/l条件下能够以100mg/l的硝态氮或亚硝态氮为唯一氮源进行生长,且能够利用有机碳源进行好氧反硝化脱氮,表明菌株lv3具备同步脱氮除碳的能力。
21.本发明还提供上述具有去除hg
2+
性能的好氧反硝化菌株在烟气脱硝领域的应用。
22.不动杆菌属(acinetobacter sp.)细菌lv3在hg
2+
浓度为4mg/l条件下还能够耐受一定浓度的pb(ii)和cr(vi)等重金属离子,这在烟气生物脱硝或实际废水处理过程中更具有优势。
23.如上所述的不动杆菌属(acinetobacter sp.)细菌lv3在hg
2+
浓度不高于4mg/l时,以丙酮酸钠和硝态氮分别为唯一碳源和氮源生长时初始氮转化为气态氮的比例接近且都大于60%,其次主要转化为胞内氮,且在整个反硝化脱氮过程中几乎没有检测到亚硝态氮和氨氮的积累,这表明菌株lv3主要靠反硝化作用以及同化作用脱氮。
24.如上所述的不动杆菌属(acinetobacter sp.)细菌lv3在hg
2+
浓度为4mg/l、硝态氮浓度为100mg/l、丙酮酸钠含量为5.0625g/l条件下对汞具有挥发效能,表明菌株lv3可将hg
2+
还原为毒性及可溶性较小的汞单质。
25.与现有技术相比本发明具有以下有益效果:本发明提供的具有去除hg
2+
性能的好氧反硝化菌株适合用于烟气生物脱硝及含汞、含氮废水的处理,应用前景广阔,具有良好的实际应用价值和社会效益。
附图说明
26.图1表示菌株lv3的菌落形态。
27.图2表示菌株lv3的系统发育树。
28.图3a表示不同hg
2+
浓度对菌株lv3生长的影响。
29.图3b表示不同hg
2+
浓度对菌株lv3硝态氮去除的影响。
30.图4a表示菌株lv3对水中2mg/l hg
2+
的去除性能。
31.图4b表示菌株lv3对水中4mg/l hg
2+
的去除性能。
32.图4c表示菌株lv3对水中6mg/l hg
2+
的去除性能。
33.图5表示菌株lv3在含汞条件下以硝态氮为唯一氮源的好氧反硝化性能。
34.图6表示菌株lv3在含汞条件下以亚硝态氮为唯一氮源的好氧反硝化性能。
35.图7a表示重金属离子与汞共存时对菌株lv3生长的影响。
36.图7b表示重金属离子与汞共存时对菌株lv3硝态氮去除的影响。
37.图7c表示重金属离子与汞共存时对菌株lv3硝态氮去除率(36h)的影响。
38.图8表示不同hg
2+
浓度下菌株lv3以硝态氮为唯一氮源的氮平衡分析。
39.图9表示菌株lv3对hg
2+
挥发显影实验结果。
具体实施方式
40.以下结合具体实施例对本发明作进一步说明。
41.下述实施例中,无特殊说明,均为常规方法。实施例中硝态氮采用水杨酸比色法测定,氨氮采用纳氏试剂分光光度法测定,亚硝态氮采用n-(1-萘基)-乙二胺分光光度法测量,总氮采用碱性过硫酸钾紫外分光光度法测量,汞离子浓度采用icp-ose仪进行测定、cod采用重铬酸钾法测定,溶解氧采用便携式溶解氧仪(hq30d, hach)进行测定,ph采用ph计(seven2go pro,瑞士梅特勒-托利多)进行测量,od
600
采用可见分光光度计在波长600nm处进行测量,ph调节采用2mol/l的盐酸和2mol/l的naoh。实施例中使用的各种单位,均统一采用国家标准。
42.实施例1具有去除hg
2+
性能的好氧反硝化菌株lv3的筛选如下:(1)、首先将1g取自富汞区域的土壤放入含100ml富集培养基的250ml锥形瓶中,富集培养基配方为蛋白胨10g/l、酵母膏5g/l、nacl 10g/l、hg
2+ 5mg/l,ph=7.0。然后用无菌呼吸密封膜将瓶口密封,将其放入30℃和120rpm的摇床中富集培养2d。,(2)、从(1)中富集培养基中取1ml富集菌悬液继续转入hg
2+
浓度为5mg/l的富集培养基中,于30℃和120rpm的摇床中驯化培养2d。该步驯化过程需要重复3次(3)、移取100μl菌液进行梯度稀释得到10
−2~10
−7的稀释液。取10
−5、10
−6和10
−7梯度稀释液100ml分别涂布在溴百里酚蓝培养基(btb)固体培养基上,其中btb固体培养基配方为乙酸钠0.683g/l、丁二酸钠0.675g/l、葡萄糖0.5g/l、nano
3 0.607g/l、kh2po
4 0.4g/l、mnso4•
h2o 0.01g/l、mgso4•
7h2o 0.05g/l、feso4•
7h2o 0.01g/l、1%的btb 1ml/l,用naoh或hcl将培养基ph调至7.0后加入20 g/l的琼脂粉。然后将固体平板放在30℃的恒温培养箱中培养3~5d,至形成可见菌落,选取具有不同形态的具有蓝色晕圈的菌株,在超净台中用接种环将其在反硝化培养基中划线分离纯化三次,反硝化培养基配方为丁二酸钠5.0625g/l、nano
3 0.607g/l、kh2po
4 0.4g/l、mnso4•
h2o 0.01g/l、mgso4•
7h2o 0.05g/l、feso4•
7h2o 0.01g/l,用naoh或hcl将培养基ph调至7.0。
43.(4)、挑取分离纯化后的菌株分别接种至100ml反硝化培养基中于30℃和120rpm的摇床进行活化(od
600
≈1.3),取活化后菌悬液1ml接种至hg
2+
浓度为4mg/l的反硝化培养基中,于30℃和120rpm的摇床中培养,期间定期测定溶液中的硝态氮以及亚硝态氮的含量,考察菌株的生长、脱氮情况、hg
2+
耐受和去除情况。最后筛选获得一株具有hg
2+
去除性能的好氧反硝化菌株,将其命名为lv3,并采用超低温冻结法和低温固体斜面保藏法两种方法保藏上述菌株。
44.实施例2具有去除hg
2+
性能的好氧反硝化菌株lv3的鉴定如下:将菌株lv3接种到btb固体琼脂平板培养基(同实施例1)上,30℃生化培养3~5d。菌株lv3的菌落形态如图1所示,菌落具有透明晕圈的乳白色不透明圆点,表面光滑湿润易被挑起,边缘规则,在菌株的反硝化作用下,btb固体平板颜色变蓝。
45.菌株lv3的革兰氏染色结果发现经过染色的菌体颜色变为红色,表明菌株lv3为革兰氏阴性菌。
46.菌株lv3的16s rdna测序碱基序列如附序列表所示,将序列提交到ncbi网站的genbank数据库分析,通过blast同源性分析表明(图2),菌株lv3与不动杆菌属关系密切,且与菌株acinetobacter sp. strain iae167和acinetobacter sp. strain s1序列同源性高达100%,因此确定菌株lv3为不动杆菌(acinetobacter sp.)。该菌株于2022年6月10日保藏于位于北京中国科学院微生物研究所的中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,保藏中心登记号为cgmcc no. 25044。
47.实施例3不同hg
2+
浓度下菌株lv3的生长及好氧反硝化实验如下:工作液是从保存的菌株lv3中提取出纯化菌,并将其在含有100ml反硝化培养基(同实施例1)的250ml锥形瓶中进行活化,于30℃和120rpm恒温摇床中培养至菌株生长的对
数期(od
600
≈1.3)。
48.以丁二酸钠和亚硝态氮分别为唯一碳源和氮源,配置hg
2+
浓度为0、1mg/l、4mg/l、6mg/l和7mg/l的反硝化培养基中(同实施例1),取5ml工作液接种到上述100ml培养基中,以封口膜密封,置于摇床在30℃和120rpm条件下研究了菌株lv3的在不同汞浓度下的生长和硝态氮降解情况。如图3a所示,与未添加hg
2+
的空白对照组相比,菌株lv3的延滞期随着hg
2+
浓度的升高而延长,延滞期内几乎没有硝态氮的降解(图3b);一旦菌株lv3进入快速生长的对数期,硝态氮含量迅速降低(图3b),表明菌株lv3对硝态氮的降解与其生长密切相关。但当hg
2+
浓度为7mg/l时,菌株lv3在整个实验周期内未观察到生长和硝态氮降解情况,表明该菌株在反硝化培养基中的最大汞耐受浓度为6mg/l。duxbury的研究表明能在4 mg/l hg
2+
中生长的菌株称为“耐汞”菌株,因此视菌株lv3为耐汞反硝化菌株。综上可得,菌株lv3可在无汞和hg
2+
浓度不高于6mg/l的好氧环境中以硝态氮为唯一氮源进行生长和反硝化,且硝态氮去除率最终都可超过95%。
49.实施例4菌株lv3对不同hg
2+
浓度的降解实验如下:实验在以丁二酸钠和亚硝态氮分别为唯一碳源和氮源,配置hg2+浓度为2mg/l、4mg/l和6mg/l的反硝化培养基中(同实施例1)进行。取5ml工作液(同实施例3)接种到上述100ml培养基中,以封口膜密封,同时以未接种菌的相对应hg
2+
浓度培养基作为空白对照,置于摇床在30℃和120rpm条件下研究了菌株lv3对不同汞浓度的降解情况。
50.如图4a、4b、4c所示,菌株lv3可以耐受汞并且可以有效地从溶液中去除汞,使最终的出水汞浓度为0 mg/l,汞去除率达到100%。此外,不可忽视的是对照组的汞浓度在实验时间内也呈现下降趋势,这一发现与胡亮等人的研究结果一致,表明介质成分对汞的去除也有一定的影响,可能是介质成分与汞离子之间存在螯合作用。在2mg/l、4mg/l、6mg/l汞浓度下,48h时菌株lv3去除汞的量分别占总量的44.6%,39.33%及41.5%,这说明菌株lv3对汞也具有去除作用。综上可得,菌株lv3以硝态氮为唯一氮源的好氧反硝化过程中可以耐受且完全去除6mg/l的hg
2+
。
51.实施例5菌株lv3在含汞条件下以硝态氮为唯一氮源的好氧反硝化实验如下:实验在以丙酮酸钠和硝态氮分别为唯一碳源和氮源,碳氮比为16、硝态氮浓度为100mg/l、hg
2+
浓度为4 mg/l的反硝化培养基中进行,反硝化培养基配方为丙酮酸钠4.80g/l、nano
3 0.607g/l、kh2po
4 0.4g/l、mnso4•
h2o 0.01g/l、mgso4•
7h2o 0.05g/l、feso4•
7h2o 0.01g/l,ph 7.0。取5ml工作液(同实施例3)接种到上述100ml培养基中,以封口膜密封,置于摇床在30℃和120rpm条件下研究菌株lv3在含汞条件下以硝态氮为唯一氮源的好氧反硝化性能。
52.如图5所示,经过碳源、c/n、温度、ph等条件优化后,菌株lv3在含汞条件下的生长延滞期缩短,12h时的od
600
值即可达到0.512,此时硝态氮的浓度从初始的101.59 mg/l在12h时降到了81.85mg/l。随后在12~36h时菌株lv3进入对数生长期,此时硝态氮和cod的值呈现快速下降趋势,表明硝态氮去除与菌株lv3的生长密切相关。硝态氮、总氮在36h时的去除率可分别达到100%及93.94%,剩余总氮浓度为6.16mg/l。随后菌株lv3的生长进入衰亡期,od
600
值呈现下降趋势,溶液中总氮含量略有升高,可能是由于菌株死亡导致氨氮释放引
起的。在整个实验过程中基本没有亚硝态氮以及氨氮的累积,表明菌株lv3可有效去除硝态氮,且在用于污水处理时不会引起二次污染。cod的去除与硝态氮的去除是同步进行的,cod、硝态氮和总氮的最大去除率分别为85.38%、100%和93.94%,表明菌株lv3可同时进行脱氮除碳。
53.实施例6菌株lv3在含汞条件下以亚硝态氮为唯一氮源的好氧反硝化实验如下:实验在以丙酮酸钠和硝态氮分别为唯一碳源和氮源,碳氮比为16、亚硝态氮浓度为100mg/l、hg
2+
浓度为4 mg/l的反硝化培养基中进行,培养基配方为丙酮酸钠4.80g/l、nano
2 0.493g/l、kh2po
4 0.4g/l、mnso4•
h2o 0.01g/l、mgso4•
7h2o 0.05g/l、feso4•
7h2o 0.01g/l,ph 7.0。取5ml工作液(同实施例3)接种到上述100ml培养基中,以封口膜密封,置于摇床在30℃和120rpm条件下研究菌株lv3在含汞条件下以亚硝态氮为唯一氮源的好氧反硝化性能。
54.含hg
2+
条件下,菌株lv3在以亚硝态氮为唯一氮源时生长与以硝态氮为唯一氮源时的生长情况类似(图6),在12h时菌株lv3的od
600
值即可达到0.529。同时,亚硝态氮的浓度从初始的99.46mg/l降至68.93mg/l。在12~36h时进入对数生长期,在36h时达到了最高的生长值1.42,此时的亚硝态氮和总氮的去除率分别达到99.96%及94.69%,对应的亚硝态氮的平均去除速率为2.76mg/l/h。张霓等人的研究中恶臭假单胞菌pseudomonas putida zn1在100 mg/l亚硝态氮的培养液中的平均亚硝态氮去除速率为1.97mg/l/h。成钰等人的研究中花津浦芽孢杆菌bacillus hwajinpoensis slwx2在初始亚硝态氮浓度为100mg/l时的平均去除效率为0.96mg/l/h。相较以上两者对亚硝态氮的平均去除效率,菌株lv3具有较好的反硝化能力。实验过程中无氨氮及硝态氮的累积,表明菌株lv3去除亚硝态氮的路径应是还原成了气体氮,而不是氧化成硝态氮或异化成铵。
55.实施例7重金属离子对菌株lv3在含汞条件下硝态氮去除实验如下:以丙酮酸钠和硝态氮分别为唯一碳源和氮源,在含hg
2+
浓度为4 mg/l的反硝化培养基(同实施例5)基础上分别添加2mg/l或4mg/l重金属离子cr
6+
和pb
2+
。取5ml工作液(同实施例3)接种到上述100ml培养基中,以封口膜密封,于在30℃和120rpm恒温摇床中研究汞存在条件下烟气中其他重金属(pb
2+
、cr
6+
)对菌株lv3生长及反硝化性能的影响。
56.共存的重金属离子在不同浓度下不同程度地抑制菌株的生长及反硝化(图7a和7b)。当pb
2+
的投加量为2mg/l时,最大的生长量及最终的脱氮效率与空白组并无明显差异(p》0.05)。然而当cr
6+
的投加量为2mg/l时,36h时的脱氮效率只有84.09%(图7c)。同时,当pb
2+
和cr
6+
的投加量均达到4mg/l时,36h时菌株硝态氮的去除率分别为94.87%和7.58%,cr
6+
的抑制作用远大于pb
2+
(图7c)。hu等人研究表明cr
6+
的存在不仅会强烈抑制菌株反硝化基因的表达,同时还会上调与细胞凋亡相关的代谢活动。shewanella oneidensis mr-1在cr
6+
浓度为45μm时的反硝化性能受到强烈的抑制作用,而菌株lv3在4mg/l hg
2+
和2mg/lcr
6+
存在的情况下仍具有较高的硝态氮去除率。且当cr
6+
为4mg/l时,虽然受到了抑制作用,但主要体现在延滞期的增长,在60h时菌株lv3对硝态氮的去除率能达到99.45%。表明菌株lv3在实验范围内具有较强的重金属耐受性。
57.实施例8
菌株lv3在不同hg
2+
浓度下以硝态氮为唯一氮源的氮平衡分析实验如下:实验在以丙酮酸钠和硝态氮分别为唯一碳源和氮源,分别配置hg
2+
浓度为0、2mg/l、4mg/l和6mg/l的反硝化培养基(同实施例5)于250ml锥形瓶中进行,取5ml工作液(同实施例3)接种到上述100ml培养基中,将锥形瓶用高纯度氧气充分充气后以封口膜密封,置于摇床在30℃和120rpm条件下进行培养36h后,分别通过注射器抽取0h和36h时瓶内的气体样品(400μl)以测量氮气,同时收集0h和36h时瓶内的菌液以测定离心前的tn1以及离心后的no3−
–
n、no2−
–
n、nh
4+
–
n、tn2。气态氮(ngas)、细胞内氮(tn
in
)和细胞外有机氮(ne-org)的浓度参照相关文献(bioresource technology, 2020, 314: 123733.)进行计算。
58.如图8所示,在以硝态氮为唯一氮源,汞浓度为0mg/l、2mg/l、4mg/l的条件下,大部分的硝态氮可在36h内被去除。主要的产物是气态氮,转化率分别为67.2%、67.83%、64.27%,转化为氨氮的量大约为2%。几乎没有硝态氮与亚硝态氮的积累。随着汞浓度的增加,tnin在tn中的比例呈上升趋势,这可能是由于汞对酶活性的影响,但该部分比例低于30%,这明显低于大部分已被报道的反硝化菌株胞内氮积累量。综上可得菌株lv3对硝态氮的降解主要是反硝化产生气态氮及同化为自身胞内氮,且以反硝化作用为主。
59.实施例9菌株lv3对hg
2+
挥发显影实验实验如下:采用x射线胶片法简单判断菌株lv3将hg
2+
挥发为hg0的能力,主要原理是hg0会与胶片上的ag
+
发生反应形成雾状区域,进而判断该菌株是否对汞具有挥发性。首先取5ml工作液(同实施例3)接种到含hg
2+
浓度为4 mg/l的100ml反硝化培养基中,置于摇床在30℃和120rpm条件下进行培养36h后,收集对数期培养好的菌液用于菌株的汞挥发显影实验研究。实验共设置实验组(缓冲液+汞溶液+菌株lv3)、对照组1(缓冲液+汞溶液)和对照组2(缓冲液+菌株lv3)三个组别,分别置于多孔板中,将x光片置于多孔板的上方,在密封、黑暗的条件下室温反应1 h。
60.图9显示利用x射线胶片法来检测细菌对汞的挥发性能,即验证菌株是否具有还原hg
2+
的能力。实验组相较于对照组1的显影部分更为明显,表明虽然在未添加菌株时,溶液中的汞也有少量的挥发,但是菌株的添加增强了这一效果。对照组2基本没有显影,故可确定菌株对汞具有挥发效能,菌株lv3可将hg
2+
还原为毒性及可溶性较小的hg0。
61.以上所述仅为本发明的实施例,并不因此限制本发明的专利范围,凡是利用本发明说明书及附图内容,对本发明的技术方案进行修改或者等同替换,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1