一种仁用杏PasLEA3-2基因及其在抗寒、促进植物提前开花或种子结实中的应用的制作方法
一种仁用杏paslea3-2基因及其在抗寒、促进植物提前开花或种子结实中的应用
技术领域
1.本发明涉及生物技术领域,特别是涉及一种仁用杏paslea3-2基因及其在抗寒、促进植物提前开花或种子结实中的应用。
背景技术:
2.仁用杏具有很高的经济价值和生态价值,是我国“三北地区”重要的生态经济型干果树种、木本油料树种和植物蛋白饮料树种。由于仁用杏休眠期短、花期早极易遭受晚霜为害,造成减产甚至绝产,实现花期的人为调控是解决仁用杏低产和不稳产的有效途径之一。一些与仁用杏花期调控相关基因的陆续被克隆和功能鉴定,为获得与开花性状相关的基因资源、了解仁用杏花期调控的低温响应机制以及花期的精准调控奠定良好基础。
3.植物中含有一种亲水性和热稳定性强的蛋白,称为胚胎发育晚期丰富蛋白(late embryogenesis abundant,lea蛋白),lea蛋白在一般条件下主要在种子发育晚期积累,在遭遇逆境条件如高盐、干旱和高温等胁迫下,植物体内会诱导产生lea蛋白。lea蛋白能保持细胞渗透压,有效维持细胞膜结构,并作为分子伴侣保护其他蛋白及生物大分子,提高植物在极端逆境条件下的适应性,维持植物在不良环境条件下正常生理活动的能力。然而lea蛋白在仁用杏低温下维持抗寒性,以及促进提前开花和结实的作用还未见报道。开花是植物由营养生长转变为生殖生长的重要阶段,通过对开花期进行调节,使植物提前或推迟开花,有利于植物适应外界环境条件,控制植物的生殖发育或营养生长,避免逆境对植物的伤害。
技术实现要素:
4.本发明的目的是提供一种仁用杏paslea3-2基因及其在抗寒、促进植物提前开花或种子结实中的应用,以解决上述现有技术存在的问题,本发明提供的仁用杏paslea3-2基因可以提高植物的抗寒性,促进开花繁殖,缩短植物开花和结实期,提高结实量和果实产量。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种仁用杏paslea3-2基因,所述paslea3-2基因的核苷酸序列如seq id no:1所示。
7.本发明还提供一种仁用杏蛋白质,所述蛋白质的氨基酸序列如seq id no:2所示。
8.本发明还提供一种重组质粒,包含上述的paslea3-2基因。
9.本发明还提供一种重组微生物菌株,包含上述的paslea3-2基因。
10.本发明还提供上述的仁用杏paslea3-2基因、仁用杏蛋白质、重组质粒或重组微生物菌株在提高植物或酵母菌抗寒性中的应用。
11.本发明还提供一种提高植物抗寒性的方法,包括将编码如seq id no:2所示的蛋白质的基因,通过遗传转化进入植物植株,得到转基因植株。
12.进一步地,编码如seq id no:2所示的蛋白质的基因的核苷酸序列如seq id no:1
所示。
13.本发明还提供上述的仁用杏paslea3-2基因、仁用杏蛋白质、重组质粒或重组微生物菌株在促进植物提前开花或种子结实中的应用。
14.本发明还提供一种促进植物提前开花的方法,包括将编码如seq id no:2所示的蛋白质的基因,通过遗传转化进入植物植株,得到转基因植株。
15.本发明还提供一种促进植物种子结实的方法,包括将编码如seq id no:2所示的蛋白质的基因,通过遗传转化进入植物植株,得到转基因植株。
16.本发明公开了以下技术效果:
17.本发明在仁用杏中筛选出具有促进植物抗寒且提前开花的基因,进行植物品种的遗传改良,促进开花繁殖,缩短植物开花和结实期,提高结实量和果实产量,为获得抗寒育种的基因资源,丰富我国经济林果市场提供了优质的种质资源。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1为paslea3-2基因扩增图,m为dl2000 marker;1:pbi121-paslea3-2基因扩增;2:pgapza-paslea3-2基因扩增;
20.图2为pgapza载体图谱;
21.图3为pbi121-paslea3-2和pgapza-paslea3-2载体酶切鉴定图,m为dl2000marker;1:pbi121-paslea3-2酶切鉴定;2:pgapza-paslea3-2酶切鉴定;
22.图4为pbi121-paslea3-2和pgapza-paslea3-2载体菌液pcr检测图,m为dl2000marker;1-4:pbi121-paslea3-2载体菌液pcr扩增产物;5-8:pgapza-paslea3-2载体菌液pcr扩增产物;
23.图5为转paslea3-2基因的酵母菌低温下在固体培养基点板结果;
24.图6为转paslea3-2基因的酵母菌低温下液体培养od
600
测定结果;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是-20℃低温处理的数值;
25.图7为paslea3-2转基因拟南芥的pcr检测,m为dl2000marker;1-8、10:paslea3-2转基因拟南芥植株;9:非转基因拟南芥植株;11:阳性质粒对照;12:野生型拟南芥对照;
26.图8为低温下paslea3-2转基因拟南芥及其对照植株的paslea3-2基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
27.图9为低温下paslea3-2转基因拟南芥及其对照植株的atpub26基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
28.图10为低温下paslea3-2转基因拟南芥及其对照植株的atbtf3l基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
29.图11为低温下paslea3-2转基因拟南芥及其对照植株的atebf1-1基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
30.图12为低温下paslea3-2转基因拟南芥及其对照植株的atrcar5基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
31.图13为低温下paslea3-2转基因拟南芥及其对照植株的atrav1基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
32.图14为低温下paslea3-2转基因拟南芥及其对照植株的atvin3基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
33.图15为低温下paslea3-2转基因拟南芥及其对照植株的atsoc1基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
34.图16为低温下paslea3-2转基因拟南芥及其对照植株的atap1基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
35.图17为低温下paslea3-2转基因拟南芥及其对照植株的atlfy基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
36.图18为低温下paslea3-2转基因拟南芥及其对照植株的atcry2基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
37.图19为低温下paslea3-2转基因拟南芥及其对照植株的atcol13基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
38.图20为低温下paslea3-2转基因拟南芥及其对照植株的atcol9基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
39.图21为低温下paslea3-2转基因拟南芥及其对照植株的atrgl1基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
40.图22为低温下paslea3-2转基因拟南芥及其对照植株的atgl基因的表达量分析;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
41.图23为低温下paslea3-2转基因拟南芥及其对照植株的表型对比图,其中wt为对照植株,leaoe-1、leaoe-2和leaoe-3为paslea3-2转基因拟南芥;
42.图24为低温下paslea3-2转基因拟南芥及其对照植株的根长对比图,其中wt为对
照植株,leaoe-1、leaoe-2和leaoe-3为paslea3-2转基因拟南芥;
43.图25为低温下paslea3-2转基因拟南芥及其对照植株的叶片大小对比图,其中wt为对照植株,leaoe-1、leaoe-2和leaoe-3为paslea3-2转基因拟南芥;
44.图26为低温下paslea3-2转基因拟南芥及其对照植株的果荚长度对比图,其中wt为对照植株,leaoe-1为paslea3-2转基因拟南芥;
45.图27为paslea3-2转基因拟南芥及其对照植株的根长测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
46.图28为paslea3-2转基因拟南芥及其对照植株的叶长测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
47.图29为paslea3-2转基因拟南芥及其对照植株的叶宽测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
48.图30为paslea3-2转基因拟南芥及其对照植株的生存率测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
49.图31为paslea3-2转基因拟南芥及其对照植株的相对导电率测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
50.图32为paslea3-2转基因拟南芥及其对照植株的超氧化物歧化酶活性测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
51.图33为paslea3-2转基因拟南芥及其对照植株的脯氨酸含量测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
52.图34为paslea3-2转基因拟南芥及其对照植株的丙二醛含量测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
53.图35为paslea3-2转基因拟南芥及其对照植株的开花时间测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
54.图36为paslea3-2转基因拟南芥及其对照植株的抽薹时间测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
55.图37为paslea3-2转基因拟南芥及其对照植株的果荚长度测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值;
56.图38为paslea3-2转基因拟南芥及其对照植株的结实率测定结果图;其中斜纹柱状图显示的是正常生长条件的数值,白色填充柱状图显示的是低温处理10天的数值。
具体实施方式
57.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
58.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
59.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
60.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
61.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
62.以下实施例中pgapza载体来自于invitrogen公司,pbi121载体来自于novagen公司,农杆菌gv3101来自于上海唯地生物技术有限公司,酵母菌株gs115来自于上海圻明生物科技有限公司。
63.实施例1仁用杏paslea3-2基因的克隆
64.仁用杏主栽品种
‘
龙王帽’种植于内蒙赤峰市喀喇沁旗锦山镇,采取花芽组织提取总rna。rna提取及第一链cdna反转录步骤如下:
65.(1)rna提取步骤及第一链cdna反转录方法:
66.1)研磨花芽组织,加1ml trizol,匀浆后,花芽组织与trizol混合物室温放置5min,使得组织样本能被trizol充分裂解。
67.2)取1ml trizol裂解的样本组织加入200μl三氯甲烷。
68.3)管盖盖严,上下剧烈摇晃15秒。
69.4)置室温放置3min。
70.5)在离心机4℃下转速12000g离心15min。
71.6)离心后静置,待管中液体分层,将明显分层的最上层的无色液体(约占总体积45%左右)转移到一个新的无rna酶的ep管中。
72.7)向移取的上层液体中加500μl 100%异丙醇。
73.8)室温放置10min。
74.9)在离心机4℃下12000g离心10min。
75.注意:离心管放置时,管柄一致向外侧,离心后,rna将沉淀于管柄一侧的底部。
76.10)小心给上清吸去,加入depc水配置的75%乙醇。
77.11)上下颠倒十次,转速7500g,4℃离心5min。
78.12)去除乙醇后,开管盖室温放置5-10min,即得到纯化的rna。
79.13)depc水溶解后琼脂糖电泳检测。
80.使用takara公司的primescript
tm rt reagent kit with gdna eraser(perfect real time)试剂盒将rna逆转录为cdna,取适量上述反转录产物,后续进行pcr扩增分离目的基因。
81.(2)目的基因扩增
82.根据pgapza载体图谱设计ecor i和xho i为插入位点,根据pbi121的图谱设计xbai和saci为插入位点。
83.扩增基因引物序列为:
84.构建pgapza-paslea3-2的引物序列:
85.paslea3-2-gap-f:caactatttcgaaacgaggaattcatggccaagtttcctgtgaac(seq id no:3);
86.paslea3-2-gap-r:agctggcggccgccgcggctcgaggtaagtttgtacttgttgttag(seq id no:4);
87.其中小写字母代表酶切位点和保护碱基序列,大写字母代表来自参考模板的5’和3’端的序列。
88.构建pbi121-paslea3-2的引物序列:
89.paslea3-2-flag-f:tggagagaacacgggggactctagaatggccaagtttcctgtgaac(seq id no:5);
90.paslea3-2-flag-r:catgatctttgtaatccatgagctcaagtttgtacttgttgttag(seq id no:6)。
91.①
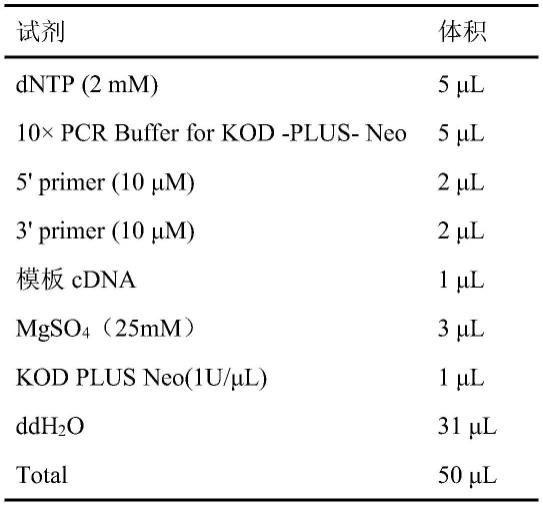
使用高保真酶扩增得到目的片段,扩增体系见表1。
92.表1 kod酶扩增体系
[0093][0094]
②
pcr反应程序:
[0095]
94℃预变性2min;循环情况为94℃变性15s,55℃退火15s,68℃延伸1min,共35个循环;68℃延伸5min。
[0096]
③
电泳检测与回收:pcr产物在1%琼脂糖凝胶进行电泳,电压调节至100v,电泳时间为20min,凝胶成像系统拍照后切取目的基因的条胶,使用诺唯赞胶回收试剂盒回收目的基因条胶,具体步骤按照试剂盒说明书进行。
[0097]
如paslea3-2基因扩增图(图1)所示,pcr产物约为300bp;m为dl2000 marker;1:pbi121-paslea3-2基因扩增;2:pgapza-paslea3-2基因扩增;对pcr产物进行测序,并在提交至ncbi数据库中进行blastn核酸序列的同源性分析(https://blast.ncbi.nlm.nih.gov/blast.cgi),确定通过上述pcr反应克隆到的是lea的同源基因。
[0098]
该基因含有一个完整的开放阅读框架,全长为294bp,见seq id no:1,该基因编码的蛋白的氨基酸序列,见seq id no:2。将这个来源于仁用杏的lea同源基因命名为paslea3-2。
[0099]
seq id no:1:
[0100]
atggccaagtttcctgtgaacccctttctcctgctaagtaggcgatcatataaggttgcaagatcagtgcaaaaggcagcgacgacaatgccgaggactgcgacaaccgaatcgggcagtggtgttaatgataatgtagcaaataatcatgatggtgaacaaatgaatcaagtgttttggatgagagacccgaagacagggaactggattccagagagccactttgaggagattgatgttgcagagctgagggagaagatcctccccaaccctaacaacaagtacaaactttaa;
[0101]
seq id no:2:
[0102]
makfpvnpflllsrrsykvarsvqkaattmprtattesgsgvndnvannhdgeqmnqvfwmrdpktgnwipeshfeeidvaelrekilpnpnnkykl。
[0103]
实施例2用于酵母和拟南芥转化的表达载体的构建
[0104]
(1)实施例1得到的目的片段与pgapza(图2)载体或pbi121载体的酶切。其中pgapza载体进行ecor i、xho i双酶切,pbi121载体进行xba i、sac i双酶切。同样,paslea3-2目的片段也分别进行ecor i、xho i双酶切,xba i、sac i双酶切,具体酶切体系见表2。
[0105]
表2目的片段与载体的酶切体系
[0106][0107]
(2)将酶切的pgapza载体或pbi121载体与同样酶切的目的基因进行体外连接,连接体系见表3,在22℃进行2小时连接。
[0108]
表3目的基因与重组质粒的连接体系
[0109]
[0110][0111]
(3)连接产物的转化
[0112]
a.超净工作台提前进行30min灭菌,从-70℃超低温冰箱中取出100μl的dh5α感受态细胞,置于冰上预冷10min;
[0113]
b.取出一个ep管,编上记号,置于冰盒上,加入80μl的感受态细胞(冰上操作)
[0114]
c.然后加入10μl目的基因与重组质粒的连接产物,用移液枪吸打混匀后冰浴30min;
[0115]
d.冰浴结束后,连接产物与感受态细胞混匀后的产物一起放在42℃的恒温水浴锅中热激90s,然后迅速放入冰块中,进行2min的冰浴;
[0116]
e.吸取500μl不含kan的lb液体培养液加入到ep管中,混匀并放置于摇床中转速160rpm,37℃振荡摇菌1h;
[0117]
f.取出摇床振荡摇菌结束的ep管,2500~3500rmp转速离心5min,弃去上清300μl,剩余的底部菌液轻柔吸打混匀,加在含kan的lb固体培养皿中,用玻璃涂棒涂匀和涂干;
[0118]
g.37℃恒温培养箱中静置培养16~20h至出现单克隆。
[0119]
(4)融合表达载体的鉴定
[0120]
将转化出来的单菌落通过摇菌后用引物进行菌液pcr鉴定,菌液pcr鉴定的体系见表4。
[0121]
表4单菌落检测pcr体系
[0122][0123]
引物序列:
[0124]
paslea3-2-f(正向引物p1):atggccaagtttcctgtgaac(seq id no:7);
[0125]
paslea3-2-r(反向引物p2):aagtttgtacttgttgttag(seq id no:8)。
[0126]
菌液pcr鉴定电泳图见图4,pcr产物约为300bp;m为dl2000marker;1-4:pbi121-paslea3-2载体菌液pcr扩增产物;5-8:pgapza-paslea3-2载体菌液pcr扩增产物。经测序鉴定插入片段无误后,pbi121-paslea3-2载体转化农杆菌gv3101感受态细胞。pcr筛选阳性克隆,提质粒进行限制性酶切验证(图3)后,证明成功转化入农杆菌中,并采用花序浸染法将
pbi121-paslea3-2载体遗传转化到拟南芥中。
[0127]
实施例3pgapza-paslea3-2质粒转化酵母菌株gs115
[0128]
1、准备酵母感受态细胞
[0129]
(1)从固体ypd平板上挑取gs115单克隆菌落,接种在含有10mlypd液体培养基的100ml摇瓶中,30℃转速250-300rpm振荡过夜。
[0130]
(2)按1/1000比例接种到含100ml新鲜培养基的1l摇瓶里,过夜振荡培养至od600=1.3-1.5。
[0131]
(3)室温1500g转速离心5min,用50ml预冷无菌水进行洗涤,4℃下1500g转速离心5min收集细胞。
[0132]
(4)用20ml无菌水洗涤一次,4℃下1500g转速离心5min收集细胞。
[0133]
(5)用10ml无菌水洗涤一次,4℃下1500g转速离心5min收集细胞。
[0134]
(6)同样4℃,1500g转速离心5min收集细胞,加入提前预冷的5ml1m山梨醇悬浮细胞。
[0135]
(7)洗涤三次后离心,最后用2-3ml预冷的1m山梨醇悬浮细胞。
[0136]
2、pgapza-paslea3-2质粒转化酵母菌株gs115
[0137]
(1)向100μl酵母感受态加入线性化质粒pgapza-paslea3-25μl,一起转移至电转杯中,进行冰浴10分钟。
[0138]
(2)使用电转仪将融合表达载体质粒转化至酵母感受态gs115中。
[0139]
(3)加入1ml提前预冷的1m山梨醇,并将溶液转移至15ml离心管中。
[0140]
(4)30℃恒温摇床,大约150rpm振荡摇动95min。
[0141]
(5)离心机800g转速室温离心4min收集转化后的酵母细胞。
[0142]
(6)弃去上清,加入400μl0.9%nacl溶液轻轻悬浮酵母细胞。
[0143]
(7)吸取上述悬浮的酵母细胞于选择性的博来霉素培养基的平板上,用刮铲涂抹开整个平板并没有液体流动。
[0144]
(8)平板置于30℃恒温箱培养3-5天。
[0145]
pcr筛选阳性克隆,含有该表达载体的酵母菌株可直接用于酵母菌株的低温检测等实验。
[0146]
实施例4paslea3-2转化酵母菌的低温检测实验
[0147]
分别挑取含有pgapza-paslea3-2转化酵母菌和空载pgapza转化酵母菌的克隆至1ml含有500μg/ml博来霉素的全氨基酸液体培养基中,30℃恒温培养12小时直至菌液变浑浊。转移100μl菌液至含2ml全氨基酸液体培养基的10ml离心管中,30℃恒温培养22-24小时,测定并调整od值至od
600
=1.0(如需进行低温处理,此时将菌液放入-20℃冰箱中低温处理24小时)。将菌液进行1、1:10、1:100和1:1000稀释,取每种稀释液的5μl点固体平板,30℃恒温培养3天。另外,取1ml菌液到含有10ml全氨基酸液体培养基的50ml培养管中,30℃恒温过夜培养后测定od
600
。
[0148]
实验结果显示,在常温状况下实验组和对照组菌体生长状态基本一致,但经过低温处理后含paslea3-2的酵母菌相比空载体酵母菌生长速度较快(固体培养基点板结果见图5),并且低温处理后取含paslea3-2基因的酵母菌进行液体培养,od
600
值相比对照有显著提高(sig=0.007),平均提高了34.07%(图6)。
[0149]
实施例5paslea3-2转基因拟南芥的pcr鉴定和低温处理实验
[0150]
转基因拟南芥种子筛选和pcr鉴定:在含有卡那霉素抗生素的平板上培养浸染后的paslea3-2转基因拟南芥种子。取大约300颗种子于含卡那霉素25μg/ml的0.5
×
ms培养基上春化2天,然后持续光照培养8-10天。成功转入pbi121-paslea3-2载体的拟南芥种子能在卡那霉素抗性培养基上正常生长,长出4片以上的真叶。根据pbi121载体上的gus报告基因序列设计引物,对paslea3-2转基因拟南芥植株进行pcr检测。引物序列为:
[0151]
正向引物:
[0152]
gus-f:tgatcagcgttggtgggaaag(seq id no:9);
[0153]
反向引物:
[0154]
gus-r:gtagatatcacactctgtctg(seq id no:10)。
[0155]
pcr鉴定结果如图7所示,可见在所检测的抗卡那霉素的11株拟南芥中,9株扩增出约750bp的dna片段,从而可以初步推断这些植株为paslea3-2基因的阳性转化植株;m为dl2000 marker;1-8、10:paslea3-2转基因拟南芥植株;9:非转基因拟南芥植株;11:阳性质粒对照;12:野生型拟南芥对照。
[0156]
非转基因拟南芥种子不能正常生长,只能长出2片子叶,并且根的生长也受到严重抑制,一般情况下种子萌发10天后便死亡。
[0157]
(1)paslea3-2转基因拟南芥植株移栽培养。将在卡那霉素抗性培养基上正常生长,并经过pcr鉴定的转基因拟南芥植株移栽到土壤继续培养。
[0158]
(2)转基因拟南芥的种植和低温处理:选用吸水性好、土质松软的至石配合营养土(1:1/2)作为拟南芥种植土壤。选用直径9cm的花盆,每盆播种15-20颗种子。播种后在花盆上搭建薄膜装置,让转基因植株在湿润的环境里生长。待拟南芥长到八片叶子时,进行低温处理10天并拍照和记录,具体为正常生长条件22℃24小时,低温设计分别为16℃24小时生长,16℃16小时和4℃8小时的三种处理进行植株的培养。具体转基因植株的低温设计方案见表5,转基因拟南芥植株进行三次平行重复实验。
[0159]
表5 paslea3-2转基因拟南芥材料处理条件示意图
[0160]
野生型转基因重复1转基因重复2转基因重复322℃,24小时22℃,24小时22℃,24小时22℃,24小时16℃,24小时16℃,24小时16℃,24小时16℃,24小时16℃,16小时16℃,16小时16℃,16小时16℃,16小时4℃,8小时4℃,8小时4℃,8小时4℃,8小时
[0161]
实施例6 paslea3-2转基因拟南芥及其对照植株的paslea3-2、抗寒和花发育相关基因的表达量分析
[0162]
paslea3-2转基因拟南芥(leaoe-1、leaoe-2和leaoe-3)及其对照植株进行低温处理10天后,运用qrt-pcr技术分别对转基因拟南芥及对照植株的paslea3-2、抗寒基因atpub26、atbtf3l、atebf1-1、atrcar5和atrav1,花发育相关基因atvin3、atsoc1、atap1、atlfy、atcry2、atcol13、atcol9、atrgl1和atgl的表达量进行测定,并采用spss软件(ibm公司)对测定的基因表达量分别进行单因素方差分析(one-way anova),结果见图8-22。抗寒正向调节基因atpub26(图9)、atbtf3l(图10)、atebf1-1(图11)、atrcar5(图12)和atrav1(图13)在paslea3-2转基因拟南芥的表达量明显提高(sig值分别为0.003、0.007、0.008和
209.32%,表明paslea3-2过表达的拟南芥启动了体内的抗氧化酶系统清除活性氧自由基,植株抗寒性明显增强并在低温下维持细胞正常的生理功能。
[0168]
图35-38统计了低温下转基因植株leaoe-1、leaoe-2和leaoe-3与对照的开花时间、抽薹时间、果荚长度和种子结实率。其中,三个转基因植株leaoe-1、leaoe-2和leaoe-3的开花时间相比对照均有所提前,分别提早了27.78%-43.75%。并且三个转基因植株的抽薹时间也相比对照均有所提前。在果荚长度和种子结实率两个指标,低温下转基因植株相比对照分别提高了10.62%-15.04%和35.59%-37.29%。这些研究表明paslea3-2基因促进了转基因拟南芥的提前开花、提高了转基因植株的种子结实率,有利于低温下种质资源的保存和后代的繁衍。
[0169]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1