多替拉韦中间体的绿色合成工艺的制作方法
本发明属于药物化学合成领域,具体的涉及一种多替拉韦中间体1-(2,2-二甲氧乙基)-1,4-二氢-3-甲氧基-4-氧代-2,5-吡啶二羧酸-2-甲酯的绿色合成工艺。
背景技术:
1、多替拉韦(dolutegravir,dtg),商品名tivicay是由英国制药巨头葛兰素史克和日本盐野义制药公司合作开发的一种抗艾滋病新药,是一种整合酶链转移抑制剂(insti),于2012年8月获得美国食品药品管理局批准,与其他抗逆转录病毒药物联用,治疗成年及12岁以上和体重至少40kg儿童的hiv-1感染。
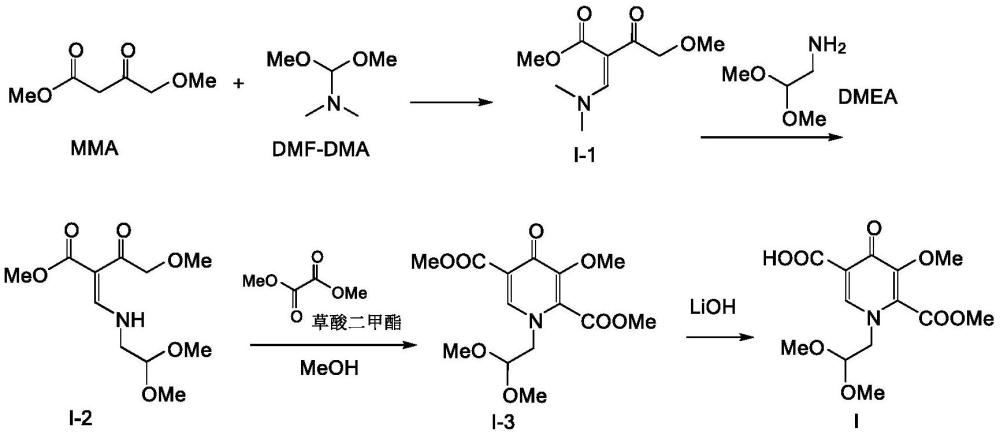
2、1-(2,2-二甲氧乙基)-1,4-二氢-3-甲氧基-4-氧代-2,5-吡啶二羧酸-2-甲酯(下式i化合物)是多替拉韦的重要中间体,目前工业中最常使用的生产方法是viiv保健公司在wo2011119566中公布的合成路线,具体如下示,该路线原料易得,操作简单,反应条件比较温和,是理想的工业化路线。
3、
4、研究重复上述路线的合成方法,发现专利中报道方法,从4-甲氧基乙酰乙酸甲酯(mma)和dmf-dma缩合开始至式i化合物的合成是一步完成,中间体没有任何的分离纯化过程,虽然减少了反应工序,节省了反应时间,提高了生产效率,但是各步中间体的转化率并不高,总产能不大;而且各步反应中均添加了大量的盐,在最后一步处理的时候,体系中存在多种盐,如草酸钠,甲醇钠等,需要消耗最后一步添加的氢氧化锂试剂,导致氢氧化锂使用量大大过量(4.0eq),同时不分离残留的大量盐,在添加氢氧化锂后部分转化成草酸锂,甲醇锂,导致体系内至少存在甲醇钠,草酸钠,甲醇锂,草酸锂,氢氧化锂等多种盐,一方面影响盐的回收,另一方面导致产物包裹盐中,分离效率低,致使总反应收率较低,只有36%左右。
5、鉴于目前工艺存在的缺点,研究开发一种多替拉韦中间体式i的合成工艺,减少反应产生的固废,提高反应转化率,在产品收率提高的同时,还能实现绿色生产,减少固废产生,降低溶剂使用。此研究是目前国家大力倡导绿色化工,也是未来化学工艺改进的方向。
技术实现思路
1、针对现有技术存在的问题,本发明的目的在于提供一种绿色,环保,反应条件温和,转化率高,且能明显减少废盐的产生,大大降低三废处理投入的制备1-(2,2-二甲氧乙基)-1,4-二氢-3-甲氧基-4-氧代-2,5-吡啶二羧酸-2-甲酯(式i化合物)的方法。
2、本发明的一方面,提供一种制备1-(2,2-二甲氧乙基)-1,4-二氢-3-甲氧基-4-氧代-2,5-吡啶二羧酸-2-甲酯(式i化合物)的方法,其特征在于,包含以下步骤:
3、(1)将4-甲氧基乙酰乙酸甲酯(mma)和n,n-二甲基甲酰胺二甲基缩醛(dmf-dma)加入有机体系中,反应得到含化合物i-1混合体系a;
4、(2)向混合体系a中加入氨基乙醛缩二甲醇(dmea),继续反应,浓缩,得到含化合物i-2的混合体系b;
5、(3)向混合体系b中加入甲醇溶剂,然后加入草酸二甲酯和甲醇钠,搅拌反应后,体系经过调节ph值,浓缩,萃取,分液,得到含化合物i-3的混合体系c;
6、(4)向混合体系c中加入氢氧化锂,反应,浓缩,加入溶剂和水的混合物,析晶,过滤,烘干得到式i化合物。
7、其中步骤(2)中浓缩后收集的有机相经过水洗,蒸馏得到的回收溶剂,可任选的套用到步骤(1)中;步骤(4)中浓缩收集的有机溶剂,经过水洗,蒸馏,可任选的套用到步骤(3)的萃取溶剂中。
8、在另一优选例中,所述步骤(1)中,mma与dmf-dma的摩尔比为1.0:0.8~4.0,优选1.0:0.9~1.5。
9、在另一优选例中,所述步骤(1)中,有机溶剂选自甲苯、四氢呋喃或其混合物,优选甲苯。
10、在另一优选例中,所述步骤(1)中,反应温度为30~70℃,优选40~50℃;反应时间为1~7小时,优选1~3小时。
11、在另一优选例中,所述步骤(2)中,dmea与mma的摩尔比为1.0~2.0:1.0,优选1.0~1.5:1.0。
12、在另一优选例中,所述步骤(2)中,反应温度为10~40℃,优选20~30℃。
13、在另一优选例中,所述步骤(2)中,浓缩为减压浓缩,浓缩温度为30~60℃,优选40~45℃。
14、在另一优选例中,所述步骤(2)中,浓缩收集的有机相,先进行水洗,分液,然后有机层蒸馏,收集的有机相可以任意的套用与步骤(1)中。
15、在另一优选例中,所述步骤(3)中,草酸二甲酯与甲醇钠与mma的摩尔比为1.5~7.5:1.0~5.0:1.0,优选2.0~4.0:1.5~2.5:1.0。
16、在另一优选例中,所述步骤(3)中,反应温度为10~50℃,优选20~40℃;反应时间为1~5小时,优选2~3小时。
17、在另一优选例中,所述步骤(3)中,反应完后,用酸调节反应体系的ph值,其中,酸可以为盐酸,硫酸,醋酸或其组合,优选盐酸;调节体系ph在5~8之间,优选ph=6~7。
18、在另一优选例中,所述步骤(3)中,具体操作步骤为向混合体系b中加入草酸二甲酯和甲醇钠,反应,向反应后的体系加入酸调节ph,减压浓缩,向浓缩物中加入有机溶剂和水,萃取,分液,得到含化合物i-3的有机溶液,即为混合体系c,其中有机溶剂选择甲苯、二氯甲烷、乙酸乙酯、甲基叔丁基醚或其组合;优选甲苯、二氯甲烷。
19、在另一优选例中,所述步骤(4)中,氢氧化锂与mma的摩尔比为1.0~3.0:1.0,优选1.0~1.5:1.0。
20、在另一优选例中,所述制备1-(2,2-二甲氧乙基)-1,4-二氢-3-甲氧基-4-氧代-2,5-吡啶二羧酸-2-甲酯(式i化合物)的方法,具体的,包括以下步骤:
21、(i)向反应器中加入甲苯,乙酸和mma,室温搅拌,滴加dmf-dma,滴加完毕,升温至40℃~50℃反应,保温搅拌1~3小时,得到混合体系a-1;
22、(ii)向混合体系a-1中滴加dmea,控制温度20~30℃,并保温反应1小时,减压浓缩,收集含甲苯的有机相s1,然后向浓缩物中加入甲醇,得到混合体系b-1;
23、(iii)向混合体系b-1中加入草酸二甲酯和甲醇钠,控制温度20~40℃,反应2小时后,体系降温至20℃以下,滴加盐酸调节ph值至6~7,减压浓缩,向浓缩物中加入二氯甲烷和水,萃取,分液,得到含化合物i-3的二氯甲烷溶液,即为混合体系c-1;
24、(iv)向c-1体系中加入氢氧化锂,20℃反应2小时,用盐酸调节ph值在2~3左右,浓缩,收集含二氯甲烷的有机相s2,然后浓缩体系中加入甲醇浓缩后,加入水,搅拌析晶,室温抽滤,滤饼水洗后,45℃真空干燥即得化合物i。
25、其中步骤(ii)中浓缩收集的含甲苯的有机相s1经过水洗,蒸馏得到的回收甲苯,可任选的套用到步骤(i)中;步骤(iv)中浓缩收集的含二氯甲烷有机相s2,经过水洗,蒸馏,得到回收二氯甲烷,可任选的套用到步骤(iii)中作为萃取溶剂。
26、在另一优选例中,所述甲苯溶剂回收,具体包括以下步骤:将步骤(ii)中浓缩的甲苯溶液加入水,洗涤两次,用盐酸调节水相ph值至2~3,分液,分液后的有机相再次用水洗涤,有机相常压蒸馏分水,得到回收甲苯,其中,每次萃取水量与甲苯的体积比为0.2~0.3:1.0。
27、在另一优选例中,所述二氯甲烷溶剂回收,具体包括以下步骤:将步骤(iv)中浓缩收集的二氯甲烷相用水洗两次,收集有机相,干燥得回收二氯甲烷。
28、在另一优选例中,回收的甲苯和二氯甲烷溶剂可任意的应用于制备1-(2,2-二甲氧乙基)-1,4-二氢-3-甲氧基-4-氧代-2,5-吡啶二羧酸-2-甲酯(式i化合物)的步骤中。
29、应理解,在本发明的范围内,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一赘述。
- 还没有人留言评论。精彩留言会获得点赞!