一种治疗新生血管相关眼底疾病的AAV药物的制作方法
:本发明属于重组腺相关病毒(raav)基因治疗,涉及raav递送fc工程化改造的vegf受体融合蛋白或抗vegf抗体的制备,应用于血管新生相关的眼底疾病的治疗,如年龄相关黄斑变性、湿性黄斑病变、糖尿病视网膜病变等疾病的治疗。
背景技术
0、
背景技术:
1、血管新生可以在视网膜、脉络膜、黄斑、视盘、角膜、虹膜睫状体等眼内组织中出现,引起这些部位组织出血、渗出及增生等病理改变,包括年龄相关黄斑变性(age-relatedmacular degeneration,amd)、糖尿病视网膜病变(diabetic retinopathy,dr)、早产儿视网膜病变(retinopathy of prematurity,rop)等,严重影响视力,是老年人群中致盲的主要原因。
2、amd分为两个主要亚型:非新生血管型(干性amd)和新生血管型(湿性amd)。血管内皮生长因子(vascular endothelial growth factor,vegf)是促进血管生成的重要蛋白质之一。目前,抗vegf药物治疗(包括ranibizumab,aflibercept,bevacizumab,conbercept,和brolucizumab等)已成为湿性amd治疗的标准治疗方案。
3、糖尿病视网膜病变(dr)是糖尿病常见的微血管并发症,致盲率高,发病机制复杂。dr的病理特征为视网膜新生血管形成和血视网膜屏障破坏。抗vegf药物治疗应用也较为普遍。
4、近年来,随着基因递送系统和编辑技术的不断进步,基因治疗领域迅速发展。目前,重组aav(raav,recombinant adeno-associated virus)已经成为体内基因治疗递送的主要平台。raav包装的基因组删除了aav蛋白编码序列,同时添加治疗性基因表达盒。唯一的病毒来源序列是itr,它们是载体生产过程中指导基因组复制和包装所必需的。由于aav具有宿主范围广、安全性高、免疫原性低、组织嗜性、可长期稳定表达等优点,已被广泛地应用于基础研究和临床试验中。
5、目前抗vegf治疗已成为新生血管型眼病的一线治疗方法。已批准在临床上使用的药物包括抗体和抗体片段(bevacizumab、ranibizumab和brolucizumab),融合蛋白(aflibercept和conbercept)以及核酸适配体pegaptanib,双抗vabysmo(faricimab-svoa)。
6、eylea(阿柏西普,aflibercept)是一种重组融合蛋白,由vegfr-1的结构域2和vegfr-2的结构域3与igg1的fc片段融合构成。它通过与血管内皮生长因子亚型a和b(vegf-a和vegf-b)和胎盘生长因子(plgf)结合,抑制新生血管形成并降低血管通透性。美国食品药品监督管理局(fda)和欧洲药物管理局(ema)分别于2014年8月前相继批准了阿柏西普通过玻璃体注射治疗视网膜静脉阻塞继发黄斑水肿、湿性年龄相关性黄斑变性和糖尿病性黄斑水肿3个适应症。
7、conbercept(朗沐,康柏西普)是一类获得世界卫生组织国际通用名称的中国生物制品。该药一类是基因工程抗体药物,与aflibercept结构类似,但区别在于conbercept包含了vegf受体ig样区域,这样的结构能提高与vegf的亲和力,还可阻断vegf-a所有亚型、vegf-b和胎盘生长因子,提高结合速率,延长药物在体内的半衰期,分子量142kd。自2013年底经中国国家食品药品管理总局批准用于治疗wamd。
8、尽管阿柏西普等蛋白药治疗方法是目前治疗新生血管型眼病的标准治疗,但长期的抗vegf治疗可能增加rpe萎缩、脉络膜萎缩及地图样萎缩的发生率。多中心临床研究发现:部分患者在抗vegf治疗七年后,其视力降至基线甚至基线水平以下,甚至伴随着黄斑萎缩和纤维化的发生。
9、而且每4-8周一次的标准治疗实际上很难维持,重复注射可以在一些患者中增加炎症、感染和其他副作用的风险,治疗成本也高,患者接受度较差。
10、因此,为了改善新生血管型眼病患者的治疗效果,必须开发出替代或补充治疗,减少给药次数,甚至一次给药终生受益,提高患者的接受度。
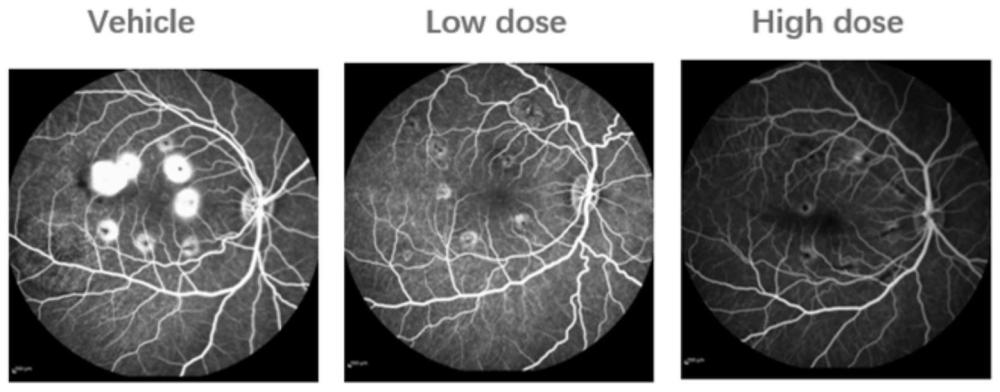
11、脉络膜新生血管(cnv)是渗出性namd的标志性病变,也是老年人视力丧失的一个重要原因。目前激光诱导cnv动物模型已经普遍用于amd治疗用药的药效评价,包括贝伐珠单抗、阿柏西普和雷珠单抗等蛋白药物。在啮齿动物和nhp激光诱导的namd的cnv模型中,脉络膜脉管系统的短暂血管渗漏和新血管反应在激光破坏bruch膜后持续2-3周(啮齿动物)或6-8周(nhp),此后自发地消退。
12、建立一个持续性和复发性血管渗漏和新生血管的模型,将大大有助于并加速对长效干预措施的评估,以解决病理性血管不稳定和新血管形成的多种临床表现。dl-α-氨基己二酸(dl-aaa)模型是一种已经在大鼠和兔中报告的慢性渗漏模型,并且已经在这些物种中进行常规候选药物筛选。dl-aaa是一种选择性神经胶质细胞毒素,据报道可抑制谷氨酰胺合成酶的作用,损害更广泛的müller细胞视网膜稳态功能而导致神经胶质功能障碍和死亡,从而导致血视网膜屏障破坏。注射d-laaa后2个月大鼠视网膜下血-视网膜屏障破坏,并增加血管的渗漏和迂曲。最近有几组研究表明,在兔ivt给予dl-aaa后2-36个月,血管渗漏和rnv升高,并且抗vegf药物贝伐单抗,雷珠单抗,阿柏西普和darpins靶向vegf-a165抑制了此类病理。大鼠、兔和人类的视网膜血管和神经元解剖结构不同,但猴和人类之间基本上是相同的。猴和人类的视网膜脉管系统,视网膜分割和基底层边界,视网膜神经元和神经胶质细胞亚型的比例丰度以及黄斑的存在是同源的。同时慢性视网膜血管渗漏和新血管形成的临床前模型允许在疾病发展的多个阶段对短效和长效抗血管生成化合物进行疗效筛查。本发明将使用dl-aaa引起的慢性血管渗漏nhp模型进行效果验证。
技术实现思路
0、
技术实现要素:
1、考虑到阿柏西普在临床上的良好表现,作为基因治疗递送候选分子在体内长期表达维持疗效同时风险低。本发明以阿柏西普表达基因为基础,通过基因改造和载体优化,用重组aav递送实现目的基因在rpe层的长期稳定表达,将优化的目的基因序列递送至患者眼底细胞。实现“一次给药,长期有效”,为患者提供更安全,更经济,和更方便的优异的治疗方式,减轻现有新生血管型眼病临床治疗的负担,满足临床上尚未满足的需求。
2、本发明提供的技术方案之一,是一种人源igg1的fc片段突变体,所述突变体是发生以下突变中的至少一种获得的:
3、t250a,l251a,m252l,i253a/d/p,s254a,t256a,l309a,h310l/v/a/d/e/q,q311a,l314a,m428l/i,h433l/v/a,n434l/v/a,h435l/v/a,y436a;
4、其中的编号由eu索引指示;
5、优选地,所述突变体具有以下单突变中的一种:h310a、h310l、h435a、h435l、i253a、i253d、i253p、h310d、h310e或h310q;
6、更优选地,所述突变体具有如下单点突变中的一种:h310a,h310e或h435a;
7、优选地,所述突变体具有以下双突变中的一种:m252l/m482l、m252l/m482i、m252l/m482l、t250a/h310l、l251a/h310l、i253a/h310l、s254a/h310l、t256a/h310l、l309a/h310l、h310l/q311a、h310l/l314a、h310l/h433a、h310l/n434a、h310l/h435a、h310l/y436a、i253a/h310a、i253a/h435a、或h310a/h435a;
8、更优选地,所述突变体具有如下双突变:h310a/h435a;
9、优选地,所述突变体是具有以下三突变中的一种:m252l/h310l/m482l、m252l/h310v/m482l、m252l/m482l/h433l、m252l/m482l/h433v、m252l/m482l/n434l、或m252l/m482l/h435v;
10、优选地,所述突变体具有以下四突变中的一种:m252l/m482l/n434v/h435l、m252l/h310l/m482l/h433l、m252l/h310l/m482l/n434l、或m252l/h310l/m482l/h435l。
11、更优选地,所述fc片段突变体具有seq id no.1、2、3或4所示的序列。
12、本发明提供的技术方案之二,是一种vegf受体重组融合蛋白或抗vegf重组抗体;
13、所述vegf受体重组融合蛋白由vegfr-1的结构域2,vegfr-2的结构域3,以及技术方案一所述的igg1的fc片段突变体融合而成;
14、进一步地,所述vegfr-1的结构域2如seq id no.5所示;
15、进一步地,所述vegfr-2的结构域3如seq id no.6所示;
16、优选地,所述igg1的fc片段突变体为:h310a(seq id no.1所示)、h310e(seq idno.2所示)、h435a(seq id no.3所示)、h310a/h435a(seq id no.4所示)。
17、更优选地,所述vegf受体重组融合蛋白的氨基酸序列如seq id no.7、8、9或10所示;
18、所述抗vegf重组抗体是在现有抗vegf抗体的基础上将其中的fc片段替换为技术方案一所述的igg1的fc片段突变体;
19、进一步地,现有抗vegf抗体包括但不限于贝伐单抗(bevacizumab)、雷珠单抗(ranibizumab)和帕普利珠单抗(brolucizumab);
20、更近一步地,所述抗vegf重组抗体是将贝伐单抗fc片段替换为技术方案一所述的igg1的fc片段突变体,更优选地,具有seq id no.11所示的氨基酸序列。
21、本发明提供的技术方案之三,是一种表达技术方案二所述vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒,所述表达盒从5’-3’端包含如下式i所述的结构:
22、itr-e1-e2-e3-e4-itr式(i),其中:
23、itr为反向末端重复序列;
24、e1为启动子;
25、e2为信号肽;
26、e3为编码技术方案二所述vegf受体重组融合蛋白或抗vegf重组抗体的核苷酸序列;
27、e4为poly a序列。
28、进一步地,所述itr(反向末端重复序列)来自于aav1,aav2,aav3,aav4,aav5,aav6,aav7,aav8或aav9,优选地,所述itr序列选自aav2;
29、进一步地,所述启动子是可以启动目的基因转录的dna序列,该序列可以被rna聚合酶所识别,并开始转录合成rna,所述启动子包括但不限于天然、优化或组合启动子;
30、更进一步地,所述启动子优选cmv、cba、ef1a、sv40、pgk1、ubc、cag、tef1、u6或h1启动子;
31、进一步地,所述信号肽来源包括但不限于human osm、gaussia luc、或者albumin(hsa);
32、进一步地,所述poly a序列选自bgh polya、sv40 polya或hgh polya;
33、进一步地,上述表达盒还包括调控元件,所述表达调控元件包括但不限于以下功能的调控元件:(1)用于调控目的蛋白的表达,例如ires,用于启动下游基因的翻译;(2)用于表达mirna和sirna序列的调控元件;(3)内含子;(4)定位序列,将目的蛋白定位表达到细胞核,细胞质或各类细胞器,以及分泌到细胞外;(5)调控元件还可以是部分的kozak序列,kozak序列为g/n-c/n-c/n-annaugg,例如gccaccaugg等;(6)增强子,增强子可以来自sv40病毒,cmv病毒或腺病毒等;(7)调控元件可以是wpre。
34、进一步地,上述表达盒还包括标签元件,所述标签元件包括但不限于flag,ha,myc,荧光蛋白,荧光素酶,sumo蛋白,泛素蛋白,gst等。
35、优选地,所述表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒,是将技术方案二所述vegf受体重组融合蛋白或抗vegf重组抗体在aav病毒载体上进行表达;
36、进一步地,所述aav病毒载体包括但不限于paav-cmv、px601、px551、paav-mcs质粒等;
37、优选地,所述表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒包括:itr-cmv启动子-cmv增强子-内含子-信号肽-kozak序列-vegf受体重组融合蛋白/抗vegf重组抗体编码序列-polya-itr;
38、更优选地,所述表达vegf受体重组融合蛋白的aav病毒载体表达盒具有seq idno.12所示的序列;
39、更优选地,所述表达抗vegf重组抗体的aav病毒载体表达盒具有seq id no.13所示的序列。
40、本发明提供的技术方案之四,是一种腺相关病毒包装载体系统,所述包装载体系统包括:技术方案三所述的表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒,携带aav rep、cap基因的载体以及辅助病毒载体,上述载体通过包装成为aav病毒;
41、进一步地,所述携带aav rep、cap基因的载体包括但不限于:aav1,aav2,aav5,aav8,aav9,aav-r100,aav-nn,aav-gl,aav8-y447f,aav8-y733f,aav8-y447f/y733f,aav-dj或aav7m8载体等;
42、进一步地,所述辅助病毒载体为腺病毒或疱疹病毒辅助病毒载体,优选phelper质粒。
43、本发明提供的技术方案之五,是一种腺相关病毒的包装方法,将技术方案四所述腺相关病毒包装载体系统转入宿主细胞中进行病毒包装;
44、进一步地,将技术方案四所述包装载体系统中的表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒与携带aav rep、cap基因的载体以及辅助病毒载体转入宿主细胞中进行病毒包装;
45、进一步地,所述宿主细胞是能够进行病毒复制且稳定遗传的细胞系,包括但不限于hela-s3,hek-293,hek-293t,hek-293ft,expi293f,a549和sf9等细胞;
46、优选地,所述宿主细胞为hek-293、hek-293t细胞或expi293f细胞。
47、本发明提供的技术方案之六,是采用技术方案之五所述的包装方法获得的腺相关病毒;
48、优选地,是将seq id no.12所示的表达vegf受体重组融合蛋白的aav病毒载体表达盒、aav8 rep-cap质粒、phelper质粒转入宿主细胞expi293f细胞中进行病毒包装获得的;
49、优选地,是将seq id no.13所示的表达抗vegf重组抗体的aav病毒载体表达盒、aav8 rep-cap质粒、phelper质粒转入宿主细胞expi293f中进行病毒包装获得的。
50、本发明提供的技术方案之七,是包含技术方案三所述表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒,或技术方案之六所述腺相关病毒的制剂或配方或药物;
51、进一步地,所述制剂或配方或药物可以是任何剂型,包括但不限于注射剂型和软膏剂型;
52、进一步地,所述制剂或配方或药物中,上述表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒,或腺相关病毒为唯一活性成分。
53、本发明提供的技术方案之八,是技术方案三所述表达vegf受体重组融合蛋白或抗vegf重组抗体的aav病毒载体表达盒,或技术方案之六所述腺相关病毒在制备治疗新生血管相关眼底疾病,特别是年龄相关黄斑变性、湿性黄斑病变、糖尿病视网膜病变等疾病的制剂或配方或药物中的应用;
54、进一步地,所述制剂或配方或药物的给药方法为单侧眼给药或双侧眼给药;
55、更进一步地,给药方式为玻璃体注射、视网膜下腔注射、脉络膜上腔注射等注射方式;
56、更进一步地,终身单次给药或多次给药,给药总剂量为1×108-1×1013个病毒基因组/眼。
57、有益效果:
58、1、本发明通过fc突变,降低与fcrn的亲和力,改善眼部pk行为,减少入血,且不影响稳定性,大幅增加在眼部的蓄积并延长半衰期;即使入血,因降低了fcrn亲和力,在循环系统的半衰期更短,避免引起其他系统性安全风险;
59、2、通过fc突变和载体元件组合设计,实现更低的aav病毒剂量在体内持续稳定表达,跟现有同类的aav产品体内蛋白表达数据相比具有明显优势;
60、3、本发明设计的raav载体元件递送fc突变改造的vegf拮抗剂组合比现有上市蛋白药对照组药效更持久;
61、4、本发明制备的aav病毒可通过一次给药终身缓解或治愈血管新生型眼底疾病的机会,或者减少蛋白药给药次数;
62、5、同样的组合设计可以采用玻璃体注射、视网膜下腔、脉络膜上腔等多种给药方式。
- 还没有人留言评论。精彩留言会获得点赞!