一种产酶菌株及其构建方法与应用
:
1.本发明属于基因工程和发酵工程领域,具体涉及一种工业酶制剂高产菌株的构建方法。
背景技术:
2.酶是具有催化活性的生物大分子,多为蛋白质。同时酶制剂也是一种重要的工业产品,被广泛应用在纺织、食品、饲料、造纸、制药、环保、医疗、基因工程以及其他重要工业领域。酶制剂的广泛应用离不开酶制剂的工业化高效生产,而工业化高效生产的核心为产酶高产菌株。
3.构建产酶高产菌株最便捷的方法为:克隆待表达酶编码基因到游离型表达载体,再转化入宿主细胞中从而获得产酶菌株。然而,该方法也存在缺点,酶表达质粒在宿主细胞中以游离的形式存在,在细胞传代过程中表达质粒会丢失,从而使细胞失去产酶的能力。目前,维持宿主细胞中表达质粒存在的方法主要有以下几种:1)在培养基中添加表达载体相应抗生素,然而,添加抗生素的方式会造成发酵成本的增加以及对终产物的污染。2)表达质粒携带某种非抗生素标记,如:乳链球菌肽免疫基因(nisl)。例如,在takala在自己的研究中使用了nisl作为替代抗生素的筛选标记构建了表达质粒,达到了维持表达质粒存在的效果(takala,applied microbiology and biotechnology,2002.)。这种方式依旧需要在培养基中添加额外的物质,使发酵过程变得复杂且增加了成本;3)使用细菌中的毒素-抗毒素(toxin-antitoxin,ta)系统维持宿主细胞中表达质粒的稳定性。在yang等的研究中(yang,et al.journal of biotechnology,2016),对枯草杆菌168菌株基因组现有的ta系统进行改造,将编码毒基因,即一种核酸内切酶基因ydce留在基因组位置进行木糖诱导表达,将其对应的抗毒基因ydcd转移到表达载体进行组成型表达,形成一个新的ta系统。在培养过程中不断的添加木糖维持ydcd的表达,迫使在重组菌细胞的分裂过程中子代细胞始终保有表达质粒。但是,使用木糖诱导的方式,不仅对培养基成分提出要求,并且增加了发酵工艺难度及发酵成本,事实上无法应用于工业酶制剂的制备目的。因此,需要建立一种简单、高效和快捷的通过游离表达实现工业酶制剂高效、稳定表达的新方法,并且所获得的酶高产菌能够满足工业化高效稳定生产的需要。
技术实现要素:
4.本发明的目的是提供一种酶高产菌株高效构建方法,构建获得的菌株具有较高的遗传稳定性,并将构建获得的菌株应用到酶制剂的生产中,有助于酶制剂的高效低成本生产。
5.为实现上述目的,本发明提供的技术方案之一,是一种酶高产菌株的构建方法,是在表达载体非编码区克隆入一种温度诱导启动子λpl pr控制下的核酸酶抑制剂编码基因,将待表达的酶编码基因克隆入表达载体中获得酶重组表达质粒,并将重组表达质粒转化入地衣芽胞杆菌中;随后将地衣芽胞杆菌中的核酸酶抑制剂编码基因删除,获得遗产稳定的
酶高产重组菌;
6.进一步地,所述构建方法具体如下:
7.(1)将地衣芽胞杆菌的核酸酶抑制剂编码基因(ri)与温度诱导型启动子λp
l pr和人工终止序列(tt)以λp
l pr启动子-ri-tt的顺序连接后,构建出温度诱导表达的核酸酶抑制剂表达盒;
8.(2)将上述表达盒克隆入芽胞杆菌表达载体的非功能区,然后将待表达的酶制剂编码基因克隆入相应的表达区获得重组表达质粒;
9.(3)将上述重组表达质粒转化到地衣芽胞杆菌宿主菌中,获得转化子后再将宿主基因组中的核酸酶抑制剂编码基因删除,完成遗传稳定的高产菌株的构建;
10.进一步地,所述温度诱导表达的核酸酶抑制剂表达盒具有seq id no.1所示的核苷酸序列;
11.进一步地,所述表达载体包括但不限于phy-wzx,pht1469(mobitec),pwh1520(rygus and hillen,1991);
12.进一步地,所述表达载体的非功能区为表达载体中除酶基因表达盒、转录起始位点、选择性标记之外的其他任意区域;
13.优选地,所选地衣芽胞杆菌宿主菌为地衣芽胞杆菌cbb3008,或其衍生菌株,如地衣芽胞杆菌bcbt0529(王正祥等,中国发明专利,cn112574977a,2020)等;
14.进一步地,基因组中的核酸酶抑制剂编码基因具有seq id no.2所示的核苷酸序列;
15.所述待表达的酶制剂包括但不限于:普鲁兰酶、中温淀粉酶、乳糖酶、蔗糖淀粉酶等。
16.本发明提供的技术方案之二,是由上述方法构建的酶高产菌株;
17.进一步地,所述酶高产菌株,是以phy-wzx为表达载体,在phy-wzx的卡那霉素抗性标记序列与3'-amyl'dna之间的位置上克隆入seq id no.1所示的温度诱导表达的核酸酶抑制剂表达盒,并在表达载体的多克隆位点克隆入高温α-淀粉酶编码基因后获得重组表达质粒;将上述重组表达质粒转化到地衣芽胞杆菌cbb3008宿主菌中,之后将宿主基因组中的核酸酶抑制剂编码基因(seq id no.2所示)删除获得的。
18.本发明提供的技术方案之三,是技术方案二所述酶高产菌株的应用,特别是在酶制剂生产中的应用;更特别的是在高温α-淀粉酶生产中的应用。
19.有益效果:
20.本发明构建的特定酶制剂高产菌株,仅需3步实验操作即可完成。所获得的酶高产菌,在其发酵生产过程中不需要额外添加诱导剂,也不需要任何抗生素,酶高产菌在生产过程中始终保持极高的遗传稳定性即无抗液体培养基传代培养10代后,携带的质粒还能维持99%以上。利用本发明方法构建的高温α-淀粉酶高产菌株,在50l发酵罐发酵120h产酶水平达到130,725u/ml。本发明有助于酶制剂的高效低成本生产,具有很好的工业应用前景。
附图说明:
21.图1表达载体pha
1-wzx与pha
2-wzx的质粒图谱;
22.其中,a,载体pha
1-wzx,核酸酶抑制剂编码基因ri表达盒与待表达基因表达盒方
向一致;b,载体pha
2-wzx,核酸酶抑制剂编码基因ri表达盒与待表达基因表达盒方向相反。
23.图2菌株构建过程结果验证
24.a,地衣芽胞杆菌cbb3008和ha-amys点种淀粉平板结果;b,泳道m为1kb ladder marker;泳道1为菌落pcr验证突变质粒pt2-δri在ha-amys中的转化结果;泳道2为以正确突变菌株a-amys基因组为模板扩增ri编码基因所获得pcr结果;泳道3为以野生型地衣芽胞杆菌基因组为模板扩增ri编码基因所获得pcr结果。
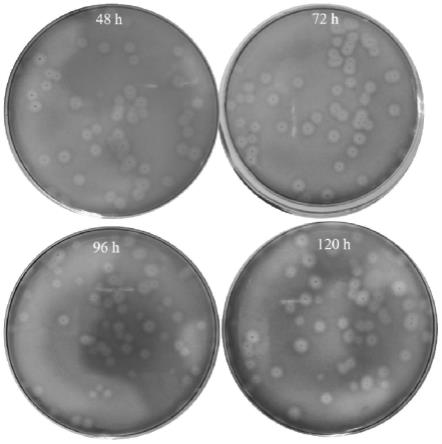
25.图3发酵过程产酶菌株的遗传稳定性
26.48h,72h,96h以及120h分别表示发酵第48h,72h,96h以及120h发酵液适当稀释后涂布淀粉平板获得的结果。
具体实施方式:
27.为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施案例及附图,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本专利,并不用于限定本发明。
28.本发明所使用的表达载体phy-wzx为现有技术,其构建方法已公开在niu dd,wang zx.development of a pair of bifunctional expression vectors for escherichia coli and bacillus licheniformis.j ind microbiol biotechnol(2007)34:357-362.doi 10.1007/s10295-0204-x.王正祥等,中国发明专利,cn112574977a,2020中也有公开,公众也可通过天津科技大学化工与材料学院生物催化与生物转化实验室获得。具体序列见seq id no.18。
29.本发明所使用的质粒pt2
ts
为现有技术,pt2
ts
是以t2(2)-ori(陈守文等,中国发明专利,zl201310562150.7)为出发质粒,采用引物t2-1(序列28)、t2-2(序列29)进行反向扩增后,pcr产物自身环化、连接获得新质粒pt2
ts
。王正祥等,中国发明专利,cn112574977a,2020中也有公开,公众也可以从天津科技大学化工与材料学院生物催化与生物转化研究室获得。
30.本发明所使用的质粒ppl451,为公开质粒,genbank登录号:ab248919.1。
31.本发明所采用的菌株地衣芽胞杆菌cbb3008为现有技术,已保藏于中国典型培养物保藏中心(简称cctcc),保藏日期2008年11月25日,保藏编号cctcc no:m208236。
32.本发明采用的主要实验方法如下:
33.1、基因克隆、分子进化与表达质粒的构建
34.常规分子克隆操作(质粒dna以及基因组dna提取、酶切、琼脂糖凝胶dna回收等)参考经典方法(sambrook,et al.molecular cloning:a laboratory manual,1989)进行。
35.2、基因扩增
36.dna扩增在0.2ml pcr薄壁管中进行。pcr扩增条件为:11(95℃5min);301(94℃10s,58℃30s,72℃307300s);11(72℃10min)。依据不同扩增长度,pcr扩增的延伸时间有所不同。pcr扩增使用高保真dna聚合酶,如pfu dna聚合酶。
37.3、重叠pcr
38.重叠pcr方法参考文献(krishnan,et al.nucleic acids research,1991,22:6177-6182)进行。一般步骤为:首先用引物p1+p2和p3+p4(引物p2和p3为反向互补的序列)
介导pcr的扩增获得片段f1和片段f2,分别获得两个产物片段f1和f2;凝胶回收纯化扩增片段f1和f2;将纯化得到的两个片段f1和f2稀释适当倍数,以摩尔比1:1混合作为模板,以引物p1和p4介导新的pcr扩增,获得融合有两个片段的全长序列。
39.4、遗传转化
40.主要步骤如下:接种新鲜单菌落到50ml液体lb培养基中,37℃、200r/min过夜培养,以5%(v/v)接种量转接2.5ml菌液到新的lb培养基中继续培养至od600为0.75-0.95。培养液冰浴10min后4℃、6000r/min离心10min收集菌体。用预冷的电转洗液(0.5mol/l山梨醇,0.5mol/l甘露醇和10%甘油)反复洗涤细胞4次。将细胞沉淀悬浮于0.5ml预冷的电转洗液中,完成感受态细胞制备。取1μl(50ng)质粒dna和约100μl感受态细胞混匀,立即电击,电转化条件为1800v、5ms,随即加入电转复苏液(含0.5mol/l山梨醇和0.5mol/l甘露醇的lb培养基),37℃、160r/min复苏培养3h后涂布对应抗性的lb平板,于合适温度培养至单菌落长出。正确转化子经菌落pcr、质粒提取酶切、发酵试验等方法验证。
41.5、基因删除
42.地衣芽胞杆菌基因删除采用温敏质粒介导的两次同源重组完成,具体操作参考文献(范如意.基因工程技术改造地衣芽孢杆菌实现中温α-淀粉酶高效表达[d].江南大学,2014)描述。
[0043]
6、酶活测定
[0044]
α-淀粉酶酶活力测定按相关国家标准gb 1886.174-2016进行。
[0045]
7、遗传稳定性测试
[0046]
接种待验证重组菌新鲜菌落到不含抗生素的液体lb培养基中,在37℃、200r/min条件下培养12h,完成一次传代,一共培养120h完成传代10次。将传代培养过程获得的菌液涂布在无抗lb固体平板,分别点种100个单菌落在无抗lb固体平板和四环素浓度为5μg/ml的lb固体平板,计算抗性平板与无抗平板生长菌落比例。
[0047]
8、其它分析方法
[0048]
蛋白含量按文献方法(bradford.analytical biochemistry,1976)进行,葡萄糖含量用酶电极法测定(sba-90,山东),细胞密度用分光光度计(uv-2000,美国)在600nm下测定。
[0049]
以下将通过具体实施例对本发明做进一步的解释说明。
[0050]
实施例1:酶表达载体的构建
[0051]
以ppl451为模板,用引物ts-f/ts-r(seq id no.3和seq id no.4)扩增获得温度诱导启动子λp
l pr序列;以地衣芽胞杆菌cbb3008基因组dna为模板,用引物ri-f/ri-r(seq id no.5和seq id no.6)扩增出核酸酶抑制剂完整读框序列;上述两段核苷酸序列混合后为模板,经引物ts-f和ri-r(seq id no.3和seq id no.6)介导进行重叠pcr扩增获得核酸酶抑制剂表达盒序列λp
l p
r-ri-tt(seq id no.1),全长为1358bp。
[0052]
以表达载体phy-wzx为基础进行酶表达载体进行构建,将上述λp
l p
r-ri-tt序列选择克隆入phy-wzx的卡那霉素抗性标记序列与3'-amyl'dna之间,以phy-wzx dna为模板经引物hy-up/hy-dn(seq id no.7和seq id no.8)反向扩增,将扩增产物经avrii消化后与经xbai酶切的表达盒λp
l p
r-ri-tt连接,获得新构建表达载体pha-wzx,其存在两种形式分别命名为pha
1-wzx和pha
2-wzx,其中,载体pha
1-wzx中,核酸酶抑制剂编码基因ri表达盒与待
表达基因表达盒方向一致;载体pha
2-wzx中,核酸酶抑制剂编码基因ri表达盒与待表达基因表达盒方向相反,如图1所示。
[0053]
实施例2:产酶高产菌株的构建
[0054]
化学合成嗜热土脂肪芽胞杆菌高温-淀粉酶成熟肽编码序列amys(genbank:hv536604.1),经mfei酶切后分别与ecori/smai双酶切的表达载体pha
1-wzx或pha
2-wzx相连接,获得重组表达质粒pha
1-wzx-amys或pha
2-wzx-amys,将此重组质粒任意一种转化地衣芽胞杆菌cbb3008,于四环素浓度为5μg/ml的淀粉平板筛选转化子,正确转化子命名为ha-amys(图2a,具体为pha1-wzx-amys转化入cbb3008的转化子。在本发明中,两种载体仅为核酸酶抑制剂编码基因ri表达盒连接方向不一致,不会影响表达载体介导酶的表达效果。)。
[0055]
以地衣芽胞杆菌cbb3008基因组dna为模板,用引物ri-up1/ri-up2(seq id no.9和seq id no.10)扩增核酸酶抑制剂编码基因ri上游同源臂片段,大小为583bp;用引物ri-dn1/ri-dn2(seq id no.11和seq id no.12)扩增核酸酶抑制剂编码基因ri下游同源臂片段,片段大小为213bp;然后将上、下游同源臂片段混合为新的模板,经过引物ri-up1/ri-dn2(seq id no.9和seq id no.12)介导扩增进行上、下游同源臂片段的组合,获得突变盒全长片段,全长为796bp(seq id no.13);再将该片段酶切后克隆入质粒pt2
ts
的bamhi/smai位点,构建获得突变质粒pt2-δri;然后将此突变质粒转化入含有淀粉酶表达质粒pha
1-wzx-amys的地衣芽胞杆菌ha-amys中,转化子在含有卡那霉素浓度为20μg/ml和四环素浓度为5μg/ml的lb平板完成初筛,正确转化子经引物mcs-f/mcs-r(seq id no.14和seq id no.15)扩增可获得大小约为1.2kb的条带(图2b-1),确认突变质粒pt2-δri转入地衣芽胞杆菌中。随后经过两次同源重组过程后经引物dri-f/dri-r(seq id no.16和seq id no.17)扩增筛选出核酸酶抑制剂编码基因删除的突变株,正确突变株的扩增产物为1088bp(图2b,泳道2),野生型扩增结果为1239bp(图2b,泳道3),将获得的含pha1-wzx-amys且核酸酶抑制剂编码基因删除的突变株,命名为地衣芽胞杆菌a1-amys。
[0056]
地衣芽胞杆菌a1-amys具有极高的遗传稳定性,将a1-amys菌株新鲜菌落接种到不含抗生素的液体lb培养基中,在37℃、200r/min条件下培养12h,完成一次传代,一共培养120h完成传代10次。将传代培养过程获得的菌液涂布在无抗lb固体平板,分别点种100个单菌落在无抗lb固体平板和四环素浓度为5μg/ml的lb固体平板观察计算抗性平板与无抗平板生长菌落比例。结果如表1,质粒保持率在99%,完全满足发酵生产的需求。
[0057]
作为稳定性评价对照菌,将嗜热土脂肪芽胞杆菌高温-淀粉酶成熟肽编码序列amys(genbank:hv536604.1),经mfei酶切后分别与ecori/smai双酶切的表达载体phy-wzx连接,获得重组质粒phy-amys,将此重组质粒转化地衣芽胞杆菌cbb3008,于四环素浓度为5μg/ml的淀粉平板筛选转化子,正确转化子命名为ph-amys。也用上述同样的稳定性评价实验进行测试,传代培养10后数据见表1。
[0058]
可见,采用本发明所述方法构建的菌株具有极高的遗传稳定性。
[0059]
表1地衣芽胞杆菌a1-amys遗传稳定性评价结果
[0060][0061]
实施例3:产酶高产菌株的性能评价
[0062]
以实施例2构建的地衣芽胞杆菌a1-amys为生产菌株,在50-l发酵罐中进行发酵生产高温α-淀粉酶。发酵过程中采用发酵温度42℃,控制溶氧为20%以上,发酵过程控制ph为6.8,流加50%(w/w)麦芽糖浆并维持发酵液中还原糖含量在2%。
[0063]
发酵培养基组成为:麦芽糖浆3%,棉籽粉4%,玉米浆2%,豆饼粉2.5%,硫酸铵0.3%,其余为水,ph 6.8;接种量为8%;
[0064]
发酵120h结束时,高温α-淀粉酶的酶活力达到130,725u/ml,发酵液中酶蛋白浓度为14.9mg/ml。
[0065]
发酵过程取样进行菌株的产酶稳定性评价,如图3所示。在整个发酵过程中发酵液所获得的重组菌菌落均可以在淀粉平板形成淀粉水解圈,具有淀粉水解圈的菌落比例均达到99%以上。可见,利用本发明方法构建的产酶菌株具有较高的遗传稳定性。
[0066]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1