一种放射线活性黄酮衍生物及其在医药或治疗上的应用
1.本发明属于生物化工领域,具体涉及一种放射线活性黄酮衍生物及其在医药或治疗上的应用。
背景技术:
2.肿瘤放射线治疗(又称放射治疗,简称放疗)是利用放射线治疗肿瘤的一种局部治疗方法。全球大约50%的癌症患者接受了放射治疗,且放射治疗贡献了约40%治愈率(de mey s,dufait i,de ridder m.front oncol 2021,11,761901.)。放射治疗在肿瘤治疗中的作用和地位日益突出,已成为治疗恶性肿瘤的主要手段之一。放疗中用到高能放射线,放射线能够电离细胞内的水分子产生强氧化性自由基,对病灶部位施加放射线可显著破坏癌细胞的遗传分子,进而达到杀死癌细胞的目的(baskar r,lee k a,yeo r,et al.int j med sci 2012,9,193-199)。虽然,电离辐射可有效穿透组织,然而放射线对癌细胞和普通细胞间无选择性,因而大剂量的放射线也会显著破坏人体机能(hall e j,giaccia a j.new york:lippincott williams&wilkins 2006)。临床上会对放射线的剂量严格控制,因此目前的放疗方式无法有效治疗需要高辐射剂量的放射线抵抗性肿瘤(takahashi j,nagasawa s.int j mol sci 2020,21(23),9324)。
3.为了能在临床限定的辐射剂量内,提高癌细胞的死亡率,从而减少放疗次数,达到减轻正常组织的损伤的目的,开发一种能够提高肿瘤的放射线感受性的增感剂显得至关重要。虽然放射线增感剂在增加dna损伤、阻碍核酸合成、阻碍细胞分裂、低氧细胞等肿瘤环境变化、阻碍dna修复、增强免疫力以及阻碍信息传递路径等各种作用机理已经被探讨过,但是没有能在临床上广泛应用且有效的x光增感剂(takahashi j,murakami m,mori t,et al.sci rep 2018,8(1),2728)。日本研究机构认为能够直接传递放射线能量的增感剂,能够显著降低放疗过程中所需的x光剂量,而日本对其研究也在稳步进行。目前为止,日本方面虽然对能够吸收x光的纳米材料及上万种小分子化合物进行了研究,然而远未达到实用水平,大多数物质的实用化受限于其高毒性和低生物兼容性(toyama m,mori t,takahashi j,et al.radiat phys chem 2018,146,11
–
8.)。
4.天然产物及其衍生物具有高生物兼容性及高安全性。日本方面于2009首次发现天然产物原卟啉ix具有放射线活性(takahashi j,misawa m,murakami m,et al.springerplus 2013,2,602.),并证实了能有效抑制体外癌细胞生长。其对小鼠肿瘤放疗的有效性目前也在持续稳步进行中(takahashi j,nagasawa s,doi m,et al.int j mol sci 2021,22(18),9762.)。因此,将具有放射线活性的天然产物及其衍生物应用于癌症放疗中,有利于安全高效治愈癌症。
技术实现要素:
5.为解决现有放疗技术的不足,本发明的目的在于提供一种安全且有高癌细胞抑制效果的放射线活性黄酮衍生物。
6.本发明的另一个目的在于提供所述放射线活性黄酮衍生物在医药或治疗上的应用。
7.本发明的目的通过下述技术方案实现:一种具有放射线活性的甲基化黄酮,其结构式如式i所示:
[0008][0009]
其中:3位为羟基,2’,4’,5,7位为甲氧基,5’位是一个具有聚集诱导效应的基团。
[0010]
优选的,所述放射线活性黄酮衍生物是一种具有聚集诱导效应(aggregation-induced emission,aie)结构的黄酮衍生物。
[0011]
优选的,所述具有聚集诱导效应的基团为被二苯基-氰基取代的乙烯基。
[0012]
优选的,所述放射线活性黄酮衍生物在水环境中能与放射线直接产生物理化学反应,产生氧化性自由基。
[0013]
本发明的目的还在于提供放射线活性黄酮衍生物在制备抗肿瘤药物中的应用。
[0014]
本发明的第三个目的在于提供放射线活性黄酮衍生物的应用,所述放射线活性黄酮衍生物用于肿瘤放疗和/或辅助放疗的用途。
[0015]
优选的,实施所述放射线活性黄酮衍生物用于肿瘤放疗和/或辅助放疗的用途包括如下步骤:
[0016]
s1,皮下注射给药,将所述放射线活性黄酮衍生物制备的化合物以磷酸盐缓冲液稀释后按照第一标准给药浓度给药;
[0017]
s2,向病灶部位进行x光辐照。
[0018]
优选的,所述以磷酸盐缓冲液稀释包括:以ph=7.4的磷酸盐缓冲液按照稀释倍数25~30进行稀释。
[0019]
优选的,所述第一标准给药浓度为50~100mg/kg体重。
[0020]
优选的,所述x光辐照的单次照射剂量为3~5gy。
[0021]
本发明具有如下优点:
[0022]
1)有效安全。对比现有的放射线增感剂候选物,本发明可有效增幅x光对癌细胞的杀伤效果,且对普通细胞毒性较小。
[0023]
2)药品易得。放射线活性的甲基化黄酮属于天然黄酮的甲基化产物,合成与分离简单,易于工业大规模生产。
[0024]
3)应用前景大,普适多种类型的癌症患者且治疗效果优良。
附图说明
[0025]
图1为根据本发明第一实施例的甲基化黄酮x光下的自由基产生活性的效果示意图。
[0026]
图2为根据本发明第二实施例的甲基化黄酮协调x光对癌细胞的抑制能力的效果示意图。
[0027]
图3为根据本发明第三实施例的甲基化黄酮的抗癌能力及生物兼容性评价的示意图。
[0028]
图4为根据本发明第四实施例的甲基化黄酮对小鼠黑色素瘤模型的抑制作用的效果示意图。
具体实施方式
[0029]
下面结合实例,对本发明做进一步说明。实例仅限于说明本发明,而非对本发明的限定。
[0030]
本发明采用x光由线性加速器产生(primus mid-energy,东芝)。x光吸收剂量由放射量测定器检测,离放射量1m处的吸收剂量为每分钟240.5cgy。细胞及小鼠实验均在室温下进行。
[0031]
实施例1-4在于提供一种安全且有高癌细胞抑制效果的放射线活性黄酮衍生物以及放射线活性黄酮衍生物在医药或治疗上的应用。
[0032]
其中,一种具有放射线活性的甲基化黄酮,其结构式如式i所示:
[0033][0034]
其中:3位为羟基,2’,4’,5,7位为甲氧基,5’位是一个具有聚集诱导效应的基团。
[0035]
作为优选的实施方式,放射线活性黄酮衍生物是一种具有聚集诱导效应(aggregation-induced emission,aie)结构的黄酮衍生物。
[0036]
作为优选的实施方式,具有聚集诱导效应的基团为被二苯基-氰基取代的乙烯基。
[0037]
作为优选的实施方式,放射线活性黄酮衍生物在水环境中能与放射线直接产生物理化学反应,产生氧化性自由基。
[0038]
本发明的目的还在于提供放射线活性黄酮衍生物在制备抗肿瘤药物中的应用。初步的药理实验发现其对于多种肿瘤细胞株具有一定的体外抑制增殖的作用,对一些肿瘤细胞株具有选择性抑制作用,一些具有很强的抑制活性,ic50高于0.6μm。另外对部分化合物进行细胞周期素依赖性激酶1/周期素b的抑制活性测定,部分化合物确实有抑制细胞周期
的作用,抑制ic50值表现为低微摩尔水平,表明化合物抑制肿瘤细胞生长的作用与其阻滞肿瘤细胞周期的进程有关。
[0039]
本发明的第三个目的在于提供放射线活性黄酮衍生物的应用,放射线活性黄酮衍生物用于肿瘤放疗和/或辅助放疗的用途。
[0040]
作为优选的实施方式,实施放射线活性黄酮衍生物用于肿瘤放疗和/或辅助放疗的用途包括如下步骤:
[0041]
s1,皮下注射给药,将放射线活性黄酮衍生物制备的化合物以磷酸盐缓冲液稀释后按照第一标准给药浓度给药;
[0042]
s2,向病灶部位进行x光辐照。
[0043]
作为优选的实施方式,以磷酸盐缓冲液稀释包括:以ph=7.4的磷酸盐缓冲液按照稀释倍数25~30进行稀释。
[0044]
作为优选的实施方式,第一标准给药浓度为50~100mg/kg体重。
[0045]
作为优选的实施方式,x光辐照的单次照射剂量为3~5gy。
[0046]
实施例1、甲基化黄酮的体外自由基产生活性。
[0047]
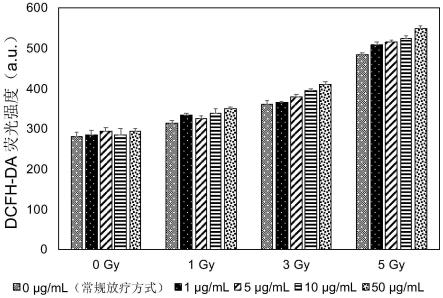
总自由基的测定采用dcfh-da荧光探针法。将dcfh-da荧光试剂溶于dmso配置成5mm的原液,工作液以pbs稀释百倍后使用。样本溶于dmso制成各种浓度原液,工作液以pbs稀释百倍后使用。两者各取100微升注入96孔平板中混合均匀,化合物在体系中的最终浓度为0、1、5、10、50μg/ml。用铅板覆盖对照部分,其余部分放x光机下直接辐照,辐射剂量为0、1、3、5gy。照射后尽快在酶标仪中读取荧光强度。激发波长取502mm,发射波长取530mm。结果详见附图1。
[0048]
结果表明,投入该化合物后水环境中的自由基水平较空白组(未投入药物,即常规放疗方式)有所提升。且当辐射剂量大于3gy,药物浓度大于1μg/ml时甲基化黄酮可显著增幅x光辐照下,水环境中的自由基水平,且其产率与其浓度及辐照浓度成正相关。
[0049]
实施例2、甲基化黄酮对黑色素瘤b16细胞系的抑制作用。
[0050]
在96孔细胞培养皿上以b16细胞1000个/孔浓度进行播种。培养24小时让细胞贴壁。加入100微升含有浓度为0、1、5、10、50微克/毫升化合物的培养基再培养24小时后,用铅板盖住对照部分,进行x光照射,辐射剂量为0、1、3、5gy。照射一小时后,用pbs洗去旧培养剂换上通常培养基。照射三天后,用试剂盒进行wst-8实验,培养时间为120分钟。结果详见附图2。
[0051]
结果表明,甲基化黄酮本身对b16细胞有一定的抑制作用,且其抑制作用与其浓度或辐照剂量成正相关。然而它能与x光协同作用,获得更好的抑制效果。充分显示了将化合物应用于癌症放疗的可能性。
[0052]
实施例3、甲基化黄酮的抗癌能力及生物兼容性评价
[0053]
将b16细胞和小鼠正常黑素细胞系melan-a以1000个/孔浓度在96孔细胞培养皿上进行播种。培养24小时让细胞贴壁。加入100微升含有浓度为5、50微克/毫升化合物的培养基再培养24小时后,用铅板盖住对照部分,进行x光照射,辐射剂量统一为5gy。照射一小时后,用pbs洗去旧培养剂换上通常培养基。照射三天后,用试剂盒进行wst-8实验,培养时间为120分钟。结果详见附图3。
[0054]
结果表明,甲基化黄酮比现有的放射线增感剂原卟啉ix拥有更高的癌细胞抑制活
性。然而原卟啉ix对正常细胞具有细胞毒性,且浓度越大毒性越大。相对,甲基化黄酮对正常细胞具有较小的毒害作用。体现出本发明的高效及高生物兼容性。
[0055]
实施例4、甲基化黄酮对小鼠肿瘤的抑制作用。
[0056]
实验鼠是由美国charles river laboratories购入的六周大c57bl/6j小鼠。小鼠被皮下注入0.1ml含有b16-bl6细胞(1.3
×
105个)而不含有胎牛血清或抗生素的培养基,以获得本实验用的小鼠黑色素瘤模型。
[0057]
被成功植入黑色素瘤的小鼠被随机分为四组,每组五只。(1)空白组,即不添加黄酮衍生物,也无x光照射;(2)仅添加黄酮衍生物;(3)仅x光辐照,即常规放疗方式;(4)添加黄酮衍生物+x光辐照。饲养三天后,第三第四组的实验鼠的肿瘤部位将每天照射3gy x光,一周五次持续两周,总计照射30gy。而第四组在被照射的24小时前在肿瘤处穿刺注射黄酮类化合物,以pbs稀释,一次投入量为50mg/kg体重。第二组与第四组以同样的方式同时用药。肿瘤体积将在实验开始后每天用卡尺测量并计算。计算公式为肿瘤体积=最小直径2
×
最大直径
×
0.5。结果详见附图4。
[0058]
结果显示,单一的甲基化黄酮或者x光处理,均不能有效抑制小鼠黑色素瘤的生长。而本发明协同x光进行小鼠肿瘤治疗,能在整个实验过程中将肿瘤尺寸维持在一个较低的水平内。充分显示了本发明在未来癌症放疗中的重要意义。
[0059]
上述实施例仅仅是为清楚的说明所作的距离,而并非对实施方式的限定。对于所述领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1