1.本发明属于光催化技术领域,具体涉及杯芳烃化合物、复合材料及其制备方法与应用。
背景技术:
2.金属-有机凝胶(mogs)是由金属中心和有机配体通过配位作用或其它超分子作用力自组装而成的一种金属凝胶材料,金属中心的引入将金属独特的电子特性、光学特性、氧化还原特性和磁性等性质与有机凝胶剂的性质结合到了一起。因此所构筑的有机-无机杂化凝胶材料mogs不仅在一定程度上克服了单个组分的缺点,而且还将金属中心和有机配体的优点整合到一起,使得其在催化、氧化还原、吸附和光电化学等方面有着独特的优势。
3.由锆作为金属中心、对苯二甲酸为配体合成的耐水锆基金属有机框架uio-66,由于其良好的稳定性已被广泛研究。然而传统的uio-66只可以吸收波长处于紫外区的光线,虽然通过调节连接配体合成了氨基化的uio-66-nh2,其光谱吸收有所改善,但是其对可见光的光谱响应仍然较弱,对太阳光的利用率较低,因而限制了其在光催化中的进一步应用。而基于uio-66-nh2的mogs也已被制备出来,并且在二氧化碳转化方面表现出了优异的催化活性。
4.构筑染料敏化体系来调整uio-66可见光捕获能力是可对基于uio-66的mogs进行光催化改性的一种有效手段。但传统的染料敏化体系中,所用的染料分子锚定位点比较单一,因此在光催化过程中染料分子容易脱落并分解。此外,大量的染料分子吸附在uio-66表面后容易发生堆叠,因而影响其光生载流子的分离。因此,选择合适结构和能带的染料分子用于改善uio-66-nh2的吸光性能用于提高光催化剂的产氢活性和稳定性是至关重要的。
5.杯芳烃是苯酚单元通过亚甲基桥连起来的一类含有洞穴的大环化合物,用于构筑染料敏化体系具有以下优点:1)杯芳烃具有丰富反应位点,容易修饰,可按需引入电子给体、桥连基团和电子受体,获得吸收谱带宽的光敏染料,且分子内可含有多个光吸收单元,通过-cooh基与uio-66-nh2中的nh2结合后,能调控半导体材料的能带结构,拓宽催化剂的光谱响应范围;2)杯芳烃具有独特的锥形构象,可减小染料分子间的聚集,增加电荷分离的时间,与uio-66-nh2复合后,电子可直接快速注入到半导体,从而可提高光电子-空穴对的分离效应;3)杯芳烃具有良好的光热稳定性,分子内可引入多个同时与-nh2结合的受体,与uio-66-nh2杂化后,可增强光催化剂的稳定性,有利于光催化过程中催化剂的循环使用。为了解决染料分子容易脱落和光催化效率不高的技术问题,需要开发一种新的杯芳烃类化合物。
技术实现要素:
6.为了克服现有技术存在的染料分子容易脱落和光催化效率不高的问题,本发明的目的之一在于提供一种杯芳烃化合物;本发明的目的之二在于提供一种复合材料;本发明的目的之三在于提供这种复合材料的制备方法;本发明的目的之四在于提供这种复合材料
的应用;本发明的目的之五在于提供一种光催化剂;本发明的目的之六在于提供一种光催化水制氢的方法。
7.为了实现上述目的,本发明所采取的技术方案是:
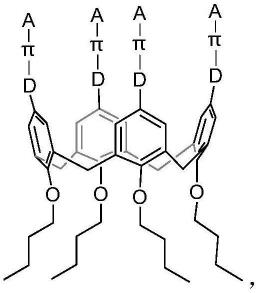
8.本发明第一方面提供一种杯芳烃化合物,其特征在于:所述杯芳烃化合物的结构如式(ⅰ)所示;
[0009][0010]
式(ⅰ)中,d为电子给体,选自π为共轭桥连体,选自选自其中n为1~3的正整数;a为电子受体,选自-cooh、
[0011][0012][0013]
优选的,所述杯芳烃选自如下所示结构的化合物;
[0014][0015]
本发明第二方面提供一种复合材料,所述复合材料包括根据本发明第一方面所述的杯芳烃化合物、金属纳米颗粒和uio-66-nh2。
[0016]
所述金属纳米颗粒包括铂纳米颗粒、钯纳米颗粒、镍纳米颗粒中的至少一种。
[0017]
优选的,所述金属纳米颗粒为铂纳米颗粒。
[0018]
优选的,所述杯芳烃化合物、金属纳米颗粒与uio-66-nh2的质量比为(0.3-10):(0.1-1):100;进一步优选的,所述杯芳烃化合物、金属纳米颗粒与uio-66-nh2的质量比为(0.5-6):(0.3-0.6):100。
[0019]
本发明第三方面提供根据本发明第二方面所述复合材料的制备方法,包括以下步骤:
[0020]
将2-氨基对苯二甲酸、锆盐、杯芳烃化合物、金属纳米颗粒和溶剂混合,进行溶剂热反应,得到所述的复合材料。
[0021]
优选的,所述2-氨基对苯二甲酸与锆盐的质量比为1:(0.6-2)。
[0022]
优选的,所述纳米颗粒为纳米颗粒溶液。
[0023]
优选的,所述溶剂包括n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙醇中的至少一种;进一步优选的,所述溶剂为乙醇。
[0024]
优选的,所述溶剂热反应的温度为70℃-100℃;进一步优选的,所述溶剂热反应的温度为70℃-90℃。
[0025]
优选的,所述溶剂热反应的时间为18h-30h;进一步优选的,所述溶剂热反应的时
间为22h-26h。
[0026]
优选的,所述锆盐包括氯化锆、硫酸锆、乙酸锆中的至少一种。
[0027]
本发明第四方面提供根据本发明第二方面所述复合材料在光催化反应中的应用。
[0028]
优选的,所述光催化反应为光催化水制氢反应。
[0029]
本发明第五方面提供一种光催化剂,所述光催化剂包括根据本发明第二方面所述的复合材料。
[0030]
本发明第六方面提供一种光催化水制氢的方法,使用根据本发明第五方面所述的光催化剂催化水制氢。
[0031]
优选的,所述光催化水制氢的方法中,光催化剂与水的质量比为1:(20-200)。
[0032]
本发明的有益效果是:
[0033]
本发明公开了一种杯芳烃化合物,该杯芳烃化合物结构新颖,具有给电子体-共轭桥连体-吸电子体组成的基团,将其与uio-66-nh2和金属纳米颗粒制备的复合材料具有优异的光催化效果,该复合材料可广泛应用于光催化制氢中。
附图说明
[0034]
图1为化合物bft-1cooh的核磁氢谱图。
[0035]
图2为化合物bft-1cooh的核磁碳谱图。
[0036]
图3为化合物bft-2cooh的核磁氢谱图。
[0037]
图4为化合物bft-2cooh的核磁碳谱图。
[0038]
图5为化合物bft-cncooh的核磁氢谱图。
[0039]
图6为化合物bft-cncooh的核磁碳谱图。
[0040]
图7为制备复合材料的反应实物图。
[0041]
图8为实施例杯芳烃化合物与uio-66-nh2结合示意图。
[0042]
图9为实施例1-3制备的复合材料x射线粉末衍射图。
[0043]
图10为实施例1-3制备的复合材料低温氮气吸附-脱附曲线图和孔径分布图。
[0044]
图11为复合材料1.5%bft-cncooh-pt@mog sem图。
[0045]
图12为实施例1-3制备的复合材料红外光谱图。
[0046]
图13为实施例1-3制备的复合材料紫外光谱图。
[0047]
图14为bft-1cooh-pt@mog和pt@mog xps测试图。
[0048]
图15为实施例1-3制备的复合材料产氢测试图。
[0049]
图16为二茂铁和杯芳烃化合物在四氢呋喃溶液中的循环伏安曲线图。
[0050]
图17为杯芳烃化合物的紫外-可见吸收光谱和荧光发射光谱。
[0051]
图18为复合材料的荧光发射光谱图。
[0052]
图19为杯芳烃化合物和mog-uio-66-nh2的能级匹配图。
具体实施方式
[0053]
为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。以下结合实例对本发明的具体实施作进一步说
明,需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
[0054]
实施例1
[0055]
本例杯芳烃化合物的制备路线图如下:
[0056][0057]
具体制备步骤如下:
[0058]
化合物3a的合成:将咔唑(1.67g,10mmol)溶于12ml的dmf溶液中,冰浴搅拌30min后加入n-溴代琥珀酰亚胺nbs(3.73g,22mmol),让其自然恢复至室温后继续搅拌过夜。反应
improved performance using cone-calix[4]arene based dyes.chemsuschem,2015,8(2):280-287)报道合成了c4,然后氮气保护下将c4(0.60g,0.62mmol),化合物3d(1.40g,4.80mmol)和pd(pph3)4(0.14g,0.12mmol)加入反应瓶中,后加入浓度为2mol/l的k2co3水溶液6.6ml和乙二醇二甲醚45ml,加热至90℃搅拌过夜。反应完成后,旋去溶剂,加入二氯甲烷和水萃取,分出有机层,以石油醚和二氯甲烷(3:1,v/v)为洗脱剂经硅胶柱层析纯化得到0.12g的化合物c4kz,产率为11.4%。化合物c4kz核磁数据为1h nmr(400mhz,thf-d8)δ7.73(s,1h),7.61(s,1h),7.51(dd,j=8.4,1.8hz,1h),7.48
–
7.41(m,1h),7.26(s,2h),7.10(dd,j=7.0,4.2hz,2h),6.94(d,j=3.5hz,1h),6.82(dd,j=5.1,3.5hz,1h),6.72(d,j=8.5hz,1h),4.74(d,j=12.8hz,1h),4.13(t,j=7.3hz,2h),3.46(d,j=12.9hz,1h),3.26(s,3h),2.18(m,j=7.4hz,2h),1.69(m,j=7.6hz,2h),1.18(t,j=7.4hz,3h).
13
c nmr(101mhz,thf-d8)δ155.34,145.76,140.06,136.73,135.07,133.11,127.59,127.36,124.74,124.70,123.10,122.98,122.68,122.58,120.95,118.00,117.09,108.04,107.84,75.00,32.60,30.86,27.76,19.54,13.69.acpi-ms:m/z 1694.6749([m+h]
+
),理论值:m/z 1694.6739([m+h]
+
)。反应式如下;
[0067][0068]
c4kz-sf-br的合成:将化合物c4kz(0.10g,0.06mmol)溶于20ml的dmf溶液中,冰浴搅拌30min后分批加入nbs(42.70mg,0.24mmol),让其自然恢复至室温后继续搅拌过夜。反应完成后,将反应液倒入水中,加入二氯甲烷萃取分出有机相,以石油醚和二氯甲烷(4:1,v/v)为洗脱剂经硅胶柱层析纯化得到0.10g的化合物c4kz-sf-br,产率为85%。化合物c4kz-sf-br核磁数据为1h nmr(400mhz,thf-d8)δ7.69
–
7.51(m,1h),7.42(s,1h),7.33(s,1h),7.26(d,j=8.3hz,3h),7.01(d,j=8.4hz,1h),6.83(d,j=11.6hz,1h),6.72(d,j=3.8hz,1h),6.38(d,j=3.7hz,1h),4.74(d,j=12.8hz,1h),4.12(d,j=7.5hz,2h),3.46(d,j=12.9hz,1h),3.31(s,3h),2.19(m,j=7.6hz,2h),1.69(m,j=7.6hz,2h),1.18(t,j=7.4hz,3h).
13
c nmr(101mhz,thf-d8)δ147.37,140.49,140.02,136.81,133.43,130.35,127.76,124.73,123.54,122.71,122.64,122.47,120.77,118.20,116.62,108.03,107.87,75.07,32.62,30.72,27.82,19.53,13.70.maldi-tof:m/z 2008.2987([m]
+
),理论值:m/z 2008.3007([m]
+
)。
[0069]
反应式如下;
[0070][0071]
c4kz-sf-coome的合成:氮气保护下将化合物c4kz-sf-br(0.50g,0.25mmol),对甲氧羰基苯硼酸(0.36g,2.0mmol)和pd(pph3)4(0.043g,0.038mmol)加入反应瓶中,后加入浓度为2mol/l的k2co3水溶液3ml和乙二醇二甲醚25ml,加热至90℃搅拌过夜。反应完成后,旋去溶剂,加入二氯甲烷和水萃取,分出有机层,以石油醚和二氯甲烷(2:1,v/v)为洗脱剂经硅胶柱层析纯化得到0.5g的化合物c4kz-sf-coome,产率为76%。化合物c4kz-sf-coome核磁数据为1h nmr(400mhz,thf-d8)δ7.96(d,j=8.0hz,2h),7.54(d,j=8.1hz,4h),7.44
–
7.17(m,4h),7.11(s,1h),6.91(s,1h),6.70(m,2h),4.75(d,j=12.8hz,1h),4.13(s,2h),3.88(s,1h),3.47(d,j=12.9hz,1h),3.17(s,3h),2.19(m,j=7.7,7.2hz,2h),1.70(m,j=7.6hz,2h),1.18(t,j=7.4hz,3h).
13
c nmr(151mhz,thf-d8)δ165.68,146.72,140.58,140.15,139.59,139.23,138.68,129.88,128.17,127.81,125.22,124.24,122.83,122.58,121.90,116.79,75.07,51.03,32.62,30.82,27.75,19.54,13.69.maldi-tof:m/z 2229.8132([m]
+
),理论值:m/z 2229.8132([m]
+
)。反应式如下;
[0072][0073]
bft-1cooh的合成:将化合物c4kz-sf-coome(0.10g,0.045mmol)溶于10ml的thf溶液中,加入10ml的乙醇,5ml的水和naoh(0.036g,0.90mmol)后加热回流12h。反应完后,冷却至室温,加入浓盐酸调节ph值至酸性,有大量固体析出,抽滤并用水和乙醇多次洗涤得到0.084g化合物bft-1cooh,产率86%。化合物bft-1cooh核磁数据为:1h nmr(400mhz,dmf-d7)δ8.29
–
8.16(m,3h),8.02(s,1h),7.88(d,j=8.2hz,2h),7.74
–
7.60(m,2h),7.58
–
7.50(m,3h),7.37(d,j=8.5hz,1h),7.17(d,j=3.7hz,1h),7.11
–
7.01(m,1h),4.91(d,j=12.8hz,1h),4.30(t,j=7.3hz,2h),3.74(d,j=13.1hz,1h),3.54(s,3h),2.34(m,j=7.3hz,2h),1.99
–
1.72(m,2h),1.33(t,j=7.4hz,3h).
13
c nmr(151mhz,dmf-d7)δ167.35,155.80,146.74,140.91,140.34,139.87,138.49,136.60,135.50,133.25,130.52,129.70,127.82,126.17,124.87,124.43,123.37,123.03,122.93,118.49,117.23,108.99,108.79,75.31,32.75,31.03,28.49,19.68,14.06.maldi-tof:m/z 2173.7455([m]
+
),理论值:m/z 2173.7506([m]
+
)。图1为化合物bft-1cooh的核磁氢谱图。图2为化合物bft-1cooh的核磁碳谱图。反应式如下;
[0074][0075]
实施例2
[0076]
本例杯芳烃化合物的制备路线如下;
[0077][0078]
具体制备步骤如下:
[0079]
c4kz-2sf的合成:保护下将化合物c4kz-sf-br(0.50g,0.25mmol),2-噻吩硼酸(0.25g,2.0mmol)和pd(pph3)4(0.043g,0.038mmol)加入反应瓶中,后加入浓度为2mol/l的k2co3水溶液3ml和乙二醇二甲醚25ml,加热至90℃搅拌过夜。反应完成后,旋去溶剂,加入二氯甲烷和水萃取,分出有机层,以石油醚和二氯甲烷(2:1,v/v)为洗脱剂经硅胶柱层析纯化得到0.41g的c4kz-2sf,产率82%。化合物c4kz-2sf的核磁数据为1h nmr(400mhz,thf-d8)δ7.70
–
7.39(m,3h),7.30(dt,j=12.8,8.0hz,4h),7.08(d,j=3.6hz,1h),7.01(dd,j=5.1,3.6hz,1h),6.93(d,j=7.8hz,1h),6.82(t,j=10.7hz,2h),6.58(s,1h),4.75(d,j=12.7hz,1h),4.13(t,j=7.4hz,2h),3.47(d,j=12.8hz,1h),3.18(s,3h),2.19(m,j=7.6hz,2h),1.70(m,j=7.6hz,2h),1.18(t,j=7.4hz,3h).
13
c nmr(101mhz,thf-d8)δ144.60,140.42,140.03,137.82,136.92,134.17,133.35,127.80,127.55,124.62,124.00,123.91,123.47,122.77,122.73,122.53,121.22,118.26,116.61,108.04,107.79,75.06,
32.62,30.79,27.71,19.55,13.71.maldi-tof:m/z 2021.6132([m]
+
),理论值:m/z 2021.6170([m]
+
)。反应式如下;
[0080][0081]
c4kz-2sf-br的合成:将化合物c4kz-2sf(0.10g,0.050mmol)溶于20ml的dmf溶液中,冰浴搅拌30min后分批加入nbs(35.6mg,0.20mmol),让其自然恢复至室温后继续搅拌过夜。反应完成后,将反应液倒入水中,加入二氯甲烷萃取分出有机相,以石油醚和二氯甲烷(3:1,v/v)为洗脱剂经硅胶柱层析纯化得到0.1g的化合物c4kz-2sf-br,产率86%。化合物c4kz-2sf-br核磁数据为1h nmr(400mhz,thf-d8)δ7.81
–
7.36(m,3h),7.36
–
7.15(m,3h),7.02(d,j=3.8hz,1h),6.94(s,1h),6.85
–
6.68(m,3h),6.56(s,1h),4.75(d,j=12.7hz,1h),4.12(s,2h),3.46(d,j=12.9hz,1h),3.21(s,3h),2.20(m,j=7.2hz,2h),1.70(m,j=7.7hz,2h),1.18(t,j=7.4hz,3h).
13
c nmr(151mhz,thf-d8)δ145.25,140.49,140.03,139.62,136.83,133.45,132.85,130.84,127.78,124.38,123.81,122.78,122.69,121.29,118.24,116.67,109.34,107.84,75.06,32.62,30.79,27.75,19.54,13.69.maldi-tof:m/z 2336.2538([m]
+
),理论值:m/z 2336.2516([m]
+
)。反应式如下:
[0082][0083]
c4kz-2sf-coome的合成:氮气保护下将化合物c4kz-2sf-br(0.50g,0.21mmol),对甲氧羰基苯硼酸(0.36g,2.0mmol)和pd(pph3)4(0.043g,0.038mmol)加入反应瓶中,后加入浓度为2mol/l的k2co3水溶液3ml和乙二醇二甲醚25ml,加热至90℃搅拌过夜。反应完成后,旋去溶剂,加入二氯甲烷和水萃取,分出有机层,以石油醚和二氯甲烷(1:2,v/v)为洗脱剂经硅胶柱层析纯化得到0.4g的c4kz-2sf-coome,产率76%。1h nmr(400mhz,thf-d8)δ7.97(d,j=7.9hz,2h),7.62(d,j=8.0hz,4h),7.49
–
7.05(m,5h),6.85(d,j=54.2hz,5h),4.75(d,j=12.8hz,1h),4.12(s,2h),3.88(s,3h),3.47(d,j=12.9hz,1h),3.22(s,3h),2.18(m,2h),1.73
–
1.62(m,2h),1.17(t,j=7.4hz,3h).
13
c nmr(101mhz,thf-d8)δ165.62,145.08,140.46,140.16,138.70,138.18,136.77,133.76,133.42,129.98,128.58,127.71,125.50,124.56,124.06,123.65,121.50,118.34,118.21,116.53,108.02,107.98,75.05,51.12,32.61,30.81,27.79,19.54,13.70.maldi-tof:m/z 2558.7658([m]
+
),理论值:m/z 2558.7675([m]
+
)。
[0084]
反应式如下:
[0085][0086]
bft-2cooh的合成:将化合物c4kz-2sf-coome(0.10g,0.04mmol)溶于10ml的thf溶液中,加入10ml的乙醇,5ml的水和naoh(0.036g,0.90mmol)后加热回流12h。反应完后,冷却至室温,加入浓盐酸调节ph值至酸性,有大量固体析出,抽滤并用水和乙醇洗涤得到0.085g的bft-2cooh,产率85%。1h nmr(600mhz,dmf-d7)δ13.34(s,1h),8.06(d,j=9.1hz,2h),7.93
–
7.63(m,4h),7.55
–
7.46(m,1h),7.34(d,j=23.8hz,4h),7.11(s,1h),7.07
–
6.65(m,4h),4.70(d,j=12.3hz,1h),4.19
–
3.98(m,2h),3.63
–
3.49(m,1h),3.37
–
3.20(m,3h),2.13(m,j=7.3hz,2h),1.65(m,j=7.6hz,2h),1.13(t,j=7.4hz,3h).
13
c nmr(101mhz,dmf-d7)δ167.12,145.12,140.57,140.41,140.10,138.34,137.86,136.41,133.94,133.04,130.45,129.80,127.62,126.20,125.19,124.96,124.45,124.18,123.20,122.74,122.43,118.34,116.83,108.80,108.57,75.11,32.57,30.84,28.25,19.50,13.89.maldi-tof:m/z2501.7043([m]
+
),理论值:m/z 2501.7015([m]
+
)。图3为化合物bft-2cooh的核磁氢谱图。图4为化合物bft-2cooh的核磁碳谱图。反应式如下:
[0087][0088]
实施例3
[0089]
本例杯芳烃化合物的制备路线如下:
[0090][0091]
具体制备步骤如下:
[0092]
c4kz-sf-cho的合成:氮气保护下将化合物c4kz-sf-br(0.50g,0.25mmol),4-甲酰基苯硼酸(0.30g,2.0mmol)和pd(pph3)4(0.043g,0.038mmol)加入反应瓶中,后加入浓度为2mol/l的k2co3水溶液3ml和乙二醇二甲醚25ml,加热至90℃搅拌过夜。反应完成后,旋去溶剂,加入二氯甲烷和水萃取,分出有机层,经硅胶柱层析纯化得到0.38g的化合物c4kz-sf-cho,产率为62%。化合物c4kz-sf-cho的核磁数据为1h nmr(400mhz,thf-d8)δ9.92(s,1h),7.82(d,j=7.9hz,2h),7.61(d,j=7.9hz,4h),7.47
–
7.05(m,5h),6.94(s,1h),6.86
–
6.54(m,2h),4.76(d,j=12.8hz,1h),4.13(s,2h),3.48(d,j=12.9hz,1h),3.20(s,3h),2.19(m,j=7.6hz,2h),1.72
–
1.63(m,2h),1.18(t,j=7.4hz,3h).
13
c nmr(101mhz,thf-d8)δ190.06,147.23,140.61,140.09,139.77,139.04,136.77,135.06,133.53,129.90,127.77,125.76,124.71,123.97,122.85,122.77,122.61,122.07,118.24,116.82,108.12,107.93,75.08,32.62,30.82,27.75,19.54,13.70.maldi-tof:m/z 2109.7644([m]
+
),理论值:m/z 2109.7710([m]
+
)。反应式如下:
[0093][0094]
bft-cncooh的合成:氮气保护下将化合物c4kz-sf-cho(0.10g,0.047mmol),氰基乙酸叔丁酯(0.053g,0.38mmol)和两滴哌啶加入反应瓶中,后加入乙腈15ml和甲苯10ml,加热回流反应12h。反应完成后,旋去溶剂,用甲醇洗涤所得固体,抽滤得到c4kz-sf-cncoobu的粗产品,未经纯化直接用于后面的反应。反应式如下:
[0095][0096]
将化合物c4kz-sf-cncoobu(0.10g,0.038mmol)溶于2.5ml的二氯甲烷和2.5ml的三氟乙酸溶液中,室温搅拌过夜。反应完后,有大量固体析出,离心并用二氯甲烷和甲醇洗涤,经硅胶柱层析纯化得到0.046g的化合物bft-cncooh,产率50%。化合物bft-cncooh核磁数据为1h nmr(400mhz,dmf-d7)δ8.42(s,1h),8.25
–
8.16(m,3h),8.01(d,j=16.8hz,1h),7.82(d,j=8.1hz,2h),7.60(d,j=8.7hz,3h),7.50(s,2h),7.23(s,2h),7.02(s,1h),4.88(d,j=12.8hz,1h),4.27(d,j=7.2hz,2h),3.71(d,j=12.9hz,1h),3.50(s,3h),2.32(m,j=7.4hz,2h),1.84(m,j=7.5hz,2h),1.32(t,j=7.4hz,3h).
13
c nmr(151mhz,dmf-d7)δ163.92,155.79,153.47,147.55,140.89,140.31,139.44,138.79,136.64,133.34,131.97,130.18,127.86,126.94,125.17,124.98,124.28,123.17,122.94,122.88,118.49,117.28,116.83,108.92,108.78,102.33,75.29,32.76,30.97,28.47,19.68,14.06.maldi-tof:m/z 2377.7954([m]
+
),理论值:m/z 2377.7942([m]
+
)。图5为化合物bft-cncooh的核磁氢谱图。图6为化合物bft-cncooh的核磁碳谱图。反应式如下;
[0097][0098]
性能测试
[0099]
1.复合材料的制备
[0100]
所制备的复合材料名称为x%bft-pt@mog-uio-66-nh2,其中的x%表示uio-66-nh2类mog复合材料中杯芳烃染料的质量分数为x%。为简化名称,以下将bft-pt@mog-uio-66-nh2记做bft-pt@mog。
[0101]
pt@mog的制备:称取2-氨基对苯二甲酸(0.11g,0.60mmol)溶于1ml的dmf中,氯化锆(0.14g,0.60mmol)溶于2ml的乙醇中,将两种溶液迅速混合,后加入1.62ml的铂纳米颗粒溶液。将得到的均匀溶液置于密闭反应容器内,80℃下反应24h。随后将得到的湿凝胶,分别用dmf和乙醇进行三次溶剂交换,每次12h。溶剂交换后,将得到的湿凝胶真空干燥得到pt@mog。
[0102]
复合材料x%bft-pt@mog的制备:称取2-氨基对苯二甲酸(0.11g,0.6mmol)和计算量(0.5wt%/1.5wt%/2.5wt%/4.5wt%)实施例3制备的杯芳烃染料bft-cncooh溶于1ml的dmf中,氯化锆(0.14g,0.60mmol)溶于2ml的乙醇中,将两种溶液迅速混合,后加入1.62ml的铂纳米颗粒(0.5mg/ml)溶液。将得到的均匀溶液置于密闭反应容器内,80℃下反应24h。随
后将得到的湿凝胶,分别用dmf和乙醇进行三次溶剂交换,每次12h。溶剂交换后,将得到的湿凝胶真空干燥得到x%bft-cncooh-pt@mog。按照相同的方法,可以制备得到复合材料1.5%bft-1cooh-pt@mog和1.5%bft-2cooh-pt@mog。
[0103]
图7为制备复合材料的反应实物图。其中,图7(a)为水热反应前的实物图;图7(b)、图7(c)和图7(d)均为1.5%bft-cncooh-pt@mog的实物图。
[0104]
图8为实施例杯芳烃化合物与uio-66-nh2结合示意图。
[0105]
2.复合材料结构表征及性质测试
[0106]
在合成了复合材料以后,为了确认其结构,对其进行了pxrd测试,图9为实施例1-3制备的复合材料x射线粉末衍射图。simulated uio-66表示模拟的uio-66数据,mog-uio-66-nh2表示未混合杯芳烃化合物的uio-66-nh2。
[0107]
为了测试制备的复合材料比表面积和孔径,对其进行了低温氮气吸附-脱附测试,图10为实施例1-3制备的复合材料低温氮气吸附-脱附曲线图和孔径分布图。其中,图10(a)为氮气吸附-脱附曲线图,图10(b)为孔径分布图。表1为测试的实施例1-3制备的复合材料的bet比表面积、孔尺寸和孔体积。
[0108]
表1实施例1-3制备的复合材料的bet比表面积、孔尺寸和孔体积
[0109][0110]
将实施例1-3制备的复合材料进行表面电镜观察,图11为复合材料1.5%bft-1cooh-pt@mog sem图。其中,图11(a)为小倍率sem图,图11(b)为大倍率sem图。
[0111]
将实施例1-3制备的复合材料进行红外光谱测试,图12为实施例1-3制备的复合材料红外光谱图。其中,图12(a)为1.5%bft-1cooh-pt@mog红外光谱图;图12(b)为1.5%bft-2cooh-pt@mog红外光谱图;图12(c)为1.5%bft-cncooh-pt@mog红外光谱图,小方框均为局部放大图。
[0112]
将实施例1-3制备的复合材料进行紫外光谱测试,图13为实施例1-3制备的复合材料紫外光谱图。其中,图13(a)为固体紫外-可见吸收光谱图;图13(b)为不同染料含量的bft-cncooh-pt@mog固体紫外-可见吸收光谱图;图13(c)为mog-uio-66-nh2的tauc plot曲线。
[0113]
将复合材料bft-1cooh-pt@mog进行xps测试,图14为bft-1cooh-pt@mog和pt@mog xps测试图。
[0114]
5.光催化制氢性能测试
[0115]
称取4mg的复合材料置于40ml的石英样品瓶中,加入20ml的乙腈,0.2ml的水和0.4ml的三乙胺,用中间留有圆孔并带有硅胶垫片的瓶盖密封。随后在搅拌下通氮气30min,
除去反应瓶内的空气。光催化制氢时,使用氙灯(300w,λ》420nm)作为光源,每隔一小时进行一次样品采集。样品采集时,取100μl的顶空气体,通过气相色谱tcd检测器进行检测和定量分析。
[0116]
图15为实施例1-3制备的复合材料产氢测试图。其中,图15(a)为实施例1-3制备的三种复合材料产氢测试图;图15(b)为不同浓度bft-cncooh-pt@mog产氢测试图;图15(c)为2.5%bft-cncooh-pt@mog稳定性测试图。mog-uio-66-nh2均有着较宽的带隙,对可见光吸收能力较弱,因此在光催化制氢过程中负载的杯芳烃染料起到了重要的光敏作用。
[0117]
为了探索不同杯芳烃染料对mog复合材料光催化制氢的影响,在合成mog的过程中分别添加了相同含量不同结构的杯芳烃染料分子,随后测试了相应复合材料的在可见光照射下(λ》420nm)的光催化制氢性能,结果如图15(a)所示。bft-cncooh复合材料表现出最高的光催化制氢性能(168μmol g-1
h-1
),其次为bft-2cooh复合材料(48μmol g-1
h-1
),而bft-1cooh复合材料光催化制氢性能最低(24μmol g-1
h-1
)。随后测试了在负载不同含量的bft-cncooh以后,相应mog复合材料在可见光照射下(λ》420nm)的光催化制氢性能。如图15(b)所示,在含量较高时,染料含量越高,其光催化活性越高,当含量为2.5%时,性能最佳(401μmol g-1
h-1
)。但是当染料含量过多时,其光催化活性反而降低。这可能是因为,当染料含量过高时染料分子之间发生聚集,激发态电子易发生复合,不利于电子向外传输,因此使得光催化活性降低。进一步测试了bft-cncooh敏化mog的复合材料的光催化稳定性,结果如图15(c)所示。在可见光照射下,四次循环测试中,2.5%bft-cncooh-pt@mog均保持着较高的光催化活性,说明杯芳烃染料可稳定包裹于mog中,并且有着较好的光稳定性。依据复合材料中pt的含量,进而得到复合材料相对于pt的光催化产氢ton值为ton pt
=3240。
[0118]
图16为二茂铁和杯芳烃化合物在四氢呋喃溶液中的循环伏安曲线图。其中,图16(a)为二茂铁在四氢呋喃溶液中的循环伏安曲线图;图16(b)为bft-1cooh在四氢呋喃溶液中的循环伏安曲线图;图16(c)为bft-2cooh在四氢呋喃溶液中的循环伏安曲线图;图16(d)为bft-cncooh在四氢呋喃溶液中的循环伏安曲线(0.1mol/l的四丁基六氟磷酸铵)。
[0119]
图17为杯芳烃化合物的紫外-可见吸收光谱和荧光发射光谱。其中,图17(a)为bft-1cooh的紫外-可见吸收光谱和荧光发射光谱;图17(b)为bft-2cooh的紫外-可见吸收光谱和荧光发射光谱;图17(c)为bft-cncooh的紫外-可见吸收光谱和荧光发射光谱。
[0120]
图18为复合材料的荧光发射光谱图。其中图18(a)为bft-1cooh-pt@mog和bft-1cooh的荧光发射光谱图;图18(b)为bft-2cooh和bft-2cooh-pt@mog的荧光发射光谱图;图18(c)为bft-cncooh和bft-cncooh-pt@mog的荧光发射光谱。
[0121]
图19为杯芳烃化合物和mog-uio-66-nh2的能级匹配图。其中a为bft-1cooh和mog-uio-66-nh2的能级匹配图;b为bft-2cooh和mog-uio-66-nh2的能级匹配图;c为bft-cncooh的能级匹配图,最后的为mog-uio-66-nh2的能级匹配图。
[0122]
鉴于杯芳烃结构的巨大优势,本实施例以杯芳烃为基本骨架,在其结构上引入具有强供电子能力的咔唑基团,以噻吩作为电子传输单元,以羧基或氰基乙酸作为电子受体,合成了三种具有d-π-a结构的杯芳烃染料分子bft-1cooh、bft-2cooh、和bft-cncooh。通过简单的溶胶凝胶方法,在pt@mog-uio-66-nh2的制备过程中,添加了三种杯芳烃染料,在反应中染料中的-cooh基既可以与mog中的-nh2形成多重氢键,又可以与金属节点锆配位,从而获得了体相敏化的杂化材料bft-1cooh/pt@mog,bft-2cooh/pt@mog和bft-cncooh/pt@
mog。本实施例测试了杯芳烃染料不同的分子结构对复合材料电子结构与光催化性能的影响,探索了复合材料中电子转移机制和光催化机理,同时也探究了基于mog光催化体系在光解水产氢中的差异及其内在影响因素。
[0123]
本实施例的复合材料以杯芳烃结合uio-66-nh2为基底,通过与氨基形成氢键和与节点锆配位的方式,三种染料分子掺杂到了pt@mog的体相中,并分别做成了复合材料。在mog-uio-66-nh2体系中,杯芳烃染料分子存在于mog的体相中,不仅与mog之间存在氢键作用,而且还参与了其构筑。因此,在mog体系中,染料分子对可见光的利用率就成为影响其光催化活性的主要因素,其中bft-cncooh-pt@mog有着最好的可见光利用率,获得了最高的产氢速率。另外,杯芳烃染料由于其独特的锥型构象,可以降低染料分子之间的堆积而引起的电荷复合效应,并且在掺杂到pt@mog后,可以实现激发态电子的快速分离。
[0124]
上述实例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:刘军民 李鑫奥 雷洋 刘勇 于肖 黄剑锋
- 技术所有人:中山大学
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....