猪圆环病毒Taqman多重荧光定量PCR检测方法
猪圆环病毒taqman多重荧光定量pcr检测方法
发明领域:
1.本技术属于分子生物学检测技术领域,具体地,本技术提供了一种猪圆环病毒taqman多重荧光定量pcr检测方法及其相应检测试剂盒。
背景技术:
2.猪圆环病毒(porcine circovirus,pcv)为圆环病毒科圆环病毒属的无囊膜单股闭合环状dna病毒,病毒粒子呈正二十面体对称结构,直径约17-22nm,全基因组大小约1.7-2.0kb,是目前已知最小的动物病毒之一。猪圆环病毒根据其核苷酸同源性的差异又细分为四种基因型,即猪圆环病毒1型(pcv1)、猪圆环病毒2型(pcv2)、猪圆环病毒3型(pcv3)、猪圆环病毒4型(pcv4)。pcv1最早被发现在1974年,最初被认定是一种pk15猪肾细胞系污染物,但无致病性;pcv2、pcv3分别在1991年和2016年被分离鉴定,均对猪极为易感,临床上常引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,pmws)、猪皮炎肾病综合征(porcine dermatitis and nephropathy syndrome,pdns)、猪呼吸道疾病综合征(porcine respiratory disease complex,prdc)、猪增生性坏死性肺炎(proliferative and necrotizing pneumonia,pnp)。这些疾病统称为猪圆环病毒病(porcine circovirus disease,pcvd)或猪圆环病毒相关疾病(porcine circovirus associated disease,pcvad);pcv4在我国于2019年在湖南省首次发现,其致病性尚不明确。猪圆环病毒通常引起机体严重的免疫抑制,临床上多呈现多种病原混合感染,对养猪业危害巨大,因此在防治过程中对于该病毒的鉴别诊断尤为重要。
3.猪只感染不同基因型的猪圆环病毒均有较为相似的临床症状和病理变化,且通常为多种病原混合感染,单纯依靠临床诊断和病理切片很难做出准确判断。因此实验室内分子水平的诊断结果通常被作为金标准进行进一步确诊,即通过分子生物学方法检测病原和通过血清学方法检测血清中和抗体。分子生物学方法主要包括:聚合酶链式反应(polymerase chain reaction,pcr)和原位核酸杂交试验(ish);血清学方法主要包括:酶联免疫吸附试验(elisa)、间接免疫荧光试验(ifa)、免疫组织化学检测(ihc)、免疫过氧化物酶单层试验(ipma)、琼扩试验和胶体金免疫层析检测等。虽然上述方法众多,但目前运用最广泛且研究最多的方法仍为pcr和elisa方法。现有技术中已经有多种pcv1-3的pcr检测方法。
4.pcv1-3,特别是pcv2、3的体外诊断技术的研究虽已相对成熟,但关于猪圆环病毒属全部成员,即同时检测pcv1-4型的体外诊断方法却鲜有报道。建立快速有效的pcv1-4型的taqman多重实时荧光定量pcr方法,可以高效、快速检测猪群中早期感染者和隐性带毒者,为掌握pcv流行情况以及后续pcv的防控净化提供帮助,具有重大意义。
技术实现要素:
5.针对以上情况,一方面,本技术提供了一种非诊断用途的猪圆环病毒taqman多重荧光定量pcr检测方法,所述方法包括使用以下引物进行taqman多重荧光定量pcr:序列为
seq id no.1的pcv1-f、序列为seq id no.4的pcv2-f、序列为seq id no.7的pcv3-f、序列为seq id no.10的pcv4-f、序列为seq id no.2的pcv1-r、序列为seq id no.5的pcv2-r、序列为seq id no.8的pcv3-r、序列为seq id no.11的pcv4-r。
6.进一步地,所述taqman多重荧光定量pcr中还使用以下探针:序列为seq id no.3的pcv1-probe、序列为seq id no.6的pcv2-probe、序列为seq id no.9的pcv3-probe、序列为seq id no.12的pcv4-probe。
7.进一步地,所述探针5’和3’端分别标记有以下荧光基团:pcv1-probe:cy5和bhq-2、pcv2-probe:fam和bhq-2、pcv3-probe:hex-bhq1、pcv4-probe:rox和bhq-2。
8.进一步地,所述taqman多重荧光定量pcr反应体系为20μ:2x t5 fast qpcr mix 10μl、10μm pcv1、3、4上游引物各0.1μl、10μm pcv1、3、4下游引物各0.1μl、10μm pcv2上游引物0.3μl、10μm pcv2下游引物0.3μl、10μm探针各0.02μl、模板dna 0.5μl、ddh2o 8.22μl。
9.进一步地,所述taqman多重荧光定量pcr反应程序为:95℃5min;95℃10s,61℃50s,共30个循环。
10.另一方面,本技术提供了猪圆环病毒taqman多重荧光定量pcr试剂盒,其包括以下引物:序列为seq id no.1的pcv1-f、序列为seq id no.4的pcv2-f、序列为seq id no.7的pcv3-f、序列为seq id no.10的pcv4-f、序列为seq id no.2的pcv1-r、序列为seq id no.5的pcv2-r、序列为seq id no.8的pcv3-r、序列为seq id no.11的pcv4-r。
11.进一步地,所述试剂盒还包括以下探针:序列为seq id no.3的pcv1-probe、序列为seq id no.6的pcv2-probe、序列为seq id no.9的pcv3-probe、序列为seq id no.12的pcv4-probe。
12.进一步地,所述探针5’和3’端分别标记有以下荧光基团:pcv1-probe:cy5和bhq-2、pcv2-probe:fam和bhq-2、pcv3-probe:hex-bhq1、pcv4-probe:rox和bhq-2。
13.进一步地,所述试剂盒中还包含t5 fast qpcr mix。
14.进一步地,本技术还提供了以下引物和探针在制备检测猪圆环病毒的taqman多重荧光定量pcr试剂盒中的应用,其中引物和探针为:序列为seq id no.1的pcv1-f、序列为seq id no.4的pcv2-f、序列为seq id no.7的pcv3-f、序列为seq id no.10的pcv4-f、序列为seq id no.2的pcv1-r、序列为seq id no.5的pcv2-r、序列为seq id no.8的pcv3-r、序列为seq id no.11的pcv4-r;序列为seq id no.3的pcv1-probe、序列为seq id no.6的pcv2-probe、序列为seq id no.9的pcv3-probe、序列为seq id no.12的pcv4-probe;所述探针5’和3’端分别标记有以下荧光基团:pcv1-probe:cy5和bhq-2、pcv2-probe:fam和bhq-2、pcv3-probe:hex-bhq1、pcv4-probe:rox和bhq-2。
15.本技术所述的非诊断用途包括但不限于环境检测、饲料检测、食品检测、流行病学调查等。可使用的样品包括但不限于水、环境取样拭子、粪便、饲料产品、不同加工程度的食品等。
16.本技术的方法和试剂盒中的试剂种类、反应体系、反应参数并不局限于发明内容和实施例部分所展示的,本领域技术人员可以根据市售产品的性能和用途以及本领域常规知识和获得适合的试剂种类、反应体系、反应参数。
17.有益效果:
18.本技术的方法和试剂盒检测对象涵盖了pcv-1至pcv-4的全部猪圆环病毒,在一个
4重taqman多重荧光定量pcr中一次性完成检测,且具有良好的灵敏度和特异性。
附图说明
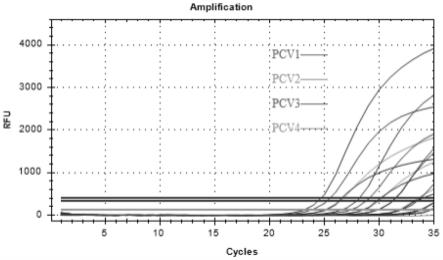
19.图1为107–
103copies/μl浓度梯度阳性标准品多重实时荧光定量pcr扩增曲线。
20.图2为107–
103copies/μl浓度梯度阳性标准品多重实时荧光定量pcr标准曲线。
21.图3为多重实时荧光定量pcr敏感性实验。
22.图4为普通pcr敏感性实验(1-5:104–
100copies/μl浓度梯度阳性标准品;n:阴性对照)。
23.图5为多重实时荧光定量pcr特异性试验(1-7:分别为prv,asfv,ppv,prrsv,rv,pedv和pk-15细胞系扩增曲线;nc:阴性对照)。
24.图6重复性实验结果数据。
具体实施方式
25.下面结合具体实施例详述本发明,但本发明的保护范围不局限于以下实施例。
26.实施例1引物和探针设计
27.选取ncbi genebank中公布的不同国家分离出的pcv1-4型orf2基因序列各4-8条,利用snap gene进行序列比对,挑选orf2基因中的高保守区域利用oligo7进行引物探针设计,设计好的引物于ncbi进行blast比对验证特异性。引物探针序列交由擎科生物科技有限公司合成,合成的引物探针用dd h2o稀释浓度至10μmol/l,4℃保存备用。经过多重pcr的实际验证,从设计的13对引物和8条探针中最终选择出以下引物和探针:
28.表1选定的引物和探针序列
29.[0030][0031]
实施例2样品处理和核酸提取
[0032]
取无菌的2ml lysing matrix组织研磨管加入1ml pbs液,再加入适量pcv2、pcv3、prv、asfv、ppv、prrsv、prv、pedv阳性组织样品,置于fastprep-24tm5g研磨仪,研磨30s后取下研磨管,置于离心机8000rpm离心1min,取上清-20℃保存备用。pk15细胞系、puc57-pcv1-orf2、puc57-pcv4-orf2省略该步骤,直接进行下述dna提取步骤。
[0033]
参照磁珠法病毒dna/rna提取试剂盒说明书,配合kingfisher duo自动化提取仪器,执行tian_kingfisher_duo.bdz程序进行dna抽提。程序执行完毕,转移洗脱的dna于1.5ml离心管-20℃保存备用。
[0034]
实施例3重组质粒标准品的制备
[0035]
用本实验所设计的taqman实时荧光定量pcr引物对提取pcv1-4型dna进行普通pcr扩增。反应条件:98℃2min;98℃10s,56℃15s,72℃20s,共35个循环;72℃5min。(25μl反应体系为:1.1x金牌mix ver.2 22μl、10μm上游引物1μl、10μm下游引物1μl、模板dna1μl)。
[0036]
将pcr产物于3%琼脂糖凝胶上样电泳,设置电压120v,电泳时间30min。电泳后切取目的条带按照dna凝胶回收试剂盒说明书进行回收纯化,回收产物立即进行连接转化。
[0037]
将胶回收产物使用pclone007 simple vector kit进行t-a连接,配制10μl反应体系(模板4μl)、pclone007 simple vector 1μl)、10x topo mix 1μl)、ddh2o补足10μl))。
[0038]
将上述连接体系至于金属浴25℃反应5min,反应完成后使用trelief tm 5α感受态细胞参照说明书立即进行转化。将转化后的感受态细胞涂布于含amp抗生素的lb培养基,37℃培养12h。培养后挑取单克隆接种于lb液体培养基,37℃250rpm过夜摇菌。过夜培养的菌液使用高纯度质粒dna小量提取试剂盒按说明进行pcv2、pcv3重组质粒提取并送至擎科生物科技有限公司测序。连接成功、测序无误的重组质粒使用核酸蛋白仪测定浓度、计算拷贝数并进行10倍梯度稀释。稀释后的质粒作为阳性标准品-20℃保存备用。拷贝数计算公
式:
[0039]
拷贝数(copies/μl)=c
×
na/mw
[0040]
其中c为阳性质粒浓度,单位ng/μl,na取6.02
×
10
23
copies/mol,mw为平均分子量,单位为dolton。
[0041]
pcv1-4型质粒拷贝数分别为:pcv1 5.86
×
10
11
copies/μl、pcv2 9.69
×
10
11
copies/μl、pcv3 6.54
×
10
11
copies/μl、pcv4 5.11
×
10
11
copies/μl。
[0042]
实施例3多重pcr反应的优化
[0043]
使用实施例1确定的特异性引物和探针,制备的阳性标准品为模板,按照试剂说明书推荐常规反应体系和反应条件进行taqman多重实时荧光定量pcr扩增,初步验证引物特异性,为后续优化提供依据。反应条件:95℃5min;95℃10s,60℃50s,共30个循环。20μl反应体系为2x t5 fast qpcr mix 10μl、10μm上游引物各0.8μl、10μm下游引物各0.8μl、10μm探针各0.4μl、模板dna 0.5μl、ddh2o 1.5μl。
[0044]
将所提取的四种阳性模板加入同一反应体系进行taqman多重实时荧光定量pcr初步扩增。结果显示,阴性对照成立,四种阳性模板均出现典型扩增曲线,表明引物探针特异性良好,可进一步优化反应体系。
[0045]
以上述反应体系、反应条件为依据,设置梯度对退火温度、循环数进行优化,采用矩阵法对引物浓度、探针浓度进行优化。引物终浓度设置0.05μm、0.1μm、0.15μm、0.2μm、0.25μm、0.3μm、0.35μm、0.4μm、0.45μm、0.5μm;探针终浓度设置0.01μm、0.05μm、0.1μm、0.15μm、0.2μm、0.25μm、0.3μm、0.35μm,退火温度采用65℃、64℃、63℃、62℃、61℃、60℃、59℃、58℃,循环数采用30次、35次、40次进行优化。相同模板浓度下,优先选择ct值较小的反应条件,若ct值相同,则选择较高的退火温度。
[0046]
经验证,相同模板浓度下退火温度控制在59-61℃,均有一致的扩增效率和荧光强度,ct值变化较小。由于较高的退火温度可减少非特异性扩增的几率,最终选择退火温度61℃。其他条件不变的情况下,pcv2、pcv3的扩增反应在第35个循环后均出现不同程度的非特异性信号,最终选择循环数为35次。矩阵法优化筛选出两组荧光强度高,扩增效率一致的引物和探针浓度,最终选取浓度较低的一组引物和探针浓度。引物终浓度优化结果:pcv1、pcv3、pcv4均为0.05μm,pcv2为0.15μm;探针终浓度优化结果:pcv1-4均为0.01μm。
[0047]
优化后的20μl反应体系为:2x t5 fast qpcr mix 10μl、10μm pcv1、3、4上游引物各0.1μl、10μm pcv1、3、4下游引物各0.1μl、10μm pcv2上游引物0.3μl、10μm pcv2下游引物0.3μl 10μm探针各0.02μl、模板dna 0.5μl、ddh2o 8.22μl。
[0048]
实施例4标准曲线的建立
[0049]
选取10倍梯度稀释后拷贝数为107
–
103copies/μl的阳性标准品0.5μl为模板加入优化后的反应体系,阴性对照模板用ddh2o代替,按照优化后的反应条件进行多重荧光定量pcr扩增。使用bio-rad cfx maestro分析扩增结果,建立标准曲线。
[0050]
taqman多重实时荧光定量pcr扩增曲线(图1)和标准曲线(图2)显示,在107-103copies/μl梯度浓度区间内,ct值(y)与阳性标准品拷贝数(x)表现出良好的线性关系,四种靶基因对应的标准曲线分别为:pcv1:y=-3.293x+36.838,r2=1.000,扩增效率(e)=101.2%;pcv2:y=-3.515x+38.358,r2=0.998,扩增效率(e)=92.5%;pcv3:y=-3.025x+36.828,r2=0.999,扩增效率(e)=114.1%;pcv4:y=-3.342x+38.392,r2=0.999,扩增效
率(e)=99.2%。
[0051]
实施例5敏感度、特异性、重复性实验
[0052]
taqman多重实时荧光定量pcr敏感性实验
[0053]
选取10倍梯度稀释后拷贝数为10
4-100copies/μl的阳性标准品0.5μl为模板,阴性对照模板用ddh2o代替,分别进行taqman多重实时荧光定量pcr和普通pcr扩增,对比两种方法的灵敏程度。并采用taqman多重实时荧光定量pcr方法分别检测和同时检测阳性标准品,重复3次,进一步评价多种病原同时存在对敏感性的影响。
[0054]
图3、4的结果显示,taqman多重实时荧光定量pcr方法的最低拷贝数检测限分别为:pcv1 5.86
×
101copies/μl、pcv2 9.69
×
102copies/μl、pcv36.54
×
101copies/μl、pcv4 5.11
×
101copies/μl。
[0055]
普通pcr方法的最低拷贝数检测限分别为:pcv1 5.86
×
102copies/μl、pcv2 9.69
×
103copies/μl、pcv3 6.54
×
103copies/μl、pcv4 5.11
×
102copies/μl。自建taqman多重实时荧光定量pcr方法在灵敏度方面优于普通pcr方法约10-100倍。
[0056]
taqman多重实时荧光定量pcr特异性实验
[0057]
以抽提好的阳性标准品、猪伪狂犬病毒(prv)、非洲猪瘟病毒(asfv)、猪细小病毒(ppv)dna,猪繁殖与呼吸综合征病毒(prrsv)、猪轮状病毒(porv)、猪流行性腹泻病毒(pedv)抽提rna后经反转录得到的cdna和pk-15细胞系核酸为模板,按照优化后的反应体系和条件进行taqman多重实时荧光定量pcr扩增,以验证所建立taqman多重实时荧光定量pcr方法特异性。图5的结果表明只有pcv阳性标准品有典型扩增曲线,其他病原、细胞的核酸均没有出现扩增曲线,说明所建立的taqman多重实时荧光定量pcr方法特异性良好。
[0058]
taqman多重实时荧光定量pcr重复性实验
[0059]
选取10倍梯度稀释后拷贝数为10
6-104copies/μl的阳性标准品为模板,用已建立的taqman多重实时荧光定量pcr方法分别进行3次重复检测,进行组内重复试验;取上述阳性标准品,在相同的反应条件下每间隔一周对其进行3次重复检测,作为组间重复试验。计算组内和组间变异系数,以验证所建立taqman多重实时荧光定量pcr方法重复性是否良好。
[0060]
图6结果显示,该方法组内变异系数在0.33%-2.48%之间,组间变异系数在0.53%-3.59%之间(表2-7),均小于5%,表明所建立的方法重复性、再现性较好。
[0061]
此外,申请人使用本技术的试剂盒和现有市售的三个不同厂家的六种猪圆环病毒单重/多重taqman实时荧光定量检测试剂盒进行了实际检测比较(使用2021年6月成都市无害化处理厂收集送检的共计30份脾脏、淋巴结混合样品),结果表明,本技术的4重pcr方法在灵敏度和特异性方面表现不亚于甚至优于现有的市售试剂盒。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1