REG1A基因和RUNX3基因作为糖尿病肾病生物标志物的应用的制作方法
reg1a基因和runx3基因作为糖尿病肾病生物标志物的应用
技术领域
1.本发明涉及分子诊断技术领域中的reg1a基因和runx3基因作为糖尿病肾病生物标志物的应用。
背景技术:
2.糖尿病肾病(diabetic kidney disease,dkd)是由糖尿病(diabetes mellitus,dm) 引起的慢性肾脏病(chronic kidney disease,ckd),临床上以持续白蛋白尿和/或肾小球滤过率(glomerular filtration rate,gfr)进行性下降为主要特征,可进展为终末期肾病(end-stage renal disease,esrd)。随着全球dm发病率的不断增加,dkd不仅已成为esrd的主要原因,而且也成为糖尿病高致残率、高死亡率的主要因素之一。早期dkd存在一定的可逆性,早期快速准确的诊断能够阻止患者肾脏的进一步恶化。然而由于dkd早期无明显症状,极容易被患者忽略,当dkd患者就诊时,往往已经处于不可逆状态。肾脏功能会随着时间逐渐衰竭,直至完全丧失。因此,发掘和鉴定高敏感性和特异性的dkd生物标志物,是临床上亟待解决的问题之一,并且对dkd 的预测、诊断和预后都有着重要的意义。
3.dkd的诊断主要基于肾脏病理和/或临床表现,除了糖尿病病程、糖尿病视网膜病变和尿蛋白水平外,还包括肾小球滤过率(gfr)的测定。虽然传统的临床特征很容易获取,但它们的诊断效能有限。随着分析技术、高通量技术和生物信息学数据库的不断发展,探索与疾病相关的基因,发现新的评估dkd风险的生物标志物成为当前的研究热点。迄今为止,dkd没有特效治疗的方法,重在预防、早期诊断和早期干预治疗。目前常用的诊断标志物灵敏度和特异性仍不能满足dkd诊断和预测的临床需求。鉴于此,研究和开发更可靠、更灵敏、更特异的生物标志物对dkd的诊断、预测和预后等具有重要的临床意义。
技术实现要素:
4.本发明所要解决的技术问题是如何诊断dkd和/或如何评估dkd进展的风险。所要解决的技术问题不限于所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
5.为解决上述技术问题,本发明首先提供了生物标志物和/或检测所述生物标志物的物质的下述任一种应用:
6.a1)在糖尿病肾病诊断或制备用于糖尿病肾病诊断的产品中的应用;
7.a2)在糖尿病肾病辅助诊断或制备用于糖尿病肾病辅助诊断的产品中的应用;
8.a3)在糖尿病肾病筛查或制备用于糖尿病肾病筛查的产品中的应用;
9.a4)在预测或评估糖尿病肾病风险或制备用于预测或评估糖尿病肾病风险的产品中的应用;
10.a5)在糖尿病肾病预后评估或制备用于糖尿病肾病预后评估的产品中的应用;
11.所述生物标志物可为下述任一种:
12.b1)reg1a基因和runx3基因;
13.b2)reg1a基因;
14.b3)runx3基因。
15.本文所述reg1a基因可为人reg1a基因,所述runx3基因可为人runx3基因。
16.本文中“reg1a”与“reg1a基因”具有相同的含义,可以互换使用,“runx3”与“runx3基因”具有相同的含义,可以互换使用。
17.所述reg1a基因的核苷酸序列是genbank accession no.p05451.3的第 79120488-79123409位(update date13-may-2022)。所述reg1a基因包括reg1a 基因以及reg1a基因的任何功能等同物的多核苷酸。
18.所述runx3基因的核苷酸序列是genbank accession no.q13761.2的第 24899511-24965138位(update date 23-jun-2022)。所述runx3基因包括reg1a基因以及reg1a基因的任何功能等同物的多核苷酸。
19.上述应用中,所述检测所述生物标志物的物质可为下述任一种:
20.c1)用于检测reg1a基因的mrna表达水平的试剂和/或用于检测runx3基因的mrna表达水平的试剂;
21.c2)用于检测reg1a基因的蛋白质表达水平的试剂和/或用于检测runx3基因的蛋白质表达水平的试剂。
22.具体地,所述mrna表达水平是指在转录水平上检测基因转录的mrna的丰度;
23.所述蛋白质表达水平是指在翻译水平上检测基因编码的蛋白质的丰度。
24.本发明可基于cdna和rna的测序技术,检测reg1a基因和/或runx3基因的表达水平。所述测序技术为核酸测序技术,包括链终止子(sanger)测序技术和染料终止子测序技术,本领域的普通技术人员所知晓的是,由于rna在细胞中不太稳定并且在实验中更易受到核酸酶攻击,因此,在测序前通常将rna逆转录成dna,此外,所述测序技术还包括下一代测序技术(即深度测序/高通量测序技术),高通量测序技术是一种基于单分子簇的边合成边测序技术,基于专有的可逆终止化学反应原理。测序时将基因组的dna的随机片段附着到光学透明的玻璃表面,这些dna片段经过延伸和桥式扩增后,在玻璃表面形成数以亿计的簇,每个簇是具有数千份相同模板的单分子簇,然后利用带荧光基团的四种特殊脱氧核糖核苷酸,通过可逆性的边合成边测序技术对待测的模板dna进行测序。本发明可使用二代测序和三代测序,检测cdna中的转录组,进而检测reg1a基因和/或runx3基因的表达水平。本发明也可使用nanopore测序,直接检测rna表达水平,从而对reg1a基因和/或runx3 基因的表达水平进行定量。
25.上述应用中,所述检测所述生物标志物的物质包括通过逆转录-聚合酶链反应、实时荧光定量pcr、转录组测序技术、northern blot、原位杂交技术、基因芯片技术、 nanopore测序技术、pacbio测序技术、免疫印迹法、免疫组化法、免疫荧光法、放射免疫测定法、免疫共沉淀法、酶联免疫吸附试验、酶免疫测定法、流式细胞术、高效液相色谱法、毛细管凝胶电泳法、近红外光谱法、质谱法、免疫化学发光法、胶体金免疫技术、荧光免疫层析技术、表面等离子共振技术、免疫-pcr技术或生物素-亲和素技术检测所述生物标志物的试剂。
26.上述应用中,所述产品可包括试剂盒、基因芯片、蛋白质芯片、免疫层析诊断试纸、高通量测序平台或生物传感器。
27.所述产品的检测样本可来源于糖尿病患者或者疑似糖尿病患者。
28.所述产品的检测样本可为血液样本或组织样本,所述血液样本可为外周血样本或外周血单个核细胞样本,所述组织样本可为肾脏样本。
29.所述试剂盒可为基因检测试剂盒或蛋白免疫检测试剂盒;所述基因检测试剂盒包括用于检测reg1a基因和/或runx3基因转录水平的试剂;所述蛋白免疫检测试剂盒包括reg1a基因编码蛋白质和/或runx3基因编码蛋白质的特异性抗体。
30.所述基因芯片包括括固相载体和固定在所述固相载体的寡核苷酸探针,所述寡核苷酸探针包括用于检测reg1a基因和/或runx3基因的寡核苷酸探针。
31.所述蛋白质芯片包括固相载体和固定在所述固相载体的reg1a基因编码蛋白质的特异性抗体和/或runx3基因编码蛋白质的特异性抗体。
32.所述免疫层析诊断试纸包括reg1a基因编码蛋白质的特异性抗体和/或runx3 基因编码蛋白质的特异性抗体。
33.所述高通量测序平台包括用于检测reg1a基因和/或runx3基因的试剂;
34.所述生物传感器包括用于检测reg1a基因和/或runx3基因的试剂。
35.本文所述抗体可以是单克隆抗体、多克隆抗体、基因工程抗体,还可以是抗体可变区fv、单链抗体scfv、抗原结合片段fab或fab’、f(ab’)2、fab
’‑
sh等抗体片段,以及抗体衍生物等。
36.上述应用中,所述产品包括用于检测所述生物标志物的物质。
37.上述应用中,所述用于检测所述生物标志物的物质可包括下述至少任一种:
38.m1)特异性扩增reg1a基因和/或runx3基因的引物;
39.m2)特异性识别reg1a基因和/或runx3基因的探针;
40.m3)结合reg1a基因编码蛋白质和/或runx3基因编码蛋白质的抗体。
41.进一步地,所述引物可包括下述至少任一种:
42.p1)核苷酸序列是seq id no.1的特异性扩增runx3基因的正向引物;
43.p2)核苷酸序列是seq id no.2的特异性扩增runx3基因的反向引物;
44.p3)核苷酸序列是seq id no.3的特异性扩增reg1a基因的正向引物;
45.p4)核苷酸序列是seq id no.4的特异性扩增reg1a基因的反向引物。
46.本发明还提供了组合物,所述组合物可为下述任一种:
47.d1)所述组合物含有用于检测reg1a基因的mrna表达水平的试剂和用于检测 runx3基因的mrna表达水平的试剂;
48.d2)所述组合物含有用于检测reg1a基因的蛋白质表达水平的试剂和用于检测 runx3基因的蛋白质表达水平的试剂。
49.本发明还提供了所述组合物的下述任一种应用:
50.f1)在糖尿病肾病诊断或制备用于糖尿病肾病诊断的产品中的应用;
51.f2)在糖尿病肾病辅助诊断或制备用于糖尿病肾病辅助诊断的产品中的应用;
52.f3)在糖尿病肾病筛查或制备用于糖尿病肾病筛查的产品中的应用;
53.f4)在预测或评估糖尿病肾病风险或制备用于预测或评估糖尿病肾病风险的产品中的应用;
54.f5)在糖尿病肾病预后评估或制备用于糖尿病肾病预后评估的产品中的应用。
55.本发明还提供了试剂盒,所述试剂盒可为下述任一种:
56.g1)所述试剂盒含有用于检测reg1a基因的mrna表达水平的试剂和/或用于检测runx3基因的mrna表达水平的试剂;
57.g2)所述试剂盒含有用于检测reg1a基因的蛋白质表达水平的试剂和/或用于检测runx3基因的蛋白质表达水平的试剂。
58.所述试剂盒的检测样本可为血液样本或组织样本,所述血液样本可为外周血样本或外周血单个核细胞样本,所述组织样本可为肾脏样本。
59.所述试剂盒的各种试剂组分可以存在于分开的容器中,或者可以全部或部分预组合成试剂混合物。
60.进一步地,所述试剂盒可为基因检测试剂盒或蛋白免疫检测试剂盒。
61.进一步地,所述试剂盒可为elisa试剂盒、qpcr试剂盒、电化学发光检测试剂盒、免疫印迹检测试剂盒、免疫层析检测试剂盒、流式细胞分析试剂盒或免疫组化检测试剂盒但不限于此。
62.进一步地,所述基因检测试剂盒(如qpcr试剂盒)可含有下述至少任一种:
63.p1)核苷酸序列是seq id no.1的特异性扩增runx3基因的正向引物;
64.p2)核苷酸序列是seq id no.2的特异性扩增runx3基因的反向引物;
65.p3)核苷酸序列是seq id no.3的特异性扩增reg1a基因的正向引物;
66.p4)核苷酸序列是seq id no.4的特异性扩增reg1a基因的反向引物。
67.进一步地,所述基因检测试剂盒还包括pcr扩增所需要的taq dna聚合酶、 dntp、pcr缓冲液、mg
2+
中的一种或多种。
68.进一步地,所述基因检测试剂盒还可包括内参基因检测试剂,所述内参基因可为 gapdh基因和/或β-actin基因但不限于此。
69.所述蛋白免疫检测试剂盒可含有结合reg1a基因编码蛋白质和/或runx3基因编码蛋白质的抗体。
70.本发明还提供了用于糖尿病肾病的诊断、辅助诊断、筛查、风险预测或预后评估的装置,所述装置包括本文中任一所述的检测所述生物标志物的物质和存储有计算机程序的计算机可读存储介质,所述计算机程序使计算机执行如下任一步骤:
71.h1)根据reg1a基因和runx3基因的表达水平进行糖尿病肾病的诊断、辅助诊断、筛查、风险预测或预后评估;
72.h2)根据reg1a基因的表达水平进行糖尿病肾病的诊断、辅助诊断、筛查、风险预测或预后评估;
73.h3)根据runx3基因的表达水平进行糖尿病肾病的诊断、辅助诊断、筛查、风险预测或预后评估。
74.本发明的目的是建立一种简化的血液生物标志物来预测dkd的风险。首先分析了从基因表达综合数据库(geo)获得的微阵列数据,随后在获得的数据集中鉴定了血液样本reg1a和runx3作为dkd的诊断性生物标志物。进一步采集健康参与者、未出现dkd的糖尿病患者和dkd患者的血液样本,并对这些样本进行qpcr分析,以确定runx3和reg1a的转录水平。然后,将获得的血液样本用于验证这些在geo 数据库中的生物标志物的诊断效果,并预测发生dkd的风险。总之,runx3和reg1a 被证明具有预测dkd风险的潜力,并可能有助于dkd
的预防和管理。
75.dkd仍然是全球范围内esrd的主要原因。大约四分之一的dm患者最终发展为dkd。因此,识别dkd患者的特征可能有助于预测疾病发展的风险。临床特征是目前使用最广泛的dkd预测因子。社区动脉粥样硬化风险研究发现,在高危载脂蛋白l1基因型、胰岛素使用、高收缩压和高糖化血红蛋白水平的糖尿病患者中,egfr 水平下降最快。华盛顿大学医院的另一项纵向观察研究显示,年龄、肥胖、高血压、高水平糖化血红蛋白和蛋白尿是2型糖尿病患者egfr降低的独立危险因素。来自瑞典国家糖尿病登记处的数据还显示,糖尿病患者发生蛋白尿的独立危险因素包括高龄、男性、吸烟、高bmi、收缩压、糖化血红蛋白、tc和ldl-c水平。随着组织学分析和测序技术的进步,大量新的生物标志物被开发出来,以弥补临床特征的低预测疗效。仙人掌研究确定了四种用于预测1型糖尿病患者egfr降低的血浆生物标志物:β-2
‑ꢀ
微球蛋白、胱抑素c、中性粒细胞明胶酶相关脂钙蛋白和骨桥蛋白。代谢组学分析进一步确定了7种血液代谢物(辛醇、草酸、磷酸、苯甲酰胺、肌酐、3,5-二甲氧基甘露烯酰胺和n-乙酰谷氨酰胺)作为糖尿病患者egfr降低的预测因子。本发明分析了从geo数据库中获得的人类dkd数据集,并确定了在血液和肾脏样本中共享的38 个差异表达基因(degs)。通过lasso回归进一步鉴定了16个degs。其中9个基因在血液和肾脏样本中的表达趋势一致。这些degs被用于比较狼疮肾炎、anca 相关肾炎、局灶节段硬化性肾病、iga肾病和微小病变肾病的诊断疗效。结果发现,只有reg1a和runx3对dkd的诊断具有特异性。因此,reg1a和runx3是区分 dkd和dm合并肾脏疾病(dkd除外)的潜在生物标志物。膜性肾病被排除在我们的分析之外,因为抗磷脂酶a2受体抗体已经被明确是膜性肾病的特异性标记物。在 dkd患者的血液样本(auc=0.917)和肾脏活检样本(auc=0.929)中,reg1a和 runx3的转录水平具有很高的诊断效力。我们选择了gse142153数据集(来自dkd 患者的血液样本的rnaseq)作为开发集,因为血液样本通常是标记物检测的首选。最后,使用来自深圳人民医院的dkd患者和健康个体的血液样本进行外部验证。结果发现,reg1a联合runx3具有同样高的诊断效果(auc=0.948)。因此,reg1a 和runx3是dkd的潜在生物标志物。
76.在dkd患者的血液和肾脏样本中,我们发现reg1a和runx3的表达水平显著升高,这表明这些基因在dkd中可能具有致病作用。血液表达水平也可能反映出肾脏的损伤。reg1a和runx3水平与血清肌酐和尿蛋白肌酐比呈正相关,与egfr呈负相关。因此,血液中reg1a和runx3水平可能与dkd患者的肾小球损伤和肾功能下降密切相关。reg1a水平也与c肽、糖化血红蛋白和空腹血糖水平呈正相关,提示reg1a水平的升高可能也与β细胞功能障碍密切相关。随着细胞外葡萄糖浓度的增加,reg1a的表达水平快速增加,这可能是β细胞调控中的一个重要的生理反馈回路质量。因此,reg1a和runx3是dkd发展的潜在生物标志物。
77.为了评估dkd发展的风险,我们绘制了reg1a、runx3和临床特征的km曲线。结果显示,reg1a和runx3高表达的人分别在糖尿病大约12年和8年后发生 dkd的风险增加。发现tc、fbg、scr、bmi和uacr水平的升高是dkd的危险因素,而egfr和hdl-c水平的升高是dkd的保护因素。表3显示了reg1a和runx3 在不同表达水平下的km分析结果。因此,与其他组相比,当reg1a和runx3的表达水平均较高时,发生dkd的风险最高(hr=6.87)。reg1a或runx3低表达(hr=1)均无dkd风险增加。与reg1a和runx3均低表达的患者相比,这两个基因都高表达的糖尿病患者在糖尿病7-8年后发生dkd的风险迅速增加。因此, reg1a和runx3是预测dkd发生风险的潜在生物标志物。
78.基因的差异表达由多种因素共同导致,并且与许多疾病的发生和发展有着密切联系,对差异化表达的基因进行生物信息学以及生物统计学的分析能为基因诊断与治疗提供重要的理论依据。筛选差异基因是用统计学的方法对高通量的基因数据进行筛选,挑出样本间有显著性差异的基因。
79.本发明人经过广泛而深入的研究,通过对糖尿病肾病(dkd)的基因表达谱进行筛选和分析,发现reg1a基因和runx3基因在糖尿病肾病(dkd)患者的血液和肾脏中高表达,并以此为基础开发糖尿病肾病(dkd)生物标志物,以实现在mrna 水平、蛋白质水平对糖尿病肾病(dkd)进行诊断、筛查、预后评估及风险评估的目的。reg1a和/或runx3对dkd具有较高的诊断效果,并经外部验证证实。reg1a 和/或runx3水平分别与uacr和egfr水平呈正相关和负相关。因此,血液样本中 reg1a和/或runx3的转录水平有预测dkd风险的潜力。本发明的生物标志物及基于检测reg1a基因和/或runx3基因的试剂盒具有敏感性强、特异性高的特点,可以为糖尿病肾病(dkd)患者诊断、预后及风险评估提供快速、有效的工具,进而给病人提供精准的治疗方案,有利于实现最佳的疾病管理,具有很好的临床应用价值。
附图说明
80.图1为在dkd患者的血液和肾脏活检样本中共享的degs的筛选。
81.图2为在dkd患者血液和肾脏活检样本中表达一致的degs的筛选。其中,图2 中a为38个特征的套索系数剖面图。根据log(λ)序列生成了一个系数剖面图。在使用5倍交叉验证选择的值处画了一条垂直线,其中最优的lambda得到了16个系数为非零的特征。图2中b为套索模型中的最优参数(λ)选择采用了通过最小准则进行的五倍交叉验证。部分似然偏差(二项偏差)曲线与对数(λ)曲线绘制。通过使用最小标准和最小标准(1-se标准)的1se,在最优值处绘制了垂直虚线。图2中c和图2中d为16个degs在血液和肾脏中的表达。其中有9种在血液和肾脏中一致表达的degs。图2中e为这9个degs在dkd患者血液样本中的分布。图2中f为9 个degs在dkd患者肾脏活检样本中的分布。套索:最小绝对收缩和选择运算符; se:标准误差。
82.图3为reg1a和/或runx3作为诊断标志物对dkd诊断效力的验证。图3中a 和图3中b分别为reg1a和runx3血液样本(gse142153)的dkd诊断效果分析,箱图显示,血液样本中reg1a和runx3的表达水平显著升高(dkd vs hc,秩和检验)。图3中c为reg1a和runx3联合诊断血液样本疗效的roc曲线。图3 中d和图3中e分别为reg1a和runx3肾脏样本(gse30122)的dkd诊断效果分析,箱图显示,肾脏样本中reg1a和runx3的表达水平显著升高(dkd vs hc)。图3中f为reg1a和runx3联合诊断肾脏样本疗效的roc曲线。p<0.05(*)表示具有统计学差异,p<0.01(**)表示统计学差异显著,p<0.001(***)表示统计学差异极为显著。
83.图4为诊断标志物在验证队列中的表达和诊断效果。图4中a和图4中b为 reg1a和runx3的表达水平的箱图,箱图显示reg1a和runx3的表达水平显著升高(dkd vs hc)。图4中c为reg1a的roc曲线和runx3的roc曲线。图4 中d为将两个诊断指标拟合到一个变量后的诊断效果验证的roc曲线。p<0.05(*) 表示具有统计学差异,p<0.01(**)表示统计学差异显著,p<0.001(***)表示统计学差异极为显著。
84.图5为开发队列和验证队列中诊断标志物的校准曲线。图5中a为开发队列(发展集)中诊断标志物的校准曲线;图5中b为验证队列(验证集)中诊断标志物的校准曲线。
85.图6为在dkd和dm队列中诊断标志物的表达及其与临床特征之间的相关性。图6中a和图6中b为reg1a和runx3的表达水平的箱图,箱图显示reg1a和 runx3的表达水平显著升高(dkd vs dm)。图6中c为reg1a与临床特征的相关性。图6中d为runx3与临床特征的相关性。p<0.05(*)表示具有统计学差异, p<0.01(**)表示统计学差异显著,p<0.001(***)表示统计学差异极为显著。
具体实施方式
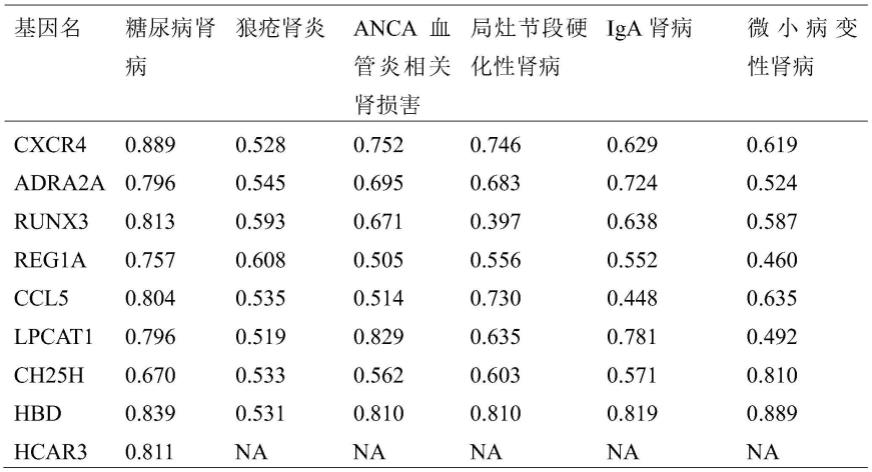
86.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
87.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
88.实施例1、糖尿病肾病生物标志物的筛选
89.1、筛选在血液和肾脏样本中共享的差异基因(degs)
90.从geo数据库(基因表达综合数据库,gene expression omnibus, https://www.ncbi.nlm.nih.gov/geo/)中获取了三个geo数据集(gse30122、gse142153 和gse72326)进行前期分析,并通过perl脚本进行基因id和符号转换。gse30122、 gse142153和gse72326分别包含了来自dkd患者肾脏样本、dkd患者血液样本、 ckd患者血液样本和健康对照样本(hc)的转录组数据。
91.差异表达基因(degs)的鉴定:使用r软件(版本4.1.0)用于数据分析和绘图。使用r软件中“limma”r包筛选degs,使用“ggplot2”包构建degs的热图和火山图,以可视化degs的表达水平。p值《0.05,视为差异有统计学意义,作为筛选差异表达基因(degs)的标准。
92.结果如图1所示,图1显示了在dkd患者的血液和肾脏活检样本中共享的degs 的筛选过程。以健康对照样本(hc)为基础,在dkd患者的血液和肾脏样本中分别鉴定出679例(gse142153:hc,n=10,dkd,n=23)和499例(gse30122: hc,n=50,dkd,n=19)degs。在dkd患者的血液和肾脏活检样本中共发现38 个共享的degs。
93.2、筛选在dkd患者的血液和肾脏样本中表达一致的degs
94.使用lasso回归算法进一步筛选dkd患者血液样本(gse142153)中共享的 degs。共鉴定出16个degs为诊断性dkd标记物(图2中a,图2中b),其中分别有5个下调的基因和11个上调的基因(图2中c)。在dkd患者的肾脏活检样本(gse30122)中,有2个下调的基因,而14个基因上调(图2中d)。
95.最终,在dkd患者的血液和肾脏活检样本中发现了9个表达谱一致的标记:包括alpha-2a肾上腺素能受体(adra2a)、c-c基序趋化因子5(ccl5)、胆固醇25-羟化酶(ch25h)、c-x-c趋化因子受体4型(cxcr4)、血红蛋白亚基delta (hbd)、羟基羧酸受体3(hcar3)、溶血磷脂酰胆碱酰基转移酶1(lpcat1)、再生胰岛衍生蛋白1a(reg1a)和runt相关转录因子3(runx3)。这些degs 在dkd患者血液和肾脏中的表达谱分布(图2中e和图2中f)显示,它们的表达均上调。
96.3、筛选诊断特异性的degs
97.诊断标记物的筛选和验证采用“glmnet”软件包中实现的最小绝对收缩和选择操作符(lasso)方法,用于dkd患者的数据降维和预测特征的选择。采用受试者工作特征(receiveroperating characteristic curve,roc)曲线法评价诊断性能。使用“proc”软件包绘制受试者工作特征曲线并计算单因素或多因素roc的曲线下面积 (area under curve,auc),roc曲线下面积是重要的试验准确度指标,roc曲线下面积越大,试验的诊断价值越大。使用“rms”软件包绘制校准曲线,以评估模型的预测概率是否近似于真实概率。
98.进一步采用上述方法对dkd的degs进行特异性筛选,分析两个血液转录组数据集(gse142153和gse72326),以确定dkd特异性degs用于诊断的价值。
99.在gse142153数据集中,发现几个degs(adra2a、ccl5、ch25h、cxcr4、 hbd、hcar3、lpcat1、reg1a和runx3)具有较高的差异,除ch25h(auc=0.67) 诊断效率较低外,其他degs的血液样本的auc均大于0.7(表1)。gse72326 数据集[狼疮性肾炎=48;anca血管炎相关肾炎=10;局灶性节段性硬化性肾病=3; iga肾病=5;微小病变肾病=3]被用来验证这些degs对dkd诊断的特异性,除了 hcar3,由于在数据集中没有发现而被排除在分析之外,其他8种degs对ln患者的诊断效果相对较低(表1)。cxcr4、lpcat1和hbd对anca相关肾炎具有较高的诊断疗效(表1)。观察到cxcr4、ccl5和hbd对fsgs患者的显著诊断性能(表1)。adra2a、lpcat1、hbd对igan患者具有较高的诊断疗效(表 1)。ch25h和hbd对mcd患者有良好的诊断疗效(表1)。
[0100]
综上所述,血液样本中reg1a和runx3的转录水平可能作为疾病发展的dkd 特异性预测因子,具有较好的诊断价值。
[0101]
表1:dkd诊断基因的特异性分析
[0102][0103]
表1:展示9个差异基因在各种慢性肾脏病中的曲线下面积(auc)。糖尿病肾病数据来自gse72326;慢性肾脏病数据来自gse72326。目的在于筛选在dkd中诊断特异性的基因。
[0104]
4、reg1a和/或runx3作为诊断标志物对dkd诊断潜力的验证
[0105]
对runx3和reg1a血液样本(gse142153)的dkd诊断效果进行分析,与健康对照样本(hc)相比,在dkd患者的血液样本中,发现reg1a和runx3 的表达水平显著升高(图3中a,图3中b;gse142153)。这些基因(runx3和 reg1a)的联合诊断效果也很高(auc=0.917,95%ci:
0.818-1)(图3中c)。
[0106]
从dkd患者的肾脏样本(gse30122)中也获得了类似的结果,与健康对照样本(hc)相比,在dkd患者的肾脏样本中,reg1a和runx3的表达水平显著升高(图3中d,图3中e;gse30122)。runx3和reg1a的联合诊断效果也很高(auc=0.929,95%ci:0.846-1)(图3中f)。这些结果表明,reg1a和runx3 联合的诊断效力优秀,并且血液中的诊断效力不劣于肾脏。
[0107]
实施例2、糖尿病肾病生物标志物的验证与应用
[0108]
本实施例在实施例1已经筛选出糖尿病肾病生物标志物reg1a和/或runx3 的基础上,进一步验证本本发明生物标志物(reg1a和/或runx3)的诊断性能。
[0109]
1、临床样本qpcr分析验证
[0110]
临床统计数据:
[0111]
从深圳市人民医院的生物样本库中,共收集了141份来自dkd患者、糖尿病患者(不伴dkd)和健康个体(hc)的人类血液样本。
[0112]
样本纳入标准:
[0113]
健康人(hc):≥18岁;无肝肾功能损害;无肿瘤病史;无糖尿病病史。
[0114]
dkd患者:1)大量白蛋白尿;2)糖尿病视网膜病变伴有微量白蛋白尿;3) 在10年以上的糖尿病病程的t1dm患者中出现微量白蛋白尿。
[0115]
糖尿病患者(无dkd患者)3项满足其中1项:1.糖尿病症状+任意时间血浆葡萄糖水平≥11.1mmol/l(200mg/dl);2.空腹血浆葡萄糖水平≥7.0mmol/l(126mg/dl); 3.ogtt试验中,2小时pg水平≥11.1mmol/l(200ng/dl)。
[0116]
所有用于实验用途的样本获取均取得病人知情同意,并通过深圳市人民医院伦理委员会批准。对于连续变量,数据以平均值
±
标准差(sd)或中位数和四分位数范围表示,并以分类变量的百分比表示。根据数据是否符合正态分布,采用 mann-whitneyu检验或t检验来比较两组间的差异。
[0117]
实时荧光定量pcr(qpcr)分析:使用trizol(invitrogen)根据制造商的说明从外周血单个核细胞(pbmc)中提取总rna。rna的逆转录使用逆转录rt逆转录试剂盒(thermofisher科学公司)进行逆转录。定量pcr采用powerupsybr绿色大师混合物(thermo科学公司)进行。研究结果采用gapdh方法进行标准化处理。qpcr采用abi实时荧光定量pcr系统(应用生物系统公司,福斯特市,ca,美国)。基因表达量利用2
‑△△
ct
法计算得出。基因特异性pcr引物见表2。
[0118]
表2、用于qrt-pcr分析的引物序列
[0119]
[0120]
验证集中reg1a和runx3的诊断性能的评估采用深圳人民医院人类生物标本库中的141份血样,对reg1a和runx3进行qpcr分析。
[0121]
dkd(n=50)组和hc(n=41)组被纳入验证集(表3)。在dkd组中,reg1a 和runx3的表达显著上调并与hc组进行了比较(图4中a、图4中b)。reg1a 和runx3的auc分别为0.912和0.859(图4中c)。当reg1a和runx3作为单变量拟合时,开发集的诊断效率为0.917(图3中c),验证集(auc=0.948,95% ci:0.989-0.998)的诊断效率更高(图4中d),说明reg1a和runx3具有较高的诊断价值。在开发集和验证集中,校准曲线的预测值和真实值也高度一致(图5 中a,图5中b),对角线虚线代表了一个理想模型的完美预测。实线表示模型的性能,实线与虚线贴合表示模型越准确。虚线和实线在发展集(图5中a)和验证集(图5中b)的拟合性都非常好。结果表明reg1a和runx3在验证集和发展集中均有令人满意的预测能力,在预测dkd方面具有显著效果。
[0122]
表3、验证队列中健康对照与dkd组中诊断标志物和临床特征的基线信息
[0123][0124]
注:n为样本数。数据以平均值(sd)、中位数(25%四分位数、75%四分位数)或数字(百分比)表示。
[0125]
2、诊断性degs表达水平与临床特征之间的相关性
[0126]
诊断标志物与临床特征的相关性使用r软件中的“ggplot2”包对诊断标志物与临床特征进行spearman相关性分析,随后使用r软件中的“ggplot2”包对结果进行可视化。验证集中的dkd和dm(无dkd)组的诊断标记物和临床特征的基线资料见表4。
[0127]
表4、dm和dkd组诊断标志物和临床特征的基线信息
[0128][0129]
注:n为样本数。数据以平均值(sd)、中位数(25%四分位数,75%四分位数)或数字(百分比)表示。简称:bmi:体重指数、fbg:空腹血糖、c-p:c肽、 hba1c:糖化血红蛋白a1c、scr:血清肌酐、肾小球滤过率(egfr):估算肾小球滤过率、ua:尿酸、uacr:尿白蛋白肌酐比值、tg:甘油三酯、tc:总胆固醇、hdl-c:高密度脂蛋白胆固醇、ldl-c:低密度脂蛋白胆固醇。
[0130]
分析结果发现,dkd组中reg1a和runx3的表达水平明显高于dm组(图 6中a,图6中b)。reg1a与血清肌酐(scr)、c肽(c-p)、hba1c、空腹血糖(fbg)、尿白蛋白肌酐比值(uacr)呈正相关,与egfr水平呈负相关(图6 中c)。runx3与uacr、scr水平呈正相关,与egfr水平呈负相关(图6中d)。结果表明,reg1a和runx3均与临床特征尿白蛋白肌酐比值(uacr)、血清肌酐(scr)呈正相关关系,与肾小球滤过率(egfr)水平呈负相关关系。而目前dkd 的诊断主要是根据uacr增高或egfr下降而做出的临床诊断,提示临床检测 reg1a和/或runx3的表达水平对dkd的诊断具有指导意义。
[0131]
3、诊断标志物及临床特征的km分析
[0132]
使用r软件“survival”软件包构建已识别的生物标志物kaplan-meier(km)曲线的预后潜力分析,以评估dkd在特定时间段发生的概率,并使用对数秩检验来确定组之间的差异。采用单因素和多因素cox比例风险模型评估诊断标志物的预后价值(表5)。采用kaplan-meier(km)方法分析相应时间段内dkd发生的概率,变量包括诊断性degs和临床特征。以dkd为终点事件,与不良预后相关的变量包括reg1a、runx3、总胆固醇(tc)、fbg、scr、体重指数
(bmi)和uacr,而高密度脂蛋白胆固醇(hdl-c)、年龄(age)和egfr的升高均提示预后良好 (表5)。最后我们将reg1a和runx3按照表达的高低分为4组,结果显示两者均高表达组患者预后最差(hr=6.87)(表6)。综上所述,reg1a和runx3不仅可作为dkd患者的诊断标记物,而且reg1a和runx3也与dkd预后密切相关。
[0133]
表5诊断标志物和临床特征的单变量cox回归
[0134][0135]
hr:危险比;ci:置信区间;tc:总胆固醇(mmol/l);fbg:空腹血糖(mmol/l);scr:血清肌酐(μmol/l);hdl-c:高密度脂蛋白(mmol/l);age:年龄(年);egfr:估算肾小球滤过率(ml/min/1.73m2);bmi:体质指数(kg/cm2);ucr:尿蛋白肌酐比(mg/g)。
[0136]
表6:reg1a和runx3不同表达水平组合的hr值
[0137][0138]
采用单因素cox回归来确定hr;报告的对数-rankp值;bonferroni检验多重检验调整进行两两比较。reg1a的高、低表达截点:1.93;runx3的高、低表达截点: 1.79。hr:危险比。
[0139]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1