一种抗癌化合物及其制药用途
1.本发明属于制药领域,具体涉及一种抗癌化合物及其制药用途。
背景技术:
2.甲状腺癌是头颈部常见的恶性肿瘤,近年来,甲状腺癌发病率每年递增约6%,在15~24岁年龄段中,甲状腺癌患者占所有恶性肿瘤患者的7.5%-10.0%。甲状腺乳头状癌是甲状腺癌中最常见的病理类型,属分化型,恶性度较其他类型低,但对放化疗不敏感,因此手术治疗仍是目前最有效的治疗方法。近年来,甲状腺乳头状癌发病率逐年上升,占甲状腺癌发病率的90%以上。由于诊断水平的提高及诊断程序的改进,使更小的肿瘤(尤其是微小乳头状癌)的检测成为可能,甲状腺癌的年发病率在过去40年中几乎增加了2倍。甲状腺乳头状癌发展缓慢,临床不适症状少见,因而其疾病性质易被忽视。甲状腺乳头状癌早期易发生淋巴转移,有报道称约40%~60%的甲状腺乳头状癌病例在首诊时已发生颈部淋巴结转移,且淋巴结转移患者的复发率约是未转移病例的6倍。因而研究甲状腺乳头状癌的发病机制并探寻新的防治方法成为研究的热点。
3.熊果酸(简称ua)作为一种广泛存在于果蔬中的天然物质,近年来其抗肿瘤作用得到了国内外学者的普遍关注。目前与熊果酸相关抗肿瘤作用研究已涉及乳腺癌、肝癌、肺癌、胃癌等多个方面,并取得了实质性进展。候东升等(医学研究生学报,2020年7月第33卷第7期,720-725页)对甲状腺乳头状癌tpc-1细胞进行熊果酸干预,检测其对tpc-1细胞增殖的影响时发现,随熊果酸浓度的逐渐增加,tpc-1细胞的增殖抑制率逐渐增大,说明熊果酸对tpc-1细胞增值具有一定的抑制作用。进一步研究发现熊果酸可通过抑制甲状腺乳头状癌tpc-1细胞中存活素及vegf的表达,进而有效抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡及影响肿瘤组织的血管生成;其诱导凋亡途径可能通过增加线粒体内活性氧含量,导致线粒体膜电位下降,进而启动线粒体凋亡途径来实现。
4.但是,熊果酸对抑制甲状腺乳头状癌tpc-1细胞增殖的效果还有待进一步提高。
技术实现要素:
5.本发明的目的在于提供一种抗癌化合物及其制药用途。
6.本发明提供了一种化合物、其药学上可接受的盐、其立体异构体,所述化合物的结构如式i所示:
[0007][0008]
其中,m选自1、2、3、4;
[0009]
r1各自独立地选自氢、c
1~5
烷基;
[0010]
r5、r6各自独立地选自氢、c
1~5
烷基,r7选自=o、羟基、oac、nr
11r12
,r
11
、r
12
各自独立地选自氢、c
1~5
烷基;或者r5、r6连接形成共价键;或者r6、r7连接形成稠环烷基或杂稠环基;
[0011]
r8、r9连接形成共价键,r
10
选自羧基、y选自o、nh、5~6元饱和杂环基,p选自0、1、2、3、4、5,a环选自取代或未取代的5~6元杂芳基、取代或未取代的5~6元饱和杂环基;或者r8选自卤素,r9、r
10
连接形成
[0012]
且当r7为羟基时,r
10
不为羧基。
[0013]
进一步地,所述化合物的结构如式ii所示:
[0014][0015]
其中,m选自1、2、3、4;
[0016]
r1各自独立地选自氢、c
1~3
烷基;
[0017]
n选自0、1、2、3、4;
[0018]
r2选自5~6元饱和环烷基、5~6元饱和杂环基、5~6元芳基、5~6元杂芳基。
[0019]
进一步地,所述化合物的结构如式iii所示:
[0020][0021]
其中,m选自1、2、3、4;
[0022]
r1各自独立地选自氢、c
1~3
烷基;
[0023]
r3选自氢、c
1~3
烷基;
[0024]
r4选自氢、c
1~3
烷基。
[0025]
进一步地,所述化合物的结构如式iv所示:
[0026][0027]
其中,m选自1、2、3、4;
[0028]
r1各自独立地选自氢、c
1~3
烷基;
[0029]
x为卤素;
[0030]
r3选自氢、c
1~3
烷基。
[0031]
进一步地,所述化合物选自:
[0032]
[0033]
[0034][0035]
本发明还提供了一种抗癌药物,它是以上述化合物、其药学上可接受的盐、其立体异构体为活性成分,加上药学上可接受的盐制备而成的制剂。
[0036]
本发明还提供了上述化合物、其药学上可接受的盐、其立体异构体在制备预防和/或治疗癌症的药物中的用途。
[0037]
进一步地,所述癌症为甲状腺癌,所述甲状腺癌优选为甲状腺乳头状癌。
[0038]
进一步地,所述药物能够调控癌细胞中的wnt/β-catenin、mapk、pi3k和/或tshr信号通路。
[0039]
进一步地,所述药物能够上调wif-1蛋白,上调dkk1蛋白,下调p-β-catenin蛋白,下调mek蛋白,下调p-mek蛋白,下调ras蛋白,上调pten蛋白,上调txnip蛋白,上调creb蛋白,和/或下调tshr蛋白。
[0040]
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
[0041]
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀c
a~b
烷基表示任何含“a”至“b”个碳原子的烷基。例如,c
1~5
烷基是指包含1~5个碳原子的直链或支链的烷基。
[0042]“稠环烷基”指多环的环烷基,且该多环的环烷基中有两个环共用两个相邻的碳原子。
[0043]“杂稠环基”指多环的杂环基,且该多环的杂环基中有两个环共用两个相邻的碳原
子或杂原子。
[0044]“杂芳基”指包含一个到多个杂原子的杂芳族基团。这里所指的杂原子包括氧、硫和氮。例如呋喃基、噻吩基、吡啶基、吡唑基、吡咯基、n-烷基吡咯基、嘧啶基、吡嗪基、咪唑基、四唑基等。
[0045]“杂环基”指饱和或不饱和的环状烃取代基,环状烃携带至少一个环杂原子(包括但不限于o、s或n)。“5~6元饱和杂环基”指环原子数为5~6的、饱和的杂环基。
[0046]
卤素为氟、氯、溴或碘。
[0047]
实验结果表明,本发明化合物可以通过wnt/β-catenin、mapk、pi3k、tshr信号通路抑制甲状腺乳头状癌细胞增殖,诱导细胞凋亡。并且,与熊果酸ua相比,本发明化合物ua-3、ua-9、ua-10、ua-19对甲状腺乳头状癌细胞的抑制效果更明显,诱导细胞凋亡的作用更强,对wnt/β-catenin、mapk、pi3k、tshr信号通路的调控作用更优异。
[0048]
本发明提供的化合物在制备预防和/或治疗甲状腺乳头状癌的药物中具有广阔的应用前景。
[0049]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0050]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
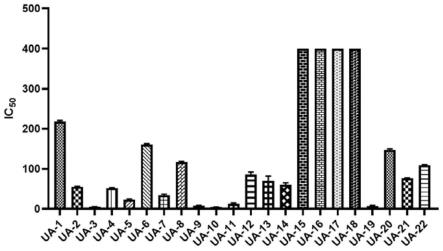
[0051]
图1:化合物对tpc-1细胞的ic
50
值。
[0052]
图2:化合物对nthy-ori3-1细胞的ic
50
值。
[0053]
图3:转录组测序信息分析流程示意图。
[0054]
图4:ua-3作用ptc的rna测序分析实验的表达水平。
[0055]
图5:ua-3作用ptc的rna测序分析实验的样本相关性分析。
[0056]
图6:qrt-pcr扩增、产物熔解曲线。
[0057]
图7:ua和ua-3对tpc-1细胞gsk3βmrna表达水平的影响。
[0058]
图8:ua和ua-3对tpc-1细胞sox7 mrna表达水平的影响。
[0059]
图9:ua和ua-3对tpc-1细胞wif-1mrna表达水平的影响。
[0060]
图10:ua和ua-3对tpc-1细胞dkk1 mrna表达水平的影响。
[0061]
图11:ua和ua-3对tpc-1细胞rhoa mrna表达水平的影响。
[0062]
图12:ua和ua-3对tpc-1细胞mtor mrna表达水平的影响。
[0063]
图13:ua和ua-3对tpc-1细胞pten mrna表达水平的影响。
[0064]
图14:ua和ua-3对tpc-1细胞p53 mrna表达水平的影响。
[0065]
图15:ua和ua-3对tpc-1细胞erk mrna表达水平的影响。
[0066]
图16:ua和ua-3对tpc-1细胞p21ras mrna表达水平的影响。
[0067]
图17:ua和ua-3对tpc-1细胞brafv600e mrna表达水平的影响。
[0068]
图18:ua和ua-3对tpc-1细胞creb mrna表达水平的影响。
[0069]
图19:ua和ua-3对tpc-1细胞txnip mrna表达水平的影响。
[0070]
图20:ua及ua-3对tpc-1细胞凋亡的影响。
[0071]
图21:ua及ua-3对tpc-1细胞早期凋亡率的影响。
[0072]
图22:ua及ua-3对tpc-1细胞晚期凋亡率的影响。
[0073]
图23:ua及ua-3对tpc-1细胞总凋亡率的影响。
[0074]
图24:各组对dkk1蛋白表达的影响。
[0075]
图25:各组对c-myc蛋白表达的影响。
[0076]
图26:各组对β-catenin蛋白表达的影响。
[0077]
图27:各组对p-β-catenin蛋白表达的影响。
[0078]
图28:各组对p-mek蛋白表达的影响。
[0079]
图29:各组对pten蛋白表达的影响。
[0080]
图30:各组对tshr蛋白表达的影响。
[0081]
图31:各组对creb蛋白表达的影响。
[0082]
图32:各组对txnip蛋白表达的影响。
具体实施方式
[0083]
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
[0084]
实施例1:制备化合物ua-2、ua-3、ua-4、ua-6、ua-19、ua-21
[0085]
按照以下合成路线1,制备化合物ua-2、ua-3、ua-4、ua-6、ua-19、ua-21:
[0086][0087]
1.1化合物a1的合成
[0088]
取熊果酸(4.57g,10mmol)于100ml圆底烧瓶中,加入50ml丙酮将其溶解后,搅拌状态下加入琼斯试剂(7.5ml,20mmol),室温条件下继续反应5h。tlc检测反应完成后,乙酸乙酯萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
石油醚
:v
乙酸乙酯
=5:1)分离纯化,即可获得化合物a1。
[0089]
1.2化合物a2的合成
[0090]
取化合物a1(4.55g,10mmol)于100ml圆底烧瓶中,加入邻氨基苯甲醛(1.57g,
13mmol),加入50ml无水乙醇将其溶解,再加入氢氧化钾(1.12g,20mmol)后,油浴加热至90℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,搅拌状态下加入饱和氯化铵水溶液至ph=5~6,继续搅拌1h。二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
石油醚
:v
乙酸乙酯
=3:1)分离纯化,即可获得化合物a2。
[0091]
1.3 ua-3、ua-4和ua-19的合成
[0092]
取化合物a2(6.47g,10mmol)于100ml圆底烧瓶中,加入无水碳酸钾(2.76g,20mmol)和50ml干燥n,n-二甲基甲酰胺,再加入1,2-二溴乙烷(5.64g,30mmol)或1,3-二溴丙烷(6.06g,30mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物无需纯化,直接投入下一步反应。
[0093]
分别取上述残余物(1.94g,3mmol)于50ml圆底烧瓶中,各加入无水碳酸钾(0.83g,6mmol),再分别加入1,2,4-三氮唑(0.41g,6mmol)、咪唑(0.41g,6mmol)和哌嗪(0.52g,6mmol),各加入15ml干燥乙腈,油浴加热至90℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=10:1:0.1)分离纯化,即可分别得到获得ua-3、ua-4和ua-19。
[0094]
1.4 ua-2和ua-6的合成
[0095]
取化合物a2(2.70g,5mmol)于50ml圆底烧瓶中,加入无水碳酸钾(1.38g,10mmol)和25ml干燥n,n-二甲基甲酰胺,再加入溴丙炔(1.78g,15mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物无需纯化,直接投入下一步反应。
[0096]
分别取上述化合物(1.16g,2mmol)于50ml圆底烧瓶中,分别加入2-溴-4
’‑
氟苯乙酮(0.56g,2.4mmol)和2-溴-4
’‑
氯苯乙酮(0.52g,2.4mmol),各加入五水硫酸铜(0.05g,0.2mmol)和10ml无水乙醇,再加入叠氮化钠(0.16g,2.4mmol),油浴加热至65℃,反应5h。tlc检测反应完成后,待反应体系冷却至室温,缓慢滴加饱和氯化铵水溶液以淬灭反应,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可分别得到ua-2和ua-6。
[0097]
1.5 ua-21的合成
[0098]
取化合物a2(2.70g,5mmol)于100ml圆底烧瓶中,加入25ml氯仿使其溶解,冰浴冷却至0℃,于搅拌状态下加入氯化亚砜(0.54ml,7.5mmol)后,移除冰浴,室温反应1h。再于冰浴条件下依次加入2-羟基-4
’‑
哌嗪基查尔酮(1.30g,4.2mmol)和无水碳酸钾(1.38g,10mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸钾水溶液至无气泡冒出,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可获得ua-21。
[0099]
实施例2:制备化合物ua-1、ua-5、ua-7、ua-8、ua-11、ua-12、ua-13、ua-14、ua-15、
ua-17
[0100]
按照以下合成路线2,制备化合物ua-1、ua-5、ua-7、ua-8、ua-11、ua-12、ua-13、ua-14、ua-15、ua-17:
[0101][0102]
2.1化合物b1的合成
[0103]
取化合物a1(5.62g,10mmol)于100ml圆底烧瓶中,加入50ml二氯甲烷二甲基亚砜混合溶液(v
二氯甲烷
:v
甲醇
=1:1)使其溶解,再加入2-碘酰基苯甲酸(8.4g,30mmol),室温反应过夜。tlc检测反应完成后,二氯甲烷萃取(3
×
50ml),合并有机层,用水洗涤(3
×
50ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
石油醚
:v
乙酸乙酯
=20:1)分离纯化,即可获得化合物b1。
[0104]
2.2化合物b2的合成
[0105]
取化合物a1(4.55g,10mmol)于100ml圆底烧瓶中,加入无水碳酸钾(2.76g,20mmol)和50ml干燥n,n-二甲基甲酰胺,再向其中加入1,2-二溴乙烷(5.64g,30mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物即为化合物b2,无需纯化,直接投入下一步反应。
[0106]
2.3化合物b3的合成
[0107]
取化合物b2(5.62g,10mmol)于100ml圆底烧瓶中,加入50ml二氯甲烷二甲基亚砜混合溶液(v
二氯甲烷
:v
甲醇
=1:1)使其溶解,再加入2-碘酰基苯甲酸(8.4g,30mmol),室温反应过夜。tlc检测反应完成后,二氯甲烷萃取(3
×
50ml),合并有机层,用水洗涤(3
×
50ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
石油醚
:v
乙酸乙酯
=20:
1)分离纯化,即可获得化合物b3。
[0108]
2.4 ua-1和ua-8的合成
[0109]
取化合物b1(2.26g,5mmol)于50ml圆底烧瓶中,加入无水碳酸钾(1.38g,10mmol)和25ml干燥n,n-二甲基甲酰胺,再加入溴丙炔(1.78g,15mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物无需纯化,直接投入下一步反应。
[0110]
分别取上述化合物(0.98g,2mmol)于50ml圆底烧瓶中,分别加入2-溴-4
’‑
氯苯乙酮(0.52g,2.4mmol)和2-溴-4
’‑
氟苯乙酮(0.56g,2.4mmol),各加入五水硫酸铜(0.05g,0.2mmol)和10ml无水乙醇,再加入叠氮化钠(0.16g,2.4mmol),油浴加热至65℃,反应5h。tlc检测反应完成后,待反应体系冷却至室温,缓慢滴加饱和氯化铵水溶液以淬灭反应,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可分别得到ua-1和ua-8。
[0111]
2.5 ua-5和ua-7的合成
[0112]
取化合物b1(5.52g,10mmol)于100ml圆底烧瓶中,加入50ml氯仿使其溶解,冰浴冷却至0℃,于搅拌状态下加入氯化亚砜(1.09ml,15mmol)后,移除冰浴,室温反应1h。再于冰浴条件下依次加入丙炔胺(0.46g,8.3mmol)和无水碳酸钾(2.76g,20mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸钾水溶液至无气泡冒出,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=100:1:1)分离纯化,所得化合物可用于下一步反应。
[0113]
分别取上述化合物(0.98g,2mmol)于50ml圆底烧瓶中,分别加入2-溴-4
’‑
氟苯乙酮(0.56g,2.4mmol)和2-溴-4
’‑
氯苯乙酮(0.52g,2.4mmol),各加入五水硫酸铜(0.05g,0.2mmol)和10ml无水乙醇,再加入叠氮化钠(0.16g,2.4mmol),油浴加热至65℃,反应5h。tlc检测反应完成后,待反应体系冷却至室温,缓慢滴加饱和氯化铵水溶液以淬灭反应,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可分别得到ua-5和ua-7。
[0114]
2.6 ua-17的合成
[0115]
取化合物b2(0.56g,1mmol)于50ml圆底烧瓶中,加入无水碳酸钾(0.28g,2mmol)和哌嗪(0.17g,2mmol),再加入10ml干燥乙腈,油浴加热至90℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=10:1:0.1)分离纯化,所得化合物可进行下一步反应。
[0116]
取4-乙酰基苯甲酸(0.25g,1.5mmol)于50ml圆底烧瓶中,加入10ml氯仿使其溶解,冰浴冷却至0℃,于搅拌状态下加入氯化亚砜(0.16ml,2.25mmol)后,移除冰浴,室温反应1h。再于冰浴条件下依次加入上述合成的化合物和无水碳酸钾(0.28g,2mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓
慢滴加稀碳酸钾水溶液至无气泡冒出,继续搅拌1h后,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可获得ua-17。
[0117]
2.7 ua-11~15的合成
[0118]
取化合物b3(5.62g,10mmol)于100ml圆底烧瓶中,加入无水碳酸钾(2.76g,20mmol)和哌嗪(1.72g,20mmol),再加入50ml干燥乙腈,油浴加热至90℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=10:1:0.1)分离纯化,即可获得ua-11。
[0119]
分别取化合物ua-11(0.56g,1mmol)于50ml圆底烧瓶中,分别加入无水碳酸钾(0.28g,2mmol),加入10ml二氯甲烷,再分别于冰浴条件下加入氯丙酰氯(0.15g,1.2mmol)、丙烯酰氯(0.11g,1.2mmol)、甲基丙烯酰氯(0.13g,1.2mmol)和4-氯苯甲酰氯(0.21g,1.2mmol),室温反应过夜。tlc检测反应完成后,于冰浴条件下加入稀氢氧化钠水溶液至无气泡冒出,继续搅拌30min后,二氯甲烷萃取(3
×
10ml),合并有机层,用水洗涤(3
×
10ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可分别获得ua-12、ua-13、ua-14、ua-15。
[0120]
实施例3:制备化合物ua-9、ua-10
[0121]
按照以下合成路线3,制备化合物ua-9、ua-10:
[0122][0123]
3.1 ua-9的合成
[0124]
取化合物a1(4.55g,10mmol)于100ml圆底烧瓶中,加入氯化铵(2.67g,50mmol)和氰基硼氢化钠(1.26g,20mmol),再加入50ml甲醇,室温反应2h后,油浴加热至80℃,回流反应12h。tlc检测反应完成后,将反应体系真空浓缩除去甲醇,再加入稀氢氧化钠水溶液将残余物溶解后继续搅拌1h,乙酸乙酯萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
石油醚
:v
乙酸乙酯
=3:1)分离纯化,即可获得ua-9。
[0125]
3.2 ua-10的合成
[0126]
取化合物ua-9(455mg,1mmol)于25ml圆底烧瓶中,加入二氯甲烷(10ml)溶解,再加入n-溴代丁二酰亚胺(213mg,1.2mmol),室温反应5h。tlc检测反应完成后,将反应体系真空浓缩,残余物经硅胶柱层析(洗脱剂:v
石油醚
:v
乙酸乙酯
=5:1)分离纯化,即可获得ua-10。
[0127]
实施例4:制备化合物ua-16、ua-18
[0128]
按照以下合成路线4,制备化合物ua-16、ua-18:
[0129][0130]
4.1 ua-16的合成
[0131]
取熊果酸(2.28g,5mmol)于100ml圆底烧瓶中,加入无水碳酸钾(1.38g,10mmol)和25ml干燥n,n-二甲基甲酰胺,再向其中加入1,2-二溴乙烷(2.82g,15mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物无需纯化,直接投入下一步反应。
[0132]
取上述化合物(2.82g,5mmol)于100ml圆底烧瓶中,加入无水碳酸钾(1.38g,10mmol)和哌嗪(0.86g,10mmol),再加入25ml干燥乙腈,油浴加热至90℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=10:1:0.1)分离纯化,所得化合物可进行下一步反应。
[0133]
取4-乙酰基苯甲酸(0.98g,6mmol)于50ml圆底烧瓶中,加入30ml氯仿使其溶解,冰浴冷却至0℃,于搅拌状态下加入氯化亚砜(0.16ml,9mmol)后,移除冰浴,室温反应1h。再于冰浴条件下依次加入上述合成的化合物和无水碳酸钾(1.38g,10mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸钾水溶液至无气泡冒出,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可获得ua-16。
[0134]
4.2 ua-18的合成
[0135]
取ua-16(0.76g,1mmol)于50ml圆底烧瓶中,加入10ml二氯甲烷将其溶解,加入乙酸酐(0.28ml,3mmol),再向其中缓慢滴加三乙胺(0.42ml,3mmol),油浴加热至35℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸氢钠水溶液至ph=7,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可获得ua-18。
[0136]
实施例5:制备化合物ua-20、ua-22
[0137]
按照以下合成路线5,制备化合物ua-20、ua-22:
[0138][0139]
5.1 ua-20的合成
[0140]
取熊果酸(0.91g,2mmol)于50ml圆底烧瓶中,加入10ml氯仿使其溶解,冰浴冷却至0℃,于搅拌状态下加入氯化亚砜(0.22ml,3mmol)后,移除冰浴,室温反应1h。再于冰浴条件下依次加入4-哌嗪苯乙酮(0.35g,1.7mmol)和无水碳酸钾(0.47g,3.4mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸钾水溶液至无气泡冒出,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,可用于下一步反应。
[0141]
取上述化合物于50ml圆底烧瓶中,加入10ml二氯甲烷将其溶解,加入乙酸酐(0.56ml,6mmol),再向其中缓慢滴加三乙胺(0.84ml,6mmol),油浴加热至35℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸氢钠水溶液至ph=7,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可获得ua-20。
[0142]
5.2 ua-22的合成
[0143]
取熊果酸(0.91g,2mmol)于50ml圆底烧瓶中,加入10ml氯仿使其溶解,冰浴冷却至0℃,于搅拌状态下加入氯化亚砜(0.22ml,3mmol)后,移除冰浴,室温反应1h。再于冰浴条件下依次加入4-氨基-4
’‑
甲基哌嗪基查尔酮(0.55g,1.7mmol)和无水碳酸钾(0.47g,3.4mmol),油浴加热至60℃,反应过夜。tlc检测反应完成后,待反应体系冷却至室温,冰浴条件下向反应体系中缓慢滴加稀碳酸钾水溶液至无气泡冒出,继续搅拌1h后,二氯甲烷萃取(3
×
20ml),合并有机层,用水洗涤(3
×
20ml),有机层经无水硫酸钠干燥后,过滤,真空浓缩,残余物经硅胶柱层析(洗脱剂:v
二氯甲烷
:v
甲醇
:v
三乙胺
=50:1:0.5)分离纯化,即可获得ua-22。
[0144]
表1.化合物ua-1~ua-22的结构
[0145]
[0146]
[0147]
[0148][0149]
以下通过实验例证明本发明的有益效果。
[0150]
实验例1:测试化合物对甲状腺乳头状癌细胞增殖的影响
[0151]
1.实验材料实验细胞:tpc-1和nthy-ori3-1细胞,贴壁生长,购自吉妮欧生物有限公司。
[0152]
2.实验方法
[0153]
2.1试剂配制
[0154]
2.1.1完全培养基(含10%胎牛血清)
[0155]
10%胎牛血清和1%双抗加入ripm-1640基础培养基,混匀备用。
[0156]
2.1.2细胞冻存液
[0157]
90%胎牛血清、10%dmso加入离心管中混匀,4℃保存。
[0158]
2.1.3 mtt溶液
[0159]
称取一定量mtt粉末,加入pbs配制成浓度为5mg/ml的溶液,避光,4℃保存。
[0160]
2.2细胞的培养
[0161]
2.2.1细胞培养
[0162]
完全培养基加入含有tpc-1、nthy-ori3-1细胞培养瓶中,于孵箱中培育,定期观察换液。
[0163]
2.2.2细胞传代
[0164]
细胞生长到约70%~80%度后,使用胰酶消化细胞,于孵箱中孵育3min后,显微镜观察,细胞消化成单个细胞离心,轻轻用完全培养基吹打混匀,取少量悬液于加入完全培养基的培养瓶中,放置孵箱中培养。
[0165]
2.2.3细胞冻存
[0166]
取生长较好的细胞,消化收集细胞,加入冻存液混悬细胞,放置4℃冰箱30min、-20℃1h后,转到-80℃冰箱过夜,液氮保存。
[0167]
2.2.4细胞复苏
[0168]
冻存管37℃水浴快速解冻,细胞悬液转移至离心管,加入9倍体积的完全培养基,离心。用完全培养基混悬,接种于培养瓶,置于孵箱中培养,定期换液。
[0169]
2.3 ua对nthy-ori3-1、tpc-1细胞增殖的影响
[0170]
2.3.1 ua的配制
[0171]
根据预实验结果,将化合物ua设5个受试浓度1.5、3、6、12、24μm。称取ua加入一定量的dmso溶解后,加入一定量的完全培养基配制成母液,按比例稀释成其余各浓度。
[0172]
2.3.2溶媒对照
[0173]
计算ua最高浓度组(24μm)中dmso含量,加入与ua最高浓度组相同量用完全培养基配制溶液作为溶媒对照组,此时dmso的浓度为0.06%。
[0174]
2.3.3方法
[0175]
培养tpc-1、nthy-ori3-1细胞,取对数生长期的细胞胰酶消化,离心,完全培养基打散后计数,调整细胞浓度后加入96孔培养板,放入培养箱24h后加不同提取物使其终浓度为(每个浓度5个),并设阴性对照(培养基)及溶媒对照,在培养箱中放置48h后加入20,继续孵育4h,在570nm和630nm波长处检测od值,重复3次。
[0176]
2.4 ua衍生物对tpc-1、nthy-ori3-1细胞增殖的影响
[0177]
2.4.1 ua衍生物的配制
[0178]
将本发明实施例合成的22个ua衍生物ua-1到ua-22,为分别设25、50、100、200、400、800μm共6个受试浓度。具体配制方法同2.3.1。
[0179]
2.4.2溶媒对照
[0180]
计算ua衍生物分子量最大的化合物ua-1最高浓度组(800μm)中dmso含量,加入与ua最高浓度组相同量用完全培养基配制溶液作为溶媒对照组,此时dmso的浓度为2.14%。
[0181]
2.4.3方法
[0182]
同2.1.3。
[0183]
2.5结果计算及分析
[0184]
计算不同浓度的od值均数及标准差,按下列公式计算细胞增殖抑制率:
[0185]
od
给药孔
=od
570nm-od
630nm
[0186]
抑制率(%)=(od阴性孔-od给药孔)/od阴性孔
×
100%
[0187]
采用spss软件计算药物的半数抑制浓度ic
50
。
[0188]
3.实验结果
[0189]
表2.ua、ua-1~ua-22对tpc-1细胞和nthy-ori3-1细胞的ic
50
值
[0190][0191][0192]
化合物对tpc-1细胞的作用结果如图1和表2所示。可以看出,本发明化合物能够有效抑制tpc-1细胞增殖;并且,与熊果酸(简称ua)相比,化合物ua-9、ua-10、ua-3、ua-19对tpc-1细胞增殖的抑制效果更优。
[0193]
化合物对nthy-ori3-1细胞的作用结果如图2和表2所示。可以看出,本发明化合物对正常甲状腺上皮细胞的毒性较小。
[0194]
上述结果表明,本发明化合物能够有效抑制甲状腺乳头状癌细胞,能够用于制备预防和/或治疗甲状腺乳头状癌的药物。
[0195]
实验例2:ua-3作用ptc的rna测序分析
[0196]
1.实验材料
[0197]
1.1受试样品
[0198]
ua-3。
[0199]
1.2细胞株
[0200]
nthy-ori3-1细胞和tpc-1细胞。
[0201]
1.3主要试剂与药品
[0202]
表3.主要试剂与药品
[0203]
名称厂家批号trigen rna提取试剂盒genstar20200519异丙醇广东光华20200104无水乙醇广东光华20200128逆转录试剂盒takara公司ak1216sybr select master mixpromega公司20201014琼脂糖genstar20200329tbe索莱宝生物科技有限公司jc1004dna上样缓冲液(5x)索莱宝生物科技有限公司ke0503
[0204]
2.实验方法
[0205]
2.1.试剂配制
[0206]
2.1.1琼脂糖凝胶
[0207]
在烧杯中加入适量琼脂糖干粉、超纯水,混匀后微波炉煮沸。
[0208]
2.1.2 75%、90%乙醇
[0209]
分别取7.5ml、9ml无水乙醇于无菌ep管中,加入2.5ml、1ml无菌超纯水混匀,待用。
[0210]
2.2细胞的培养
[0211]
同实验例1的2.2。
[0212]
2.3 ua作用ptc的rna测序分析
[0213]
2.3.1细胞分组
[0214]
实验分成四组:tpc-1细胞组(t1、t2、t3)、ua-3 2μm组(ua3l-1、ua3l-2、ua3l-3)、ua-3 4μm组(ua3m-1、ua3m-2、ua3m-3)、ua-3 8μm组(ua3h-1、ua3h-2、ua3h-3)。
[0215]
2.3.2 rna提取、质量检测、文库建立、上机测序、结果分析
[0216]
trizol法提取rna,琼脂糖凝胶电泳法检测rna完整性,纯度(od260/280、od260/230比值)、并对rna浓度定量。
[0217]
对mrna按照neb普通建库方式或链特异性建库方式建库,qrt-pcr对文库有效浓度进行准确定量,以保证文库质量。库检合格后,进行illumina测序。
[0218]
rna-seq信息分析包括质控、序列比对、定量、差异分析、功能富集,流程如图3所
示。
[0219]
2.4 qrt-pcr验证富集通路上相关基因的表达
[0220]
实验所用到的细胞样本为转录组测序样本。
[0221]
2.4.1细胞总rna的提取
[0222]
将细胞用胰酶消化,pbs洗涤,离心后加1ml trizol在冰上裂解,加核酸提取液混匀,离心,取上层水相400μl于干净无酶ep管中。加等体积异丙醇颠倒混匀,离心,弃上清,管底白色沉淀即为总rna。
[0223]
加入1ml 75%乙醇洗涤两次,室温干燥,用适量无酶水溶解rna样品,-80℃保存
[0224]
2.4.2检测rna纯度及定量
[0225]
2.4.2.1检测rna纯度
[0226]
检测提取的rna在260nm与280nm波长处吸光度的比值(od260/od280),计算rna样品的纯度,-80℃保存。
[0227]
2.4.2.2变性琼脂糖凝胶电泳检测rna的完整性
[0228]
琼脂糖凝胶加入核酸染料后混匀制备胶,加缓冲液后拔出上样梳,上样,电泳,结束后置胶于透射紫外灯上,观察核酸区28s和18s rna分子区带的带型和亮度比例。
[0229]
28s/18s在1.8~2.0范围内则表明rna完整性较好,基本无降解。电泳条带上应是28s在上,18s在下,且亮度为28s是18s的两倍。
[0230]
2.4.3逆转录合成cdna
[0231]
2.4.3.1将样品rna,加入表4中的反应体系,总反应为20μl计算,事先按照rna浓度计算逆转录体系。按照试剂盒程序包括42℃(15min)的延伸和70℃(15min)的反转录酶灭活,4℃(10min)冷却,取出-20℃保存。
[0232]
表4.rna逆转成cdna反应体系
[0233][0234][0235]
2.4.4 qrt-pcr上机检测
[0236]
2.3.4.1引物序列:引物的设计和合成由昆明中云美有限公司合成、分离、纯化,并经查对genebank和blast验证其可靠性。引物序列如表5:
[0237]
表5.基因引物序列
[0238]
[0239][0240]
2.4.4.2引物配制与分装:将引物按说明书用te缓冲液配制为10μm,-20℃冰箱保存。
[0241]
2.4.4.3 qpcr反应
[0242]
按照表6加样,盖上反应盖,充分涡旋混匀,离心。
[0243]
表6.qpcr反应体系
[0244]
组分每反应加入量2x powerup sybr green master mix10μlnuclease-free water8μlforward primer0.5μlreverse primer0.5μlcdna模板1μl总体积20μl
[0245]
以上反应体系共20μl,引物tm《60℃,按照以下程序进行反应:
[0246]
表7.qpcr反应程序
[0247][0248]
3.统计学分析
[0249]
各组实验数据均以均数
±
标准差(mean
±
sd)表示,用graphpad prism8软软件进行数据统计分析。采用单因素方差分析对各组间结果的比较进行统计,,p<0.05有统计学意义。
[0250]
4.实验结果
[0251]
3.1 ua-3作用ptc的rna测序分析
[0252]
表8.ua-3作用于ptc的rna测序分析结果
[0253][0254]
表9.质控分析
[0255][0256][0257]
注:(1)sample
·
name:样品名。
[0258]
(2)library
·
nmne:文库名。
[0259]
(3)raw
·
reads:原始数据中的reads数。
[0260]
(4)clean
·
reads:原始数据过滤后的reads数。
[0261]
(5)clean
·
bases:原始数据过滤后的碱基数。
[0262]
(6)error
·
rate(%):数据整体测序错误率。
[0263]
(7)q20:phred数值大于20的碱基占总碱基的百分比。
[0264]
(8)q30:phred数值大干30的碱基占总碱基的百分比。
[0265]
(9)gc
·
content:clean
·
reads中g与c占四种碱基的百分比。
[0266]
表10.样本对比分析
[0267][0268][0269]
注:(1)total
·
reads:用于比对分析的clean
·
reads数。
[0270]
(2)total
·
mapped
·
reads(rate):比对到基因组上的reads数及比对到基因组上的reads占总clean
·
reads数的百分比。
[0271]
(3)uniquely
·
mapped
·
reads(rate):比对到基因组单一位置的reads数及比对到基因组单一位置的reads数占总clean
·
reads数的百分比。
[0272]
(4)multiple
·
mapped
·
reads(rate):比对到基因组多个位置的reads数及比对到基因组多个位置的reads数占总clean
·
reads数的百分比。
[0273]
结果如表8-表10、图4-图5所示。由图可知组间皮尔逊相关系数的平方r2均大于0.94,说明样本的重复性好,组间皮尔逊相关系数的平方r2均大于0.88,说明两样本其表达模式有差异。
[0274]
3.2 qrt-pcr验证富集通路相关基因的表达水平
[0275]
3.2.1 ua和ua-3对tpc-1细胞wnt/β-catenin通路上相关基因mrna表达水平的影响
[0276]
表11.ua和ua-3对tpc-1细胞gsk3βmrna表达水平的影响
[0277]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.05
±
0.05ua低浓度组1.16
±
0.03ua中浓度组1.30
±
0.05**ua高浓度组1.45
±
0.08****ua-3低浓度组1.24
±
0.08*ua-3中浓度组1.54
±
0.04****ua-3高浓度组2.10
±
0.20****
[0278]
表12.ua和ua-3对tpc-1细胞sox7 mrna表达水平的影响
[0279]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.18
±
0.02ua低浓度组1.32
±
0.10*ua中浓度组1..59
±
0.12****ua高浓度组1.73
±
0.14****ua-3低浓度组1.30
±
0.21*ua-3中浓度组1.81
±
0.07****ua-3高浓度组2.48
±
0.12****
[0280]
表13.ua和ua-3对tpc-1细胞wif-1mrna表达水平的影响
[0281]
[0282][0283]
表14:ua和ua-3对tpc-1细胞dkk1 mrna表达水平的影响
[0284]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组0.99
±
0.04ua低浓度组1.14
±
0.15ua中浓度组1.30
±
0.25ua高浓度组1.06
±
0.24ua-3低浓度组1.50
±
0.31ua-3中浓度组2.03
±
0.91*ua-3高浓度组2.42
±
0.48**
[0285]
3.2.2 ua和ua-3对tpc-1细胞wnt/ca2+、wnt/pcp通路上相关基因mrna表达水平的影响
[0286]
表15.ua和ua-3对tpc-1细胞rhoa mrna表达水平的影响
[0287]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组0.90
±
0.05ua低浓度组1.00
±
0.09ua中浓度组0.98
±
0.11ua高浓度组0.93
±
0.19ua-3低浓度组0.99
±
0.18ua-3中浓度组0.90
±
0.07ua-3高浓度组0.68
±
0.10
[0288]
3.2.3 ua和ua-3对tpc-1细胞pi3k通路上相关基因mrna表达水平的影响
[0289]
表16.ua和ua-3对tpc-1细胞mtor mrna表达水平的影响
[0290]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.01
±
0.01ua低浓度组0.84
±
0.18ua中浓度组0.77
±
0.09
ua高浓度组0.23
±
0.08**ua-3低浓度组0.95
±
0.12ua-3中浓度组0.67
±
0.13*ua-3高浓度组0.34
±
0.15****
[0291]
表17.ua和ua-3对tpc-1细胞pten mrna表达水平的影响
[0292]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.13
±
0.06ua低浓度组0.21
±
0.09ua中浓度组1.50
±
0.11ua高浓度组2.09
±
0.59***ua-3低浓度组1.84
±
0.30**ua-3中浓度组2.04
±
0.12***ua-3高浓度组3.01
±
0.40****
[0293]
3.2.4 ua和ua-3对tpc-1细胞mapk通路上相关基因mrna表达水平的影响
[0294]
表18.ua和ua-3对tpc-1细胞p53 mrna表达水平的影响
[0295]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.01
±
0.05ua低浓度组1.09
±
0.23ua中浓度组1.51
±
0.23ua高浓度组1.64
±
0.23ua-3低浓度组1.32
±
0.22ua-3中浓度组1.64
±
0.23ua-3高浓度组2.37
±
0.67***
[0296]
表19.ua和ua-3对tpc-1细胞erk mrna表达水平的影响
[0297][0298][0299]
表20.ua和ua-3对tpc-1细胞p21ras mrna表达水平的影响
[0300]
组别相对表达倍数
阴性对照组1.00
±
0.00溶媒对照组1.06
±
0.03ua低浓度组0.84
±
0.36ua中浓度组0.76
±
0.08ua高浓度组0.55
±
0.17ua-3低浓度组0.74
±
0.16ua-3中浓度组0.56
±
0.17ua-3高浓度组0.30
±
0.11**
[0301]
表21.ua和ua-3对tpc-1细胞brafv600e mrna表达水平的影响
[0302]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.09
±
0.09ua低浓度组0.90
±
0.08ua中浓度组0.80
±
0.11**ua高浓度组0.59
±
0.05****ua-3低浓度组0.82
±
0.05*ua-3中浓度组0.67
±
0.04****ua-3高浓度组0.31
±
0.04****
[0303]
3.2.5 ua和ua-3对tpc-1细胞mapk通路上相关基因mrna表达水平的影响
[0304]
表22.ua和ua-3对tpc-1细胞creb mrna表达水平的影响
[0305][0306][0307]
表23.ua和ua-3对tpc-1细胞txnip mrna表达水平的影响
[0308]
组别相对表达倍数阴性对照组1.00
±
0.00溶媒对照组1.07
±
0.06ua低浓度组1.02
±
0.10ua中浓度组1.11
±
0.10ua高浓度组1.16
±
0.03ua-3低浓度组0.99
±
0.09
ua-3中浓度组1.19
±
0.05ua-3高浓度组1.30
±
0.06**
[0309]
上述实验结果表明:与阴性对照组比较,ua 12μm、ua-3 4μm、8μm给药组细胞内wnt/β-catenin通路基因wif-1、dkk1、gsk3β、sox7 mrna表达上调,cyclin d1、β-catenin、c-myc、tnks、jrk、foxm1、pygo2 mrna表达下调;ua、ua-3给药组细胞内wnt/ca
2+
、wnt/pcp通路基因rhoa、pkc、jnk mrna的表达差异均无显著性;ua-3 8μm给药组细胞内mapk基因通路p53 mrna表达上调,erk、p21ras、braf
v600e mrna表达下调;ua 12μm、ua-3 4μm、8μm给药组细胞内pi3k基因通路pten mrna表达上调,akt1、mtor mrna表达下调;ua-3 8μm给药组细胞内tshr通路基因creb txnip mrna表达上调。
[0310]
实验例3:ua和ua-3对tpc-1的作用及机制研究
[0311]
1.实验材料
[0312]
1.1受试样品
[0313]
ua及其衍生物ua-3。
[0314]
1.2细胞株
[0315]
tpc-1细胞。
[0316]
1.3主要试剂与药品
[0317]
表24.主要试剂与药品
[0318]
[0319]
[0320][0321]
2.实验方法
[0322]
2.1试剂配制
[0323]
2.1.1 10%sds溶液
[0324]
1g sds,溶于10ml纯化水,室温保存。
[0325]
2.1.2 10%过硫酸铵溶液
[0326]
1g过硫酸铵,溶于10ml纯化水,-20℃保存。
[0327]
2.1.3 10
×
tris-甘氨酸电泳缓冲液
[0328]
30.3g tris,188g甘氨酸,10g sds,纯化水定容至1l,实验时稀释成1
×
。
[0329]
2.1.4转移缓冲液
[0330]
甘氨酸14.4g,tris 3.03g,200ml甲醇,ph 8.3,定容至1l,现配现用。
[0331]
2.1.5 10
×
tbs
[0332]
nacl 80g,kcl 2g,tris 30g,加800ml双蒸水,ph 7.4,定容到1l,4℃保存。
[0333]
2.1.6 tbst
[0334]
10
×
tbs稀释10倍,加入0.1%(v/v)吐温-20,溶解即为tbst缓冲液,现配现用。
[0335]
2.1.7封闭液
[0336]
5%(w/v)脱脂奶粉的tbst。
[0337]
2.1.8 ripa裂解液的配制
[0338]
取1000μl裂解液加入10μl pmsf溶液,现配现用。
[0339]
2.2细胞的培养
[0340]
同实验例1中的2.2。
[0341]
2.3 ua及ua-3对tpc-1细胞凋亡的影响
[0342]
2.3.1 ua、ua-3和溶媒对照的配制
[0343]
化合物ua设3、6、12μm共3个受试浓度,化合物ua-3设2、4、8μm共3个受试浓度化合物(此浓度根据预试验结果设定)。配置方法同第一部分2.3.1
[0344]
取ua 12μm浓度所含dmso的量,加入高浓度ua组完全培养基用量配制相应的溶媒对照,此时dmso的浓度为0.03%。
[0345]
2.3.2实验方法
[0346]
(1)取对数生长期的tpc-1细胞以6.67
×
104个/ml接种于6孔培养板中,细胞接种24h贴壁后即给ua 3、6、12μm、ua-3 2、4、8μm作用48h,收集细胞,用pbs洗涤,离心收集细胞;
[0347]
(2)分别加入binding buffer和annexin v-fitc混匀细胞,再加入propidium iodide,避光,1h内进行流式细胞仪的检测。
[0348]
2.4 ua和ua-3对tpc-1细胞中wnt/mapk/pi3k/tshr信号通路的影响
[0349]
2.4.1 ua和溶媒对照的配制
[0350]
配置方法同2.4.1。
[0351]
取ua 12μm浓度所含dmso的量,加入高浓度ua组完全培养基用量配制相应的溶媒对照,此时dmso的浓度为0.07%。
[0352]
2.4.2实验方法
[0353]
(1)细胞种板
[0354]
取对数生长期的tpc-1细胞以6.67
×
104个/ml接种于6孔培养板中,24h后给不同浓度ua(3μm、6μm、12μm)、ua-3(2μm、4μm、8μm))作用细胞48h,胰酶消化收集细胞。
[0355]
(2)细胞总蛋白的提取
[0356]
收集细胞,pbs洗涤,在冰上加入ripa裂解液吹打细胞,震荡、离心14000g 5min,收集细胞裂解液上清,分装,变性,-80℃保存。
[0357]
(3)总蛋白浓度测定(bca法)
[0358]
按照试剂说明书配置bca工作液,于96孔板中加入25μl蛋白溶液和200μl bca工作液,混匀,37℃孵育30min,用酶标仪在562nm波长处检测吸光值od,绘制标准曲线y=ax+b,计算各样品蛋白浓度。计算公式:总蛋白浓度(μg/μl)=(od样品-标准曲线截距)/标准曲线斜率。
[0359]
(4)sds-page电泳和western blot分析
[0360]
b.配制压缩胶和分离胶:取两支离心管,一支加入浓缩胶a液和b液(1:1),另一支加入分离胶a液和b液(1:1),且离心管中均加入10%aps(100:1)混匀待用。
[0361]
c.将分离胶灌入模具,胶干后加入浓缩胶,插入梳子,胶干后拔出梳子,加入各组样品和marker,150v电泳。
[0362]
d.转模:电泳后,按转移装置负极板-海绵垫-滤纸-胶-pvdf膜-滤纸-海绵垫-转移装置正极板的顺序放好各层,放入转移槽里,4℃300ma恒流下电泳70min。
[0363]
e.转膜结束后,脱脂奶粉封闭,摇床振摇2h,tbst洗3次,一抗稀释液封闭,过夜,tbst洗3次,室温孵育二抗2h,二抗孵育完后,tbst洗3次。
[0364]
f.将ecl发光液a液和b液按1:1的比例混匀,每张pvdf膜加入200μl,fce化学发光成像系统曝光处理,并观察拍照,使用软件imagej对结果进行灰度分析,计算各组目的蛋白相对于各组内参蛋白的相对表达倍数。
[0365]
3.实验结果
[0366]
3.1 ua及ua-3对tpc-1细胞凋亡的影响
[0367]
表25.ua及ua-3对tpc-1细胞早期凋亡率的影响
[0368]
组别早期凋亡率%阴性对照组3.97
±
0.02溶媒对照组3.61
±
1.32ua 3μm8.82
±
0.15****ua 6μm7.93
±
0.73****ua 12μm34.35
±
1.81****ua-3 2μm7.84
±
1.06****ua-3 4μm18.94
±
0.37****
ua-3 8μm49.36
±
1.82****
[0369]
表26.ua及ua-3对tpc-1细胞晚期凋亡率的影响
[0370]
组别晚期凋亡率%阴性对照组3.25
±
0.13溶媒对照组3.56
±
0.31ua 3μm5.78
±
2.84**ua 6μm11.34
±
1.63****ua 12μm38.2
±
2.86****ua-3 2μm3.62
±
1.69ua-3 4μm11.85
±
2.93****ua-3 8μm32.7
±
2.47****
[0371]
表27:ua及ua-3对tpc-1细胞总凋亡率的影响
[0372]
组别总凋亡率%阴性对照组6.93
±
0.09溶媒对照组7.03
±
1.07ua 3μm14.87
±
2.33****ua 6μm19.82
±
2.17****ua 12μm73.24
±
2.79****ua-3 2μm11.28
±
1.96**ua-3 4μm31.06
±
2.65****ua-3 8μm81.92
±
3.31****
[0373]
上述实验结果表明:与ua相比,ua-3诱导tpc-1细胞凋亡的效果更强。
[0374]
3.2 ua和ua-3对tpc-1细胞中wnt/β-catenin通路相关蛋白的影响
[0375]
3.2.1 tpc-1细胞中dkk1蛋白表达的变化情况
[0376]
表28.各组对dkk1蛋白表达的影响
[0377]
组别相对表达倍数阴性对照组1溶媒对照组0.95
±
0.04ua低浓度组1.52
±
0.06***ua中浓度组1.93
±
0.06***ua高浓度组1.93
±
0.03****ua-3低浓度组1.78
±
0.17****ua-3中浓度组1.87
±
0.10****ua-3高浓度组2.11
±
0.17****
[0378]
注:与阴性对照组比较:***p《0.001,****p《0.0001
[0379]
与阴性对照组相比,溶媒对照组tpc-1细胞中dkk1表达无显著性,ua低、中、高浓度组、ua-3低、中、高浓度组tpc-1细胞中dkk1表达上调(p《0.05);ua-3给药组与ua给药组相比,其作用于tpc-1细胞dkk1表达上调更明显。
[0380]
3.2.2 tpc-1细胞中c-myc蛋白表达的变化情况
[0381]
表29.各组对c-myc蛋白表达的影响
[0382]
组别相对表达倍数阴性对照组1溶媒对照组0.95
±
0.03ua低浓度组0.73
±
0.03****ua中浓度组0.66
±
0.04****ua高浓度组0.68
±
0.02****ua-3低浓度组0.87
±
0.03****ua-3中浓度组0.46
±
0.02****ua-3高浓度组0.41
±
0.01****
[0383]
注:与阴性对照组比较:****p《0.0001
[0384]
与阴性对照组相比,溶媒对照组tpc-1细胞中c-myc表达无显著性,ua低、中、高浓度组、ua-3低、中、高浓度组tpc-1细胞中c-myc表达下调(p《0.05);ua-3给药组与ua给药组相比,其作用于tpc-1细胞c-myc表达下调更明显。
[0385]
3.2.3 tpc-1细胞中β-catenin蛋白表达的变化情况
[0386]
表30.各组对β-catenin蛋白表达的影响
[0387][0388][0389]
注:与阴性对照组比较:****p《0.0001
[0390]
与阴性对照组相比,溶媒对照组tpc-1细胞中β-catenin表达无显著性,ua-3高浓度tpc-1细胞中β-catenin表达下调(p《0.05)。
[0391]
3.2.4 tpc-1细胞中p-β-catenin蛋白表达的变化情况
[0392]
表31.各组对p-β-catenin蛋白表达的影响
[0393]
组别相对表达倍数阴性对照组1溶媒对照组1.00
±
0.01ua低浓度组1.05
±
0.02ua中浓度组1.12
±
0.09*ua高浓度组0.72
±
0.01****
ua-3低浓度组0.85
±
0.01**ua-3中浓度组0.82
±
0.01***ua-3高浓度组0.43
±
0.04****
[0394]
注:与阴性对照组比较:*p《0.05,**p《0.01,***p《0.001,****p《0.0001
[0395]
与阴性对照组相比,溶媒对照组tpc-1细胞中p-β-catenin表达无显著性,ua中浓度组tpc-1细胞中p-β-catenin表达上调(p《0.05),ua高浓度组、ua-3低、中、高浓度组tpc-1细胞中p-β-catenin表达下调(p《0.05)。
[0396]
上述实验结果表明:ua-3处理后,tpc-1细胞中wnt/β-catenin信号通路中抑癌基因dkk1表达上调,cyclind1、β-catenin、p-β-catenin蛋白表达下调;且与ua相比,ua-3组dkk1、c-myc、cyclind1、β-catenin、p-β-catenin蛋白表达水平更为显著。
[0397]
3.3 ua和ua-3对tpc-1细胞中mapk通路相关蛋白的影响
[0398]
3.3.1 tpc-1细胞中p-mek蛋白表达的变化情况
[0399]
表32.各组对p-mek蛋白表达的影响
[0400]
组别相对表达倍数阴性对照组1溶媒对照组1.16
±
0.03**ua低浓度组1.10
±
0.01*ua中浓度组1.13
±
0.01**ua高浓度组1.00
±
0.04ua-3低浓度组0.81
±
0.01****ua-3中浓度组0.76
±
0.02****ua-3高浓度组0.46
±
0.03****
[0401]
注:与阴性对照组比较:*p《0.05,**p《0.01,****p《0.0001
[0402]
与阴性对照组相比,溶媒对照组tpc-1细胞中p-mek表达显著上调,差异有统计学意义,ua低浓度tpc-1细胞中p-mek表达显著上调,差异有统计学意义,ua中浓度tpc-1细胞中p-mek表达上调(p《0.05),ua-3低、中、高浓度tpc-1细胞中p-mek表达下调(p《0.05)。
[0403]
上述实验结果表明:ua-3处理后,tpc-1细胞中wnt经典途径wnt/β-catenin通路表达与rna-seq结果一致,非经典途径wnt/ca
2+
、wnt/pcp通路不表达;与ua相比,ua-3组p-mek蛋白表达水平更为显著。
[0404]
3.4 ua和ua-3对tpc-1细胞中pi3k通路相关蛋白的影响
[0405]
3.4.1 tpc-1细胞中pten蛋白表达的变化情况
[0406]
表33.各组对pten蛋白表达的影响
[0407]
组别相对表达倍数阴性对照组1溶媒对照组0.91
±
0.01ua低浓度组1.06
±
0.03ua中浓度组1.18
±
0.01****ua高浓度组1.25
±
0.02***ua-3低浓度组1.07
±
0.02
ua-3中浓度组1.17
±
0.01****ua-3高浓度组1.63
±
0.01****
[0408]
注:与阴性对照组比较:***p《0.001,****p《0.0001
[0409]
与阴性对照组相比,溶媒对照组tpc-1细胞中pten表达无显著性,ua中、高浓度组、ua-3中、高浓度组tpc-1细胞中pten表达上调(p《0.05)。
[0410]
上述实验结果表明:ua-3处理后,tpc-1细胞中pi3k信号通路中抑癌基因pten表达上调,且与ua相比,ua-3组pten蛋白表达水平更为显著。
[0411]
3.5 ua和ua-3对tpc-1细胞中tshr通路相关蛋白的影响
[0412]
3.5.1 tpc-1细胞中tshr蛋白表达的变化情况
[0413]
表34.各组对tshr蛋白表达的影响
[0414]
组别相对表达倍数阴性对照组1溶媒对照组1.03
±
0.01ua低浓度组1.03
±
0.01ua中浓度组1.03
±
0.01ua高浓度组0.94
±
0.01**ua-3低浓度组0.84
±
0.01****ua-3中浓度组0.74
±
0.02****ua-3高浓度组0.70
±
0.01****
[0415]
注:与阴性对照组比较:**p《0.01,****p《0.0001
[0416]
与阴性对照组相比,溶媒对照组tpc-1细胞中tshr表达无显著性,ua高浓度组、ua-3低、中、高浓度组tpc-1细胞中tshr表达下调(p《0.05)。
[0417]
3.5.2 tpc-1细胞中creb蛋白表达的变化情况
[0418]
表35.各组对creb蛋白表达的影响
[0419]
组别相对表达倍数阴性对照组1溶媒对照组1.35
±
0.09**ua低浓度组2.32
±
0.07****ua中浓度组2.44
±
0.05****ua高浓度组2.70
±
0.01****ua-3低浓度组2.82
±
0.04****ua-3中浓度组3.20
±
0.01****ua-3高浓度组2.94
±
0.01****
[0420]
注:与阴性对照组比较:**p《0.01,****p《0.0001
[0421]
与阴性对照组相比,溶媒对照组tpc-1细胞中creb表达显著上调,差异有统计学意义,ua低中、高浓度组、ua-3低、中、高浓度组tpc-1细胞中creb表达上调(p《0.05)。
[0422]
3.5.3 tpc-1细胞中txnip蛋白表达的变化情况
[0423]
表36.各组对txnip蛋白表达的影响
[0424]
组别相对表达倍数阴性对照组1溶媒对照组0.98
±
0.02ua低浓度组0.96
±
0.02ua中浓度组0.79
±
0.01****ua高浓度组0.77
±
0.01***ua-3低浓度组0.84
±
0.02****ua-3中浓度组0.83
±
0.01****ua-3高浓度组0.30
±
0.09****
[0425]
注:与阴性对照组比较:****p《0.0001
[0426]
与阴性对照组相比,溶媒对照组tpc-1细胞中txnip表达无显著性,ua中、高浓度组、ua-3低、中、高浓度组tpc-1细胞中txnip表达下调(p《0.05)。
[0427]
上述实验结果表明:ua-3处理后,tpc-1细胞中tshr信号通路中抑癌基因txnip、creb表达上调,tshr蛋白表达下调;且与ua相比,ua-3组tshr、creb、txnip蛋白表达水平更为显著。
[0428]
综上,以上结果表明,ua-3作用tpc-1细胞48h,可诱导细胞凋亡,ua-3诱导细胞凋亡效果强于ua;wnt/β-catenin信号通路中抑癌基因wif-1、dkk1表达上调,p-β-catenin蛋白表达下调;makp信号通路中mek、p-mek、ras蛋白表达下调;pi3k信号通路中抑癌基因pten表达上调;tshr信号通路中抑癌基因txnip、creb表达上调,tshr蛋白表达下调。ua及ua-3可以通过wnt/β-catenin、mapk、pi3k、tshr信号通路抑制tpc-1增殖,且ua-3比ua抑制效果明显。
[0429]
本发明提供了一种抗癌化合物及其制药用途,本发明化合物可以通过wnt/β-catenin、mapk、pi3k、tshr信号通路抑制甲状腺乳头状癌细胞增殖,诱导细胞凋亡。并且,与熊果酸ua相比,本发明化合物ua-3、ua-9、ua-10、ua-19对甲状腺乳头状癌细胞的抑制效果更明显,诱导细胞凋亡的作用更强,对wnt/β-catenin、mapk、pi3k、tshr信号通路的调控作用更优异。本发明提供的化合物在制备预防和/或治疗甲状腺乳头状癌的药物中具有广阔的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1