一种环己酮单加氧酶突变体及其应用
1.本发明涉及一种环己酮单加氧酶突变体及其应用,属于酶工程和微生物工程技术领域。
背景技术:
2.手性亚砜是一类重要的手性化合物,可用于合成手性辅助试剂和手性配体,同时,手性亚砜在医药领域均具有广泛的应用。
3.埃索美拉唑(s-奥美拉唑,esomeprazole),化学名为(s)-5-甲氧基-2-[[(4-甲氧基-3,5-二甲基-2-吡啶基)甲基]亚硫酰基]-1h-苯并咪唑,是一种指定用于治疗消化不良、消化性溃疡(pud),胃食管反流病(gord/gerd)和zollinger-ellison综合征的质子泵抑制剂(ppi),同时也是第一个上市的光学纯质子泵抑制剂。埃索美拉唑较消旋体奥美拉唑具有更好的抑酸效果。埃索美拉唑的生产方法主要有化学合成法及生物酶法,目前较成熟的化学合成法反应复杂、副产物多,而生物法因绿色环保、步骤简单、立体选择性高而具有重要的研究价值。生物催化法生产手性药物埃索美拉唑在医药行业拥有巨大的市场空间。目前,国内外主要采用化学法生产手性药物埃索美拉唑,生物法生产埃索美拉唑尚处在实验室研究阶段。国外对生物酶催化法生产埃索美拉唑研究较多并取得了一定的研究成果,而国内在这方面的研究仍存在一大缺口。
[0004]
2013年,美国codexis公司用具有30个以上突变位点的工程化环己酮单加氧酶突变体,在75ml反应体系中,加入100g/l的奥美拉唑硫醚底物,并使混合物脱气、充气4次,通过分批补料酶与辅酶,并在氧气氛中搅拌反应,转速为200rpm下共转化69h,最终使得转化率达99.6%,e.e.值为99.9%。2011年,peter,eva等分离到一株氧化奥美拉唑硫醚的赖氨酸芽孢杆菌。采用分批补料酶与底物的方式,每5ml的lb培养基中,添加菌体量为25mg cdw,底物总添加量为0.1g/l,在200rpm下摇瓶转化24h,最终得到了77%的转化率,e.e.值为100%。2019年,许建和团队构建了一个工程化的环己酮单加氧酶突变体,具有15个以上突变位点,选择性氧化奥美拉唑硫醚生成所需的(s)-奥美拉唑。奥美拉唑硫醚加载为15mm底物时,在6h内完全转化。chmo在手性药物的合成领域存在巨大的应用潜力,其中包括本研究中的埃索美拉唑,2014年5月关键性的旋光纯的埃索美拉唑的盐(包括钠盐、镁盐、锂盐、钾盐、钙盐等)专利到期,面临具有丰富利润的市场,但化学有其工艺复杂、环境污染、副产物多、光学选择性不高等缺点,生物法生产埃索美拉唑因其具有环境友好、条件温和、特性强等优点,受到越来越多的关注。环己酮单加氧酶因其对奥美拉唑硫醚高度的立体选择性而具有工业化生产的可能性。
[0005]
因此,急需得到更多不对称氧化潜手性奥美拉唑硫醚生产手性埃索美拉唑的环己酮单加氧酶以早日实现手性埃索美拉唑的大规模工业化生产以及手性埃索美拉唑在医药领域的大规模应用。
技术实现要素:
[0006]
为解决上述问题,本发明提供了一种不对称氧化潜手性硫醚生产手性亚砜的转化效率高的环己酮单加氧酶(cyclohexanone monooxygenase,简称chmo,ec 1.1.1.1)。
[0007]
本发明的第一个目的是提供一种环己酮单加氧酶突变体,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),同时将第435位苏氨酸突变为丙氨酸(t435a),得到突变体f434i/t435a。
[0008]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),同时将第437位亮氨酸突变为半胱氨酸(l437c),得到突变体f434i/t435a/l437c。
[0009]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),同时将第507位苯丙氨酸突变为缬氨酸(f507v),得到突变体f434i/t435a/l437c/f507v。
[0010]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),同时将第428位亮氨酸突变为谷氨酰胺(l428q),得到突变体f434i/t435a/l437c/f507v/l428q。
[0011]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),将第428位亮氨酸突变为谷氨酰胺(l428q),同时将第440位丝氨酸突变为异亮氨酸(s440i),得到突变体f434i/t435a/l437c/f507v/l428q/s440i。
[0012]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),将第428位亮氨酸突变为谷氨酰胺(l428q),将第440位丝氨酸突变为异亮氨酸(s440i),同时将第328位赖氨酸突变为半胱氨酸(k328c),得到突变体f434i/t435a/l437c/f507v/l428q/s440i/k328c。
[0013]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),将第428位亮氨酸突变为谷氨酰胺(l428q),将第440位丝氨酸突变为异亮氨酸(s440i),将第328位赖氨酸突变为半胱氨酸(k328c),同时将第279位苯丙氨酸突变为缬氨酸(f279v),得到突变体f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v。
[0014]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),将第428位亮氨酸突变为谷氨酰胺(l428q),将第440位丝氨酸突变为异亮氨酸(s440i),将第328位赖氨酸突变为半胱氨酸(k328c),将第279位苯丙氨酸突变为缬氨酸(f279v),同时将第
290位丙氨酸突变为缬氨酸(a290v),得到突变体f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v/a290v。
[0015]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),将第428位亮氨酸突变为谷氨酰胺(l428q),将第440位丝氨酸突变为异亮氨酸(s440i),将第328位赖氨酸突变为半胱氨酸(k328c),将第279位苯丙氨酸突变为缬氨酸(f279v),将第290位丙氨酸突变为缬氨酸(a290v),将第245位缬氨酸突变为丙氨酸(v245a),同时将第246位缬氨酸突变为亮氨酸(v246l),得到突变体f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v/a290v/v245a/v246l。
[0016]
进一步地,所述的突变体是将氨基酸序列如seq id no.1所示的环己酮单加氧酶的第434位苯丙氨酸突变为异亮氨酸(f434i),将第435位苏氨酸突变为丙氨酸(t435a),将第437位亮氨酸突变为半胱氨酸(l437c),将第507位苯丙氨酸突变为缬氨酸(f507v),将第428位亮氨酸突变为谷氨酰胺(l428q),将第440位丝氨酸突变为异亮氨酸(s440i),将第328位赖氨酸突变为半胱氨酸(k328c),将第279位苯丙氨酸突变为缬氨酸(f279v),将第290位丙氨酸突变为缬氨酸(a290v),将第245位缬氨酸突变为丙氨酸(v245a),将第246位缬氨酸突变为亮氨酸(v246l),将第491位丝氨酸突变为半胱氨酸(s491c),同时将第492位色氨酸突变为精氨酸(w492r),得到突变体f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v/a290v/v245a/v246l/s491c/w492r。
[0017]
本发明的第二个目的是提供编码所述环己酮单加氧酶突变体的基因。
[0018]
本发明的第三个目的是提供携带所述基因的重组质粒。
[0019]
进一步地,所述重组质粒的载体为pet-28a(+)质粒、pet-28b(+)质粒或pet-20b(+)质粒。
[0020]
本发明的第四个目的是提供表达所述环己酮单加氧酶突变体的宿主细胞。
[0021]
进一步地,所述宿主细胞为细菌、真菌、植物细胞或动物细胞。
[0022]
进一步地,所述细菌为大肠杆菌,优选为大肠杆菌e.coli bl21(de3)。
[0023]
进一步地,上述环己酮单加氧酶突变体由以下步骤制备得到:将上述表达环己酮单加氧酶突变体的宿主细胞接种至发酵培养基中进行发酵,获得发酵液;将发酵液进行离心,收集菌体;将菌体进行破碎后离心,获得细胞破碎上清液;将细胞破碎上清液进行提取,获得上述环己酮单加氧酶突变体。
[0024]
本发明的第五个目的是提供上述环己酮单加氧酶突变体、基因、表达载体或宿主细胞在生产手性亚砜中的应用。
[0025]
进一步地,所述应用为将上述环己酮单加氧酶突变体添加至含有潜手性硫醚的反应体系中进行反应,得到反应液;将反应液进行提取,获得手性亚砜。
[0026]
进一步地,所述潜手性硫醚为苯甲硫醚、2-甲硫基萘、苄基苯基硫醚或奥美拉唑硫醚。
[0027]
进一步地,所述手性亚砜为苯甲亚砜、2-(甲基亚磺酰基)萘、苄基苯基亚砜或手性奥美拉唑。具体地,潜手性苯甲硫醚时,手性亚砜为苯甲亚砜;潜手性2-甲硫基萘时,手性亚砜为2-(甲基亚磺酰基)萘;潜手性苄基苯基硫醚时,手性亚砜为苄基苯基亚砜;潜手性奥美
拉唑硫醚时,手性亚砜为手性奥美拉唑。
[0028]
进一步地,所述手性亚砜为(s)-奥美拉唑或(r)-奥美拉唑。
[0029]
进一步地,含有潜手性硫醚的反应体系中还含有辅酶和辅酶循环系统;所述辅酶循环系统含有d-葡萄糖和葡萄糖脱氢酶,或者,含有甲酸和甲酸脱氢酶,或者,含有乳酸和乳酸脱氢酶,或者,含有甘油和甘油脱氢酶。
[0030]
进一步地,所述辅酶为nadp
+
、nadph、nad
+
和nadh中的一种或几种。
[0031]
进一步地,所述环己酮单加氧酶突变体在反应体系中的添加量为1~10ku/l。
[0032]
进一步地,所述反应体系中,潜手性硫醚的浓度为1~5mmol/l。
[0033]
进一步地,所述反应体系中,辅酶的浓度为0.1~1mmol/l。
[0034]
进一步地,所述反应体系中,葡萄糖脱氢酶的浓度为1~10ku/l。
[0035]
进一步地,所述反应体系中,d-葡萄糖的浓度为2~10mmol/l。
[0036]
进一步地,所述反应体系为含有潜手性硫醚、辅酶以及辅酶循环系统的缓冲液。
[0037]
进一步地,所述缓冲液为tris-hcl缓冲液。
[0038]
进一步地,所述tris-hcl缓冲液的浓度为0.1~0.2mol/l。
[0039]
进一步地,所述反应的温度为30~35℃、ph为7~9。
[0040]
本发明的有益效果:
[0041]
(1)本发明的环己酮单加氧酶突变体不对称氧化潜手性硫醚生产手性亚砜的转化效率高,其中,突变体m2不对称氧化潜手性奥美拉唑硫醚生产手性(r)-奥美拉唑的催化效率为0.144min
–1·
mm
–1,ee值可达99%r。而野生型同条件下不能转化奥美拉唑硫醚产生(r)-奥美拉唑。
[0042]
(2)本发明的环己酮单加氧酶突变体不对称氧化潜手性硫醚生产手性亚砜的催化效率高,其中,突变体m3不对称氧化潜手性奥美拉唑硫醚生产手性(r)-奥美拉唑的催化效率为5.83min
–1·
mm
–1,是突变体m2的40倍,ee值可达99%r。
[0043]
(3)本发明的环己酮单加氧酶突变体不对称氧化潜手性硫醚生产手性亚砜的催化效率较高,其中,突变体m7不对称氧化潜手性奥美拉唑硫醚生产手性(s)-奥美拉唑的催化效率为0.06min
–1·
mm
–1,ee值可达97.3%s。而野生型同条件下不能转化率奥美拉唑硫醚产生(s)-奥美拉唑。
[0044]
(4)本发明的环己酮单加氧酶突变体不对称氧化潜手性硫醚生产手性亚砜的催化效率较高,其中,突变体m10不对称氧化潜手性奥美拉唑硫醚生产手性(s)-奥美拉唑的催化效率为0.38min
–1·
mm
–1,是突变体m7的6.3倍,ee值可达97.3%s。
[0045]
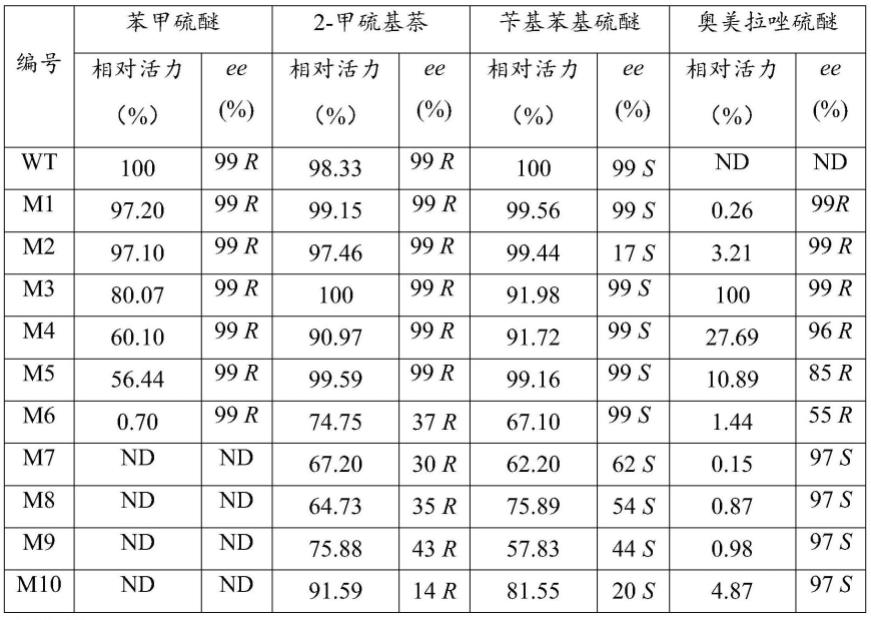
(5)野生型环己酮单加氧酶可不对称氧化潜手性2-甲硫基萘和苄基苯基硫醚,且ee值分别可达99%(r)和99%(s);而本发明的环己酮单加氧酶突变体也能不对称氧化潜手性2-甲硫基萘和苄基苯基硫醚,其中,突变体m2-m6可不对称氧化潜手性2-甲硫基萘和苄基苯基硫醚,且ee值分别可达99%(r)和99%(s)。活力和选择性均能与野生型保持一致。
[0046]
(6)本发明的环己酮单加氧酶突变体不对称氧化潜手性硫醚生产手性亚砜的催化效率高,因此,本发明的环己酮单加氧酶突变体在生产如(s)-奥美拉唑、(r)-奥美拉唑等的手性亚砜中具有极高的应用前景。
附图说明
[0047]
图1为重组质粒的的pcr扩增电泳图谱;其中,m:marker,泳道1~11:野生型wt和突变体重组质粒pet28a-amchmo-1~重组质粒pet28a-amchmo-10的pcr产物。
[0048]
图2为重组大肠杆菌摇瓶诱导发酵获得的表达产物的sds-page电泳分析结果;其中,m:标准蛋白maker,泳道1~11:野生型及突变体重组大肠杆菌e.coli bl21/pet28a-amchmo-1~重组大肠杆菌e.coli bl21/pet28a-amchmo-10摇瓶诱导发酵获得的野生型wt和突变体m1~m10的纯酶。
[0049]
图3为突变体m3和m10不对称氧化潜手性奥美拉唑硫醚所得产物(r)-奥美拉唑和(s)-奥美拉唑的手性色谱图。
具体实施方式
[0050]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0051]
下述实施例中涉及的大肠杆菌e.coli bl21(de3)购自北纳生物;下述实施例中涉及的pet-28a(+)质粒、nadph购自novagen公司;下述实施例中涉及的葡萄糖脱氢酶(gdh)、乳酸脱氢酶(ldh)购自诺唯赞公司;下述实施例中涉及的d-葡萄糖购自捷瑞公司;下述实施例中涉及的潜手性硫醚购自国药集团(上述菌株大肠杆菌e.coli bl21(de3)可以购买得到,不需要进行用于专利程序的保藏)。
[0052]
下述实施例中涉及的培养基如下:
[0053]
lb液体培养基:酵母粉5.0g
·
l-1
、胰蛋白胨10.0g
·
l-1
、nacl 10.0g
·
l-1
、卡那霉素100mg
·
l-1
。
[0054]
lb固体培养基:酵母粉5.0g
·
l-1
、胰蛋白胨10.0g
·
l-1
、nacl 10.0g
·
l-1
、琼脂粉15g/l、卡那霉素50mg
·
l-1
。
[0055]
下述实施例中涉及的检测方法如下:
[0056]
环己酮单加氧酶酶活的检测方法如下:
[0057]
将含有1mm nadph、1.0mm底物潜手性奥美拉唑硫醚的tris-hcl缓冲液(100mm,ph 9.0)于30℃保温2min后,取10μl纯酶液加入tris-hcl缓冲液中于30℃进行反应30min,等体积乙腈终止反应,使用高效液相色谱测定产物的生成量,并以此为依据计算酶活;
[0058]
酶活的计算公式如下:
[0059]
酶活力(u/mg)=(c1
×
v1)
×
103/(t
×
c2
×
v2);
[0060]
式中,c1为生成产物的浓度,单位为m/l;v1为反应液的体积,单位为ml;c2为酶的蛋白浓度,单位为mg/ml;v2为反应体系里添加的酶的体积,单位为μl;t为反应时间,单位为min;
[0061]
酶活的定义:在该条件下每分钟催化氧化lμmol底物产生lμmol产物所需酶量为一个酶活力单位(1u)。
[0062]
环己酮单加氧酶不对称氧化潜手性奥美拉唑硫醚生成手性(s)-奥美拉唑和(r)-奥美拉唑的转化效率和立体选择性的检测方法如下:
[0063]
将含有1mm nadph、1.0mm底物潜手性奥美拉唑硫醚的tris-hcl缓冲液(100mm,ph 9.0)于30℃保温2min后,取10μl纯酶液加入tris-hcl缓冲液中于30℃反应60min;反应结束
后加,入500μl乙酸乙酯,震荡1~2min,12000rpm离心2~5min,取上清到离心管中,待有机相自然挥发完全,加入500μl色谱纯乙醇,进行手性液相色谱分析转化效率和ee值;
[0064]
转化效率色谱条件具体如下:c18(5μm,250mm
×
4.6mm)液相色谱柱,流动相为乙腈:水(53:47,v/v/v),流速1ml/min,柱温30℃,紫外检测波长254nm,进样量10μl,底物奥美拉唑硫醚和产物奥美拉唑保留时间分别为4.12min和8.71min;
[0065]
立体选择性色谱条件具体如下:daicel chiralcel ad-3(5μm,250mm
×
4.6mm)液相色谱柱,流动相为正已烷:异丙醇:乙酸(50:50:0.01,v/v/v),流速0.5ml/min,柱温30℃,紫外检测波长250nm,进样量10μl,(s)-奥美拉唑和(r)-奥美拉唑保留时间分别为11.12min和13.71min;
[0066]
转化效率的计算方法如下:
[0067][0068]
ee值的计算方法如下:
[0069][0070][0071]
as:反应液中(s)-奥美拉唑的摩尔浓度;ar:反应液中(r)-奥美拉唑的摩尔浓度;a
sub
:反应液中未反应完的奥美拉唑硫醚的摩尔浓度。
[0072]
实施例1环己酮单加氧酶突变体的构建、表达及纯化
[0073]
化学合成编码氨基酸序列如seq id no.1所示的环己酮单加氧酶的基因(基因的核苷酸序列如seq id no.2所示);将获得的基因与pet-28a(+)质粒经双酶切(ndeⅰ和xhoⅰ)后进行连接,连接产物转化大肠杆菌e.colibl21(de3),转化产物涂布于lb固体培养基,于37℃培养8~10h,在lb固体培养基上挑取5个转化子,接入lb液体培养基培养,于37℃培养10h后提取质粒,将提取得到的质粒进行酶切验证以及测序验证,验证正确即获得含有编码野生型环己酮单加氧酶的基因的重组质粒pet28a-amchmo以及含有编码野生型环己酮单加氧酶的基因的重组菌e.coli bl21/pet28a-amchmo。
[0074]
利用全质粒pcr技术,以获得的重组质粒pet28a-amchmo为模板进行定点突变,获得含有编码环己酮单加氧酶突变体f434i(第434位苯丙氨酸突变为异亮氨酸)、t435a(第435位苏氨酸突变为丙氨酸)、l437c(第437位亮氨酸突变为半胱氨酸)、f507v(第507位苯丙氨酸突变为缬氨酸)、l428q(第428位亮氨酸突变为谷氨酰胺)、s440i(第440位丝氨酸突变为异亮氨酸)、k328c(第328位赖氨酸突变为半胱氨酸)、f279v(第279位苯丙氨酸突变为缬氨酸)、a290v(第290位丙氨酸突变为缬氨酸)、v245a/v246l(第245位,第246位的两个缬氨酸分别突变为丙氨酸和亮氨酸)、s491c/w492r(第491位,第492位丝氨酰和色氨酸突变为半胱氨酸和精氨酸);
[0075]
突变体的突变位点及编号:f434i/t435a(m1)、f434i/t435a/l437c(m2)、f434i/t435a/l437c/f507v(m3)、f434i/t435a/l437c/f507v/l428q(m4)、f434i/t435a/l437c/f507v/l428q/s440i(m5)、f434i/t435a/l437c/f507v/l428q/s440i/k328c(m6)、f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v(m7)、f434i/t435a/l437c/f507v/l428q/
s440i/k328c/f279v/a290v(m8)、f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v/a290v/v245a/v246l(m9)、f434i/t435a/l437c/f507v/l428q/s440i/k328c/f279v/a290v/v245a/v246l/s491c/w492r(m10),将上述环己酮单加氧酶突变体分别命名为m1~m10;
[0076]
其中,突变f434i、t435a、l437c、f507v、l428q、s440i、k328c、f279v、a290v、v245a/v246l、s491c/w492r所用引物如下:
[0077]
f434i-f:cctaacggcccgatcgctaat;
[0078]
f434i-r:cgggcaattagcgatcgggcc;
[0079]
t435a-f:aacggcccgctggctaattgc;
[0080]
t435a-r:cggcgggcaattagccagcgg;
[0081]
l437c-f:ccgatcgctaattgcccgccg;
[0082]
l437c-r:ggcggahnattgcacagagc;
[0083]
f507v-f:aatgcagtgatggtgtatctg;
[0084]
f507v-r:gcctgccagatacaccatcac;
[0085]
l428q-f:atgtttatgattccaggtcct;
[0086]
l428q-r:gccgttaggaccctgaatcat;
[0087]
s440i-f:tgctgcccgatcatcgaaacc;
[0088]
s440i-r:ggtttcaatgatgtacgggca;
[0089]
k328c-f:gatttatatgcctgccgtccg;
[0090]
k328c-r:gcacagcggacggcaggcata;
[0091]
f279v-f:aaaggcaatggtgtgcgcttt;
[0092]
f279v-r:gaacataaagcgcacaccatt;
[0093]
a290v-f:ttttgtgatattgtgaccaat;
[0094]
a290v-r:ttccggattggtcacaatatc;
[0095]
v245a/v246l-f:gtgcgtaatagtgctgctctgtttggt;
[0096]
v245a/v246l-r:aaaaccaaaggccacagagctattacg;
[0097]
s491c/w492r-f:ccgaaagccgattgccgaattttt;
[0098]
s491c/w492r-r:tgcaccaaaaattcggcaatcggc,
[0099]
pcr反应体系(50μl)为:kod酶(2.5u/ml)l.0μl,模板(5~50ng)l.0μl,dntp 4.0μl,10
×
reaction buffer 5.0μl,上下游引物各1.0μl,ddh2o补足至50μl;
[0100]
pcr产物扩增条件均为:(1)94℃变性3min,(2)94℃变性30sec,(3)54℃退火30sec,(4)72℃延伸150sec,重复步骤(2)~(4)进行10~15个循环,最后72℃延伸10min,4℃保存pcr扩增产物。
[0101]
pcr扩增产物用1%琼脂糖凝胶电泳进行检测,检测结束后,向10μl扩增产物中加入0.5μl甲基化模板消化酶(dpn i),枪头吹吸进行混匀,于37℃条件下反应1h,将dpn i处理后的扩增产物转化大肠杆菌e.coli bl21(de3),转化产物涂布于lb固体培养基,于37℃培养8~10h,在lb固体培养基上挑取3个转化子,接入lb液体培养基培养,于37℃培养10h后提取质粒,将提取得到的质粒进行酶切验证(验证结果可见图1)以及测序验证,验证正确即获得分别含有编码环己酮单加氧酶突变体m1~m10的基因的重组质粒pet28a-amchmo-1~重组质粒pet28a-amchmo-10以及分别含有编码环己酮单加氧酶突变体m1~m10的基因的重
组菌e.coli bl21/pet28a-amchmo-1~重组菌e.coli bl21/pet28a-amchmo-10。
[0102]
将获得的重组菌e.coli bl21/pet28a-amchmo-1~重组菌e.coli bl21/pet28a-amchmo-10分别涂布于lb固体培养基,于37℃培养8~10h,获得单菌落;挑取单菌落接入lb液体培养基,于37℃培养12~14h,获得种子液;将种子液按照2%(v/v)的接种量接入lb液体培养基,于37℃、200rpm培养至od
600
达到0.8后,在发酵液中加入终浓度为0.2mm的iptg,于25℃继续诱导培养8h,得到发酵液;将发酵液于4℃、8000rpm离心10min后,收集细胞;将收集得到的细胞悬浮于磷酸钾缓冲液(100mmol
·
l-1
,ph 6.0)中进行超声破碎,收集分别含有野生型环己酮单加氧酶、环己酮单加氧酶突变体m1~m10的细胞破碎上清液。
[0103]
将获得的细胞破碎上清液使用亲和柱histrap ff crude(镍柱)进行纯化,纯化过程如下:先使用缓冲液a(20mmol
·
l-1
tris-hcl,500mmol
·
l-1
nacl,20mmol
·
l-1
咪唑,ph 7.4)平衡镍柱,并实施例1获得的细胞破碎上清液过镍柱,继续使用缓冲液a洗脱未与镍柱结合的蛋白,待穿透峰流尽后,从缓冲液a到缓冲液b(20mmol
·
l-1
tris-hcl,500mmol
·
l-1
nacl,500mmol
·
l-1
咪唑,ph 7.4)进行梯度洗脱,将结合到镍柱上的重组蛋白洗脱下来,获得野生型环己酮单加氧酶、环己酮单加氧酶突变体m1~m10的纯酶液。
[0104]
将获得的环己酮单加氧酶突变体m1~m10的纯酶液进行sds-page分析,分析结果见图2。
[0105]
由图2可知,环己酮单加氧酶突变体m1~m10的纯酶液均在59kda左右显示单条带,且杂蛋白较少,说明镍柱纯化效果较好。
[0106]
实施例2环己酮单加氧酶突变体的动力学参数以及不对称氧化潜手性硫醚生成手性亚砜的立体选择性
[0107]
选择实施例1获得的野生型环己酮单加氧酶以及环己酮单加氧酶突变体m1-m10,分别以浓度为0.1~1mm的潜手性奥美拉唑硫醚为底物,测定实施例1获得的野生型环己酮单加氧酶以及环己酮单加氧酶突变体m2~m10的初始氧化活力,采用graph pad prism 7.0软件中的非线性回归方法对数据进行拟合,分别得到米氏(michaelis-menten)方程的km值,再计算得到k
cat
和k
cat
/km值,计算结果见表1;其中,k
cat
值的计算公式为:k
cat
=v
max
·
m/1;其中,m为酶的分子质量,单位为kda。
[0108]
由表1可知,环己酮单加氧酶突变体m3不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑的催化效率均较野生型环己酮单加氧酶有了显著的提升;环己酮单加氧酶突变体m8不对称氧化潜手性奥美拉唑硫醚生成(s)-奥美拉唑的催化效率较环己酮单加氧酶突变体m7有10倍的提升;环己酮单加氧酶突变体m10不对称氧化潜手性奥美拉唑硫醚生成(s)-奥美拉唑的催化效率则较环己酮单加氧酶突变体m8有5倍的提升。
[0109]
检测实施例1获得的野生型环己酮单加氧酶以及环己酮单加氧酶突变体m2~m10不对称氧化潜手性硫醚生成手性亚砜的立体选择性及相对活力,检测结果见表2。
[0110]
由表2可知,环己酮单加氧酶突变体m2~m6不对称氧化潜手性苯甲硫醚生成手性亚砜的立体选择性较野生型环己酮单加氧酶并没有下降;但相对活力逐渐降低,并且到环己酮单加氧酶突变体m7~m10时,不对称氧化潜手性苯甲硫醚的活力丧失;由表2可知,野生型环己酮单加氧酶可不对称氧化潜手性2-甲硫基萘,且环己酮单加氧酶突变体m2~m5不对称氧化潜手性苯甲硫醚生成手性亚砜的立体选择性较野生型环己酮单加氧酶并没有下降,ee值可达99%(r),活力基本保持不变;与野生型环己酮单加氧酶相比,环己酮单加氧酶突
变体m6-m10不对称氧化潜手性2甲硫基萘时,选择性降低而活力先降低后升高;对于苄基苯基硫醚,除了环己酮单加氧酶突变体m2以外,环己酮单加氧酶突变体m3~m6的选择性与野生型环己酮单加氧酶相比没有下降;对于奥美拉唑硫醚,环己酮单加氧酶突变体m2~m10不对称氧化潜手性奥美拉唑醚生成手性奥美拉唑的活力性较野生型环己酮单加氧酶均明显提高;其中,环己酮单加氧酶突变体m2~m3不对称氧化潜手性奥美拉唑硫醚生成手性(r)-奥美拉唑的活力逐渐提高,选择性保持不变。环己酮单加氧酶突变体m4~m6不对称氧化潜手性奥美拉唑醚生成手性奥美拉唑的立体选择性逐渐下降;而且相对活力也逐渐降低,并且到环己酮单加氧酶突变体m7时,活力降到最低,但是选择性发生了翻转,ee值可达97.3%(s),之后环己酮单加氧酶突变体m8~m10,保持选择性不变,但是活力逐渐提高。
[0111]
表1野生型环己酮单加氧酶以及环己酮单加氧酶突变体m1-m10的动力学参数
[0112]
entrykm(mm)kcat(min
–1)kcat/km(min
–1·
mm
–1)wtndndndm10.1250.0060.048m20.2920.0420.144m30.2471.445.834m40.2320.3561.534m50.2560.1110.435m60.2370.0150.063m70.0280.0020.072m80.1570.0170.108m90.1530.0740.136m100.2150.0880.380
[0113]
nd:没有测到活力。
[0114]
表2野生型环己酮单加氧酶以及环己酮单加氧酶突变体m2-m10不对称氧化潜手性硫醚生成手性亚砜的相对活力及立体选择性
[0115][0116]
nd:没有测到活力。
[0117]
实施例3环己酮单加氧酶突变体不对称氧化潜手性硫醚生成亚砜的转化效率
[0118]
选择实施例1获得的环己酮单加氧酶突变体m1-m10,将实施例1获得的环己酮单加氧酶突变体m1-m10分别以2g/l的添加量添加至分别含有5mm、潜手性苯甲硫醚、2-甲硫基萘、苄基苯基硫醚100mm tris-hcl缓冲液(ph 9.0)中,在30℃、ph 9.0、200rpm条件下反应1-12h,得到反应液;除潜手性奥美拉唑硫醚外,tris-hcl缓冲液中还含有浓度为0.02mm的辅酶nadp+、浓度为1.5mm的葡萄糖、浓度为1.5mm的葡萄糖脱氢酶gdh和浓度为5%(v/v)的甲醇。
[0119]
分别检测反应不同时间时环己酮单加氧酶突变体m1-m10不对称氧化潜手性苯甲硫醚、2-甲硫基萘、苄基苯基硫醚生成相应亚砜的转化率和选择性,检测结果见表3。
[0120]
表3环己酮单加氧酶突变体m1-m10不对称氧化潜手性苯甲硫醚、2-甲硫基萘、苄基苯基硫醚生成相应亚砜的转化率
[0121][0122]
nd:没有测到活力。
[0123]
由表3可知,5mm底物浓度下,环己酮单加氧酶突变体m1-m10分别在反应1-12h时达到》90%的转化率,其中环己酮单加氧酶突变体m1-m3不对称氧化潜手性苯甲硫醚、2-甲硫基萘、苄基苯基硫醚生成相应亚砜的转化率与野生型环己酮单加氧酶保持一致。而环己酮单加氧酶突变体m4-m10不对称氧化潜手性苯甲硫醚、2-甲硫基萘、苄基苯基硫醚生成相应亚砜的转化率与野生型环己酮单加氧酶转化效率相比有非常明显的降低。以上结果说明,与野生型环己酮单加氧酶相比,随着突变位点的增加,突变体的底物结合口袋也逐渐扩大,对体积较小的底物逐渐失去催化活力。
[0124]
实施例4环己酮单加氧酶突变体不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑和(s)-奥美拉唑的转化效率
[0125]
选择实施例1获得的环己酮单加氧酶突变体m1-m10,将实施例1获得的环己酮单加氧酶突变体m1-m10分别以2g/l的添加量添加至分别含有2mm、潜手性奥美拉唑硫醚100mm tris-hcl缓冲液(ph 9.0)中,在30℃、ph 9.0、200rpm条件下反应1-12h,得到反应液;除潜手性奥美拉唑硫醚外,tris-hcl缓冲液中还含有浓度为0.02mm的辅酶nadp+、浓度为1.5mm的葡萄糖、浓度为1.5mm的葡萄糖脱氢酶gdh和浓度为5%(v/v)的甲醇。
[0126]
分别检测反应不同时间时环己酮单加氧酶突变体m1-m10不对称氧化潜手性奥美拉唑硫醚生成(s)-奥美拉唑和(r)-奥美拉唑的转化率和选择性,并计算环己酮单加氧酶突变体m3以及环己酮单加氧酶突变体m10不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑和(s)-奥美拉唑的转化效率,检测结果见表4。
[0127]
表4环己酮单加氧酶突变体m1-m10不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑或者(s)-奥美拉唑的转化率
[0128][0129]
nd:没有测到活力。
[0130]
由表4可知,2mm底物浓度下,环己酮单加氧酶突变体m1-m10分别在反应1-12h时达到》99%的转化率,而野生型环己酮单加氧酶没有转化,可见,环己酮单加氧酶突变体m1-m10不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑和(s)-奥美拉唑的转化效率较野生型环己酮单加氧酶不对称氧化潜手性奥美拉唑硫醚的转化效率有非常显著的提高。
[0131]
选择实施例1获得的环己酮单加氧酶优异突变体m3和m10,将实施例1获得的环己酮单加氧酶优异突变体m3以及环己酮单加氧酶优异突变体m10分别以1g/l和4g/l的添加量添加至分别含有1mm、2mm、5mm潜手性奥美拉唑硫醚100mm tris-hcl缓冲液(ph 9.0)中,在30℃、ph 9.0、200rpm条件下反应12h,得到反应液;除潜手性奥美拉唑硫醚外,tris-hcl缓冲液中还含有浓度为0.02mm的辅酶nadp
+
、浓度为1.5mm的葡萄糖、浓度为1.5mm的葡萄糖脱氢酶gdh和浓度为5%(v/v)的甲醇。
[0132]
分别检测反应不同时间时环己酮单加氧酶优异突变体m3以及环己酮单加氧酶优异突变体m10不对称氧化潜手性奥美拉唑硫醚生成(s)-奥美拉唑和(r)-奥美拉唑的转化率,并计算环己酮单加氧酶优异突变体m3以及环己酮单加氧酶优异突变体m10不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑和(s)-奥美拉唑的转化效率,检测结果见表5~6。
[0133]
由表5~6可知,1mm底物浓度下,环己酮单加氧酶优异突变体m3以及环己酮单加氧酶优异突变体m10分别在反应0.5h和3h时达到》99.9%的转化率,可见,环己酮单加氧酶优异突变体m3不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑的转化效率较环己酮单加氧酶优异突变体m10不对称氧化潜手性奥美拉唑硫醚生成(s)-奥美拉唑的转化效率的显著提高;并且,由表3~4可知,当潜手性奥美拉唑硫醚的添加量为5mm时,环己酮单加氧酶优异突变体m10无法完全转化,而环己酮单加氧酶优异突变体m3的转化率则不受高浓度潜手性硫醚的影响,可见,环己酮单加氧酶优异突变体m3可适应高浓度潜手性奥美拉唑硫醚的环境,不对称氧化高浓度潜手性奥美拉唑硫醚生成(r)-奥美拉唑,并且具有较高的转化效率。
[0134]
表5环己酮单加氧酶优异突变体m10不对称氧化潜手性奥美拉唑硫醚生成(s)-奥美拉唑的转化率
[0135][0136]
表6环己酮单加氧酶优异突变体m3不对称氧化潜手性奥美拉唑硫醚生成(r)-奥美拉唑的转化率
[0137][0138]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1