sgRNA、CRISPR/Cas试剂及其应用的制作方法
sgrna、crispr/cas试剂及其应用
技术领域
1.本发明属于基因编辑技术领域,具体涉及一种sgrna、crispr/cas试剂及其应用,该sgrna、crispr/cas试剂适用于斑马鱼slc25a13基因的编辑。
背景技术:
2.随着基因工程技术的发展,crispr/cas家族在基因功能研究实验中已成为最炙手可热的研究工具,其中以cas9、cas12、cas13家族等应用最为广泛。这些基因编辑工具能够通过基因敲除或基因敲降来永久或非永久性改变基因,将基因型与表型联系起来,使得正向遗传学研究能更广泛与深入。rna干扰(rna interference,rnai)作为一种“基因敲降(gene knockdown)”技术,广泛应用于遗传性疾病的基因治疗、肿瘤的抑制、转基因植物的研究领域,但在非洲爪蟾(xenopus)、斑马鱼(danio rerio)及其它硬骨鱼中却很难实现;mos(吗啉反义寡核苷酸,morpholinos)通过阻断蛋白质翻译或剪接来阻断rna功能,在斑马鱼等模式生物中广泛实施,但mos高昂的费用、验证方法的繁琐度和实验观察到的mos引起的毒性、脱靶效应以及突变动物表型不一致的现象使其在两栖类动物、硬骨鱼的基因功能研究中具有一定的局限性。cas13是一类vi型crispr/cas rna内切酶,用于rna敲降、单碱基编辑及核酸检测等领域,在哺乳动物细胞中,cas13比rnai有效性及特异性更高。其中,rfxcas13d是cas13系统中的一种能有效和精确介导斑马鱼胚胎中特定mrna转录的蛋白。
3.斑马鱼slc25a13基因位于第19号染色体,cds区约2,000bp,编码667个氨基酸,蛋白约73kda,与人slc25a13蛋白的同源性达82%,目前关于斑马鱼slc25a13基因的注释及功能验证未见相关报道。人类slc25a13基因编码了一种天冬氨酸(asp)/谷氨酸转运蛋白citrin,该蛋白位于线粒体内膜,是天冬氨酸由线粒体至胞浆的重要载体。天冬氨酸进入胞浆后与瓜氨酸在精氨酸琥珀酸合成酶(argininosuccinate synthetase,ass)的催化下形成精氨酸丁二酸酯,并进入尿素循环(urea cycle)。citrin蛋白缺乏将导致瓜氨酸在血液中积累,引发ii型瓜氨酸血症(type ii citrullinemia,ctln2)。此外,citrin蛋白缺乏还会导致新生儿肝内胆汁淤积症(neonatal intrahepatic cholestasis,niccd)和生长迟缓和血脂异常(failure to thrice and dyslipidemia,fttdcd)。
4.2013年,斑马鱼完整基因组序列发布及数据库建立,推动了斑马鱼作为脊椎动物模式生物在科学研究领域的广泛应用。不论在环境毒理学研究方向,还是在基因功能研究方向,抑或是高通量药物筛选领域,斑马鱼都是一种良好的动物模型。斑马鱼表现出胰腺、肝脏和脂肪组织的保守功能,可作为代谢性疾病研究的良好动物模型,实现在斑马鱼模型上对葡萄糖内稳态调节、炎症、神经调控代谢功能障碍等表型的动态观测。另外,斑马鱼具有的体型小、成本低、繁殖快、生长快、通量大等特性更加充分发挥了其作为临床前药物筛选模型的潜力。目前未有利用crispr/rfxcas13d基因编辑技术产生斑马鱼slc25a13基因敲降模型的报道。
技术实现要素:
5.针对以上问题,本发明目的之一在于提供一种sgrna,该sgrna可以靶向斑马鱼slc25a13基因,利用crispr/cas基因编辑技术对斑马鱼slc25a13基因进行敲除或敲低。
6.为了达到上述目的,本发明可以采用以下技术方案:
7.本发明一方面提供了一种sgrna,其包括如seqidno.1、seqidno.2或seqidno.3所示序列。
8.具体地,上述sgrna分别对应斑马鱼slc25a13基因不同位点,靶向位点位于斑马鱼slc25a13基因第1、第5或第14个外显子上,首先选择在citrin蛋白的ef-hand结构域设置靶向位点,更有效地在敲降模型中影响citrin蛋白的结构构象;在使用sgrna进行斑马鱼slc25a13编辑时,可以优选多靶向位点同时敲降,其中靶向位点的选择应遵循3’端为-ngg的原则(n代表任意碱基)。
9.本发明另一方面提供了一种crispr/cas试剂,其包括如seqidno.1所示序列sgrna、包括如seqidno.2所示序列sgrna和包括如seqidno.3所示序列sgrna中一种或多种sgrna;和mrfxcas13d或rfxcas13d。需要说明的是,mrfxcas13d为rfxcas13d的mrna形式。
10.进一步地,rfxcas13d的氨基酸序列如seqidno.15所示。
11.进一步,crispr/cas试剂还包括转录激活因子,转录激活因子可以与sgrna结合。具体地,转录激活因子招募到sgrna,这些激活因子启动细胞的转录程序。
12.具体地,上述mrfxcas13d的方法可以为:(1)mrfxcas13d的dna模板制备:上游引物:sp6启动子序列连接真核生物kozak序列以及质粒pxr001上游sv40nls扩增序列,序列为seq id no.8所示序列;下游引物为seq id no.9所示序列;(2)通过pcr扩增的方式并对扩增产物进行割胶回收,获得目的dna片段即为mrfxcas13d的dna模板。通过琼脂糖凝胶电泳验证模板的分子量大小是否符合预期;(3)通过体外转录得到mrfxcas13d;需要说明的是步骤(1)中,真核生物kozak序列可优化为斑马鱼kozak序列aaacatggc。
13.本发明再一方面提供了一种上述sgrna的转录模板,包括如seqidno.1所示序列sgrna的转录模板是通过以下引物对扩增得到:上游引物包括如seq id no.4所示序列,下游引物包括seq id no.5所示序列;或包括如seqidno.2所示序列sgrna的转录模板是通过以下引物对扩增得到:上游引物包括如seq id no.4所示序列,下游引物包括seq id no.6所示序列;或包括如seqidno.3所示序列sgrna的转录模板是通过以下引物对扩增得到:上游引物包括如seq id no.4所示序列,下游引物包括seq id no.7所示序列。
14.具体地,上述sgrna的转录模板的制备方法可以包括:(1)设计构建sgrna的上游引物:t7启动子序列连接30nt含有sgrna固定引物的正向重复序列,序列为seqidno.4所示序列;下游引物:22nt-25nt靶向位点识别序列,连接18nt反向重复序列,序列为seqidno.5、seqidno.6或seqidno.7所示序列;(2)以上下游引物自体连接的方式制备sgrna的dna模板,扩增产物进行pcr产物回收得到上述sgrna的转录模板;应当理解的是,得到的上述sgrna的转录模板进行体外转录得到即可得到上述的sgrna(也称slc25a13-sgrna);需要说明的是,步骤(1)中设计上游引物可在t7启动子的上游添加6个左右任意碱基,可提高转录效率。
15.本发明再一方面提供了一种上述的sgrna或上述的crispr/cas试剂在制备靶向斑马鱼slc25a13基因制剂中的应用。
16.进一步地,上述sgrna靶向位点位于斑马鱼slc25a13基因第1、第5或第14个外显子
上。
17.本发明再一方面提供了一种上述的sgrna或上述的crispr/cas试剂在制备用于降低斑马鱼citrin蛋白表达制剂中的应用。
18.本发明再一方面提供了一种上述的sgrna或上述的crispr/cas试剂在培育斑马鱼中的应用。
19.进一步地,培育的斑马鱼为低表达citrin蛋白斑马鱼。
20.具体地,上述的sgrna或上述的crispr/cas试剂在使用时,可以将sgrna和mrfxcas13d混匀成rna-mix导入斑马鱼受精卵,sgrna的终浓度分别为100ng/μl,mrfxcas13d的终浓度为200ng/μl,导入每个斑马鱼受精卵的液体体积为1nl;其中可以加入10%酚红,用于指示rna-mix导入斑马鱼受精卵是否成功。
21.本文中使用的术语仅用于描述特定实施例,并且无意于限制本公开。除非在上下文中具有明显不同的含义,否则单数形式的表达包括复数形式的表达。如本文所使用的,应当理解,诸如“包括”、“具有”、“包含”之类的术语旨在指示特征、数字、操作、组件、零件、元件、材料或组合的存在。在说明书中公开了本发明的术语,并且不旨在排除可能存在或可以添加一个或多个其他特征、数字、操作、组件、部件、元件、材料或其组合的可能性。如在此使用的,根据情况,“/”可以被解释为“和”或“或”。
22.本发明有益效果至少包括:
23.(1)本发明提供的sgrna可以精准靶向识别斑马鱼slc25a13基因位点,使得crispr/cas在敲低或敲除斑马鱼slc25a13基因时更加精准;
24.(2)本发明提供的crispr/cas技术可以有效敲除斑马鱼slc25a13基因,使得slc25a13基因表达降低,得到的斑马鱼基因敲降突变体在不改变遗传物质情况下获得与citrin(希特林)蛋白缺乏综合征相关表型的斑马鱼。
附图说明
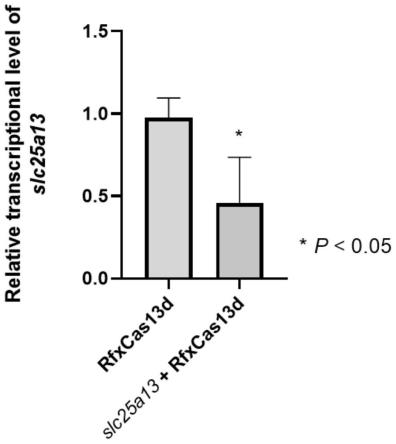
25.图1为斑马鱼slc25a13基因敲降模型3dpf时slc25a13基因相对表达量降低,以β-actin作为内参基因(n=4,*p《0.05);
26.图2为斑马鱼slc25a13基因敲降模型60hpf时表现出生长发育迟缓;
27.图3为斑马鱼slc25a13基因敲降模型60hpf时体长测量数据,(n=10,****p《0.0001)。
具体实施方式
28.所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
29.以下实施例中,涉及的斑马鱼ab品系,由福建省医学科学研究院提供;质粒为pxr001质粒(addgene,#109049)。
30.以下实施例中,主要试剂情况如下:sanprepcolumnplasmidmini-prepskit(sangonbiotech,#b518191),sanprepcolumndnagelextractionkit(sangonbiotech,#b518131),sanprepcolumnpcrproductpurificationkit(sangonbiotech,#b518141),
invitrotranscriptiont7kit(takara,#6140),mmessagemmachinetmsp6transcriptionkit(invitrogen,#am1340),poly(a)tailingkit(invitrogen,#am1350);transstartfastpfudnapolymerase(trans,#ap221),10mmhighpuredntps(trans,#ad101-1)。
31.以下实施例中,主要仪器情况如下:实时荧光定量pcr扩增仪(品牌:abi,型号:steponeplus),超微量分光光度计(品牌:thermofisherscintific,型号:nanodropone),高速裂解样品台式均质仪(品牌:mp,型号:fastprep-245g),垂直拉针仪(品牌:narishige,型号:pc-100),微量注射系统(品牌:worldprecisioninstruments,型号:nanojectiii),体式显微镜(品牌:nikon,型号:smz745t)。
32.实施例1构建crispr/rfxcas13d系统
33.(1)在斑马鱼slc25a13基因上选择slc25a13-sgrna靶向位点,分析确认slc25a13-sgrna靶向位点的特异性
34.从zfin数据库中获取斑马鱼slc25a13基因的蛋白编码序列;在crispor网站上输入slc25a13基因的蛋白编码序列并设计靶向位点,设定基因组信息为斑马鱼,选择pam序列为20bp-ngg,挑选出自动生成的靶向位点序列,序列为seqidno.12~14所示序列。通过blast比对序列,结果显示3条slc25a13-sgrna靶向序列均是slc25a13基因的特异序列,分别位于slc25a13的第1、5、14个外显子;
35.(2)制备slc25a13-sgrna
36.1)设计构建sgrna的上游引物:t7启动子序列连接30nt含有sgrna固定引物的正向重复序列,序列为seqidno.4所示序列;下游引物:22-25nt靶向位点识别序列,连接18nt反向重复序列,序列为seqidno.5-7所示序列,具体如下表1所示;
37.表1 上述表1中所述的扩增引物信息
[0038][0039]
2)以上下游引物自体连接的方式制备sgrna的dna模板,反应体系见表2所示;
[0040]
表2 pcr反应体系
[0041]
组分体积t7-sgrna-f(10μm)8μlslc25a13-r(10μm)8μl2
×
pcr mix25μlddh2oto 50μl
[0042]
3)按表2所述反应体系进行pcr反应并使用琼脂糖凝胶电泳验证扩增条带的分子量大小,得到大小约75bp的电泳条带;将扩增产物进行pcr产物回收;使用invitrotranscriptiont7kit进行体外转录得到slc25a13-sgrna中间产物,反应体系见表3所示,体系混匀后以37℃,2h反应程序进行反应;
[0043]
表3 slc25a13-sgrna体外转录反应体系
[0044]
组分体积2
×
ntp/cap10μl10
×
reaction buffer2μllinear template dna50ngenzyme mix2μlnuclease-free waterto 20μl
[0045]
4)使用poly(a)tailingkit对slc25a13-sgrna中间产物进行3’端加尾,反应体系见表4所示,体系混匀后以37℃/1h反应程序进行反应;
[0046]
表4 3’端加尾反应体系
[0047]
组分体积表3所得slc25a13-sgrna中间产物20μl5
×
e-pap buffer20μl25mm mncl210μl10mm atp10μle-pap4μlnuclease-free waterto 100μl
[0048]
5)使用nanodropone超微量分光光度计检测体外转录所得rna的浓度和纯度,检测结果如下表5所示。
[0049]
表5 体外转录所得rna的浓度和纯度
[0050][0051]
(3)制备mrfxcas13d
[0052]
1)mrfxcas13d的dna模板制备:上游引物:sp6启动子序列连接真核生物kozak序列以及质粒pxr001上游sv40nls扩增序列,序列为seqidno.8所示序列;下游引物为seqidno.9所示序列,具体情况如下表6所示;
[0053]
表6 mrfxcas13d扩增引物信息
[0054]
引物名称引物序列(5
’‑3’
)rfxcas13d-sp6-kozak-fseq id no.8rfxcas13d-wpre-rseq id no.9
[0055]
2)通过高保真pcr扩增的实验方式扩增mrfxcas13d的dna模板,反应体系如表7所示;
[0056]
表7 mrfxcas13d的dna模板扩增体系
[0057]
组分体积pxr001100ngrfxcas13d-sp6-kozak-f1μlrfxcas13d-wpre-r1μldna polymerase1μl10mm dntps1μl5
×
transstart fastpfu buffer10μlddh2oto 50μl
[0058]
3)按表6所述反应体系进行pcr反应并使用琼脂糖凝胶电泳验证扩增条带的分子量大小,得到大小约4.5kb的电泳条带。将扩增产物进行割胶回收,获得目的dna片段即为mrfxcas13d的dna模板。使用mmessagemmachine
tm
sp6transcriptionkit进行体外转录得到mrfxcas13d,反应体系见表8所示,体系混匀后以42℃/2h反应程序进行反应;再向体系中加入2μlrnasefreednasei并混匀,37℃/30min;
[0059]
表8 mrfxcas13d体外转录反应体系
[0060][0061][0062]
4)使用nanodropone超微量分光光度计检测体外转录所得rna的浓度和纯度;结果为:mrfxcas13d浓度:10013.1ng/μl;纯度od
260/280
:2.03,od
260/230
:2.49。
[0063]
(4)将slc25a13-sgrna和mrfxcas13d混匀成rna-mix。
[0064]
实施例2构建斑马鱼slc25a13基因敲降突变体模型构建及验证
[0065]
(1)模型构建
[0066]
将实施例1中的rna-mix通过显微注射至斑马鱼单细胞期的受精卵中,其中slc25a13-sgrna的终浓度分别为100ng/μl,mrfxcas13d的终浓度为200ng/μl,加入10%酚红,用于指示rna-mix导入斑马鱼受精卵是否成功,注射进入每个斑马鱼受精卵的液体体积为1nl;
[0067]
(2)鉴定slc25a13基因在敲降动物模型中表达是否降低以及是否在模型中出现了希特林蛋白缺乏综合征的病理表型
[0068]
1)取注射成功的3dpf斑马鱼10条,添加到1mltrizol试剂中并将混合物转移到裂解基质管中,使用fastprep-24以5m/s的速率匀浆两次,两次匀浆之间将样本置于冰上5min;根据thermofisherscientific手册中所述的标准trizol抽提方案进行rna提取;在进行qpcr实验之前,使用超微量分光光度计检测rna的浓度和纯度;
[0069]
2)以seqidno.10和seqidno.11为引物对,扩增slc25a13-sgrna靶向位点上下游序列约200bp,通过实时荧光定量pcr的方法检测slc25a13基因的相对表达量;结果如图1所示,在mrfxcas13d和slc25a13-sgrna共同注射进斑马鱼体内时,slc25a13基因的相对表达量下降,并具有显著性差异;
[0070]
3)于体视显微镜镜下观察注射成功的60hpf斑马鱼发育情况,测量斑马鱼体长;结果如图2和图3所示,在mrfxcas13d和slc25a13-sgrna共同注射进斑马鱼体内时,斑马鱼体长相较于对照组和仅注射mrfxcas13d组更短(如图2所示),并在具体测量其体长数据后发现具有显著性差异(如图3所示)。
[0071]
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1