斑马鱼hoxb1a基因缺失突变体的制备方法和应用
1.本发明属于分子生物学领域,具体涉及斑马鱼hoxb1a基因缺失突变体的制备方法和应用。
背景技术:
2.近年来,crispr/cas9系统编辑基因组的能力已经在很大程度上革新了基因组工程领域,这套系统最先发现于细菌的获得性免疫系统,噬菌体或质粒等外源dna识别后被整合到crispr基因座上与重复序列一起串联形成短的间隔序列,接着这个crispr基因座被转录成成熟的小rna叫做crrna,每一个crrna都包含着重复序列和一个单独的间隔序列。这些crrna与对应的间隔序列正好反向互补,可以帮助识别间隔序列,此时crrna若与cas蛋白结合形成核糖核蛋白复合物,那么靶点处将会被cas蛋白切割。而目前应用最广泛的crispr/cas9系统属于crispr/cas系统中的type ii,自2012年doudna与charpentier两个团队将crrna和tracrna改进成为一条grna,与cas9成功实现在生物体内的基因编辑。但是在生物体中,一旦cas9和sgrna发挥作用后,会导致双链dna断裂(dsb),机体自身会进行自我修复。
3.hox基因是编码含有同源框的一大类转录因子家族,其广泛存在于后生动物,其不仅在决定躯体形态形成中发挥了关键的作用,而且还参与调控器官的发育及成熟。在2015年,zaffran实验室发现hoxb1突变体存在心室间隔损坏、血管位置异常以及流出道变短等心脏发育异常的表型,并且这些异常是由于第二生心区的心脏祖细胞的增殖和分化被扰乱所导致的。此外,vahidi mehrjardi my等发现候选基因hoxb1突变可能会导致罕见的先天性面部神经疾病的发生,比如遗传性先天性面神经麻痹(hcfp)。
4.遗传性先天性面神经麻痹(hcfp)是罕见的先天性颅神经失调疾病,表现为非进行性孤立性面神经麻痹(颅神经vii),是由面神经核及其神经发育异常引起的。先天性面瘫(cfp)分为获得性或发展性、单侧或双侧、完全性(瘫痪)或不完全性(瘫痪)。为了确定病因,仔细的诊断检查和鉴别诊断很重要,因为根据潜在的病理生理学,预后和治疗方法不同。根据以往的研究,认为该疾病存在遗传异质性和不同的遗传模式。在2个常染色体显性遗传性hcfp家族中,分别定义hcfp1(mim%601471)和hcfp2(mim%604185)两个基因位点,但均未确定。唯一已知的常染色体隐性hcfp(hcfp3)是由chr17q21.32(mim 614744)中hoxb1(mim%142968)双等位基因突变引起的。最近,在来自5个hcfp3不相关近亲家庭的12例患者中,发现了hoxb1基因的4个突变(3个错义,1个无义),对目前已知的该疾病的候选基因进行遗传筛选,发现hoxb1中有一个新的纯合截断突变。相关的实验数据支持这样的结论:hoxb1功能丧失会导致面部无力和发育畸形。
5.已有报道发现小鼠hoxb1突变会影响第二生心区祖细胞的增殖和分化,说明hoxb1基因在胚胎发育中起到至关重要的作用。该基因在心血管疾病上发挥重要功能,但其具体作用机制和影响的下游信号通路尚需深入研究。在实验研究中小鼠突变体在心脏功能基因研究上存在一定程度的缺陷,其无法进行活体实时动态的细致观察,而斑马鱼幼时胚胎透明,是很好的用于心血管疾病研究的模式动物。
技术实现要素:
6.本发明的目的在于提供斑马鱼hoxb1a基因缺失突变体的制备方法,首次利用crispr/cas9技术在斑马鱼基因组上进行hoxb1a基因敲除,实现斑马鱼中hoxb1a基因特异性敲除的同时又不会干扰其他基因功能,得到hoxb1a敲除的斑马鱼。
7.本发明的另一目的是提供斑马鱼hoxb1a基因缺失突变体作为动物模型为心脏发育机制和人类hcfp相关疾病的探索提供理论基础。
8.本发明的目的是通过以下技术方案来实现的:
9.本发明提供的斑马鱼hoxb1a基因缺失突变体的制备方法,通过crispr/cas9技术制备斑马鱼hoxb1a基因缺失突变体,包括如下步骤:
10.s1、确定hoxb1a基因敲除的靶点在斑马鱼hoxb1a基因第1个外显子上设计grna序列;
11.s2、设计合成hoxb1a grna所需的上游引物t7-hoxb1a-sfd和下游grna反向引物;
12.s3、以grna骨架质粒为模板,使用上游引物t7-hoxb1a-sfd和下游grna反向引物进行pcr扩增;
13.s4、对步骤s3的pcr产物进行体外转录获得grna;
14.s5、将grna与cas9蛋白导入斑马鱼中;
15.s6、培养获得稳定遗传的斑马鱼hoxb1a基因突变体。
16.步骤s1中,所述靶点grna序列为ggaactgggacaacaagtta(seq id no:1)。
17.步骤s2中,上游引物f1(t7+target site+),即引物t7-hoxb1a-sfd的序列为:
[0018][0019]
下游引物r1(trans reverse),即grna反向引物的序列为:
[0020]
aaaaaaagcaccgactcggtgccac(seq id no:3)。
[0021]
步骤s4中,所述grna的序列为taatacgactcactataggaactgggacaacaagttagttttagagctagaaatagcggacagattcatgtcctggacgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt(seq id no:6)。
[0022]
作为优选,步骤s5中,将grna与cas9蛋白导入斑马鱼具体为:将grna与cas9蛋白混合,显微注射到斑马鱼一细胞期胚胎中;其中,grna终浓度为100ng/μl,cas9蛋白终浓度为800ng/μl;每枚受精卵注射1nl。
[0023]
作为优选,步骤s6具体包括如下步骤:
[0024]
a1、分别取导入grna与cas9蛋白的斑马鱼以及野生型未注射的斑马鱼胚胎进行hoxb1a基因敲除检测,确定hoxb1a基因敲除阳性f0养至成鱼;
[0025]
a2、将hoxb1a基因敲除阳性f0成鱼与野生型斑马鱼外交进行可遗传性及有效突变检测,筛选可遗传的有效突变f1进行喂养至成鱼;经基因型鉴定获得hoxb1a f1突变体斑马鱼;
[0026]
a3、将相同突变的hoxb1a f1突变体斑马鱼内交,获得hoxb1a f2突变体斑马鱼;
[0027]
a4、鉴定为f2代中hoxb1a基因敲除的纯合子即为稳定遗传的斑马鱼hoxb1a基因突变体。
[0028]
作为更优选,步骤a1中,hoxb1a基因敲除检测采用的引物序列包括:
[0029]
上游引物hoxb1a-f:acgctgatggacgactttacg(seq id no:4);
[0030]
下游引物hoxb1a-r:caatccacctgttttggggg(seq id no:5)。
[0031]
作为更优选,步骤s6包括如下步骤:
[0032]
(1)在靶点周围设计引物,使其距离靶位点两侧都大于100bp,且引物距离靶点的距离之差的绝对值大于100bp;选择一对健康的wt斑马鱼作为亲本,剪尾巴进行pcr,将pcr产物直接送去测序,检测亲鱼待敲除的基因是否为纯合子,要求待注射的成鱼对靶点序列为纯合子,如果测序结果显示靶点序列为杂合子,重新选择待注射的成鱼;
[0033]
(2)将grna与cas9蛋白显微注射入斑马鱼中,混合注射体系的终浓度grna:100ng/μl;cas9蛋白:800ng/μl;总体积v=1nl;
[0034]
(3)注射当天晚上将死卵挑出,同时换一半新水,之后每天早晚换水一次,受精后48h,双外侧引物pcr检测,敲除成功f0斑马鱼进行饲养;
[0035]
(4)3-4个月斑马鱼性成熟后,将突变的f0斑马鱼与野生型的斑马鱼杂交,得到一定概率的杂合子,收集胚胎提取基因组,使用检测引物进行pcr后,ta克隆送测序确定基因型,确定可遗传且发生移码突变的f1斑马鱼进行饲养;
[0036]
(5)经过3-4个月性成熟后,f1突变体斑马鱼成年的雄鱼与雌鱼再次剪尾巴,进行基因型鉴定筛选,将突变体斑马鱼再次交配,从而得到hoxb1a基因缺失纯合突变体斑马鱼。
[0037]
作为更优选,所述斑马鱼hoxb1a基因突变体在4.5dpf时观察到心包水肿、心脏环化异常的心脏畸形现象,原位杂交突变体心房和心室的腔室发育无明显异常。
[0038]
本发明还提供斑马鱼hoxb1a基因缺失突变体作为动物模型在研究hoxb1a基因的生物学功能和与hoxb1a基因缺失相关疾病中的应用,其中所述斑马鱼hoxb1a基因缺失突变体通过上述任一所述斑马鱼hoxb1a基因缺失突变体的制备方法得到。
[0039]
本发明利用crispr/cas9技术在斑马鱼上构建hoxb1a基因缺失突变体,具有生长快、数量多的技术优势,同时表型明显,可以更好的模拟心脏发育异常、颅面发育异常等疾病,弥补了相关研究的空白,模拟hoxb1a基因缺失造成的疾病便于在斑马鱼上观察hoxb1a基因缺失所造成的疾病表型,同时利用该模型进行药物筛选实验为后续hox基因功能研究提供方式方法,本发明具有以下有益效果:
[0040]
1)首次利用crispr/cas9技术设计一段特异的打靶位点,实现斑马鱼中hoxb1a基因的特异敲除,在对hoxb1a基因进行敲除的同时,又不会影响其他基因,得到hoxb1a特异性敲除的斑马鱼,对相关单位点敲除提供有价值的思路和方法。
[0041]
2)hoxb1a基因共编码316个氨基酸,而缺失13bp的突变体编码214个氨基酸,其中前97个氨基酸编码正确,其后编码的氨基酸因为出现终止子而不表达。
[0042]
3)hoxb1a基因突变可稳定遗传,便于后续hoxb1a基因功能机制的深入研究。
[0043]
4)hoxb1a-/-突变体斑马鱼表型严重,在4.5dpf(days post fertilization)时观察到心包水肿,心脏环化异常等明显的心脏畸形的现象,同时伴随有面部发育畸形的情况。
[0044]
5)利用斑马鱼hoxb1a-/-突变体分析心脏疾病相较于小鼠hoxb1突变体优势在于,胚胎透明便于观察心脏畸形,并且一对亲本可产大约300枚后代,增大实验分析和药物筛选的样本量。
附图说明
[0045]
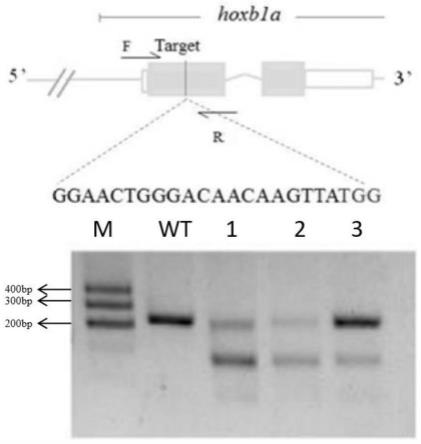
图1为crispr/cas9介导的斑马鱼hoxb1a基因的敲除模式图,hoxb1a基因敲除后测序和t7e1实验检测显示hoxb1a基因敲除成功。
[0046]
图2为hoxb1a f
0 germline transmission检测结果;取5尾hoxb1a f0基因检测敲除成功的成鱼与野生型斑马鱼外交,得到的f1胚胎5枚一管,取3-4管进行t7e1酶切鉴定,酶切结果显示,该5尾斑马鱼将突变传递给后代。
[0047]
图3为f
1-hoxb1a成年斑马鱼基因型检测t7e1内切酶酶切鉴定凝胶电泳结果;剪尾检测13尾外交获得的斑马鱼hoxb1a基因,经t7e1检测,获得13条阳性斑马鱼。
[0048]
图4为hoxb1a野生型及纯合突变体基因型测序结果;(a)野生型和突变体的测序峰图;(b)野生型和突变体编码的氨基酸序列比较结果;(c)野生型和突变体的hoxb1a蛋白二级结构模式图。
[0049]
图5为hoxb1a基因缺失后斑马鱼心包水肿的心脏畸形的情况,箭头所示(a,b);(a’,b’)心脏区域放大图片,虚线描绘心包腔的轮廓。
[0050]
图6为hoxb1a缺失导致斑马鱼心脏异常。光镜显微镜拍照显示hoxb1a突变体心包腔肿大(图6a,c);hoxb1a突变体相较野生型心脏环化异常(图6b,d,e,f);心脏腔室特异性表达基因anf的原位杂交实验结果显示,hoxb1a突变体anf信号异位表达在箭头所指的心脏房室间隔处,而野生型仅表达在心室和心房,不在房室间隔表达(图6g,h)。
[0051]
图7为hoxb1a基因缺失后斑马鱼面部发育畸形的情况(a,b);(a’,b’)面部区域放大图,虚线描绘出突变体与野生型相比有差异,箭头所示下颌区域突变体比野生型更厚。
具体实施方式
[0052]
下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
[0053]
实施例
[0054]
1材料及设备
[0055]
1.1实验所用斑马鱼和质粒
[0056]
本实验中所用的斑马鱼来源于上海海洋大学水产与生命学院斑马鱼平台。
[0057]
本实验所有grna骨架质粒来源于文献:chang n,sun c,gao l,zhu d,xu x,zhu x,xiong jw,xi jj.genome editing with rna-guided cas9 nuclease in zebrafish embryos,cell res,2013,23(4):465-472。
[0058]
1.2主要试剂
[0059]
表1:实验试剂
[0060][0061][0062]
1.3主要仪器
[0063]
表2:实验仪器
[0064][0065][0066]
2实验方法
[0067]
2.1grna合成
[0068]
1)靶点设计
[0069]
(1)从斑马鱼基因组数据库(http://www.ensembl.org/danio_rerio/info/index)得到hoxb1a基因序列和结构信息(ensdarg00000039077和ensdarg00000024771)
[0070]
(2)在在线网站http://zifit.partners.org/zifit/上设计靶位点。
[0071]
靶点设计要求:
[0072]
a.长度首选为20bp,若没有20bp的则选择19bp的长度,5
′
端以gg开头,这是为了提高t7启动子的合成效率;
[0073]
b.尽量选择gc含量高的靶位点,而不要有连续的at序列,紧邻靶点3
′
端的3个碱基为ngg(n为任意碱基,称为pam区)。
[0074]
(3)设计好靶位点后,到ncbi网站检测靶点特异性,在整个基因组上面有没有其他位置存在同样序列,若有,应舍弃。
[0075]
(4)设计检测引物,本文需要用t7e1酶检测突变,为了让检测的胶图更为明确,设计的检测引物要求上下游引物与靶点之间的距离差大于100bp,上下游引物各自与靶点的距离要求大于100bp。
[0076]
(5)将用于基因敲除的wt斑马鱼剪尾并用碱裂解法获得基因组dna,进行pcr扩增
靶点附近的一段序列。
[0077]
(6)用t7e1内切酶酶切检测wt斑马鱼,看t7e1酶能否将扩增的片段切开,若切不开,则可用于后续敲除检测;若被切开,则需要根据扩增序列信息选择特异性的酶进行酶切检测。
[0078]
(7)测序鉴定:将pcr产物送测序,峰图及序列比对,确认亲本为纯合子,不存在自然突变,从而保证后续制备的突变体为基因敲除后造成的。
[0079]
表3:hoxb1a靶位点序列
[0080][0081]
2)设计检测引物:设计的引物应保证距离靶点两侧大于100bp,并且上下游引物到靶点的距离与下游引物到靶点的距离应相差大于100bp,至少50bp。引物扩增应具备特异性,扩增片段约500bp。引物在上海生工生物工程股份有限公司合成(表4)。
[0082]
表4:实验所用引物信息
[0083][0084]
3)grna产物合成:以grna骨架质粒为模板,使用引物t7-hoxb1a-sfd、grna反向引物和2
×
easytaq pcr supermix(+dye)扩增片段并用试剂盒纯化。
[0085]
4)体外转录:
[0086]
表5:体外转录反应体系
[0087]
nuclease-free waterto 20μldna template1μg10
×
transcription buffer2μl10mm atp/ctp/gtp/utp1μl/1μl/1μl/1μlt7enzyme mix2μl
[0088]
注意:最后添加10
×
transcription buffer和t7enzyme mix
[0089]
混匀并短暂离心后,37℃孵育80min;之后向体系中加入1μl turbo dnase并混匀,短暂离心后37℃孵育15min。
[0090]
5)纯化grna:
[0091]
(1)向20μl体外转录体系中加入2.5μl 4m licl和100μl无水乙醇,轻轻混匀并短暂离心后放于-80℃冰箱至少1h。
[0092]
(2)从冰箱取出样品,4℃,12000rmp,离心15min。弃上清后用70%乙醇清洗沉淀。4℃,12000rmp,离心5min。弃上清后将离心管放于通风橱中使乙醇挥发干净。
[0093]
(3)根据沉淀大小加入适量depc水溶解grna沉淀。之后用nanodrop检测浓度和od值并用电泳检测,其中grna的序列为taatacgactcactataggaactgggacaacaagttagttttagagctagaaatagcggacagattcatgtcctggacgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt(seq id no:6)。
[0094]
2.2显微注射
[0095]
将grna与cas9蛋白(购买于gencrispr nls-cas9-nls(金斯瑞,z03389-25))混合,利用显微注射仪器将混合后的物质注射到斑马鱼一细胞期胚胎中,每次注射都留一批未注射的同批次胚胎作为对照组。混合注射终浓度:grna为100ng/μl,cas9蛋白为800ng/μl。
[0096]
2.3检测敲除是否成功及敲除效率(t7e1酶切检测)
[0097]
(1)提取鱼卵基因组
[0098]
每组5枚卵,加35μl 50mm naoh,95℃孵育20min,中间取出振荡,短暂离心一次。之后加3.5μl 1m的tris
·
hcl(ph≈8.0),剧烈振荡混匀后离心。
[0099]
(2)pcr扩增目的片段
[0100]
根据靶点附近设计的引物扩增目的片段。
[0101]
表6:pcr反应体系
[0102]
h2oto 25μlmix taq enzyme12.5μlf/r0.5μl/0.5μl模板10ng
[0103]
pcr反应条件:
[0104]
98℃预变性2sec;98℃变性10sec,55℃退火30sec,72℃延伸1min,共36个循环;72℃再延伸5min;4℃保存。
[0105]
2%琼脂糖凝胶120v电泳25min。
[0106]
(3)t7e1内切酶酶切检测
[0107]
表7:t7e1酶切预反应体系
[0108]
buffer1.1μlpcr product5μlh2o4μltotal11.1μl
[0109]
95℃孵育5min,冷却至室温,加0.5μl t7e1酶和ddh2o 1:1混合物,37℃孵育45min。
[0110]
(4)电泳检测
[0111]
电泳后利用凝胶电泳成像仪对电泳的琼脂糖凝胶成像,观察目的条带,判断敲除是否成功。
[0112]
2.4 hoxb1a纯合突变体斑马鱼基因型鉴定
[0113]
不同的缺失类型进行基因型筛选鉴定。
[0114]
3实验结果
[0115]
3.1 hoxb1a突变体的构建
[0116]
3.1.1 hoxb1a f0基因敲除检测结果
[0117]
t7e1酶切结果显示hoxb1a基因敲除成功(图1)。
[0118]
3.1.2 hoxb1a f
0 germline transmission检测结果
[0119]
取5尾hoxb1a f0基因检测敲除成功的成鱼与野生型斑马鱼外交,得到的f1胚胎5枚一管,取3-4管进行t7e1酶切鉴定,酶切结果显示,有该5尾斑马鱼将突变传递给后代(图2)。
[0120]
3.1.3 hoxb1a f1杂合突变体斑马鱼基因型鉴定
[0121]
剪尾检测13尾外交获得的斑马鱼hoxb1a基因,经t7e1检测,获得13条阳性斑马鱼,进行ta克隆,确定6条鱼发生有效突变,突变类型为-13bp(图3和图4)。
[0122]
3.1.4 hoxb1af2突变体斑马鱼表型观察拍照
[0123]
将hoxb1a杂合突变体内交,产卵后收集培养用于早期胚胎发育观察,在4.5dpf时观察到心脏心包腔水肿和心脏不能正常环化的现象(图5,图6a-d)。原位杂交实验在4.5dpf的hoxb1a突变体和对照组中检测了myl7,anf,vmhc这三个心脏标记基因的表达谱。正常野生型斑马鱼中myl7基因特异表达在心脏心肌层,vmhc基因特异表达在心室的心肌层,anf基因特异地表达在心脏腔室,而房室间隔(avc)不表达;心脏腔室特异性表达基因anf的原位杂交实验结果显示,hoxb1a突变体anf信号异位表达在箭头所指的心脏房室间隔处,而野生型仅表达在心室和心房,不在房室间隔表达(图6g,h),表明hoxb1a-/-的心房和心室的腔室形态并无异常,但影响房室间隔的发育(图6e,f,i,j),同时野生型面部发育正常,而纯合突变体在4.5dpf时面部发育异常(图7)。
[0124]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1