一种利用解脂耶氏酵母高产斑蝥黄的培养基组合和发酵工艺的制作方法
1.本发明涉及微生物发酵技术领域,具体涉及一种利用解脂耶氏酵母高产斑蝥黄的培养基组合和发酵工艺。
背景技术:
2.斑蝥黄是一种重要的类胡萝卜素,为深紫色晶体或结晶性粉末,对氧及光不稳定,需贮存于充惰性气体的遮光性容器内。斑蝥黄在自然界生物体内广泛存在,因其着色效果好,故而常作为食品、饲料、化妆品等中的着色剂使用。同时斑蝥黄还因其生理功能而广泛应用于医学领域,斑蝥黄与维生素e、虾青素、β-胡萝卜素等在对自由基的淬灭作用方面相类似,但效果是β-胡萝卜素的近两倍,是维生素e的五十倍,又称为超级维生素e。其能够提高免疫力、延缓衰老、预防老年疾病,甚至具有一定的抗癌功效。
3.斑螯黄的获取方法主要有天然原料提取、化学合成和生物发酵生产。由于各类物种体内的斑蝥黄含量都非常微量,无法通过人工提取的方法大量生产;目前工业生产中主要采用化学合成生产:包括全化学合成法和β-胡萝卜素氧化法。全化学合成法制备斑蝥黄路线过长,成本普遍较高;β-胡萝卜素氧化法是利用β-胡萝卜素为原料进行一步氧化的方法,相较而言具有操作方便、设备简单等特点,是工业化生产斑蝥黄的主要方法,β-胡萝卜素一步氧化法分为固相研磨法和双液相氧化法。生物发酵生产β-胡萝卜素则克服了以上两种方法的缺点,具有生产工艺简单、周期短、成本低、产品质量好等优点。但是生物发酵法要先得到合适的高产菌株,再通过发酵工艺开发使其高效生产。目前尚无发酵法生产斑蝥黄的其他公开报导。
技术实现要素:
4.针对目前缺少通过发酵工艺高效生产斑螯黄方法的技术问题,本发明提供一种利用解脂耶氏酵母高产斑蝥黄的培养基组合和发酵工艺,可在100l发酵罐上实现发酵效价5g/l的较高水平,具有广泛的工业化应用前景。
5.第一方面,本发明提供一种利用解脂耶氏酵母高产斑蝥黄的培养基组合,包括斜面培养基、种子培养基和发酵培养基;其中,斜面培养基包括麦芽膏粉100-190g/l,琼脂15-20g/l,氯霉素0.05-0.2g/l;种子培养基包括葡萄糖5-15g/l,大豆蛋白胨5-20g/l,硝酸钾1-10g/l,硫酸铵2-12g/l,磷酸二氢钾2-10g/l;发酵培养基包括葡萄糖120-300g/l,蛋白胨15-45g/l,玉米浆5-20g/l,硫酸铵2-12g/l,硫酸镁1-6g/l,硫酸锰1-6g/l,菜籽油20-110g/l。
6.进一步的,斜面培养基包括麦芽膏粉130g/l,琼脂20g/l,氯霉素0.1g/l;种子培养基包括葡萄糖15g/l,大豆蛋白胨10g/l,硝酸钾2g/l,硫酸铵5g/l,磷酸二氢钾3g/l;发酵培养基包括葡萄糖260g/l,蛋白胨30g/l,玉米浆10g/l,硫酸铵5g/l,硫酸镁
locus. nucleicacids res. 2001,29(12):e59),其中ura3(genebank登录号:aj306421)由苏州泓迅生物科技股份有限公司合成,并在其两端加上hisg序列(genebank登录号:af324729),插入puc57载体获得puc-huh。
19.本发明所使用的ggs1基因(多核苷酸序列如seq id no:84所示)、thmgr(多核苷酸序列如seq id no:85所示)启动子tefp、expp、gdpp及终止子pext、xprt、lipt等均来源于解脂耶氏酵母mya-2613,通过pcr方法获得。
20.实施例1 解脂耶氏酵母基因工程菌mc-ctx4的构建以解脂耶氏酵母mc209为出发菌株,解脂耶氏酵母mc209为中国专利申请cn202210057473.x记载的mc-3rp-gh-foa菌株,该菌株是以购自atcc的解脂耶氏酵母mya-2613为出发菌株,经导入拷贝的卷枝毛霉β-胡萝卜素合成基因carb及carrp,并增强解脂耶氏酵母牻牛儿基牻牛儿基焦磷酸(ggpp)合成酶基因ggs1及截短形式的hmg-coa还原酶基因thmgr的表达获得的,解脂耶氏酵母mc209已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏日期为2021年11月08日,保藏编号为cgmcc no.23758。
21.首先分别将两个不同的bsw重组质粒导入解脂耶氏酵母(yarrowia lipolytica)mc209细胞中,然后通过同源臂的同源重组整合到解脂耶氏酵母mc209染色体上,然后依次将重组质粒pmd-h7brp、重组质粒pmd-h8gh转入菌株中,即得解脂耶氏酵母基因工程菌。具体步骤如下:s1 重组质粒pmd-h1brp的制备以解脂耶氏酵母mya-2613染色体为模板,利用引物h1u-f/r(seq id no:1~2)、h1d-f/r(seq id no:3~4)扩增染色体上的同源臂序列,并通过重叠pcr将两者相连插入pmd19-t simple载体获得pmd-h1质粒;以解脂耶氏酵母mya-2613染色体为模板,利用引物tef1-f/r(seq id no:5~6)、pex1-f/r(seq id no:9~10)分别扩增启动子tefp及终止子pext;以puc-cb为模板,利用引物cb1-f/r(seq id no:7~8)扩增carb基因;然后通过重叠pcr构建tefp-carb-pext模块;以解脂耶氏酵母mya-2613染色体为模板,利用引物exp1-f/r(seq id no:11~12)、xpr1-f/r(seq id no:15~16)分别扩增启动子expp及终止子xprt;以puc-crp为模板,利用引物crp1-f/r(seq id no:13~14)扩增carrp基因;然后通过重叠pcr构建expp-carrp-xprt模块;以puc-leu为模板,利用引物leu-f/r(seq id no:17~18)扩增筛选标记leu;利用one step fusion cloning mix试剂盒将tefp-carb-pext模块、expp-carrp-xprt模块及筛选标记leu整合到pmd-h1质粒同源臂之间构建获得pmd-h1brp。
22.s2 重组质粒pmd-h2brpg的制备以解脂耶氏酵母mya-2613染色体为模板,利用引物h2u-f/r(seq id no:19~20)、h2d-f/r(seq id no:21~22)扩增染色体上的同源臂序列,并通过重叠pcr 将两者相连插入pmd19-t simple 载体获得pmd-h2质粒;将puc-huh上的可回收筛选标记hisg-ura3-hisg通过酶切插入到pmd-h2获得pmd-h2-huh;
h5-huh;以解脂耶氏酵母mya-2613染色体为模板,利用引物exp3-f/r(seq id no:61~62)、xpr3-f(seq id no:65)/brp-r(seq id no:56)分别扩增启动子expp、终止子xprt;以puc-bsw为模板,利用引物bsw-f/r(seq id no:63~64)扩增bsw基因,然后通过重叠pcr构建expp-bsw-xprt模块;利用one step fusion cloning mix试剂盒将expp-bsw-xprt模块整合到pmd-h5-huh质粒获得pmd-h5bsw。
26.s6 重组质粒pmd-h6bsw的制备以解脂耶氏酵母mya-2613染色体为模板,利用引物h6u-f/r(seq id no:66~67)、h6d-f/r(seq id no:68~69)扩增染色体上的同源臂序列,并通过重叠pcr将两者相连插入pmd19-t simple载体获得pmd-h6质粒;将puc-huh上的可回收筛选标记hisg-ura3-hisg通过酶切插入到pmd-h6获得pmd-h6-huh;以前述pmd-h5bsw为模板,利用引物ewx-f(seq id no:70)/brp-r(seq id no:56)扩增expp-bsw-xprt模块;利用one step fusion cloning mix试剂盒将expp-bsw-xprt模块整合到pmd-h6-huh质粒获得pmd-h6bsw。
27.s7 重组质粒pmd-h7brp的制备以解脂耶氏酵母mya-2613染色体为模板,利用引物h7u-f/r(seq id no:71~72)、h7d-f/r(seq id no:73~74)扩增染色体上的同源臂序列,并通过重叠pcr将两者相连插入pmd19-t simple载体获得pmd-h7质粒;将puc-huh上的可回收筛选标记hisg-ura3-hisg通过酶切插入到pmd-h7获得pmd-h7-huh;以重组质粒pmd-h4brp为模板,利用引物brp2-f(seq id no:75)/brp-r(seq id no:56)扩增tefp-carb-pext+expp-carrp-xprt模块;利用one step fusion cloning mix试剂盒将tefp-carb-pext+expp-carrp-xprt模块整合到pmd-h7-huh质粒获得pmd-h7brp。
28.s8 重组质粒pmd-h8gh的制备以解脂耶氏酵母mya-2613染色体为模板,利用引物h8u-f/r(seq id no:76~77)、h8d-f/r(seq id no:78~79)扩增染色体上的同源臂序列,并通过重叠pcr将两者相连插入pmd19-t simple载体获得pmd-h8质粒;将puc-huh上的可回收筛选标记hisg-ura3-hisg通过酶切插入到pmd-h8获得pmd-h8-huh;以重组质粒pmd-h2brpg为模板,利用引物ggl-f/r(seq id no:80~81)扩增gpdp-ggs1-lipt模块;以重组质粒pmd-h3hm为模板,利用引物thp-f(seq id no:82)/pex3-r(seq id no:50)扩增tefp-thmgr-pext模块;利用one step fusion cloning mix试剂盒将gpdp-ggs1-lipt、tefp-thmgr-pext模块整合到pmd-h8-huh质粒获得pmd-h8gh。
29.s9 β-胡萝卜素酮化酶基因的导入将构建的重组质粒pmd-h5bsw、pmd-h6bsw以swaⅰ酶切线性化后,利用frozen-ez yeast transformation ii kit(zymo research公司)转入解脂耶氏酵母mc209细胞,涂布于sd培养基平板(葡萄糖20g/l,酵母基础氮源6.7g/l,琼脂粉20g/l,其余为水)进行筛选。
30.s10 斑蝥黄合成效果的强化将构建的重组质粒pmd-h7brp、pmd-h8gh以swaⅰ酶切线性化后转入细胞中,得到解脂耶氏酵母基因工程菌mc-ctx4。
31.实施例2 摇瓶发酵使用实施例1最终得到的解脂耶氏酵母基因工程菌进行摇瓶发酵,培养基组合如下:斜面培养基
①
:麦芽膏粉170/l,琼脂15g/l,氯霉素0.05g/l;种子培养基
①
:葡萄糖8g/l,大豆蛋白胨17g/l,硝酸钾6g/l,硫酸铵10g/l,磷酸二氢钾8g/l;发酵培养基
①
:葡萄糖150g/l,蛋白胨20g/l,玉米浆20g/l,硫酸铵9g/l,硫酸镁5g/l,硫酸锰5g/l,菜籽油100g/l。
32.发酵方法如下:(1)将解脂耶氏酵母接种于斜面培养基
①
中,于24-28℃、湿度60%-80%条件下培养箱培养3天,得到一代斜面种子,挑取一环一代斜面种子,划线于新鲜空白斜面,于24-28℃、湿度60%-80%条件下培养箱培养3天得到二代斜面种子;(2)采用挖块法将二代斜面接种于含25ml种子培养基
①
的250ml三角摇瓶中,于26℃、通气比1vvm条件下培养36h,摇床转速200r/min,得到成熟的种子液;(3)将种子液按3%-15%接种量转种于含25ml发酵培养基
①
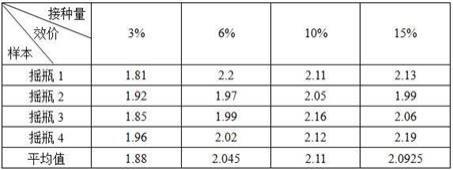
的250ml三角摇瓶中,调节ph至5.0-5.3,于26℃条件下培养120h,摇床转速240r/min,得到发酵液。
33.放瓶时发酵产量约为1.8-2.2g/l,具体发酵结果如下表1所示。
34.表1 摇瓶发酵结果(单位:g/l)实施例3 5l玻璃罐发酵使用实施例1最终得到的解脂耶氏酵母基因工程菌进行5l玻璃罐发酵,培养基组合如下:斜面培养基
②
:麦芽膏粉150g/l,琼脂18g/l,氯霉素0.15g/l;种子培养基
②
:葡萄糖10g/l,大豆蛋白胨8g/l,硝酸钾3g/l,硫酸铵12g/l,磷酸二氢钾3g/l;发酵培养基
②
:葡萄糖160g/l(发酵开始时发酵培养基中含有25%的葡萄糖,剩余
葡萄糖在发酵过程中补加),蛋白胨45g/l,玉米浆10g/l,硫酸铵3g/l,硫酸镁2g/l,硫酸锰6g/l,菜籽油30g/l。
35.发酵方法如下:(1)将解脂耶氏酵母接种于斜面培养基
②
上,于24-28℃、湿度60%-80%条件下培养箱培养3天,得到一代斜面种子,挑取一环一代斜面种子,划线于新鲜空白斜面,于24-28℃、湿度60%-80%条件下培养箱培养3天得到二代斜面种子;(2)将二代斜面菌种接种于含3l种子培养基
②
的5l玻璃发酵罐中,于26℃、通气比1vvm条件下培养36h,摇床转速200r/min,得到成熟的种子液;(3)将种子液按10%接种量转种于含3l发酵培养基
②
的5l玻璃发酵罐中,调节ph至5.0-5.3,于26℃、最高通气比为2.5vvm条件下培养120h,转速600r/min,发酵过程中补加剩余75%的葡萄糖,速率为4-8.5ml/(h
·
l),得到发酵液。
36.最高产量可达4.92g/l,具体发酵结果如下表2所示。
37.表2 5l玻璃罐发酵结果(单位:g/l)实施例4 100l发酵罐发酵使用实施例1最终得到的解脂耶氏酵母基因工程菌进行100l发酵罐发酵,培养基组合如下:斜面培养基
③
:麦芽膏粉130g/l,琼脂20g/l,氯霉素0.1g/l;种子培养基
③
:葡萄糖15g/l,大豆蛋白胨10g/l,硝酸钾2g/l,硫酸铵5g/l,磷酸二氢钾3g/l;发酵培养基
③
:葡萄糖210~290g/l(发酵开始时发酵培养基中含有10g/l的葡萄糖,剩余葡萄糖在发酵过程中补加),蛋白胨30g/l,玉米浆10g/l,硫酸铵5g/l,硫酸镁2.5g/l,硫酸锰2.5g/l,菜籽油100g/l(发酵开始时发酵培养基中含有70g/l的菜籽油,剩余菜籽油在发酵过程中补加)。
38.发酵方法如下:(1)将解脂耶氏酵母接种于斜面培养基
③
上,于24-28℃、湿度60%-80%条件下培养箱培养3天,得到一代斜面种子,挑取一环一代斜面种子,划线于新鲜空白斜面,于24-28℃、湿度60%-80%条件下培养箱培养3天得到二代斜面种子;(2)将二代解脂耶氏酵母斜面制备的菌悬液接种到20l种子培养基
③
中,于26℃、通气比1vvm条件下培养36h,摇床转速300r/m,得到成熟的种子液;(3)将种子液按10%接种量转种于含50l发酵培养基
③
的100l发酵罐中,调节ph至5.0-5.3,于26℃、通气比为2vvm条件下培养120h,摇床转速500r/m,发酵过程中补加葡萄糖和菜籽油,补糖速率为6-8ml/(h
·
l),补油速率为1-2ml/(h
·
l),得到发酵液。
39.最高产量可达5.05g/l,具体发酵结果如下表3所示。
40.表3 100l发酵罐发酵结果对比例1使用实施例1最终得到的解脂耶氏酵母基因工程菌进行5l玻璃罐发酵,培养基组合如下:斜面培养基
④
:葡萄糖20g/l,蛋白胨20g/l,酵母粉10g/l,琼脂粉20g/l;种子培养基
④
:葡萄糖20g/l,蛋白胨20g/l,酵母粉10g/l;发酵培养基
④
:葡萄糖540g/l(发酵开始时发酵培养基中含有40g/l的葡萄糖,剩余葡萄糖在发酵过程中补加),蛋白胨15g/l,酵母粉20g/l,磷酸二氢钾4g/l,硫酸亚铁1g/l。
41.发酵方法如下:(1)将解脂耶氏酵母接种于斜面培养基
④
上,于28℃下培养3天;(2)挖块接种于含50ml种子培养基
④
的500ml摇瓶中,于28℃下培养24h,摇床转速220r/m,得到成熟的种子液;(3)将种子液按10%接种量转种于含3l发酵培养基
④
的5l发酵罐中,发酵温度28℃,通气量1:1(vol:vol),摇床转速400-600r/m,发酵过程中补加葡萄糖,补糖速率为6-8ml/(h
·
l),补油速率为10ml/(h
·
l),得到发酵液。发酵三批次,160h时的斑蝥黄产量分别为3.37g/l、3.58g/l、3.54g/l,斑蝥黄的平均产量为3.5g/l。
42.尽管通过优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明的涵盖范围内/任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1