一种富马酸泰诺福韦酯的生产方法与流程
1.本发明属于医药制品生产技术领域,具体涉及一种富马酸泰诺福韦酯的生产方法。
背景技术:
2.富马酸泰诺福韦酯,性状为白色结晶性粉末,其水溶性特性为,在二甲基甲酰胺中易溶,在甲醇中溶解;在水、乙腈中微溶,一般用作抗病毒药物,作用特点与tenofovir类似,但本药的细胞毒性更强,化学及酶学的稳定性也更强,由于本药的活性代谢产物pmpapp在细胞内迅速蓄积,因而在细胞内的重摄取也迅速增快,发挥强效抗逆转录病毒作用,除k65r有轻微抵抗作用外,本品可抗多种耐药hiv株,泰诺福韦酯中间体,替诺福韦中间体,同时富马酸泰诺福韦酯的生产纯度越高,其效用越大。
3.常规富马酸泰诺福韦酯的制备生产,其自身溶解度所限,制备纯度较低,内含杂质较高,产品效用易遭受影响,而且现有的制取工艺较为繁琐,有待改进,本案由此产生。
技术实现要素:
4.本发明的目的,在于提供一种富马酸泰诺福韦酯的生产方法,解决了常规富马酸泰诺福韦酯的制备生产,其自身溶解度所限,制备纯度较低,内含杂质较高,产品效用易遭受影响,以及制取工艺较为繁琐等问题。
5.为了达成上述目的,本发明的解决方案是:
6.一种富马酸泰诺福韦酯的生产方法,包括如下步骤:
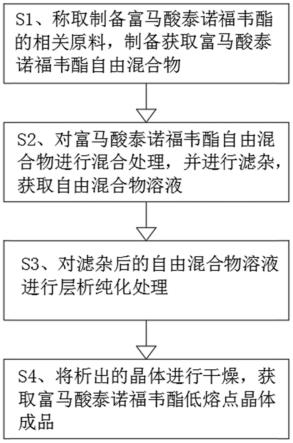
7.s1、称取制备富马酸泰诺福韦酯的相关原料,制备获取富马酸泰诺福韦酯自由混合物;
8.s2、对富马酸泰诺福韦酯自由混合物进行混合处理,并进行滤杂,获取自由混合物溶液;
9.s3、对滤杂后的自由混合物溶液进行层析纯化处理;
10.s4、将析出的晶体进行干燥,获取富马酸泰诺福韦酯低熔点晶体成品。
11.上述步骤s1中,以腺嘌呤为富马酸泰诺福韦酯制备的起始基底原料,并将氯甲基异丙基碳酸酯作为中间体,在反应釜中与缚酸剂作缩合反应,调控反应的环境状态,进行富马酸泰诺福韦酯自由混合物的制备。
12.上述反应的环境状态为90~120℃,并保证反应处于真空状态,压强保持在0.09mpa~0.11mpa之间,反应时间为3~4小时,此外,腺嘌呤与中间体的摩尔比为2~3:1。
13.上述步骤s2还包括有,将步骤s1制备的富马酸泰诺福韦酯自由混合物置于二甲基甲酰胺中,用转速约100~150转/min的离心混合设备搅合3~5分钟,进行混合,再对自由混合物溶液进行滤杂,并调控处理温度范围在40~60℃内。
14.上述步骤s3还包括有,层析纯化处理时,利用酯类溶液进行混合析晶,将其萃取分离为有机层与水层,多次加入酯类有机溶液,分批次降温析晶,降温范围为0~40℃。
15.上述酯类有机溶液为乙酸乙酯、二氯甲烷、乙酸异丙酯或乙酸丁酯中的任意一种,且酯类有机溶液与自由混合物溶液的体积比为4~7:1。
16.上述步骤s4还包括有,采用医药中间体干燥机进行干燥,并保证干燥温度处于60~70℃之间,具体干燥时间根据富马酸泰诺福韦酯的晶体的体积进行调控。
17.采用上述方案后,本发明相比现有技术的有益效果是:
18.(1)本发明提供一种富马酸泰诺福韦酯的生产方法,利用缚酸剂与富马酸泰诺福韦酯中杂质的取代反应相聚集,配合膦酸酯中间体与酸性物质的水解,得到泰诺福韦的杂质,解决富马酸泰诺福韦酯自身溶解度所限,制备纯度较低,内含杂质较高,产品效用易遭受影响,以及制取工艺较为繁琐等问题,降低生产成本,保证工艺的稳定;
19.(2)本发明提供一种富马酸泰诺福韦酯的生产方法,通过温和的反应条件与常规设备进行的操作,控制工艺的成本,确保富马酸泰诺福韦酯的生产符合工业化生产的特性,进而提高富马酸泰诺福韦酯的大规模生产产量;
20.(3)本发明提供一种富马酸泰诺福韦酯的生产方法,通过调控降温析晶的温度速率,避免析晶过程难以调控,而致使富马酸泰诺福韦酯成品纯度及成品率较低的问题,从而提高成品的收率与纯度。
附图说明
21.图1是本发明的流程图。
具体实施方式
22.下面结合实施例对本发明做进一步详细说明:
23.如图1所示,本发明提供了一种富马酸泰诺福韦酯的生产方法,由以下步骤组成:
24.s1、称取制备富马酸泰诺福韦酯的相关原料,制备获取富马酸泰诺福韦酯自由混合物,以腺嘌呤为富马酸泰诺福韦酯制备的起始基底原料,并将氯甲基异丙基碳酸酯作为中间体,在反应釜中与缚酸剂作缩合反应,调控反应的环境状态,进行富马酸泰诺福韦酯自由混合物的制备;
25.s2、对富马酸泰诺福韦酯自由混合物进行混合处理,并进行滤杂,获取自由混合物溶液,将富马酸泰诺福韦酯自由混合物置于二甲基甲酰胺中,用转速约100~150转/min的离心混合设备搅合3~5分钟,进行混合,再对自由混合物溶液进行滤杂,并调控处理温度范围在40~60℃内;
26.s3、对滤杂后的自由混合物溶液进行层析纯化处理,层析纯化处理时,利用酯类溶液进行混合析晶,将其萃取分离为有机层与水层,多次加入酯类有机溶液,分批次降温析晶,降温范围为0~40℃;
27.s4、将析出的晶体进行干燥,获取富马酸泰诺福韦酯低熔点晶体成品,采用医药中间体干燥机进行干燥,并保证干燥温度处于60~70℃之间,具体干燥时间根据富马酸泰诺福韦酯的晶体的体积进行调控,调控降温析晶的温度速率,提升对工艺的掌控度,提高成品的收率与纯度。
28.进一步的,步骤s1的反应环境状态为90~120℃,并保证反应处于真空状态,压强保持在0.09mpa~0.11mpa之间,反应时间为3~4小时,此外,腺嘌呤与中间体的摩尔比为2
~3:1,酸性环境下,利用缚酸剂使得富马酸泰诺福韦酯中的杂质产生取代反应聚集,使得膦酸酯中间体与酸性物质进行水解,得到泰诺福韦的杂质,简化生产工艺,确保成品的纯度。
29.此外,酯类有机溶液为乙酸乙酯、二氯甲烷、乙酸异丙酯或乙酸丁酯中的任意一种,且酯类有机溶液与自由混合物溶液的体积比为4~7:1,增加工艺的方向,确保富马酸泰诺福韦酯的生产符合工业化生产的特性,进而调控工艺的成本。
30.实施例1
31.步骤1,称取摩尔比为2:1的腺嘌呤与氯甲基异丙基碳酸酯,在酸性环境下,富马酸泰诺福韦酯中的杂质产生取代反应聚集,使得膦酸酯中间体与酸性物质进行水解,制备获取富马酸泰诺福韦酯自由混合物,反应釜保持真空状态,温度为100℃,压强保持在0.11mpa,反应时间为3.5小时;
32.步骤2,将步骤1获取的富马酸泰诺福韦酯自由混合物置于二甲基甲酰胺中,以转速120转/min离心混合5分钟,再进行滤杂,离心混合温度为50℃,得到自由混合物溶液;
33.步骤3,向自由混合物溶液中加入乙酸乙酯溶液,萃取分离得到有机层和水层,然后在温度0℃下降温析晶,重复多次,加入的乙酸乙酯溶液与自由混合物溶液的体积比为6:1;
34.步骤4,利用医药中间体干燥机将步骤3析出的晶体在温度60~70℃下进行干燥,得到富马酸泰诺福韦酯晶体,安全储存。
35.实施例2
36.步骤1,称取摩尔比为5:2的腺嘌呤与氯甲基异丙基碳酸酯,在酸性环境下,富马酸泰诺福韦酯中的杂质产生取代反应聚集,使得膦酸酯中间体与酸性物质进行水解,制备获取富马酸泰诺福韦酯自由混合物,反应釜保持真空状态,温度为100℃,压强保持在0.10mpa,反应时间为3小时;
37.步骤2,将步骤1获取的富马酸泰诺福韦酯自由混合物置于二甲基甲酰胺中,以转速140转/min离心混合5分钟,再进行滤杂,离心混合温度为60℃,得到自由混合物溶液;
38.步骤3,向自由混合物溶液中加入二氯甲烷溶液,萃取分离得到有机层和水层,然后在温度20℃下降温析晶,重复多次,加入的二氯甲烷溶液与自由混合物溶液的体积比为7:1;
39.步骤4,利用医药中间体干燥机将步骤3析出的晶体在温度60~70℃下进行干燥,得到富马酸泰诺福韦酯晶体,安全储存。
40.实施例3
41.步骤1,称取摩尔比为3:1的腺嘌呤与氯甲基异丙基碳酸酯,在酸性环境下,富马酸泰诺福韦酯中的杂质产生取代反应聚集,使得膦酸酯中间体与酸性物质进行水解,制备获取富马酸泰诺福韦酯自由混合物,反应釜保持真空状态,温度为90℃,压强保持在0.09mpa,反应时间为4小时;
42.步骤2,将步骤1获取的富马酸泰诺福韦酯自由混合物置于二甲基甲酰胺中,以转速150转/min离心混合4分钟,再进行滤杂,离心混合温度为60℃,得到自由混合物溶液;
43.步骤3,向自由混合物溶液中加入乙酸异丙酯溶液,萃取分离得到有机层和水层,然后在温度10℃下降温析晶,重复多次,加入的乙酸异丙酯溶液与自由混合物溶液的体积
比为5:1;
44.步骤4,利用医药中间体干燥机将步骤3析出的晶体在温度60~70℃下进行干燥,得到富马酸泰诺福韦酯晶体,安全储存。
45.实施例4
46.步骤1,称取摩尔比为8:3的腺嘌呤与氯甲基异丙基碳酸酯,在酸性环境下,富马酸泰诺福韦酯中的杂质产生取代反应聚集,使得膦酸酯中间体与酸性物质进行水解,制备获取富马酸泰诺福韦酯自由混合物,反应釜保持真空状态,温度为120℃,压强保持在0.11mpa,反应时间为4小时;
47.步骤2,将步骤1获取的富马酸泰诺福韦酯自由混合物置于二甲基甲酰胺中,以转速130转/min离心混合4分钟,再进行滤杂,离心混合温度为40℃,得到自由混合物溶液;
48.步骤3,向自由混合物溶液中加入乙酸丁酯溶液萃取分离得到有机层和水层,然后在温度10℃下降温析晶,重复多次,加入的乙酸丁酯溶液与自由混合物溶液的体积比为4:1;
49.步骤4,利用医药中间体干燥机将步骤3析出的晶体在温度60~70℃下进行干燥,得到富马酸泰诺福韦酯晶体,安全储存。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1