一种QS抑制活性化合物、组合物及在制备抗菌制剂领域的应用
一种qs抑制活性化合物、组合物及在制备抗菌制剂领域的应用
技术领域
1.本发明属于qs抑制活性化合物技术领域,具体涉及一种qs抑制活性化合物,包含所述化合物的药物组合物及其在制备抗菌制剂领域的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.随着抗菌药物广泛使用和滥用,细菌感染已经成为了严重威胁人类生命健康的重大问题之一。2017年世界卫生组织(world health organization,who)指出,鲍曼不动杆菌、铜绿假单胞菌、大肠杆菌和肺炎克雷伯菌等革兰氏阴性菌对碳青霉烯类和第三代头孢菌素等广谱抗生素具有显著的耐药性。其中美国2011-2014年的数据显示铜绿假单胞菌对碳青霉烯类药物的耐药率为25%,临床上因耐药性铜绿假单胞菌感染导致的死亡仍居高不下。
4.铜绿假单胞菌(pseudomonas aeruginosa)是医院感染的主要致病菌,对严重烧伤和免疫功能受损的患者(如艾滋病)极具危险性。其常见的感染部位主要包括胃肠道感染、肺部感染、尿路感染、外耳炎、皮肤、软组织感染、菌血症、脓毒症和骨关节感染等。此外铜绿假单胞菌也是囊性纤维病的罪魁祸首,患者粘液逐步阻塞呼吸道,引起肺部感染,患者最终因呼吸衰竭而死亡。但目前针对铜绿假单胞菌耐药仍无有效治疗药物,因此急需研发新药应对铜绿假单胞菌耐药。
5.铜绿假单胞菌产生耐药的一个重要机制是细菌群体感应(quorum sensing,qs)调控的生物膜以及毒力因子。群体感应是一种微生物之间普遍存在的依赖于菌体密度的沟通协调机制,控制着细菌的生长、增殖、致病性、生物被膜形成及相关群体活动行为。qs抑制剂不直接杀菌可避免细菌产生耐药。同时抑制细菌的qs可降低其毒性和耐药性。
技术实现要素:
6.为了解决现有技术的不足,本发明的提供了苯并噁唑酮类和噁唑酮并吡啶类以及苯取代的咪唑烷二酮类衍生物及其制备方法和应用,该衍生物与已报道的qs抑制剂母核结构完全不同,具有不同的理化性质,经实验表明,该类衍生物具有抑制铜绿假单胞菌qs的作用,可以作为新型qs抑制剂,还可以作为抗菌增敏剂。
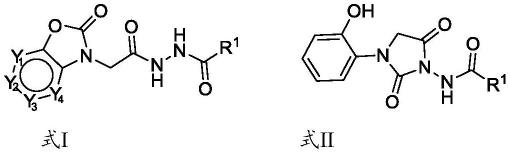
7.本发明第一方面,提供一种qs抑制活性化合物,所述化合物满足如下式i或式ii所示的通式:
[0008][0009]
其中,所述y1、y2、y3和y4独立的选自n、ch和c(r2);
[0010]
所述r1选自烷基、环烷基、取代或未取代的芳基、芳杂基或当r1为n为2-6,x为o或s,z选自环烷基、环杂烷基、取代或未取代的芳基及芳杂基。
[0011]
上述第一方面中,所述r1、z可独立的为取代或未取代的芳基及芳杂基;优选的,所述芳基选自苯基、萘基、蒽基、菲基、茚基、芴基或苊基;所述芳杂基选自呋喃基、吡咯基、噻吩基、咪唑基、噁唑基、异噁唑基、噻唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、吗啉基、吡唑基、吲哚基、苯并呋喃基、苯并噁唑基、苯并噻唑基、苯并咪唑基、喹啉基、四氢喹啉基、异喹啉基、咔唑基、嘌呤基、吩噻嗪基或吩噁嗪基;
[0012]
优选的,所述取代芳基和芳杂基被以下的取代基单或多取代:烷基、杂烷基、卤素、氰基、硝基、氨基、羟基、取代烷基、取代烷氧基或取代氨基;
[0013]
其中,所述烷基优选c原子个数为1~9的直链或支链烷基或杂烷基、c原子数为3-8的环烷基;所述杂烷基是指至少含有一个杂原子的烷基;所述取代烷基为卤素取代烷基,氢原子的取代个数为一个或多个,例如氟甲基、氟乙基、二氟甲基、三氟甲基等;所述取代烷氧基为卤素取代的烷氧基,氢原子的取代个数为一个或多个,例如一氟甲氧基、一氟乙氧基、二氟甲氧基、三氟甲氧基等;所述取代氨基为伯胺基中的一个或两个氢被烷基或酰基取代,例如甲氨基、二甲氨基、乙酰氨基等。
[0014]
优选的,式i中y1、y2、y3和y4中至多含有三个n,选自以下结构:
[0015][0016]
进一步的,上述取代基中,r2为氢、烷基、杂烷基、卤素、氰基、硝基、氨基、羟基、取代烷基、取代烷氧基、取代氨基中的单或多取代;所述烷基、取代烷基、取代烷氧基和取代氨基如前所述。
[0017]
本发明验证的一种实施方式中,y1为n,y2、y3、y4及r2为氢,该系列的实施方式中,式i所示化合物具体选自以下结构:
[0018][0019]
[0020]
另外的一些实施方式中,式ii所示化合物具体选自以下结构:
[0021][0022]
另外还应当说明的是,上述第一方面所述qs抑制活性化合物,还包括式i或式ii所示化合物的消旋体、旋光异构体、其药学可接受的盐、溶剂合物或水合物;其中,所述药学上可接受的盐包括有机酸或无机酸形成的盐,所述有机酸如甲磺酸、甲苯磺酸或三氟乙酸,所述无机酸如盐酸、硫酸、硝酸或氢溴酸。
[0023]
本发明第二方面,提供第一方面所述qs抑制活性化合物的制备方法,其中,式i所示化合物的合成路线如下:
[0024][0025]
式ii所示化合物的合成路线如下:
[0026][0027]
优选的,式i所示化合物为所述r3为邻位或对位取代的-f、-cf3、-och3、-cl、-ch3、-no2,其制备方法如下:
[0028][0029]
所述制备方法包括如下步骤:
[0030]
(1)将邻氨基苯酚和尿素溶解于n,n-二甲基甲酰胺中,140~160℃发生环合反应,搅拌反应7~9h后,经硅胶柱层析纯化得化合物1;
[0031]
(2)化合物1溶解于重蒸四氢呋喃中,加入氢化钠拔氢,室温搅拌0.5~1.5h;再加入溴乙酸乙酯发生亲核取代反应,继续搅拌1~3h,反应完毕后,旋干溶剂,低温条件下加二氯甲烷/水萃取及纯化得化合物2;
[0032]
(3)化合物2与水合肼溶解于乙醇溶液中发生肼解反应,回流1~3h,经柱层析纯化得化合物3;
[0033]
(4)将6-溴己酸乙酯加入乙腈溶解,再加入碳酸铯;与不同取代的苯酚发生亲核取代反应,搅拌7~9h后萃取,去除溶剂得到化合物4;
[0034]
(5)将化合物4溶解于乙醇中,加入氢氧化钠溶液发生水解反应,回流1~3h;反应完全后,去除溶剂并加水稀释残渣,调节溶液ph至4.5~5.5,产生白色沉淀,获取沉淀部分即为化合物5;
[0035]
(6)化合物5和二氯亚砜反应生成不同取代的酰氯,所得酰氯与化合物3发生酰胺缩合,采用三乙胺为缚酸剂,柱层析纯化得到相应i式化合物。
[0036]
优选的,式ii所示化合物为其中,r3为邻位或对位取代的-f、-cf3、-och3、-cl、-ch3、-no2,所述制备方法如下:
[0037]
将上述化合物2,与水合肼溶解于丙醇溶液中回流,40~50h进行肼解反应,柱层析纯化得化合物8;化合物5和二氯亚砜反应生成不同取代的酰氯,所得酰氯与化合物8进行酰胺缩合,以三乙胺作为缚酸剂,柱层析纯化得到相应ii式化合物。
[0038]
本发明第三方面,提供一种药物组合物,所述组合物中,包括有效剂量的第一方面所述qs抑制活性化合物。
[0039]
本发明优选的方案中,所述药物组合物用于制备一种抗菌制剂,所述有效剂量为实现抗菌活性所需要的药物剂量,可通过本领域常规方式确定;又一种优选的实施方式中,所述药物组合物中还包括其他具有抗菌活性的成分,优选为抗生素,如环丙沙星、左氧氟沙星、克拉霉素、诺氟沙星、阿奇霉素等。
[0040]
优选的,所述药物组合物中,还包括药学上所必须的载体;所述载体应当是无毒且安全的,可由本领域技术人员根据实际情况能够确定的;合适的载体的实例包括葡萄糖、水、乳糖、蔗糖、甘油、乙醇、丙二醇、甘露醇、玉米淀粉、明胶、海藻酸、微晶纤维素、高岭土、磷酸二钙、氯化钠、交联羧甲基纤维素钠和淀粉羟乙酸钠等;还包括亲水载体、疏水载体或其组合,其中,疏水载体例如脂肪乳剂、脂质、聚乙二醇化磷脂、生物相容的聚合物、脂质球、脂质体、小囊泡、聚合物基质和颗粒等。
[0041]
上述载体与药物组合物构成的制剂,可以以单位剂量形式给药,给药剂型包括注射剂、片剂、丸剂、胶囊、悬浮剂、乳剂、气雾剂、粉剂、冻干粉针剂、包合物、填埋剂、贴剂和擦剂等,上述剂型的选择可根据治疗需求等因素进行常规选择。
[0042]
本发明第四方面,提供第一方面所述qs抑制活性化合物、第三方面所述药物组合物在制备抗菌制剂领域的应用。
[0043]
本发明研究以铜绿假单胞菌为例,对上述qs抑制活性化合物的抗菌作用进行了验证。本领域公知,铜绿假单胞菌的毒力因子包括绿脓菌素、lasa蛋白酶、鼠李糖脂等,其行为的表达均受到群体感应系统调控。上述qs抑制活性化合物能够有效抑制绿脓菌素、鼠李糖脂等毒力因子的表达,抑制致病菌生物膜形成,有望作为一种qs抑制剂应用于致病菌或耐药菌。另外,本发明研究还证实了,上述qs抑制活性化合物与抗生素联合具有协同抗菌效果,可作为一种增敏剂与抗菌药物进行联合治疗。
[0044]
优选的,所述在制备抗菌制剂领域的应用具体包括以下方式:
[0045]
(1)第一方面所述qs抑制活性化合物应用于制备抗菌增敏剂;
[0046]
(2)第一方面所述qs抑制活性化合物、第三方面所述药物组合物应用于制备抗菌药物;
[0047]
(3)第一方面所述qs抑制活性化合物应用于制备qs抑制研究模型。
[0048]
上述抗菌制剂优选应用于革兰氏阴性致病菌,包括应用于所述致病菌的体外群集效应抑制、或用于治疗所述致病菌引发的相关疾病;所述致病菌包括但不限于铜绿假单胞菌、不动杆菌属、大肠杆菌、肺炎杆菌、霍乱弧菌、流感(嗜血)杆菌、副流感(嗜血)杆菌、嗜肺军团菌、百日咳杆菌、变形杆菌、痢疾杆菌、布氏杆菌、卡他(摩拉)菌、耶尔森菌属、副百日咳
杆菌、志贺菌属、巴斯德菌属或副溶血性杆菌。
[0049]
本发明第四方面,提供一种抗菌增敏剂,所述抗菌增敏剂中包括活性剂量的第一方面所述qs抑制活性化合物。
[0050]
优选的,所述抗菌增敏剂与抗生素联合应用。
[0051]
本发明第五方面,提供一种抗菌药物,所述抗菌药物中,包括第一方面所述qs抑制活性化合物、或第三方面所述药物组合物。
[0052]
所述抗菌药物优选适用于革兰氏阴性致病菌所导致的疾病,所述疾病包括但不限于肺炎、囊性纤维病、心内膜炎、腹膜炎、脓胸、败血症、胆囊炎、膀胱炎、腹泻或胃肠炎。
[0053]
与现有技术相比,本发明有益效果主要体现在:
[0054]
(1)本发明的苯并噁唑酮类和噁唑酮并吡啶类以及苯取代的咪唑烷二酮类对多种敏感菌及耐药菌的生长没有影响,不容易诱导产生耐药。
[0055]
(2)本发明的苯并噁唑酮类和噁唑酮并吡啶类以及苯取代的咪唑烷二酮类对铜绿假单胞菌qs系统具有显著的干扰作用,并且随浓度增加而作用增加。
[0056]
(3)本发明的苯并噁唑酮类和噁唑酮并吡啶类以及苯取代的咪唑烷二酮类具有良好的抗菌协同效果。
附图说明
[0057]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0058]
图1实施例3中化合物i1-i10对铜绿假单胞菌pao1绿脓菌素抑制活性的考察结果;
[0059]
图2实施例3中化合物i11-i30对铜绿假单胞菌pao1绿脓菌素抑制活性的考察结果;
[0060]
图3实施例3中化合物ii1-ii10对铜绿假单胞菌pao1绿脓菌素抑制活性的考察结果;
[0061]
图4实施例3中化合物i1-i10对铜绿假单胞菌pao1鼠李糖脂抑制活性的考察结果;
[0062]
图5实施例3中化合物i11-i30对铜绿假单胞菌pao1鼠李糖脂抑制活性的考察结果;
[0063]
图6实施例3中化合物ii1-ii10对铜绿假单胞菌pao1鼠李糖脂抑制活性的考察结果;
[0064]
图7实施例3中化合物i-10和i30对铜绿假单胞菌pao1鼠李糖脂抑制活性(ic
50
)的结果;
[0065]
其中,图7a为化合物i-10对鼠李糖脂的抑制活性;
[0066]
图7b为化合物i-30对鼠李糖脂的抑制活性;
[0067]
图8实施例3中化合物对铜绿假单胞菌pao1生物膜形成抑制的考察结果;
[0068]
图9实施例3中化合物与抗菌剂的协同抗菌效果;
[0069]
其中,图9a为化合物与环丙沙星的协同抗菌效果;
[0070]
图9b为化合物与克拉霉素的协同抗菌效果。
具体实施方式
[0071]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0072]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0073]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0074]
实施例1
[0075]
1、苯并噁唑-2(3h)-酮中间体1的合成
[0076][0077]
称取邻氨基苯酚(4.36g,40mmol)、尿素(3.60g,60mmol),溶解于20ml n,n-二甲基甲酰胺中,加热至150℃,反应8h。tlc监测反应完全后,加10倍水稀释,用适量乙酸乙酯反复萃取,合并有机相,减压浓缩。再用饱和食盐水洗涤三次,无水硫酸钠干燥,过滤,减压蒸干得粗品,经硅胶柱层析(洗脱剂为石油醚-乙酸乙酯,10:1-8:1-5:1-2:1)纯化得化合物1,黄色固体4.16g(收率为76.97%)。
[0078]
2、2-(2-苯并噁唑酮-3-基)乙酸乙酯中间体2的合成
[0079][0080]
取化合物1(4.05g,30mmol),65%氢化钠(3.32g,90mmol)溶解于重蒸四氢呋喃(75ml)中,室温搅拌1h。再加入溴乙酸乙酯(7.52g,45mmol),继续搅拌2h。tlc检测反应完毕后,旋干溶剂。加适量的二氯甲烷溶解,转移到-2℃下再缓慢加水淬灭,然后用二氯甲烷萃取。合并有机相,饱和氯化钠洗涤三次,无水硫酸钠干燥,过滤。滤液旋干得粗品,经硅胶柱层析(洗脱剂为石油醚-乙酸乙酯,10:1-5:1)纯化得化合物2,黄色固体5.79g,收率为87.25%。
[0081]
3、2-(苯并噁唑酮-3-基)乙酰肼中间体3的合成
[0082][0083]
取化合物2(4.42g,20mmol)溶解于乙醇溶液中,加入80%水合肼(1.25g,20mmol),
回流2h。tlc检测反应有新点产生,原料还有剩余,补加1当量的水合肼(1.25g,20mmol),继续反应2h。tlc检测反应完毕后,冷却至室温,析出白色沉淀。旋干,经硅胶柱层析(洗脱剂为二氯甲烷-甲醇,30:1-25:1-10:1)纯化得化合物3,白色固体。
[0084]
4、6-(3-(三氟甲基)苯氧基)己酸乙酯中间体4的合成
[0085][0086]
将3-三氟甲基苯酚(648.4mg,4mmol)、6-溴己酸乙酯(1388.6mg,6mmol)依次加入至100ml茄形烧瓶中,用20ml乙腈溶解。再加入碳酸铯(8mmol),n2保护。加热至50℃,搅拌8h。tlc监测反应结束后,旋干。残渣用水稀释,再用乙酸乙酯萃取。合并有机层,饱和氯化钠洗涤三次,无水硫酸钠干燥,过滤。滤液减压蒸干,得到化合物4,黄绿色油状物,不需进一步提纯即可用于下一步。
[0087]
5、6-(3-(三氟甲基)苯氧基)己酸中间体5的合成
[0088][0089]
取化合物4(912.9mg,3mmol)溶解于15ml乙醇中。在室温下向氢氧化钠(12mmol)中加水3ml,再加入至反应瓶中。回流2h。tlc监测反应完全后,减压蒸干。残渣用水稀释,用1m盐酸将溶液ph调节至5,产生白色沉淀。抽滤,用少量水洗涤,干燥,得到化合物5,白色固体770.8mg,收率为93.00%。
[0090]
6、式i所示化合物的合成
[0091][0092]
将取化合物5(1.2mmol),溶于8ml二氯亚砜中,于78℃下加热回流2h,tlc检测反应完全。反应液减压旋干,再加入10ml二氯甲烷,减压旋干,反复三次,得无色油状物,不经纯化直接投下一步。
[0093]
在-2℃下,将化合物3(207.2mg,1mmol)和干燥的三乙胺(303.6mg,3mmol)溶解于10ml干燥的n,n-二甲基甲酰胺中。在此温度下,将已制备好的酰氯(303.1mg,1.2mmol)逐滴加入到反应瓶中。然后转移至室温,搅拌6-12h。tlc检测反应完毕后,加10倍水稀释,乙酸乙酯萃取多次。合并有机相,再用饱和食盐水洗涤,无水硫酸钠干燥,过滤,滤液旋干得粗品。经硅胶柱层析(洗脱剂为二氯甲烷-甲醇,80:1-60:1-50:1-40:1)纯化,得i-10,白色固体261.4mg,收率为56.16%。化合物相关结构确证信息如表1中所示。
[0094]
化合物i-1~i-9、i-11~i-30的制备过程如上述制备i-10的过程,仅需要对原料进行相应替换即可。
[0095]
表1化合物i-1~i-30的结构确证信息表
[0096]
[0097]
[0098]
[0099]
[0100]
[0101]
[0102][0103][0104]
实施例2
[0105]
1、3-氨基-1-(2-羟基苯基)咪唑烷-2,4-二酮中间体8的合成
[0106][0107]
取化合物2(4.42g,20mmol)溶解于乙醇溶液中,加入80%水合肼(1.25g,20mmol),回流2h。tlc检测反应有新点产生,原料还有剩余,补加1当量的水合肼(1.25g,20mmol),继续反应2h。tlc检测反应完毕后,冷却至室温,析出白色沉淀。旋干,经硅胶柱层析(洗脱剂为二氯甲烷-甲醇,30:1-25:1-10:1)纯化得化合物8,白色固体。
[0108]
2、式ii所示化合物的合成
[0109][0110]
将取化合物5(1.2mmol),溶于8ml二氯亚砜中,于78℃下加热回流2h,tlc检测反应完全。反应液减压旋干,再加入10ml二氯甲烷,减压旋干,反复三次,得无色油状物,不经纯化直接投下一步。
[0111]
在-2℃下,将化合物3(207.2mg,1mmol)和干燥的三乙胺(303.6mg,3mmol)溶解于10ml干燥的n,n-二甲基甲酰胺中。在此温度下,将已制备好的酰氯(303.1mg,1.2mmol)逐滴加入到反应瓶中。然后转移至室温,搅拌6-12h。tlc检测反应完毕后,加10倍水稀释,乙酸乙酯萃取多次。合并有机相,再用饱和食盐水洗涤,无水硫酸钠干燥,过滤,滤液旋干得粗品。经硅胶柱层析(洗脱剂为二氯甲烷-甲醇,80:1-60:1-50:1-40:1)纯化,得ii-10,白色固体144.1mg,收率为30.96%。化合物相关结构确证信息如表2中所示。
[0112]
化合物ii-1~ii-9的制备过程如上述制备ii-10的过程,仅需要对原料进行相应替换即可。
[0113]
表2化合物ii-1~ii-10的结构确证信息表
[0114]
[0115]
[0116][0117]
实施例3抗菌效果验证
[0118]
1、实施例1和2中衍生物对铜绿假单胞菌pao1绿脓菌素表达产生的影响
[0119]
本实施例通过测定目标化合物(即本发明的化合物i-1~i-30、ii-1~ii-10)对铜绿假单胞菌(p.aeruginosa)pao1绿脓菌素表达产生的影响,表征本发明化合物的qs抑制作用强度,所用菌株菌种来源于中国普通微生物菌种保藏管理中心(cgmcc)。
[0120]
实验方法:将铜绿假单胞菌pao1接种至lb培养基中,在37℃恒温培养箱中培养20h,之后将传代的铜绿假单胞菌以新鲜lb培养基稀释成od
600
=0.05的菌液,继续培养8h至对数生长期。再次稀释至od
600
=0.05。将稀释后的菌液以5ml分装至10ml ep管中。加入50μl目标化合物溶液(终浓度为256μg/ml),并设置阴性对照dmso、空白对照blank。每个样品平行做4次。置于37℃,200rpm震荡培养箱中培养18h。之后以9000rpm离心5min,接着倒出上清液,用3ml氯仿萃取,静置分层。弃去上层,再以1ml盐酸(0.2m)反萃取得浅红色溶液,再次以5000rpm离心10min,取上层浅红色溶液100μl于96孔板中,测定其od
492
。与阴性对照相比较,绿脓菌素抑制率为1-(abs
sample-abs
blank
)/(abs
negative-abs
blank
)
×
100%。
[0121]
由图1可知,在苯并噁唑酮类化合物(i1-i10)中,i9和i10是中等的绿脓菌素抑制剂,加入这两个化合物的试管中绿脓菌素表达量为阴性对照的64.83
±
4.14%和63.45
±
3.90%。加入化合物i4和i7的试管,绿脓菌素表达量为阴性对照的75.86
±
4.97%和81.38
±
3.08%。
[0122]
由图2、图3可知,在噁唑酮并吡啶类衍生物(i11-i30)中,化合物i19、i30对铜绿假单胞菌pao1绿脓菌素抑制活性较强(分别为54.48
±
4.08%和53.10
±
4.52%)。在苯取代的咪唑烷二酮类衍生物(ii1-ii10)中,显然化合物ii2、ii9和ii10是较为强效的绿脓菌素抑制剂(绿脓菌素表达量分别阴性对照的55.86
±
4.08%、54.48
±
4.08%和38.62
±
1.95%)。
而化合物ii3、ii5、ii6和ii7分别可抑制铜绿假单胞菌的绿脓菌素表达至正常量的66.90
±
4.08%、65.52
±
2.29%、66.21
±
1.95%和61.38
±
4.08%,这些化合物是绿脓菌素表达的中效抑制剂。
[0123]
2、实施例1和2中衍生物对铜绿假单胞菌pao1鼠李糖脂表达产生的影响
[0124]
实验方法:将铜绿假单胞菌pao1复苏,再接种至lb培养基中,在37℃,200rpm培养18-24h。测定od
600
=1.0左右,之后将菌以新鲜无糖培养基按1:100稀释,取3ml分装至5ml ep管中。再加入30μl含目标化合物的dmso母液至其终浓度为256μg/ml。同时设置阴性对照dmso,阳性对照c10-cpa(59.85μg/ml)。每个样品平行6次。置于37℃,200rpm恒温箱中培养24h。再以10000rpm离心5min。取250μl上清液于新ep管中,加500μl乙酸乙酯萃取两次,萃取液转移至新管中,放置于通风橱中过夜蒸发。然后加50μl去离子水溶解,再加入450μl现配的苔黑酚-浓硫酸试剂,涡旋,80℃水浴加热30min,得黄橙色溶液,冷却至室温后测样品溶液的od
421
。鼠李糖脂抑制率为1-(abs
sample-abs
blank
)/(abs
negative-abs
blank
)
×
100%。
[0125]
由图4可知,在苯并噁唑酮类化合物(i1-i10)中,所有化合物的活性均优于阳性对照c10-cpa,其中ii3、ii7、ii9和ii10具有强效的鼠李糖脂抑制活性。在这些化合物的作用下,鼠李糖脂的表达量分别被抑制为阴性对照的53.35
±
4.88%、47.12
±
5.37%、51.33
±
5.07%和33.79
±
2.53%。
[0126]
由图5、图6可知,在噁唑酮并吡啶类衍生物(i11-i30)中,此类化合物大都展现出强效的鼠李糖脂抑制活性,其中化合物i30的抑制活性最强,其鼠李糖脂表达量是阴性对照的6.34
±
3.59%。化合物i14、i16、i25、i27、i28和b29也是强效的鼠李糖脂抑制剂,其鼠李糖脂表达量分别是阴性对照的19.60
±
3.10%、14.31
±
4.01%、17.38
±
2.38%、13.91
±
4.23%、20.25
±
3.86%和19.84
±
9.10%,证实了这一系列化合物作为qs抑制剂的潜力。在苯取代的咪唑烷二酮类衍生物(ii1-ii10)中,化合物ii2、ii4、ii6和ii9是强效的鼠李糖脂抑制剂(鼠李糖脂表达量分别为41.99
±
2.76%、39.88
±
2.95%、37.46
±
3.62%和38.07
±
4.98%)。
[0127]
挑选i10和i30,测定其鼠李糖脂抑制活性的ic
50
。结果如图7所示,i10具有强效的鼠李糖脂抑制活性,ic
50
=66.35μg/ml,r2=0.9199。同时化合物i30的抑制活性最强,ic
50
=56.75μg/ml,r2=0.9060。浓度依赖性实验表明这两个化合物对铜绿假单胞菌pao1鼠李糖脂表达的抑制作用具有靶向特异性。
[0128]
3、实施例1和2中衍生物对铜绿假单胞菌pao1生物膜形成的影响
[0129]
实验方法:首先将铜绿假单胞菌pao1复苏,传代至lb培养基,置于37℃恒温培养箱培养20h。之后将菌液用lb培养基稀释至吸光度od
600
为0.05,在37℃恒温培养箱培养至对数生长期后,再用培养基稀释至吸光度od
600
为0.05,菌液待用;向96孔板中第一孔加入190μl菌液,随后每孔加入100μl菌液。第一孔加入10μl药液(i16、i10、i19、i30、ii6和ii10浓度为1280μg/ml,阿奇霉素(azm)浓度为为1280μg/ml),二倍稀释至所需浓度。最后两孔分别设置空白对照100μl新鲜肉汤和阴性对照100μl含dmso的菌液。每个样品有6个复孔。置于37℃恒温培养箱中培养16小时;培养结束后取出96孔板,吸掉培养液,以pbs缓冲液(ph=7.2-7.4)洗三次。残留的生物膜以无水甲醇150μl固定15min。然后弃去甲醇,将96孔板置于40℃烘箱中烘干30min;烘干后每孔加入0.1%的结晶紫染液150μl将生物膜染色15min。之后用去离子水洗净残余结晶紫染液,将96孔板置于30℃烘箱中烘干30min;烘干后每孔加入33%冰醋
酸溶液150μl消化生物膜,置于酶标仪中震荡5min,读取595nm处的吸光度值,生物膜抑制率为1-(abs
sample-abs
blank
)/(abs
negative-abs
blank
)
×
100%,graphpad prism 8作图。
[0130]
如图8所示,阳性对照azm在64μg/ml浓度下对铜绿假单胞菌pao1具有抑制效果,可显著降低细菌生物膜的形成。化合物i10、i30在测试浓度下对铜绿假单胞菌pao1的生长没有影响,但对细菌生物膜的形成依然具有中等的抑制作用,分别是阴性对照的55.77
±
1.06%和60.00
±
3.07%。化合物i16、i19、ii6和ii10与i10、i30相似,具有中等的生物膜抑制作用。
[0131]
4、化合物与抗菌剂的协同抗菌效果
[0132]
实验方法:将铜绿假单胞菌pao1接种至lb培养基中,在37℃恒温箱中培养20h,之后将铜绿假单胞菌以新鲜lb培养基质稀释成od
600
=0.05的菌液,继续培养至对数生长期。再次稀释至od
600
=0.05,然后将稀释后的菌液以2ml分装至5ml ep管中。再加入20μl含目标化合物(i10、i16、i19、i30、ii6、ii9和ii10)的dmso母液,至其终浓度为32μg/ml。同时设置blank组和阴性对照control,阳性对照环丙沙星(cip)浓度为0.2μg/ml、克拉霉素(cla)浓度为3.2μg/ml以及样品分别与上述抗菌药的联合用药组,重复3次。置于37℃恒温箱中培养20h后,取样测定其od
600
。细菌死亡率为1-(abs
sample-abs
blank
)/(abs
negative-abs
blank
)
×
100%。
[0133]
由图9可知,当化合物浓度为32μg/ml时,化合物i10、i16、i19、i30、ii6、ii9和ii10可明显提高cip(0.2μg/ml)和cla(3.2μg/ml)对铜绿假单胞菌pao1的抑制效果,其中i10与cip、cla联用,增效分别为155.0%和80.3%;i30与cip和cla联用,增效分别为184.1%和71.0%。由联合抗菌实验可以看出,化合物i30与抗菌剂的协同效果最佳,在32μg/ml浓度下明显提高常见抗生素如环丙沙星和克拉霉素的抗菌效果。因此该实验表明i30作为新一代qs抑制剂,有望开发为增强现有抗生素效力,降低细菌耐药性的新型抗菌增敏剂。
[0134]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1