一种大环内酯-喹诺酮衍生物及其制备方法和应用
本发明涉及化学合成及制药领域,特别是涉及一种含有大环内酯-喹诺酮衍生物及其制备方法和应用。
背景技术:
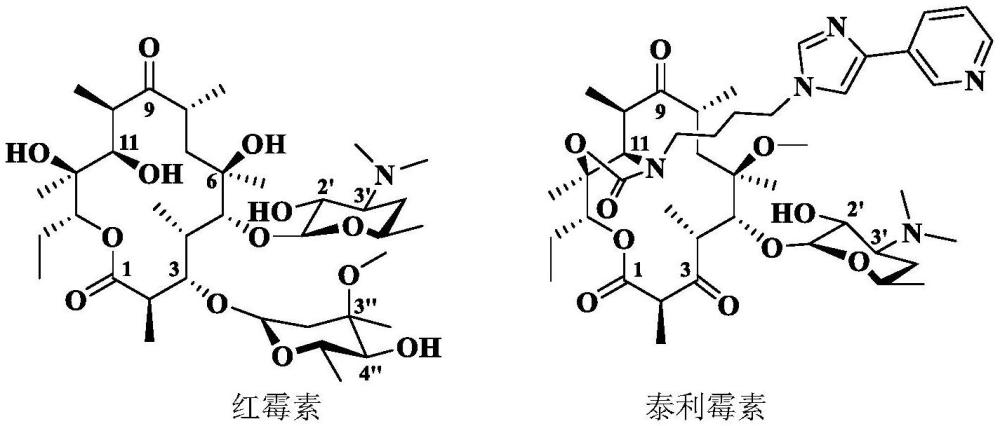
1、十四元大环内酯抗生素—红霉素(erythromycin)是非常重要的抗上下呼吸道感染的治疗药物,作用靶标是微生物核糖体的50s大亚基,作用机制是抑制微生物的蛋白质输出,临床上用于病原微生物引起的上下呼吸道感染以及皮肤和软组织感染等的治疗之中,副作用轻微,半个世纪来为人类特别是儿童提供了一条非常高效而且安全的用药途径。目前,临床上分离得到的病原微生物越来越多显示具有耐药性,如肺炎链球菌(s.pneumoniae)、金黄色葡萄球菌(s.aureus)和化脓链球菌(s.pyogenes)以及肺炎支原体(m.pneumoniae)等。上世纪80年代出现的第二代红霉素—克拉霉素(clarithromycin)和阿奇霉素(azithromycin)虽然耐(胃)酸性高、药代动力学性质好,但对红霉素耐药微生物并无活性。其主要原因是3-位的克拉定糖会诱导病原微生物产生耐药性,如关键靶点a2058被修饰或者被外排泵泵出细胞外。
2、
3、社区获得性细菌性肺炎和医院获得性细菌性肺炎的主要病原菌包括肺炎链球菌、金黄色葡萄球菌、嗜血流感杆菌等。其中,组成型耐药的肺炎链球菌(constitutivelyresistant streptococcus pneumoniae)是目前中国临床上常见的导致细菌性肺炎感染的高水平耐药病原菌,其不依赖于红霉素、克拉霉素、阿奇霉素等的存在,就可以将a2058修饰。这导致细菌对抗生素的亲和力大幅下降而耐药。
4、目前大环内酯的抗耐药菌结构主要包括将克拉定糖子结构进行修饰或者将克拉定糖替换为其它基团如羰基(酮内酯,ketolide)、酰基(酰内酯,acylide)或者烃基(烃基内酯,alkylide)等。构效关系分析显示,大多数大环内酯对组成型耐药菌活性较低。大环内酯靶向新的结合位点是其提高抗组成型耐药菌的关键,泰利霉素是迄今唯一被批准上市用于治疗社区获得性细菌肺炎感染的红霉素衍生物,对诱导性和外排耐药菌具有优异的抗菌活性,同时它作用于微生物核糖体的碱基对a752和u2609,因此对组成型耐药的肺炎链球菌和化脓链球菌具有良好的抗菌活性,但对组成型耐药的金黄色葡萄球菌和耐药支原体无活性。泰利霉素在人体内代谢不稳定,其侧链结构末端芳基即“吡啶基咪唑”与“烟碱”(1-甲基-2-(3-吡啶基)吡咯烷)结构类似,而且侧链咪唑代谢不稳定而降解后所引起的脱靶效应(作用于烟碱胆碱受体)与各种毒副作用高度相关。
5、因此,有必要寻找一种新型大环内酯抗生素,治疗临床上对红霉素耐药病原微生物引起的感染。
技术实现思路
1、为改善上述技术问题,本发明中提供了一种式(i)所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、药学上可接受的盐或其前药化合物:
2、
3、其中,a表示o或n-oc1-6烷基;
4、b表示o或nh;
5、x表示ch2、nh或o;
6、y表示h、无取代或任选被一个、两个或更多个r1取代的下列基团:c1-6烷基、c3-8环烷基、3-8元杂环基、c6-10芳基、5-14元杂芳基;每个r1相同或不同,彼此独立地选自卤素、oh、cn、no2、nh2、cooh、c1-20烷基、c3-20环烷基;
7、z表示h、卤素、c1-6烷基、c1-6烷氧基;
8、或者,y与z以它们的端基相连,形成与喹诺酮环稠合的6-8元杂环,所述6-8元杂环是无取代或任选被一个、两个或更多个r2取代,每个r2相同或不同,彼此独立地选自卤素、oh、cn、no2、nh2、cooh、c1-20烷基、c3-20环烷基;
9、r表示h、卤素、氨基、c1-6烷基或c1-6烷氧基;
10、m选自0-10的整数;例如选自0-8的整数,如1、2、3、4或5;
11、n选自0-10的整数,例如选自0-6的整数,如1、2或3。
12、根据一些实施方案,a可以选自o或n-och3。
13、根据一些实施方案,y可以选自h、无取代或任选被一个、两个或更多个r1取代的下列基团:c1-12烷基、c3-12环烷基、3-14元杂环基、c6-14芳基、5-14元杂芳基;每个r1相同或不同,彼此独立地选自卤素、c1-12烷基。
14、根据一些实施方案,y选自h、c1-6烷基、c3-8环烷基、卤代c1-6烷基或卤代苯基。
15、根据一些实施方案,y可以选自h、c1-3烷基、c3-6环烷基、卤代c1-3烷基、卤代c3-6环烷基、或氟代苯基。
16、根据一些实施方案,y可以选自h、甲基、乙基、正丙基、异丙基、三氟甲基、2-氟乙基、环丙基、氟代环丙基或2,4-二氟苯基。
17、根据一些实施方案,z可以选自h、f、甲基或甲氧基。
18、根据一些实施方案,式(i)化合物可以具有式(ia)的结构:
19、
20、
21、
22、
23、根据一些实施方案,所述前药化合物具有式(ii)所示的结构:
24、
25、其中,g选自c1-20烷基、c3-20环烷基、5-20元杂环基,例如c1-6烷基,如选自甲基、乙基或异丙基;a、b、x、y、z、r、m、n彼此独立地具有上文所述的定义。
26、本文中还提供了式(i)所示化合物的制备方法,包括以下步骤:化合物i-1脱保护基r0得到式(i)所示化合物;
27、
28、其中,r0选自羟基保护基,例如甲基、三苯甲基、乙酰基、新戊酰基、苯甲酰基、苄基等;a、b、x、y、z、r、m、n彼此独立地具有上文所述的定义;
29、根据一些实施方案,式(i-1)的制备方法包括以下方案1或方案2:
30、方案1:化合物i-2与化合物i-3反应得到化合物i-1;
31、
32、其中,z0选自卤素,如氯、溴或碘;r0选自羟基保护基,例如乙酰基、甲基、三苯甲基、苯甲酰基、新戊酰基、苄基等;a、b、x、y、z、r、m、n彼此独立地具有上文所述的定义;
33、方案2:化合物i-4与化合物i-5反应得到化合物i-1;
34、
35、其中,x'选自羟基的保护形式,例如甲磺酸酯基或对甲苯磺酸酯基;r0选自羟基保护基,例如甲基、三苯甲基、乙酰基、新戊酰基、苯甲酰基、苄基等;a、b、x、y、z、r、m、n彼此独立地具有上文所述的定义。
36、本文中还提供了式(i)化合物的中间体化合物或前药:
37、
38、其中,a、b、r、r0、x、x'、y、z、m、n彼此独立地具有上文所述的定义。
39、本文中还提供一种药物组合物,其包含治疗有效量的式(i)所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、药学上可接受的盐或其前药化合物中的至少一种。
40、根据一些实施方案,所述药物组合物还包括一种或多种药学上可接受的辅料。
41、根据一些实施方案,所述药物组合物还可以进一步含有一种或多种额外的治疗剂。
42、本文中还提供式(i)所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、药学上可接受的盐或其前药化合物中的至少一种在制备药物中的用途。
43、根据一些实施方案,所述药物为抗病原微生物药物,如抗生素。
44、根据一些实施方案,所述病原微生物可以为细菌或者其它非细菌病原微生物;例如肺炎链球菌、化脓链球菌、金黄色葡萄球菌、卡他莫拉菌、流感嗜血杆菌、支原体、衣原体等。
45、根据一些实施方案,所述细菌可以为耐药菌。
46、本文中还提供了式(i)所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、药学上可接受的盐或其前药化合物中的至少一种作为抗生素的应用。
47、本文中还提供了一种预防和/或治疗与细菌感染有关的疾病的方法,包括给予患者预防或治疗有效量的式(i)所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、药学上可接受的盐、其前药化合物或所述药物组合物中的至少一种。
48、根据一些实施方案,所述细菌可以为链球菌、葡萄球菌或嗜血杆菌;例如肺炎链球菌、化脓链球菌、金黄色葡萄球菌、流感嗜血杆菌。
49、在一些实施方案中,所述患者哺乳动物,优选是人。
50、本文中还提供用于与细菌感染有关的疾病的式(i)所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、药学上可接受的盐或其前药化合物中的至少一种,或其药物组合物。
51、有益效果
52、本文提供了一种式(i)所述的大环内酯-喹诺酮化合物,该化合物具有较好的抗菌消炎作用,可作为抗生素,尤其是用于治疗临床上对红霉素耐药病原微生物引起的感染。
53、本发明的化合物的结构特点为大环内酯3-位的氨基甲酸酯官能团中的氮原子上连接有长度适宜的侧链且侧链的末端炔基与各类喹诺酮-7’-基连接,由此替代了克拉霉素的3-o-克拉定糖;9-位为羰基或者烷氧基肟,同时11,12-oh环化成环碳酸酯或者环氨基甲酸酯。根据试验验证,本发明化合物中喹诺酮-7-基相比对应的喹诺酮-6-基取代的具有很大的优越性,炔烃连接7-喹诺酮比对应烷烃连接6-喹诺酮整体上也较有优势。
54、术语定义与说明
55、除非另有说明,否则本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当被理解为本技术说明书和/或权利要求书记载的范围内。
56、除非另有说明,否则本说明书和权利要求书记载的数值范围相当于至少记载了其中每一个具体的整数数值。例如,数值范围“1-20”相当于记载了1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20。
57、术语“卤素”表示氟、氯、溴和碘。
58、术语“c1-20烷基”应理解为表示具有1~20个碳原子的直链或支链饱和一价烃基。例如,“c1-10烷基”表示具有1、2、3、4、5、6、7、8、9或10个碳原子的直链和支链烷基,“c1-8烷基”表示具有1、2、3、4、5、6、7、或8个碳原子的直链和支链烷基,“c1-6烷基”表示具有1、2、3、4、5或6个碳原子的直链和支链烷基。所述烷基是例如甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等或它们的异构体。
59、术语“c3-20环烷基”应理解为表示饱和的一价单环、二环(如稠环、桥环、螺环)烃环或三环烷烃,其具有3~20个碳原子,优选“c3-10环烷基”,更优选“c3-8环烷基”。术语“c3-10环烷基”应理解为表示饱和的一价单环、双环(如桥环、螺环)烃环或三环烷烃,其具有3、4、5、6、7、8、9或10个碳原子。所述c3-10环烷基可以是单环烃基,如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基或环癸基,或者是双环烃基如龙脑基、吲哚基、六氢吲哚基、四氢萘基、十氢萘基、二环[2.1.1]己基、二环[2.2.1]庚基、二环[2.2.1]庚烯基、6,6-二甲基二环[3.1.1]庚基、2,6,6-三甲基二环[3.1.1]庚基、二环[2.2.2]辛基、2,7-二氮杂螺[3,5]壬烷基、2,6-二氮杂螺[3,4]辛烷基,或者是三环烃基如金刚烷基。
60、术语“3-20元杂环基”是指饱和的或不饱和的非芳族的环或环系,例如,其是4-、5-、6-或7-元的单环、7-、8-、9-、10-、11-或12-元的二环(如稠环、桥环、螺环)或者10-、11-、12-、13-、14-或15-元的三环环系,并且含有至少一个,例如1、2、3、4、5个或更多个选自o、s和n的杂原子,其中n和s还可以任选被氧化成各种氧化状态,以形成氮氧化物、-s(o)-或-s(o)2-的状态。优选地,所述杂环基可以选自“3-10元杂环基”。术语“3-10元杂环基”意指饱和的或不饱和的非芳族的环或环系,并且含有至少一个选自o、s和n的杂原子。所述杂环基可以通过所述碳原子中的任一个或氮原子(如果存在的话)与分子的其余部分连接。所述杂环基可以包括稠合的或桥连的环以及螺环的环。特别地,所述杂环基可以包括但不限于:4元环,如氮杂环丁烷基、氧杂环丁烷基;5元环,如四氢呋喃基、二氧杂环戊烯基、吡咯烷基、咪唑烷基、吡唑烷基、吡咯啉基;或6元环,如四氢吡喃基、哌啶基、吗啉基、二噻烷基、硫代吗啉基、哌嗪基或三噻烷基;或7元环,如二氮杂环庚烷基。任选地,所述杂环基可以是苯并稠合的。所述杂环基可以是双环的,例如但不限于5,5元环,如六氢环戊并[c]吡咯-2(1h)-基环,或者5,6元双环,如六氢吡咯并[1,2-a]吡嗪-2(1h)-基环。杂环基可以是部分不饱和的,即它可以包含一个或多个双键,例如但不限于二氢呋喃基、二氢吡喃基、2,5-二氢-1h-吡咯基、4h-[1,3,4]噻二嗪基、1,2,3,5-四氢噁唑基或4h-[1,4]噻嗪基,或者,它可以是苯并稠合的,例如但不限于二氢异喹啉基。所述3-20元杂环基与其它基团相连构成本文中的化合物时,可以为3-20元杂环基上的碳原子与其它基团相连,也可以为3-20元杂环基环上杂环原子与其它基团相连。
61、术语“c6-20芳基”应理解为优选表示具有6~20个碳原子的一价芳香性或部分芳香性的单环、二环(如稠环、桥环、螺环)或三环烃环,其可以是单芳族环或稠合在一起的多芳族环,优选“c6-14芳基”。术语“c6-14芳基”应理解为优选表示具有6、7、8、9、10、11、12、13或14个碳原子的一价芳香性或部分芳香性的单环、双环或三环烃环(“c6-14芳基”),特别是具有6个碳原子的环(“c6芳基”),例如苯基;或联苯基,或者是具有9个碳原子的环(“c9芳基”),例如茚满基或茚基,或者是具有10个碳原子的环(“c10芳基”),例如四氢化萘基、二氢萘基或萘基,或者是具有13个碳原子的环(“c13芳基”),例如芴基,或者是具有14个碳原子的环(“c14芳基”),例如蒽基。当所述c6-20芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为邻位、对位或间位取代。
62、术语“5-20元杂芳基”应理解为包括这样的一价单环、二环(如稠环、桥环、螺环)或三环芳族环系:其具有5~20个环原子且包含1-5个独立选自n、o和s的杂原子,例如“5-14元杂芳基”。术语“5-14元杂芳基”应理解为包括这样的一价单环、双环或三环芳族环系:其具有5、6、7、8、9、10、11、12、13或14个环原子,特别是5或6或9或10个碳原子,且其包含1-5个,优选1-3各独立选自n、o和s的杂原子并且,另外在每一种情况下可为苯并稠合的。
63、“卤代烷基”指被一个或多个卤素取代的烷基,其中烷基如上所定义。
64、本文中的化合物可以溶剂合物(如水合物)的形式存在,其中本文中的化合物包含作为所述化合物晶格的结构要素的极性溶剂,特别是例如水、甲醇或乙醇。极性溶剂特别是水的量可以化学计量比或非化学计量比存在。
65、术语“患者”是指包括哺乳动物在内的任何动物,优选小鼠、大鼠、其它啮齿类动物、兔、狗、猫、猪、牛、羊、马或灵长类动物,最优选人。
66、术语“治疗有效量”是指研究人员、兽医、医师或其它临床医师正在组织、系统、动物、个体或人中寻找的引起生物学或医学反应的活性化合物或药物的量,它包括以下一项或多项:(1)预防疾病:例如在易感染疾病、紊乱或病症但尚未经历或出现疾病病理或症状的个体中预防疾病、紊乱或病症。(2)抑制疾病:例如在正经历或出现疾病、紊乱或病症的病理或症状的个体中抑制疾病、紊乱或病症(即阻止病理和/或症状的进一步发展)。(3)缓解疾病:例如在正经历或出现疾病、紊乱或病症的病理或症状的个体中缓解疾病、紊乱或病症(即逆转病理和/或症状)。
67、本文中所用的术语“喹诺酮”表示苯并吡啶酮或羟基喹啉,例如喹啉-4(1h)-酮或4-羟基喹啉。尤其是,在本文中,喹诺酮由于3-位羧基的存在而具有如下骨架结构:
68、
69、其中,n-1位可以被烷基、环烷基、芳基取代,或者卤代烷基、卤代环烷基、卤代芳基取代,如甲基、乙基、氟代乙基、环丙基、氟代环丙基、2,4-二氟代苯基等。6-位可以被卤素取代,如氯、氟。7-位可以被卤素、炔烃、烷烃、氨基、杂环烷基取代,如碘、溴、哌嗪、四氢吡咯等。5-位、6-位和8-位可以分别彼此独立地被烷基、卤素、氨基、烷氧基取代,如甲基、氯、氟、甲氧基等。另外,8-位取代基可以与1位取代基成环。作为一个实例,在这种情况下如左氧氟沙星中的8-位和1-位之间所形成的杂环,例如本发明中的喹诺酮可以包括7-氧代-7h-吡啶并[1,2,3-de]-[1,4]苯并噁嗪环。
70、本领域技术人员可以理解,式(i)所示化合物可以以各种药学上可接受的盐的形式存在。如果这些化合物具有碱性中心,则其可以形成酸加成盐;如果这些化合物具有酸性中心,则其可以形成碱加成盐;如果这些化合物既包含酸性中心(例如羧基)又包含碱性中心(例如氨基),则其还可以形成内盐。在本发明中,各种药用可接受的酸可以在5-o-糖胺的二甲氨基的氮上形成盐。所述酸可以为无机酸或有机酸;所述无机酸为盐酸、硫酸、氢溴酸、氢碘酸或磷酸;所述有机酸为醋酸、丙二酸、甲磺酸、琥珀酸、对甲苯磺酸、柠檬酸、马来酸、富马酸、苹果酸或者枸橼酸。
71、本文中使用的术语“辅料”是指任何和全部的溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和药学活性物质的吸收延迟剂,这些是本领域公知的。除了与该化合物不相容的任何常规介质或试剂外,可以考虑任何常规介质或试剂在药物组合物中的使用。补充性的化合物也可以加入到该组合物中。
72、本文中的术语“前药化合物”可以是以某种虽未公开的结构给药但是在人体内代谢或者转化成本文中公开的化合物,并作为药效成分发挥药理作用。在本发明中,所述前药化合物可以是在喹诺酮的3-羧基上酯化,如甲酯、乙酯、异丙基酯、或者其它含有杂原子的(环)烷基酯等,体内水解酯基释放出活性基团3-羧基。前药的制备常规方法见《design ofprodrugs》(h.bundgaad,elsevier,1985)。
- 还没有人留言评论。精彩留言会获得点赞!