:本发明属于生物医药领域,具体涉及一种含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的嵌合抗原受体(car)及其载体、t细胞、制备方法和用途。
背景技术
0、
背景技术:
1、bcma car-t疗法在复发难治多发性骨髓瘤治疗史中作了突破性贡献,患者生存率得到了显著提高,但在治疗r/rmm过程中部分患者出现无应答、耐药和易复发。car-t治疗后复发与car-t的抗肿瘤功能持久性低下相关,为了消除肿瘤细胞,t细胞不仅必须存活,而且必须维持细胞溶解和增殖功能。前面章节我们通过对car共刺激信号结构域的优化策略增强t细胞的持久性抗肿瘤作用。另外,患者抗bcmacar-t疗法治疗后出现的短期复发原因是因为复发难治多发性骨髓瘤的肿瘤免疫抑制性微环境所致。免疫系统是激活和抑制协同的平衡系统,在激活免疫细胞的同时,也在准备启动抑制免疫细胞的活动。所以不可避免的,t细胞被激活后,不但开始启动了抗肿瘤的活性,随着抗肿瘤活性的增加,自然会诱导共抑制受体的上调。r/r mm的肿瘤微环境存在突出的免疫抑制特点,来自r/r mm患者的t细胞上往往过表达pd-1,而骨髓瘤的肿瘤微环境中大量存在的肿瘤细胞以及部分免疫细胞(包括浆细胞样树突状细胞和髓系衍生抑制细胞),均大量表达pd-l1。pd-1与pd-l1的结合限制t细胞抗肿瘤免疫反应,表现为t细胞增殖能力下降、肿瘤杀伤活性降低,促进效应t细胞凋亡并抑制treg凋亡,最终不能发挥持续性抗肿瘤的作用。所以pd-1/pd-l1的t细胞抑制性通路的激活和增强,造成car-t抗肿瘤功能的下降,car-t细胞抗肿瘤活性和功能无法持久性发挥是导致骨髓瘤复发的一个关键因素。
2、pd-1是cd28辅助受体家族的细胞表面受体成员,t细胞表面持续表达pd-1与t细胞抗肿瘤功能障碍有关。pd-1下游通路机制减弱免疫细胞功能,与pd-l结合后,pd-1募集磷酸酶shp1和shp2,抑制zap70和pi3k的激活,从而抑制下游akt和erk的激活抑制免疫细胞活性。抑制pd-1/pd-l1免疫检查点是提高免疫效应的经典策略,目前被广泛应用于肿瘤治疗中,也取得了显著的的临床效应。但一些临床数据显示,单独使用pd-1和pd-l1封闭抗体作为单一药物治疗多发性骨髓瘤似乎没有像其应用在治疗其他肿瘤那样有效。pd-1单抗nivolumab进行i期研究中27名骨髓瘤患者中没有一人表现出客观的临床反应,pd-1通路阻断的单一药物抗肿瘤疗效有限。pd-1免疫检查点作为靶点往往需要与其他免疫疗法联用以产生最大的临床益处,pd-1/pd-l1阻断抗体也已被证明可增强car-t细胞治疗作用,抗bcmacar-t疗法与降低pd-1免疫检查点抑制作用的策略在治疗多发性骨髓瘤治疗中显示出可观的前景。目前临床用于针对pd-1免疫检查点的药物主要是抗pd-1或抗pd-l1阻断性抗体以及一些小分子药物,对于多数血液和实体肿瘤治疗有显著的疗效,但其引起的毒副作用和不良事件也很大的限制了pd-1单抗的使用。pd-1单抗阻断t细胞负性调控信号,全身给药后,在增强t细胞抗肿瘤效应的同时可能也会出现异常增强自身免疫反应的副作用,从而导致免疫耐受失衡,若累及到正常组织,会表现出自身免疫样炎症反应,即为免疫相关不良事件(immune-related adverse events,iraes)。这种以静脉全身给药的方式很难避免iraes的发生,对此有研究者设计一种四代car-t,赋予car-t自分泌pd-1抗体的功能,使pd-1抗体作用于局部,在提高car-t疗效的同时降低全身性不良反应。为了降低pd-1/pd-l1通路的免疫抑制作用,还有研究者对car-t细胞的pd-1分子通过基因编辑的方法进行敲除,主动降低car-t受到肿瘤刺激过程中pd-1的表达,使car-t展现出更高的抗肿瘤活性和更长的存活时间。但是值得注意的是,基因编辑敲除pd-1基因的方法存在着两种主要的风险,一是基因编辑技术本身所带来的“基因脱靶”而造成的不可控的影响t细胞其它基因表达,甚至癌变的风险,另一方面,当pd-1/pd-l1这一“免疫刹车”系统完全失效后,car-t细胞是否会处于不可控的过度免疫激活状态也会埋下风险。所以相对于彻底敲除pd-1的思路,利用rna干扰(rna interference,rnai)的手段在mrna水平进行pd-1分子敲减的方法似乎更安全,并且pd-1一定程度的敲减有利于t细胞的细胞因子释放和cd107a的表达可有效增强抗肿瘤效应。
3、rna干扰由双链rna(double-stranded rna,dsrna)诱发,特指进化过程中高度保守的同源mrna特异性沉默的现象。由于rnai技术具有序列专一和干扰能力强的特点,可特异性沉默基因降低基因表达量,因而广泛应用到药物靶点筛选、细胞信号传导通路分析、疾病治疗等领域。rnai的发现和对基因调控技术获得2006年诺贝尔生理学或医学奖诺奖。目前一般有两种策略应用rnai技术,第一,通过瞬时表达的转染方式将靶向特定基因的小干扰rna(small interfering rna,sirna)进入细胞发挥靶基因沉默的效应。但是转染的不确定性导致进入rnai途径的沉默效率难以控制。第二种是设计短发卡rna(short hairpinrna,shrna),在细胞内dicer酶的辅助下,生成相应的sirna,发挥rnai作用。第二种策略可通过构建稳定表达shrna的转基因载体,替代化学合成的sirna和基于瞬时表达载体构建的shrna。常用的可稳定表达的载体有逆转录病毒载体和慢病毒载体两种,均可将基因整合到宿主细胞染色体的dna中,稳定持续表达“目标”基因;这两种病毒载体可用于转导传统方法难以转导的原代悬浮细胞,常用于car-t细胞的制备,这为rnai技术在car-t疗法抗肿瘤免疫领域的应用提供了持续和有效途径。
技术实现思路
0、
技术实现要素:
1、本发明的目的在于,克服bcmacar-t治疗r/r mm耐药易复发的问题,提供一种含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的四代car。本发明将shrna-pd-1与前期优选的抗bcma-ox40.28ζcar基因融合表达在同一个质粒载体上,将沉默pd-1基因表达的shrna-pd-1元件克隆到表达car基因的质粒载体上,并通过慢病毒包装体系制备慢病毒载体。通过慢病毒载体转基因技术将car基因和shrna-pd-1序列转导至t细胞中,精准地降低car-t细胞本身pd-1的表达从而降低pd-1免疫检查点的抑制作用,使bcmacar-t细胞抗肿瘤疗效和持久性得到提升。
2、本发明提供了一种含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car,包括靶蛋白scfv区、含有ox40和cd28组合的共刺激结构域和shrna-pd-1敲减序列。
3、进一步地,所述靶蛋白scfv区的靶蛋白选自:bcma、cd19、cd7、cd20、cd22、cd38、cd138和mlsn中的一种或多种。优选所述靶蛋白为bcma。较佳的,所述靶蛋白scfv区为bcmascfv,氨基酸序列为:seq id no.1所示。
4、进一步的,所述靶蛋白scfv区为bcma scfv,氨基酸序列为:seq id no.1所示的氨基酸序列经过添加、缺失、修饰和/或保守性置换至少1个氨基酸残基获得的氨基酸序列。
5、进一步地,所述含有ox40和cd28组合的共刺激结构域中,所述ox40的氨基酸序列为seq id no.2所示的氨基酸序列经过添加、缺失、修饰和/或保守性置换至少1个氨基酸残基获得的氨基酸序列;所述cd28的氨基酸序列为seq id no.3所示的氨基酸序列经过添加、缺失、修饰和/或保守性置换至少1个氨基酸残基获得的氨基酸序列。
6、进一步的,所述含有ox40和cd28组合的共刺激结构域包含与ox40和cd28的氨基酸序列具有至少90%、95%、96%、97%、98%、99%或100%同源性的氨基酸序列。
7、在一些实施方案中,所述共刺激结构域包括选自cd28、4-1bb、cd27、icos、gitr、cd40l和tnfrsf13c中的至少两种。
8、进一步的,所述shrna选自下述中的任一项:
9、f.seq id no.4和seqid n0.5所示的核苷酸序列;
10、g.seq id no.6和seqid n0.7所示的核苷酸序列;
11、h.seq id no.8和seqid n0.9所示的核苷酸序列;
12、i.seq id no.10和seqid n0.11所示的核苷酸序列;
13、j.seq id no.12和seqid n0.13所示的核苷酸序列;
14、优选seq id no.12和seqid n0.13所示核苷酸序列。
15、进一步的,一种含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car,包括:依次串联的cd8膜受体信号肽、靶蛋白scfv区、cd8嵌合受体铰链区、cd8 tm嵌合受体跨膜区、含有ox40和cd28组合的共刺激结构域、cd3ζ胞内信号肽和shrna-pd-1敲减序列。
16、本发明还公开了编码所述含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car的核酸序列,包含:编码如seq id no.14所示的cd8嵌合受体信号肽的核酸序列、编码如seq id no.15所示的cd8嵌合受体铰链区的核酸序列、编码如seq id no.16所示的cd8 tm嵌合受体跨膜区的核酸序列、编码如seq id no.17和seq id no.18所示的ox40和cd28组合共刺激结构域的核酸序列、编码如seq id no.19所示的cd3ζ胞内信号肽的核酸序列、编码如seq id no.12和seqid n0.13所示的shrna-pd-1的核酸序列和编码如seq id no.20所示的bcma scfv的核酸序列。
17、本发明还提供与抗bcmacar相关的载体、核酸,其包含前面所述的scfv。在一些实施方案中,所述载体为重组慢病毒载体;所述重组慢病毒载体含有抗bcma scfv的核苷酸序列。
18、本发明还提供一种质粒,其含有编码如上所述的含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car的核酸序列。
19、进一步地,用限制性内切酶ecor i和bamh i切慢病毒表达质粒plve1819k得到线性质粒;将含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的四代car的编码核酸片段与所述线性质粒充分混合,加入重组酶进行同源重组;利用top10感受态细胞使同源重组后的质粒进行热激转化,转化后的菌液涂布于含有ampr的琼脂平皿上,放在co2培养箱中培养;挑选单个菌落,进行pcr扩增目的片段,pcr产物采用凝胶电泳鉴定阴阳菌落;选取阳性菌落接种于含有ampr的液体培养基中,转移至摇床培养;抽提菌落里的质粒,测序验证,软件比对测序结果,序列匹配的即为所需要的目的质粒——所述重组慢病毒质粒。
20、本发明还提供一种重组慢病毒载体,其含有编码如上所述的含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car的核酸序列。
21、另一方面,本发明还提供一种如上所述的重组慢病毒载体的构建方法,包括以下步骤:
22、步骤一、将含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car的编码核酸片段,经过酶切、连接、重组反应克隆至慢病毒表达质粒plve1819k中,得到重组慢病毒质粒;
23、步骤二、将得到的所述重组慢病毒质粒与慢病毒骨架质粒gag/pol、vsvg、rev组成四质粒表达体系,共同转染hek293t细胞,在hek293t细胞中进行基因转录表达后,包装成功的重组慢病毒载体会释放到细胞培养上清中,收集上清液;
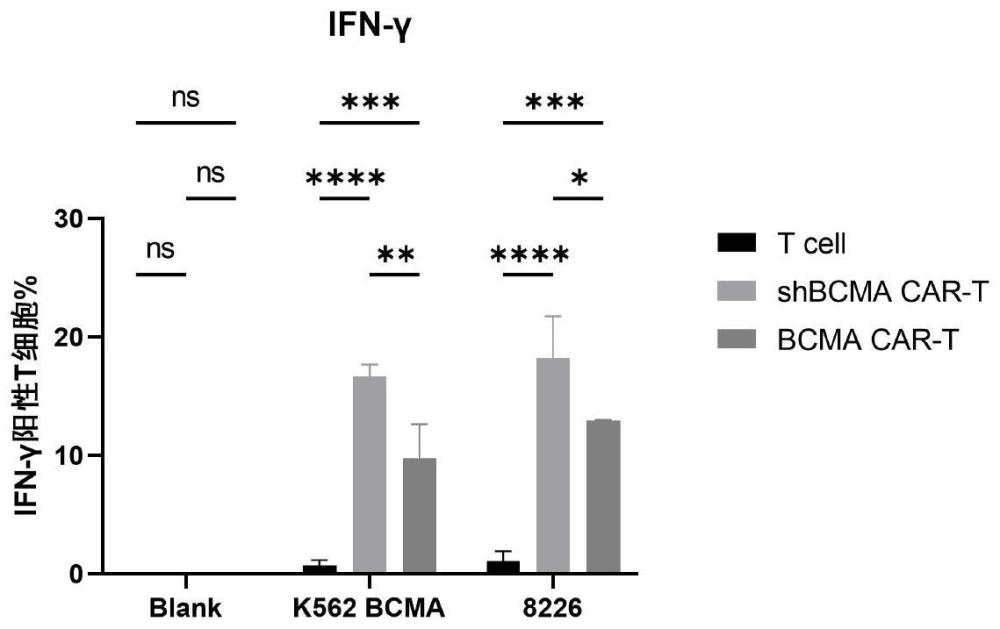
24、步骤三、将所述步骤二得到的上清液采用过滤、切向流包膜浓缩重组慢病毒载体,得到所述重组慢病毒载体。
25、本发明还提供一种car-t细胞,其car为如上所述的含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car。。
26、在一些实施方案中,抗bcmacar-t中的t细胞包括但不限于αβt细胞、γδt细胞、nkt细胞、mait细胞和cik细胞中的一种或多种。
27、本发明还提供一种应用,如上所述的含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car、如上所述的质粒、如上所述的重组慢病毒载体和/或如上所述的car-t细胞在制备治疗肿瘤的药物中的应用。
28、进一步地,所述肿瘤选自多发性骨髓瘤、白血病、淋巴瘤、胰腺癌、胃癌、结肠癌、胆管癌、食道癌、肝癌、肺癌、脑胶质瘤、乳腺癌、黑色素瘤、宫颈癌、卵巢癌和睾丸癌中的一种或者多种。
29、如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
30、如本文所用,术语“抗bcmacar-t”中的t细胞除非在具体实施时特别指明为某一类的t细胞外,应理解为是广义上的t细胞,即包括但不限于αβt细胞和/或γδt细胞,还包括一些非典型t细胞,例如自然杀伤t(nkt)细胞、粘膜相关不变t(mucosalassociatedinvariant t,mait)细胞、细胞因子诱导的杀伤细胞(cytokine-inducedkiller,cik)等。这些非典型t细胞也作为t淋巴细胞的效应类型。t细胞的来源也不限于外周血,包括脐带血、干细胞、ipsc、细胞系等分化诱导转化而来的细胞,及其t细胞分化而成的其他的细胞类型。αβt和γδt细胞是根据tcr类型不同对典型t细胞的分类。
31、如本文所用,术语“宿主细胞”应从广义上来理解,可以是原核细胞或真核细胞;可以是本领域已知的任何适宜宿主细胞,例如,哺乳动物宿主细胞、细菌宿主细胞、酵母宿主细胞、昆虫宿主细胞等。
32、与现有技术相比,本发明具有如下有益效果:
33、本发明所涉及的含ox40与cd28组合共刺激域和shrna-pd-1敲减序列的car修饰的t细胞在体外和体内试验中均显示肿瘤细胞裂解能力以及ifn-γ和tnf-α细胞因子表达释放能力均更强。进一步动物实验发现与其它在细胞水平比较的两组car-t细胞相比,抗bcma-ox40.28ζshrna-pd-1-car-t细胞抗肿瘤的效应更快更强;更重要的是,具有pd-1沉默的抗bcma-ox40.28ζshrna-pd-1-car-t细胞更趋于向年轻化的tscm分化,使得car-t的抗原反应迅速且具有更大的增殖潜力,不但提高了抗肿瘤的效应,而且还有利于增强体内抗肿瘤持久力,从而更具有降低car-t治疗后短期复发率的潜力。
