基于噻吩-氧杂蒽染料的硫化氢荧光探针的制备和应用
1.本发明属于荧光探针技术领域,具体涉及一种基于噻吩-氧杂蒽染料的硫化氢荧光探针的制备和应用。
背景技术:
2.硫化氢(h2s)是生命中不可缺少的气体递质(r.wang,antioxid.redox signaling.2003,5,493-501.)。这种气体小分子可在体内通过酶催化的半胱氨酸(cys)及其衍生物的代谢产生,在许多生理过程中发挥重要作用(b.xu,h.zhou,q.mei,w.tang,y.sun,m.gao,c.zhang,s.deng,y.zhang,anal.chem.2018,90,2686-2691.)。同时,细胞内h2s水平异常与多种疾病有关,比如:糖尿病、唐氏综合征、肝硬化和阿尔茨海默病(c.szabo.nat.rev.drug discovery.2007,6,917-935;m.lavu,s.bhushan.clin.sci.2011,120,219-229;a.martelli,l.testai,m.c.breschi,c.blandizzi,res.rev.2012,32,1093-1130.)。因此,开发一种方便可靠的实时检测活细胞和体内h2s水平的方法至关重要。
3.荧光方法具有灵敏度高、操作简单、无创原位和实时空间成像的优点而显示出很大的潜力(w.xuan,c.sheng,y.cao,w.he,w.wang,angew.chem.int.ed.2012,51,2282-2284;v.s.lin,c.j.chang,curr.opin.chem.biol.2012,16,595-601.)。到目前为止,已经开发了一些检测h2s的荧光探针,用于实时监测细胞内的h2s浓度(p.ou,r.l.zhang,z.j.liu,x.t.tian,g.m.han,b.h.liu,z.j.hu,z.p.zhang,angew.chem.int.ed.2019,58,2261-2265;z.qian,h.y.zhang,k.w.wang,y.r.zhang,talanta.2019,195,850-856;l.yuan,q.p.zuo,sensors andactuators b.2014,196,151-155.)。但是,这些h2s探针分析波长较短,没有达到近红外范围,容易被活体内生物分子产生的自发荧光信号干扰,且组织穿透能力较弱,从而限制了在生物体内的应用。
4.噻吩-氧杂蒽作为一种新型的荧光染料,具有斯托克斯位移大,灵敏度高等优点。特别是,由于其染料具有近红外发射,因此具有较深的组织穿透深度,不易受到生物自体荧光的干扰,对生物成像更有利。二硝基苯基作为一种h2s识别团,已被成功用于构建荧光探针来特异性检测h2s(z.p.she,w.x.wang,w.l.jiang,z.q.wang,g.j.mao,j.j.fei,y.f.li,c.y.li,anal.chem.2021,93,11826-11835;l.yan,q.s.gu,w.l.jiang,m.tan,z.ke.tan,g.j.mao,f.xu,c.y.li,anal.chem.2022,94,5514-5520.)。但是,到现在为止,还没有基于噻吩-氧杂蒽染料作为荧光探针来检测h2s。因此,设计和合成一种基于噻吩-氧杂蒽染料的荧光探针来检测h2s是非常有必要的。
技术实现要素:
5.根据所提出的要求,本发明人对此进行了深入研究,在付出了大量创造性劳动后,提供了一种基于噻吩-氧杂蒽染料的硫化氢近红外荧光探针。
6.本发明的技术方案是,一种硫化氢近红外荧光探针,其结构式如下:
[0007][0008]
一种硫化氢近红外荧光探针的制备方法。步骤如下:
[0009]
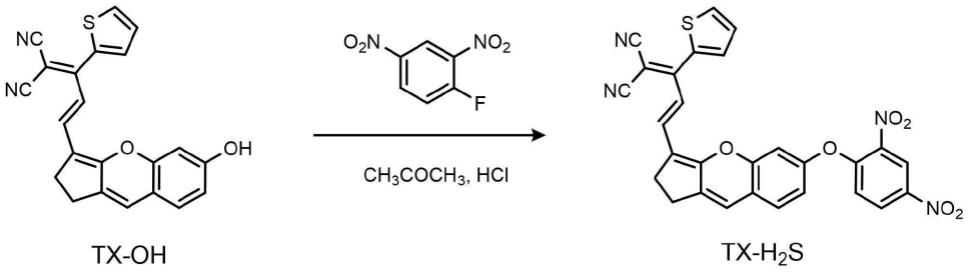
将1.0当量的tx-oh,1.0当量的2,4-二硝基氟苯和0.4~0.6ml的三乙胺分别加入到25ml圆底烧瓶中,然后加入6~10ml丙酮将其溶解。将反应混合液回流搅拌0.5~1小时,反应完成后,减压蒸发除去丙酮。在所得混合物中加入8~12ml 5%的hcl溶液,过滤沉淀物,并用蒸馏水洗涤数次。将粗产物在丙酮中重结晶纯化,得到深绿色固体tx-h2s,即为所述的荧光探针。
[0010]
本发明的有益效果是,一种基于噻吩-氧杂蒽染料的h2s荧光探针的良好的光谱响应性能。首先,研究该探针的荧光光谱性质。探针本身在715nm处没有明显的近红外发射;加入h2s后,在715nm处出现了明显的近红外发射。并且,随着h2s浓度的增大,探针的近红外荧光强度不断增强。当加入50μm的h2s时,荧光强度大约增强9倍。该探针的检测范围从0.5μm到50μm,检测限为0.24μm,这说明该探针可以高灵敏的检测h2s。接着,研究探针的紫外吸收光谱。探针本身在530nm附近有吸收带,加入h2s后,530nm附近的吸收峰明显减小,在590nm附近出现新的吸收峰。然后,研究探针的选择性。考察了探针与无机离子(k
+
、na
+
、ca
2+
、mg
2+
、cu
2+
、cl-、br-、s2o
32-、so
42-),活性氧(clo-、h2o2),活性氮(no
2-、no),氨基酸(lys、phe、met、thr、ile、val),生物硫醇(cys、hcy、gsh)以及检测物(h2s)的荧光响应情况。结果发现,只有h2s引起荧光光谱的改变,其他检测物对探针的荧光光谱没有明显的影响。最后,研究了ph值对荧光探针测定h2s的影响,当ph值在5.0到8.0之间时,不影响荧光探针对h2s的测定。此外,该荧光探针响应比较迅速,响应时间在3分钟以内。
[0011]
一种硫化氢近红外荧光探针的应用。在对照组肝癌细胞hepg2中观察不到明显的荧光,当细胞中加入荧光探针后,可以观察到较强的荧光,这说明细胞中的h2s含量较高。在hepg2细胞中加入nahs,再和荧光探针共同孵育时,可以观察到更强的荧光,这是因为细胞中的h2s含量增加。而用n-乙基马来酰亚胺(nem)预处理细胞,再用探针共同孵育时,只能在细胞中观察到微弱的荧光,这是因为nem清除了细胞内硫醇。这些结果说明荧光探针能检测到细胞内产生的h2s,这为监控人体内和硫化氢相关病变提供一种可靠的手段。
附图说明
[0012]
图1为荧光探针的合成路线。
[0013]
图2为荧光探针与不同浓度的h2s作用后的荧光光谱图。
[0014]
横坐标为波长,纵坐标为荧光强度。荧光探针的浓度为10μm,h2s的浓度分别为:0,0.5,1.0,5.0,10.0,15.0,20.0,25.0,30.0,35.0,40.0,45.0,50.0μm。发射波长范围为650~850nm,对应的激发波长为590nm。
[0015]
图3为荧光探针对不同h2s浓度的荧光线性响应图。
[0016]
图4为荧光探针与h2s作用后的紫外可见吸收光谱图。
[0017]
横坐标为波长,纵坐标为吸光度。荧光探针的浓度为10μm,h2s浓度为50μm。
[0018]
图5为荧光探针的选择性图。
[0019]
荧光探针的浓度为10μm,h2s浓度为50μm,gsh,cys和hcy的浓度为5mm,其它分析物浓度均为200μm。
[0020]
图6为ph对荧光探针的影响图。
[0021]
图7为荧光探针与h2s作用后荧光强度随时间变化的关系曲线图,h2s浓度为0,10,20,30,40,50μm。
[0022]
图8为细胞毒性实验图。横坐标为荧光探针的浓度,纵坐标为细胞的存活率。
[0023]
图9为荧光探针与h2s作用的细胞成像图,以及细胞的相对荧光强度图。(a)细胞成像图,(b)相对荧光强度图。
具体实施方式
[0024]
下面结合附图和具体实施例对本发明进行详细说明,但不限于此。
[0025]
实施例1:
[0026]
荧光探针的合成
[0027]
合成路线如图1。将tx-oh(110mg,0.30mmol),2,4-二硝基氟苯(60mg,0.30mmol),0.5ml的三乙胺分别加入到25ml圆底烧瓶中,然后加入10ml的丙酮使其溶解。将反应混合物回流搅拌0.5小时。蒸发除去丙酮,然后加入10ml 5%的hcl溶液,将沉淀物抽滤,并用蒸馏水洗涤数次。将粗产物在丙酮中重结晶纯化,得到深绿色固体tx-h2s(150mg,产率93%),即为所述的荧光探针。1h nmr(400mhz,dmso-d6,δ,ppm)δ8.87(d,j=4.0hz,1h),8.42(d,j=8.0hz,1h),8.02(d,j=4.0hz,1h),7.57(d,j=4.0hz,1h),7.44(d,j=8.0hz,1h),7.30(t,j=8.0hz,3h),7.15(s,1h),7.06(d,j=8.0hz,1h),6.92(s,1h),6.67(d,j=12.0hz,1h),2.82(s,2h),2.73(s,2h).
13
c nmr(100mhz,dmso-d6,δ,ppm)δ161.7,159.5,154.9,154.8,153.0,142.4,140.8,140.1,138.8,133.4,133.2,130.2,129.1,122.4,121.5,120.8,117.9,117.2,115.8,115.0,108.6,74.3,55.4,25.8,24.6.ms(tof):536.2.
[0028]
实施例2:
[0029]
荧光探针和h2s溶液配制
[0030]
称取一定量荧光探针tx-h2s固体溶解在dmso中来制备1.0
×
10-4
mol
·
l-1
的tx-h2s储备溶液。h2s储备溶液(1.0
×
10-3
mol
·
l-1
)是通过将一定量的nahs固体溶解在蒸馏水中所制备,然后逐步稀释至5.0
×
10-4
~5.0
×
10-6
mol
·
l-1
。将1.0ml tx-h2s储备溶液、2.0ml dmso和1.0ml不同浓度的h2s储备溶液加入10ml的容量瓶,通过pbs缓冲溶液定容,然后进行荧光检测。
[0031]
实施例3:
[0032]
荧光探针与h2s作用的荧光光谱的测定
[0033]
图2为荧光探针与h2s作用的荧光光谱,荧光探针的浓度为10μm,h2s的浓度依次为0,0.5,1.0,5.0,10.0,15.0,20.0,25.0,30.0,35.0,40.0,45.0,50.0μm。实验所用激发波长为590nm,发射波长范围为650~850nm。狭缝宽度为10.0nm/10.0nm,所用的荧光测定仪器为日立f4600荧光分光光度计。从图2可以看出,加入h2s之前,由于二硝基苯醚基团的淬灭作用,探针本身几乎没有发射峰;随着h2s的加入,在715nm处发射峰大幅度的增强,并且随着h2s浓度的增大,探针的荧光强度不断增强。图3为探针对不同h2s浓度的线性响应图。荧光强
度跟h2s的浓度呈现线性关系,该探针的检测范围从0.5μm到50μm,检测限为0.24μm。这说明该探针可以高灵敏的检测h2s。
[0034]
实施例4:
[0035]
荧光探针与h2s作用的紫外可见吸收光谱的测定
[0036]
图4为荧光探针与h2s作用后的紫外可见吸收光谱图,荧光探针的浓度为10μm,h2s的加入量为50μm。紫外可见吸收光谱测定用的仪器为安捷伦cary60紫外可见分光光度计。从图4中可以看出,探针本身在530nm处有吸收带;加入h2s之后,530nm处的吸收峰红移,在590nm附近出现新的强吸收峰。
[0037]
实施例5:
[0038]
荧光探针对h2s测定的选择性
[0039]
图5为荧光探针对h2s测定的选择性图。考察在浓度为10μm的荧光探针中加入h2s(50μm)以及无机离子(k
+
、na
+
、ca
2+
、mg
2+
、cu
2+
、cl-、br-、s2o
32-、so
42-),活性氧(clo-、h2o2),活性氮(no
2-、no),氨基酸(lys、phe、met、thr、ile、val),生物硫醇(cys、hcy、gsh)的荧光响应情况。从图5可以看出,只有h2s能引起荧光光谱的明显增强,其他检测物对探针的荧光光谱没有明显的影响。这些结果表明,荧光探针对h2s有良好的选择性。
[0040]
实施例6:
[0041]
溶液ph值对荧光探针测定h2s的荧光性质的影响
[0042]
考察ph值对荧光探针测定h2s的荧光光谱的影响,其结果如图6。我们研究的ph范围为3.0~12.0,荧光探针的浓度为10μm,h2s的浓度为50μm。从图中可以看出,荧光探针随着ph的变化,荧光强度基本不变,说明ph对探针本身没有影响。然而,加入h2s之后,在ph在5.0~8.0范围内,荧光强度比值显著增强。综上所述,当ph值在5.0到8.0之间时,不影响荧光探针对h2s的测定,是比较合适的ph值范围,这非常有利于该探针用于实际样品中h2s的测定。
[0043]
实施例7:
[0044]
荧光探针与h2s作用的响应时间的测定
[0045]
我们研究了荧光探针对h2s的响应时间,其结果如图7。从图中可以看出,该探针对h2s的响应时间为3min,这能够满足在实际样品中进行实时监测的要求。从图7还可以看出,荧光强度达到最大值后,在之后的时间里,荧光强度不再发生变化,这表明此荧光探针光稳定性较好。
[0046]
实施例8:
[0047]
荧光探针在活细胞中的应用
[0048]
首先,我们做了细胞毒性实验,如图8所示。当加入0~30μm探针,肝癌细胞hepg2的存活率在90%以上。这说明该荧光探针毒性较小,可应用于检测活细胞内的h2s。然后,我们研究荧光探针在活细胞中的应用,选择肝癌细胞hepg2进行共聚焦显微成像,结果如图9(a)所示。在对照组细胞中,几乎没有观察到荧光。细胞用探针孵育后,观察到荧光增强。当在细胞中加入nahs后,再加入探针,观察到荧光明显增强。而在细胞中加入h2s清除剂nem后再加入探针,发现细胞内的荧光几乎消失。图9(b)为相对荧光强度图。这些结果说明该探针可以高灵敏性的检测细胞内的h2s。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1