一种马氏珠母贝肉抗光老化多肽及其制备方法与应用
1.本发明属于生物医药技术领域,具体涉及一种具有显著抗光老化活性的马氏珠母贝肉多肽及其制备方法和应用。
背景技术:
2.马氏珠母贝是生产珍珠的主要母贝,属重要的海水养殖贝类,广泛分布于我国东南沿海一带。研究发现,马氏珠母贝肉肽具有抗氧化、抗肿瘤、降血糖、降血脂、免疫调节、延缓衰老等多种功效,但在抗光老化方面的研究与应用报道较少。马氏珠母贝的主要经济价值来源于珍珠,而贝肉主要用作饲料,经济附加值低。因此,对马氏珠母贝肉进行酶解,可拓宽其应用领域,有利于马氏珠母贝的进一步开发利用。
3.皮肤光老化是指自然界中的日光或人工来源的紫外线辐射对皮肤造成损伤并使其老化的过程,能够诱发表皮的角质化和真皮层的老化,并且降低皮肤胶原蛋白的合成,引起皮肤真皮层变薄,弹性变差,临床症状包括皱纹、色素沉着、弹性降低、毛细血管扩张和紫癜区。
4.目前,在已研究的抗皮肤光老化的活性物质中,已经有相当多的报道证明天然植物提取物中黄酮类和多酚类等天然产物拥有较好的抗氧化、抗光老化活性;动物源抗光老化活性物质主要有胶原蛋白和胶原蛋白肽、弹性蛋白和弹性蛋白肽;也有大量的研究证明生长因子和细胞因子对皮肤光老化有显著改善作用。
5.现有技术中,cn 113481271 a公开了一种可有效减轻皮肤晒伤的海洋生物活性肽及其制备方法和应用,通过中性蛋白酶酶解扇贝,并通过超滤以及葡聚糖凝胶分离,收集洗脱组分,通过细胞和动物实验研究活性肽对皮肤光老化的影响;
6.cn113337565a公开了一种具有显著皮肤晒伤防护作用的海洋生物活性肽及其制备方法和应用,通过胰蛋白酶酶解扇贝,并通过超滤以及葡聚糖凝胶分离,收集洗脱组分,并测定各分离组分对uvb照射hacat细胞活性的影响,但在现有技术中,通过胰蛋白酶、中性蛋白酶等酶解得到的活性肽生物利用率低,其原因为通过胰蛋白酶、中性蛋白酶等酶解得到的活性肽在胃肠道环境中蛋白结构改变,降低生物利用率,而通过前期研究发现体外模拟胃肠酶解能够提高活性多肽的生物利用率,进而更有利于其在体内外发挥抗光老化作用,并且通过胃肠酶解马氏珠母贝肉得到的活性肽在抗光老化活性方面还缺少更多的研究。
技术实现要素:
7.为了克服现有技术存在的不足,本发明的目的是提供一种具有显著抗光老化活性的马氏珠母贝肉多肽及其制备方法与应用。
8.本发明采用体外模拟胃肠酶解、超滤以及葡聚糖凝胶g-25分离制备得到马氏珠母贝肉抗光老化多肽。该方法简单、成本低廉、绿色环保,适用于大批量工业生产,能提高马氏珠母贝肉的深加工技术,拓宽马氏珠母贝肉的应用范围。
9.本发明的目的之一在于提供一种马氏珠母贝肉抗光老化多肽,所述马氏珠母贝肉抗光老化多肽的蛋白质含量为75-93%,分子量为200-3000da、氨基酸含量为11-25%(甘氨酸与丙氨酸),弹性蛋白酶抑制率ic
50
值为0.2-0.5mg/ml,生物利用率为60-83%。
10.进一步的,所述马氏珠母贝肉抗光老化多肽的蛋白质含量为80-91%,分子量为220-2000da、氨基酸含量为10-23%(甘氨酸与丙氨酸),弹性蛋白酶抑制率ic
50
值为0.21-0.40mg/ml,生物利用率为65-80%。
11.更进一步的,所述马氏珠母贝肉抗光老化多肽的蛋白含量为85-90%,分子量为250-1000da、氨基酸含量为9-20%(甘氨酸与丙氨酸),弹性蛋白酶抑制率ic
50
值为0.22-0.35mg/ml,生物利用率为67-71%。
12.本发明的另一个目的在于提供一种马氏珠母贝肉抗光老化多肽的制备方法,包括以下步骤:
13.将水加入马氏珠母贝肉中混合稀释,体外模拟胃肠消化酶解,酶解液经过超滤分离、g-25葡聚糖凝胶分离得到马氏珠母贝肉肽。
14.具体的,所述马氏珠母贝肉抗光老化多肽的制备方法,包括以下步骤:
15.(1)体外模拟胃肠消化酶解:将马氏珠母贝肉进行预处理,加入蒸馏水与马氏珠母贝肉混合,调整ph值,加入蛋白酶1进行酶解后得到混合液1;调整混合液1的ph值,加入蛋白酶2进行酶解后到混合液2;将混合液2沸水浴灭酶,离心,取上清液。
16.(2)超滤分离:将步骤(1)所得上清液超滤后通过不同截留分子量的超滤膜超滤,收集不同分子量范围的截留液和透过液,并进行浓缩与冻干。
17.(3)葡聚糖凝胶柱分离:将步骤(2)所述抗光老化活性最佳的组分,经过葡聚糖凝胶g-25分离,收集各个洗脱峰组分,冻干制得马氏珠母贝肉肽。
18.优选的,步骤(1)中,所述马氏珠母贝肉的预处理为:将新鲜马氏珠母贝去壳,取软体部位,清洗,沥干水分后匀浆。
19.进一步优选的,步骤(1)中,所述混合液1中料液比为1:2-1:4(w/v),ph值为2.0-4.0,蛋白酶1为胃蛋白酶,酶的添加量为300-1000u/(g原料),酶解温度为37℃,酶解时间为2-4h;所述混合液2的ph值为7.0-8.0,蛋白酶2为胰蛋白酶和胰凝乳蛋白酶,酶的添加量分别为50-400u/(g原料)和40-150u/(g原料),酶解温度为37℃,酶解时间为2-4h;
20.以及,所述沸水浴灭酶时间为10-15min;所述离心的转速为6000-12000r/min,离心时间为10-20min。
21.优选的,步骤(2)中,所述超滤分离的截留分子量为10kda、5kda和3kda,收集不同分子量大小范围的截留液和透过液,分别得到》10kda、5kda-10kda、3kda-5kda和《3kda的活性肽组分。
22.优选的,步骤(3)中,所述葡聚糖凝胶柱分离纯化的葡聚糖凝胶为g-25,流动相为蒸馏水,分离纯化样品为由超滤分离所得抗光老化活性最好的组分,上样浓度为20-25mg/ml,上样体积为4-6ml,流速为1.0-1.2ml/min,收集时间为4-5min/管,收集各个洗脱峰组分,冻干制得马氏珠母贝肉抗光老化多肽。
23.需要说明的是,上述工艺步骤中,胃蛋白酶添加量与酶解时间为关键工艺参数,在上述规定酶添加量范围内,胃蛋白酶添加量越高,活性肽的活性越好;并随着酶解时间增长至4h,其所制备出活性肽的抗光老化活性逐渐升高。
24.本发明还请求保护以上所述的一种马氏珠母贝肉抗光老化多肽在制备抗光老化型功能食品中的应用。
25.与现有技术相比,本发明公开提供的一种马氏珠母贝肉抗光老化多肽及其制备方法与应用,具有如下优点和有益效果:
26.(1)本发明采用模拟胃肠消化酶解制备马氏珠母贝肉肽,通过超滤、葡聚糖凝胶g-25分离纯化得到活性肽,操作简便,条件温和,无污染,可使活性肽显著富集。
27.(2)本发明所制备的马氏珠母贝肉肽能够有效抑制弹性蛋白酶,显著提高uvb辐射后人永生化表皮细胞hacat的存活率和降低白细胞介素il-6和基质金属蛋白酶mmp-3的水平,具有显著的抗光老化活性,且生物利用率大大提高。
附图说明
28.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
29.图1为本发明实施例1、2、3及对比例1、2制备的马氏珠母贝肉肽的生物利用率图,不同字母代表在p《0.05水平上具有显著性差异。
30.图2为本发明实施例1、2、3制备的马氏珠母贝肉肽的弹性蛋白酶抑制活性图,不同字母代表在p《0.05水平上具有显著性差异。
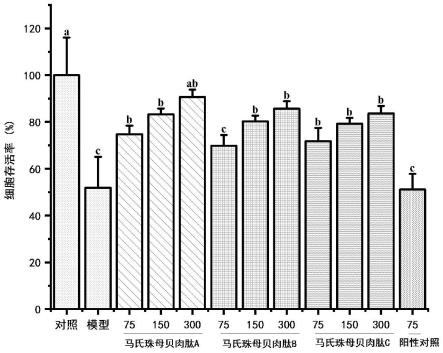
31.图3为本发明实施例1、2、3制备的马氏珠母贝肉肽对uvb辐射后hacat细胞存活率的影响结果图,不同字母代表在p《0.05水平上具有显著性差异。
32.图4为本发明实施例1、2、3制备的马氏珠母贝肉肽对uvb辐射后hacat细胞mmp-3含量的影响结果图,不同字母代表在p《0.05水平上具有显著性差异。
33.图5为本发明实施例1、2、3制备的马氏珠母贝肉肽对uvb辐射后hacat细胞il-6含量的影响结果图,不同字母代表在p《0.05水平上具有显著性差异。
具体实施方式
34.下面将结合本发明实施例及说明书附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
36.实施例1
37.一种马氏珠母贝肉抗光老化多肽,其制备方法如下:
38.(1)原料预处理:将新鲜马氏珠母贝去壳,取软体部位,清洗,沥干水分后匀浆,分装后-20℃保存备用。
39.(2)体外模拟胃肠消化酶解:将步骤(1)所述贝肉按照料液比1:2(w/v)加入蒸馏水
稀释混匀,以1000u/(g原料)的添加量加入胃蛋白酶,酶解温度为37℃,酶解ph值为3.0,酶解时间为4h,得到混合液1;再按照300u/(g原料)、75u/(g原料)的添加量在混合液1中分别加入胰蛋白酶和胰凝乳蛋白酶,酶解温度为37℃,酶解ph值为7.0,酶解时间为4h;沸水浴灭酶10min,8000r/min离心20min,取上清液;
40.(3)超滤分离:将步骤(2)所述上清液抽滤后依次通过截留分子量为10kda、5kda和3kda的超滤膜超滤,收集不同分子量范围的截留液和透过液,并进行浓缩以及冻干,以弹性蛋白酶抑制率为筛选指标,得到抗光老化活性最佳的组分。
41.(4)葡聚糖凝胶柱分离:将步骤(3)所述抗光老化活性最佳组分通过葡聚糖凝胶柱g-25(2.6
×
50cm)分离,洗脱的流动相为蒸馏水,上样的浓度为25mg/ml,上样体积为5ml,洗脱流速为1.2ml/min,收集时间为4min/管,共收集110管,检测波长为220nm,收集第二个洗脱组分,并浓缩冻干,即得所述具有显著抗光老化活性的马氏珠母贝肉肽(标记为马氏珠母贝肉肽a)。
42.实施例2
43.一种马氏珠母贝肉抗光老化多肽,其制备方法如下:
44.(1)原料预处理:将新鲜马氏珠母贝去壳,取软体部位,清洗,沥干水分后匀浆,分装后-20℃保存备用。
45.(2)体外模拟胃肠消化酶解:将步骤(1)所述贝肉按照料液比1:3(w/v)加入蒸馏水稀释混匀,以300u/(g原料)的添加量加入胃蛋白酶,酶解温度为37℃,酶解ph值为2.0,酶解时间为3h,得到混合液1;再按照400u/(g原料)、150u/(g原料)的添加量在混合液1中分别加入胰蛋白酶和胰凝乳蛋白酶,酶解温度为37℃,酶解ph值为7.5,酶解时间为3h;沸水浴灭酶10min,6000r/min离心20min,取上清液;
46.(3)超滤分离:将步骤(2)所述上清液抽滤后依次通过截留分子量为10kda、5kda和3kda的超滤膜超滤,收集不同分子量范围的截留液和透过液,并进行浓缩以及冻干,以弹性蛋白酶抑制率为筛选指标,得到抗光老化活性最佳的组分。
47.(4)葡聚糖凝胶柱分离:将步骤(3)所述抗光老化活性最佳组分通过葡聚糖凝胶柱g-25(2.6
×
50cm)分离,洗脱的流动相为蒸馏水,上样的浓度为20mg/ml,上样体积为4ml,洗脱流速为1.0ml/min,收集时间为4min/管,共收集110管,检测波长为220nm,收集第二个洗脱组分,并浓缩冻干,即得所述具有显著抗光老化活性的马氏珠母贝肉肽(标记为马氏珠母贝肉肽b)。
48.实施例3
49.一种马氏珠母贝肉抗光老化多肽,其制备方法如下:
50.(1)原料预处理:将新鲜马氏珠母贝去壳,取软体部位,清洗,沥干水分后匀浆,分装后-20℃保存备用。
51.(2)体外模拟胃肠消化酶解:将步骤(1)所述贝肉按照料液比1:4(w/v)加入蒸馏水稀释混匀,以500u/(g原料)的添加量加入胃蛋白酶,酶解温度为37℃,酶解ph值为4.0,酶解时间为2h,得到混合液1;再按照50u/(g原料)、40u/(g原料)的添加量在混合液1中分别加入胰蛋白酶和胰凝乳蛋白酶,酶解温度为37℃,酶解ph值为8.0,酶解时间为2h;沸水浴灭酶15min,8000
×
g离心20min,取上清液;
52.(3)超滤分离:将步骤(2)所述上清液抽滤后依次通过截留分子量为10kda、5kda和
3kda的超滤膜超滤,收集不同分子量范围的截留液和透过液,并进行浓缩以及冻干,以弹性蛋白酶抑制率为筛选指标,得到抗光老化活性最佳的组分。
53.(4)葡聚糖凝胶柱分离:将步骤(3)所述抗光老化活性最佳组分通过葡聚糖凝胶柱g-25(2.6
×
50cm)分离,洗脱的流动相为蒸馏水,上样的浓度为25mg/ml,上样体积为6ml,洗脱流速为1.2ml/min,收集时间为5min/管,共收集110管,检测波长为220nm,收集第二个洗脱组分,并浓缩冻干,即得所述具有显著抗光老化活性的马氏珠母贝肉肽(标记为马氏珠母贝肉肽c)。
54.对比例1
55.一种马氏珠母贝肉肽,其制备方法如下:
56.(1)原料预处理:将新鲜马氏珠母贝去壳,取软体部位,清洗,沥干水分后匀浆,分装后-20℃保存备用。
57.(2)马氏珠母贝肉酶解:将步骤(1)所述贝肉按照料液比1:2(w/v)加入蒸馏水稀释混匀,以500u/(g原料)的添加量加入木瓜蛋白酶,酶解温度为55℃,酶解ph值为7.0,酶解时间为2h,沸水浴灭酶10min,8000r/min离心20min,取上清液。
58.(3)超滤分离:将步骤(2)所述上清液抽滤后依次通过截留分子量为10kda、5kda和3kda的超滤膜超滤,收集不同分子量范围的截留液和透过液,并进行浓缩以及冻干,以弹性蛋白酶抑制率为筛选指标,得到抗光老化活性最佳的组分。
59.(4)葡聚糖凝胶柱分离:将步骤(3)所述抗光老化活性最佳组分通过葡聚糖凝胶柱g-25(2.6
×
50cm)分离,洗脱的流动相为蒸馏水,上样的浓度为25mg/ml,上样体积为5ml,洗脱流速为1.2ml/min,收集时间为4min/管,共收集110管,检测波长为220nm,收集第二个洗脱组分分,并浓缩冻干,即得所述具有显著抗光老化活性的马氏珠母贝肉肽(标记为马氏珠母贝肉肽d)。
60.对比例2
61.一种马氏珠母贝肉肽,其制备方法如下:
62.(1)原料预处理:将新鲜马氏珠母贝去壳,取软体部位,清洗,沥干水分后匀浆,分装后-20℃保存备用。
63.(2)马氏珠母贝肉酶解:将步骤(1)所述贝肉按照料液比1:2(w/v)加入蒸馏水稀释混匀,以500u/(g原料)的添加量加入碱性蛋白酶,酶解温度为55℃,酶解ph值为8.0,酶解时间为2h,沸水浴灭酶10min,8000r/min离心20min,取上清液。
64.(3)超滤分离:将步骤(2)所述上清液抽滤后依次通过截留分子量为10kda、5kda和3kda的超滤膜超滤,收集不同分子量范围的截留液和透过液,并进行浓缩以及冻干,以弹性蛋白酶抑制率为筛选指标,得到抗光老化活性最佳的组分。
65.(4)葡聚糖凝胶柱分离:将步骤(3)所述抗光老化活性最佳组分通过葡聚糖凝胶柱g-25(2.6
×
50cm)分离,洗脱的流动相为蒸馏水,上样的浓度为25mg/ml,上样体积为5ml,洗脱流速为1.2ml/min,收集时间为4min/管,共收集110管,检测波长为220nm,收集第二个洗脱组分,并浓缩冻干,即得所述具有显著抗光老化活性的马氏珠母贝肉肽(标记为马氏珠母贝肉肽e)。
66.效果验证
67.本发明对比了实施例1、2、3与对比例1、2方法制得的马氏珠母贝肉肽a、b、c、d、e的
生物利用率,进一步对比实施例1、2、3方法制得的马氏珠母贝肉肽a、b、c的弹性蛋白酶抑制率、人永生化表皮细胞hacat细胞存活率、白细胞介素il-6和基质金属蛋白酶mmp-3含量以评价体外抗光老化活性。具体实验步骤如下:
68.1、蛋白质含量的测定
69.参照gb 5009.5-2016-蛋白质含量分析:凯氏定氮法测蛋白质含量。
70.2、分子量的测定
71.采用高效体积排阻色谱法(sec)对多肽分子量进行测定。分别以三甘肽(ggg,mw:189da)、氧化型谷胱甘肽(mw:351da)、杆菌酶(mw:1422.69da)、抑肽酶(mw:6511.44da)和细胞色素c(mw:12400da)制作标准曲线;分别用超纯水配制成浓度为1mg/ml的上述不同标准品溶液,样品用超纯水配制成配制浓度为8mg蛋白/ml的溶液,标准溶液和样品溶液经0.22μm孔径的水相滤膜过滤后备用。
72.色谱条件:检测器:岛津rid-10a示差检测器;色谱柱:岛津tskgel g-2000swxl(7.8
×
300mm);流动相:乙腈:0.1%三氟乙酸(tfa)=20:80(v/v);柱温:30
±
1℃;流速:1ml/min;进样量:10μl;检测波长:220nm。以保留时间(rt)为横坐标,标品分子量的对数值(logmw)为纵坐标,对多肽标准品的保留时间及分子量的对数进行线性拟合,制定标准曲线,并采用面积归一化法进行分子量分布计算多肽分子量。
73.3、氨基酸组成的测定
74.样品中总氨基酸组成参照gb 5009.124-2016方法将样品液酸解后采用自动氨基酸分析仪进行分析,色氨酸分析是将样品液碱解后采用自动氨基酸分析仪进行测定。氨基酸检测条件:美国waters高效液相色谱,pico.tag氨基酸分析柱,温度38℃,流速1ml/min,检测波长254nm。
75.4、弹性蛋白酶抑制率的测定
76.将20μl样品与100μl弹性蛋白酶(100mu/ml)在96孔板的孔中混合,37℃孵育20min,加入80μl nsuccinyl-ala-ala-ala-pna(2mmol/l),37℃孵育20min,所有物质均溶于ph 8.0的50mm tris-hcl缓冲液中。每个样品一式三份进行分析。在410nm记录反应产物的吸光度。tris-hcl缓冲液用作空白对照。弹性蛋白酶抑制率计算公式如下:
[0077][0078]
其中,a是反应前对照组的吸光度,而b是指反应后对照组的吸光度,c是反应前样品组的吸光度,而d是反应后样品组的吸光度。
[0079]
5、uvb辐射后hacat细胞存活率的测定
[0080]
hacat细胞以1.5
×
104个/孔接种于96孔细胞培养板后,置于37℃,含有5%co2的恒温培养箱中,用含有10%胎牛血清的完全培养基培养24h,吸弃培养基,对照组和模型组加入基础培养基0.1ml,实验组加入用基础培养基配制的马氏珠母贝肉肽溶液(75、150、300μg/ml)0.1ml,阳性对照组加入用基础培养基配制的谷胱甘肽溶液(75μg/ml)0.1ml,培养6h后,吸弃培养基,pbs清洗一遍,每孔加入0.05ml pbs,模型组和实验组于uvb辐射仪下辐照18mj/cm2。吸弃pbs,用完全培养基继续孵育24h。吸弃培养基,每孔加入0.05ml1
×
mtt溶液,在37℃孵育4h,使mtt还原为甲臜。吸弃培养基,每孔加入0.15ml dmso使甲臜溶解,用平板摇床摇匀。采用酶标仪在570nm波长处检测每孔的吸光度,计算不同浓度与对照组吸光度的
比值,根据细胞活力值来判断药物对uvb辐射后hacat细胞存活率的影响。
[0081]
6、uvb辐射后hacat细胞il-6和mmp-3含量的测定
[0082]
hacat细胞以4.5
×
105个/孔接种于6孔细胞培养板后,置于37℃,含有5%co2的恒温培养箱中,用含有10%胎牛血清的完全培养基培养24h,吸弃培养基,对照组和模型组加入基础培养基2ml,阳性对照组加入用基础培养基配制的谷胱甘肽溶液(75μg/ml)2ml,实验组加入用基础培养基配制的马氏珠母贝肉肽溶液(75、150和300μg/ml)2ml。培养6h后,吸弃培养基,pbs清洗一遍,每孔加入1.5ml pbs,模型组、阳性对照组和实验组于uvb辐射仪下辐照18mj/cm2。吸弃pbs,用完全培养基继续孵育24h。收集上清液测定il-6和mmp-3的含量。il-6和mmp-3的测定采用elisa试剂盒。
[0083]
如图1所示,通过体外模拟胃肠道消化获得的马氏珠母贝肉肽a、b、c较于通过木瓜蛋白酶及碱性蛋白酶获得的马氏珠母贝肉肽d、e具有更高的生物利用率,因此选择体外模拟胃肠道消化酶解作为马氏珠母贝肉肽的酶解方法。
[0084]
通过本发明实施例1、2、3制得的马氏珠母贝肉肽a、b、c的蛋白含量分别为90
±
1.83%、85
±
3.96%、88
±
0.47%,其中马氏珠母贝肉肽a的蛋白含量最高;马氏珠母贝肉肽a、b、c的分子量大小分别为294.14da、360.57da、550.04da。
[0085]
通过分析本发明实施例1、2、3制得的马氏珠母贝肉肽a、b、c的氨基酸含量结果发现,丙氨酸与甘氨酸的含量较高,共占9-20%,在已有报道中,抗光老化肽的氨基酸组成主要为丙氨酸与甘氨酸等疏水性氨基酸,其中马氏珠母贝肉肽a的丙氨酸与甘氨酸的含量最高,达20%。
[0086]
如图2所示,马氏珠母贝肉肽a、b、c中,马氏珠母贝肉肽a弹性蛋白酶抑制率最佳,其ic
50
值最低,为0.28mg/ml,表明马氏珠母贝肉肽a具有最佳的弹性蛋白酶抑制效果。
[0087]
如图3所示,经uvb辐射后,模型组hacat细胞存活率较正常组显著降低(p<0.05),表明细胞受到了光老化损伤。马氏珠母贝肉肽a、b、c处理后,hacat细胞存活率均显著上升,且存活率高于阳性对照组,且马氏珠母贝肉肽a对hacat细胞保护效果最佳,说明马氏珠母贝肉肽a具有显著抗光老化活性。
[0088]
基质金属蛋白酶(mmps)是一类锌依赖性内肽酶,可降解多种细胞外基质成份。mmp-3可以降解基底膜中的iv型胶原纤维,并部分降解其他胶原纤维,与皮肤光老化密切相关。如图4所示,经uvb辐射后,模型组hacat细胞mmp-3含量较正常组显著升高(p<0.05),表明uvb辐射能够诱导细胞分泌mmp-3,马氏珠母贝肉肽a处理后,hacat细胞mmp-3的分泌量显著下降,说明马氏珠母贝肉肽a能够抑制mmp-3的表达,具有显著抗光老化活性。
[0089]
由紫外引起的皮肤损伤易诱发炎症反应,如图5所示,经uvb辐射后,模型组hacat细胞il-6含量较正常组显著升高(p<0.05),表明辐射后细胞分泌白细胞介素il-6,马氏珠母贝肉肽a处理后,hacat细胞il-6分泌量显著下降,说明马氏珠母贝肉肽a具有显著抗光老化活性。
[0090]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
[0091]
以及,对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所
定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1