一种肺炎克雷伯菌的重组蛋白MrkD及其作为疫苗抗原的应用
一种肺炎克雷伯菌的重组蛋白mrkd及其作为疫苗抗原的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种肺炎克雷伯菌的重组蛋白mrkd及其作为疫苗抗原的应用。
背景技术:
2.肺炎克雷伯杆菌(klebsiella pneumoniae,kp)常定植于人体肠道和呼吸道,是临床上常见的条件致病菌之一(martin rm,bachman ma.front cell infect microbiol,2018),其可在全身各部位导致感染发生,常见于老年患者、营养不良、慢性酒精中毒、慢性疾病和全身衰竭的患者,可引起肺炎、尿路感染、脑膜炎、全身败血症等全身或局部感染,严重时危及患者生命安全(akova m,daikos gl,tzouvelekis l,et al.clin microbiol infect,2012)。近年来,耐碳青霉烯类肺炎克雷伯菌(crkp)在临床上检出率逐年增加,因其超强的耐药性和致病性被称为“超级细菌之王”,给临床治疗制造巨大的阻碍,因此也成为目前研究关注的热点(munoz-price ls,poirel l,bonomo ra,et al.lancet infect dis,2013)(hu f,zhu d,wang f.et al.clin infect dis,2018)。有研究表明,对碳青霉烯类抗菌药物敏感的kp感染致死率为20%~30%,而crkp感染致死率可达40%~70%(iredell j,brown j,tagg k.mechanisms and clinical implications.bmj.2016)(nordmann p,cuzon g,naas t.lancet infect dis.2009),严重威胁人类健康,考虑到其日益严峻的耐药形势,研发新的防治手段迫在眉睫。疫苗接种能有效保护机体免受细菌侵害,并且不受抗生素耐药机制的影响,是一种非常有潜力的防治手段。
3.肺炎克雷伯菌的灭活疫苗由于安全性有限,当前没有获批上市的相关药物产品。随着免疫学、分子生物学、纳米科学等学科的不断发展,细菌疫苗的类型、组成都发生了很大变化,出现了多糖疫苗、多糖结合疫苗、蛋白疫苗、纳米疫苗等新型疫苗(hackett rj,marcus s.infect immun,1970)。全菌及灭活疫苗发挥作用的组分较为复杂且安全性较低,单纯的多糖组分免疫原性较差,可通过与其他组分如载体蛋白结合来提高免疫效果。重组亚单位疫苗是很有前景的疫苗类型。
技术实现要素:
4.本发明通过反向疫苗学的方法,对肺炎克雷伯菌全基因组进行分析,筛选出潜在的抗原决定簇,对其进行高通量的克隆、表达、纯化,并在动物体内进行保护性评价,从而筛选出了150多种具有保护性的候选抗原,并对其中42种候选抗原进行动物体内保护性评价,从而筛选出了一系列具有保护性的候选抗原。其中,筛选出mrkd蛋白为菌毛粘附蛋白,与细菌毒力相关,研究结果表明:mrkd基因阳性率为94%,与其他测试基因rmpa、irp-1和maga基因相比更丰富(ahmadi m et al.,expert rev anti infect ther.2022)。将上述mrkd抗原蛋白表达纯化后与氢氧化铝作为佐剂制备疫苗,免疫balb/c小鼠,在多次动物攻毒保护实验中疫苗保护率在50%左右,体现出较好的保护效果,同时,能够诱导高效的体液免疫应答,可作为有效的疫苗候选抗原组分。
5.为解决上述技术问题,本发明提供了一种用作肺炎克雷伯菌抗原的重组蛋白mrkd,其氨基酸酸序列为seq id no:2。
6.本发明还提供了上述的重组蛋白mrkd的编码基因,其核苷酸序列为seq id no:1。
7.本发明进一步提供了一种表达载体,其包含骨架质粒和上述的编码基因。
8.在根据本发明的一个实施方案中,所述编码基因的一端连接蛋白纯化标签的编码序列;所述蛋白纯化标签选自his、gst、mbp、nusa或sumo中的任一种;优选为组氨酸标签(his)。通过在蛋白两端引入his标签序列以方便后续产业化纯化。
9.在根据本发明的一个实施方案中,所述骨架质粒选自pgex系列载体、pet系列载体或pqe系列载体中的任一种;优选为pet30a质粒。采用原核表达质粒pet30a来构建重组表达质粒,该载体具有卡那霉素抗性,可用于阳性克隆的筛选。
10.在根据本发明的一个实施方案中,核苷酸序列为seq id no:3。
11.本发明进一步提供了一种重组工程菌,其含有上述的表达载体。
12.在根据本发明的一个实施方案中,宿主菌为大肠杆菌xl1-blue菌株、bl21系列菌株或hms174系列菌株,优选为大肠杆菌bl21菌株。
13.本发明还提供一种用作肺炎克雷伯菌抗原的重组蛋白mrkd的纯化方法。主要技术方案是:收集表达该重组蛋白的基因工程菌;按照高压破菌、离心;离子交换;酶切的顺序组合对重组蛋白进行纯化。该方法工艺简单,所获得目标蛋白纯度高,容易放大、重复性好,回收率较好。
14.本发明的再一方面提供了上述的重组蛋白mrkd在制备用于诊断、预防或治疗肺炎克雷伯菌感染的制剂中的应用;优选地,所述制剂还包含药学上可接受的佐剂,更优选地,所述佐剂选自佐剂氢氧化铝佐剂、磷酸铝佐剂、单硬脂酸铝佐剂、mf59、完全弗氏佐剂、不完全弗氏佐剂和分枝杆菌卡介苗佐剂中的任一种。
15.本发明还进一步提供了一种用于预防或治疗肺炎克雷伯菌感染的亚单位疫苗,其含有上述的重组蛋白mrkd;优选地,还包含药学上可接受的佐剂,更优选地,所述佐剂选自佐剂氢氧化铝佐剂、磷酸铝佐剂、单硬脂酸铝佐剂、mf59、完全弗氏佐剂、不完全弗氏佐剂和分枝杆菌卡介苗佐剂中的任一种。
16.本发明的上述技术方案的有益效果如下:
17.1)重组蛋白mrkd表达质粒在大肠杆菌bl21菌株中诱导表达。
18.2)选择pet30a载体时,重组蛋白以融合蛋白形式表达;所表达的重组蛋白c端含有一个组氨酸标签,使得纯化条件简单,从而纯化后的蛋白能最大限度保持其空间构象和免疫原性;纯化出来的重组蛋白纯度大于90%。
19.3)利用本发明重组蛋白mrkd制备的疫苗可通过皮下(肌肉)注射途径进行免疫接种,激发机体产生高滴度igg抗体。并经动物实验证实,所述基因工程重组蛋白疫苗具有良好的抗kp感染的免疫保护效果。为进一步的联合疫苗和多亚单位疫苗研究打下基础,同时为防治疫苗和诊断试剂盒的研制及应用具有重要的作用。
附图说明
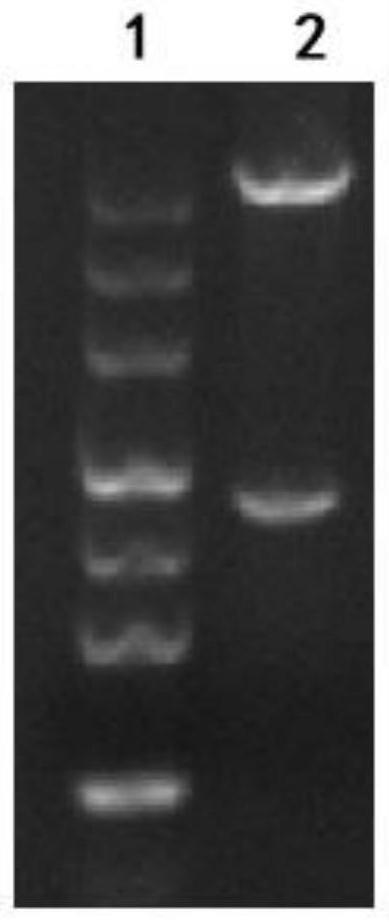
20.图1:重组质粒pet30a-mrkd的双酶切鉴定结果图;其中,
21.泳道1:核酸(dna)分子量标准(marker),从上到下大小分别为:4500、3000、2000、
1200、800、500、200bp;泳道2:重组表达质粒pet30a-mrkd经酶切后的鉴定结果,酶切后分离的片段约5400bp和约930bp。
22.图2:重组抗原蛋白mrkd诱导表达sds-page电泳鉴定结果图;其中,
23.泳道1:蛋白分子量标准(marker),从上到下大小分别为:170、130、100、70、55、40、35、25、15、10kda;
24.泳道2:破菌沉淀;泳道3:破菌上清。
25.图3:重组抗原蛋白mrkd纯化后sds-page电泳结果图;其中,
26.泳道1:蛋白分子量标准(marker),从上到下大小分别为:170、130、100、70、55、40、35、25、15、10kda;
27.泳道2:ni sepharose hp亲和填料洗脱原液。
具体实施方式
28.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
29.本发明所使用的菌株与各种试剂如下:
30.质粒pgex-6p-1购自ge healthcare公司;
31.大肠杆菌菌株bl21购自上海超研生物科技有限公司;
32.肺炎克雷伯菌国际标准株700721,购自atcc;
33.质粒pet30a,大肠杆菌菌株bl21购自上海超研生物科技有限公司;
34.dna marker、限制性内切酶nde i和xho i、蛋白marker购自大连takara公司;
35.质粒提取试剂盒和凝胶回收试剂盒购自美国omega公司。
36.na2hpo4·
12h20、nah2po4·
2h20、nacl、naoh、tween-20、nahco3,na2co3购自国药集团化学试剂有限公司;
37.hrp标记的羊抗小鼠igg、igg1、igg2a抗体购自北京中杉金桥生物技术有限公司;
38.tryptone、yeast extract均购自英国oxoid公司;
39.kanamycin购自太极集团西南药业;琼脂粉、iptg购自生工生物工程(上海)股份有限公司;
40.al(oh)3购自brenntage公司;
41.硫酸、盐酸购自成都科龙化工试剂厂;
42.牛血清白蛋白v购自biosharp公司;
43.异氟烷购自深圳市瑞沃德生命科技有限公司。
44.实施例1:重组抗原蛋白mrkd基因的合成、克隆及鉴定
45.1.编码重组抗原蛋白mrkd的dna序列(seq id no:1)合成和该序列与pet30a的连接由上海生工生物工程有限公司合成。
46.2.重组质粒的转化:
47.从-80℃冰箱取1管大肠杆菌bl21感受态细胞,加入1μl合成的pet30a-mrkd质粒。冰浴50min,42℃金属浴中热击90s,迅速冰浴2min。加入600μl lb培养基,混匀,置于37℃摇床中220rpm振摇1h。取100μl涂布于,kana抗性lb固体培养基平板。平板倒置于37℃培养箱中培养16h。挑取单克隆,接种于含有kana抗性的lb液体培养基中,37℃振荡培养过夜。
48.3.pet30a-mrkd阳性重组质粒的双酶切鉴定
49.取37℃摇床培养过夜的菌液,参照质粒提取试剂盒说明书抽提质粒,使用ndeⅰ和xhoⅰ进行双酶切,37℃酶切2h,酶切反应体系如下:
[0050][0051]
1%的琼脂糖凝胶电泳检测双酶切结果,结果如图1所示,发现阳性克隆的质粒被切成2个片段,大片段约5400bp为表达载体pet30a部分,小片段约930bp,为插入的编码抗原mrkd的dna片段。
[0052]
其中:
[0053]
kanamycin溶液的配制:
[0054]
取kanamycin 500mg加入5ml i级水溶解完全,0.22μm无菌过滤器过滤。
[0055]
kana抗性lb固体培养基的配制:取tryptone 1g,yeast extract 0.5g,nacl 1g,琼脂粉1.5g,加i级水100ml溶解完全,调ph值至7.4,高压灭菌冷却至40℃左右加入0.1ml kanamycin溶液,依次取约10ml倒入无菌培养皿中,冷却后4℃保存。
[0056]
kana抗性lb液体培养基的配制:
[0057]
取tryptone 1g,yeast extract 0.5g,nacl 1g加i级水100ml溶解完全,调ph值至7.4,高压灭菌冷却至40℃左右加入0.1ml kanamycin溶液。
[0058]
实施例2:重组抗原蛋白mrkd在大肠杆菌中诱导表达及表达形式的鉴定
[0059]
1.重组蛋白mrkd的诱导表达
[0060]
取过夜培养的pet30a-mrkd/bl21菌液100μl加入10ml kana抗性的lb液体培养基中,200rpm 37℃培养5h,培养至od600为0.8~1.0时,加入iptg 2μl(iptg溶液的配制:取2.38g iptg溶于10ml i级水溶解完全,0.22μm无菌过滤器过滤),使其终浓度为200μm,再置于摇床30℃诱导表达5h。
[0061]
将诱导表达后的菌液取出,以12000rpm离心5min,弃去上清,加入1ml 20mm pbs,ph7.5(20mm pbs配制:取na2hpo4·
12h20 6.02g,nah2po4·
2h20 0.49g,8.77g nacl,加i级水900ml溶解完全,调ph值至7.5,加i级水定容至1l)混匀,超声裂解3min,再4℃14000rpm离心15min,分离上清和沉淀。
[0062]
2.sds-page电泳鉴定
[0063]
将5%浓缩胶灌入制胶版中,在加入蒸馏水将胶压平,室温放置30min使其凝固,将上层的蒸馏水倒干,再灌入10%分离胶,立即插上梳子,室温放置30min使其凝固备用。将处
理好的上清和沉淀分别取40μl加入10μl蛋白上样缓冲液(5x)混匀,100℃加热5~10min,取10μl上样,进行sds-page电泳。电压先80v电泳30min,再调至180v,电泳1~2h后,将胶取出,置于考马斯亮蓝染色液中振荡染色,再置于脱色液中振荡脱色后,在呈像系统下观察结果,pet30a-mrkd/bl21菌在30℃下表达的重组抗原蛋白mrkd为可溶性蛋白(图2)。
[0064]
实施例3:重组抗原蛋白mrkd的大规模制备
[0065]
1.大规模培养收获菌体
[0066]
取保存在4℃冰箱中备用的pet30a-mrkd/bl21菌液200μl加入到20ml含kana抗性的lb液体培养基中进行一次活化,200rpm37℃培养5~6h后,取20ml一次活化的菌液加入到2000ml含kana抗性的lb液体培养基中进行二次活化,37℃培养3~4h至od600为1.0时,加入iptg(终浓度为200μm)置于30℃摇床中诱导5h,12000rpm离心15min收集菌体。菌体用30ml 20mm pbs缓冲液重悬,将菌液进行超声裂解10min,再4℃14000rpm离心15min,收集上清用于后续纯化。
[0067]
2.ni sepharose hp亲和层析制备原液
[0068]
取ni sepharose hp亲和填料5ml,用20mm pbs,ph7.5清洗3次后,将准备好的离心上清加入终浓度10mm咪唑混匀后与ni亲和填料混匀,室温垂直旋转结合30min。通过空气重力柱去除未结合上清,先使用20mm pb+0.5m nacl+20mm咪唑,ph 7.5(溶液配制:取na2hpo4
·
12h20 6.02g,nah2po4
·
2h20 0.49g,29.22g nacl,1.36g咪唑,加i级水900ml溶解完全,调ph值至7.5,加i级水定容至1l)清洗亲和填料3次,在使用20mm pbs清洗2次。向清洗后的亲和填料中加入10ml 20mm pbs+300mm咪唑,ph 7.5洗脱液洗脱,收集流穿液,再用上述洗脱液重复洗脱1次,并与上述流穿液合并,即为蛋白原液。
[0069]
3.sds-page电泳
[0070]
将上述破菌上清结合gst填料、酶切后洗脱蛋白原液和酶切后gst填料各取40μl加入10μl蛋白上样缓冲液(5x)混匀,100℃加热5~10min,取10μl上样,进行sds-page电泳。电压先80v电泳30min,再调至180v,电泳1~2h后,将胶取出,置于考马斯亮蓝染色液中振荡染色,再置于脱色液中振荡脱色后,在呈像系统下观察结果,亲和填料纯化后结果如图3,目的蛋白纯度大于90%。
[0071]
实施例4:重组抗原蛋白mrkd动物免疫程序
[0072]
用pbs稀释抗原,加入浓度为1mg/ml的al(oh)3;在0、7和14天用5号半型针头,在双侧大腿肌肉注射免疫balb/c小鼠,每只小鼠注射量为100μl,抗原含量为50μl,空白对照组采用相同体积的pbs免疫。
[0073]
实施例5:重组抗原蛋白mrkd免疫后抗体检测
[0074]
第三次免疫后第7和14天,采集balb/c小鼠的血,用elisa检测小鼠免疫后,igg、igg1、igg2a体液应答水平。
[0075]
1.制备液体
[0076]
(1)包被液的配制:称取na2co
3 1.6g,nahco
3 2.9g,溶于1l ddh2o,用ph计将ph调至9.6;
[0077]
(2)封闭液的配制:1g牛血清
ⅴ
,溶于100ml抗体稀释液(1:100);
[0078]
(3)抗体稀释液的配制:将磷酸盐溶于1l ddh2o,再加入500μl tween 20,再用ph计将ph调至7.4;
[0079]
(4)洗涤液的制备:同抗体稀释液
[0080]
(5)显色液(tmb),为天根公司产品;
[0081]
(6)终止液(2m h2so4)的制备:将22.2ml浓硫酸倾注入177.8ml ddh2o中。
[0082]
2.elisa检测重组蛋白免疫小鼠产生的抗体效价
[0083]
1)用包被液将纯化后的mrkd重组蛋白稀释为:1ug/ml、5ug/ml;
[0084]
2)包被:将重组蛋白稀释液加入酶标板,100μl/孔,4℃过夜后用洗涤液洗涤3遍,空干后用保鲜膜包上,置于4℃冰箱中备用;
[0085]
3)封闭:酶标板加封闭液200μl/孔,置于37℃孵育箱中2小时,洗涤3遍;
[0086]
4)将血清进行1:1000、1:2000、1:4000、1:8000等倍比稀释;
[0087]
5)取封闭好的酶标板,依次加入稀释血清,100μl/孔,置于37℃孵育箱1h,洗涤3遍,空干;
[0088]
6)将加hrp标记的羊抗小鼠igg、igg1、igg2a抗体保存液,稀释1:5000,制成抗体工作液;
[0089]
7)加入稀释抗体工作液,100μl/孔,置于37℃孵育箱40min,洗涤三遍,空干;
[0090]
8)加入底物显色液(tmb)100μl/孔,室温避光反应5min;
[0091]
9)加入终止液(2m h2so4),立即置于酶标仪上以450nm波长处测定od值;
[0092]
10)结果判断:a
样品
/a
阴性
值≧2.1为阳性(阴性对照为小鼠免疫前血清1:1000倍稀释)。
[0093]
结果:检测重组蛋白mrkd抗原免疫小鼠产生的抗体igg、igg1、igg2a效价分别达到1:256000,1:128000,1:64000;免疫后第7天的抗体阳性率达到100%,说明本发明构建的重组蛋白能够使免疫小鼠体内产生抗体。
[0094]
实施例6:重组抗原蛋白mrkd免疫后攻毒保护效果评价
[0095]
末次免疫后14天,用生理盐水将培养的肺炎克雷伯菌标准株700721菌液调节浓度至1.5
×
109cfu/ml,用异氟烷麻醉小鼠后采用滴鼻的方式感染,每只小鼠感染量为20μl,采用同样剂量的生理盐水(ns)作为空白对照。感染结束后每隔1天观察小鼠死亡情况,观察周期为7天,观察期结束后剩余动物以co2吸入法安乐处死。统计各组小鼠的存活率,结果如下表1。
[0096]
表1重组抗原蛋白mrkd免疫小鼠后的攻毒保护效果
[0097][0098]
表1显示:空白对照组的平均免疫保护率为10%,重组抗原蛋白mrkd加al(oh)3佐剂组的平均免疫保护率为50%。综上,本发明的重组抗原蛋白mrkd不仅具有良好的免疫原性,能够诱导机体产生体液免疫应答,而且能够对肺炎克雷伯菌标准株700721的感染起到良好的保护效果,可作为有效的疫苗候选抗原成分制备亚单位疫苗用于预防肺炎克雷伯菌
的感染。
[0099]
以上所述仅为本发明的较佳实施例,并非用来限定本发明的实施范围;如果不脱离本发明的精神和范围,对本发明进行修改或者等同替换,均应涵盖在本发明权利要求的保护范围当中。
[0100]
本领域技术人员可以将本发明重组蛋白mrkd用于其他任何适用的用途。
[0101]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1