一种接骨木多糖及其多糖组合物与应用
1.本发明涉及多糖结构和功能技术领域,具体涉及一种接骨木多糖及其多糖组合物与应用。
背景技术:
2.多糖(又叫多聚糖)是由多个单糖通过糖苷键组成的一类天然高分子生物聚合物。近年来,植物、动物和微生物多糖因作为生物活性成分和食品添加剂而受到医疗和食品行业的广泛关注,且人们普遍认为,从天然产物中提取的多糖毒性较低,可作为功能性食用品的原料或补充剂,具有抗氧化、抗疲劳、抗肿瘤、调节人体的免疫功能、抗炎和降血脂,以及抑制细胞增殖等功能。尤其是在抗氧化方面可以防止自由基对人体的伤害。越来越多的研究表明,多糖的化学组成和结构特征,包括分子量(mw)、单糖组成、糖苷键、链构象、构象特征等与其生物活性有着密切的关系。
3.接骨木为忍冬科接骨木属植物。研究表明,接骨木是一种食用和药用植物,是抗氧化剂的潜在来源,作为健康的膳食补充剂用于果酱、酸奶的制备中;也可用于治疗与感冒、发烧、咳嗽等和流感有关的常见症状。多糖是接骨木的重要活性物质之一,其总糖含量在接骨木果实中占7.86~11.50%。接骨木果实产量较大,提取其中的多糖,对其结构及抗氧化活性进行研究,并开发成为一种天然抗氧化剂应用于食品、药品及化妆品行业将具有广阔的市场前景。但目前从接骨木果实中提取多糖却鲜有报道;而且,对接骨木多糖的化学组成和结构特征的研究更是未见报道。
4.另外,多糖虽然具有广泛的生理活性,但单一种类多糖的功效有限,将多种多糖复合形成多糖组合物是当前多糖领域研究的热点。因此,以接骨木多糖为基础,开发新的多糖组合物,对于接骨木资源的深度利用具有十分重要的意义。
技术实现要素:
5.针对上述现有技术,本发明的目的是提供一种接骨木多糖及其多糖组合物与应用。本发明首先以接骨木果实为原料,从中提取纯化得到接骨木多糖,并对接骨木多糖的结构组成进行了解析。然后以接骨木多糖为基础,与黑枣多糖进行复配,得到多糖组合物;所述多糖组合物在抗氧化损伤方面具有显著的协同增效作用。
6.为实现上述目的,本发明采用如下技术方案:
7.本发明的第一方面,提供一种接骨木多糖,所述接骨木多糖为efp-0、efp-1、efp-2、efp-3和efp-4中的一种或多种;
8.其中,efp-0、efp-1是中性多糖,efp-2、efp-3和efp-4是酸性多糖;efp-0、efp-1、efp-2、efp-3和efp-4的分子量分别为:4.0995
×
105、1.7981
×
106、7.0523
×
106、7.7638
×
106、4.3855
×
105、7.3173
×
105da。
9.efp-0单糖组成包括阿拉伯糖、岩藻糖、葡萄糖、半乳糖、甘露糖、盐酸氨基葡萄糖,摩尔比为47.70:17.60:15.00:14.10:4.10:1.50;
10.efp-1单糖组成包括阿拉伯糖、半乳糖、葡萄糖、盐酸氨基葡萄糖、甘露糖,摩尔比为55.00:22.30:16.30:4.00:2.40;
11.efp-2单糖组成包括阿拉伯糖、半乳糖、葡萄糖、半乳糖醛酸、甘露糖和盐酸氨基葡萄糖,摩尔比为41.40:24.80:18.00:6.90:6.60:2.30;
12.efp-3单糖组成包括岩藻糖、半乳糖醛酸、阿拉伯糖、葡萄糖、半乳糖、甘露糖和盐酸氨基葡萄糖,摩尔比为24.10:22.70:19.20:15.40:10.10:7.50:1.10;
13.efp-4单糖组成包括半乳糖醛酸、阿拉伯糖、葡萄糖、半乳糖、甘露糖和盐酸氨基葡萄糖,摩尔比为30.60:23.20:19.40:16.10:8.70:2.00。
14.优选的,所述接骨木多糖为efp-2。
15.进一步的,通过核磁共振光谱分析结合单糖组成、甲基化分析对efp-2的糖链结构进行表征。结果确定efp-2是由
→
4)-manp(1
→
4)-β-d-glcp(1
→
和
→
4)-β-d-glcp(1
→
5)-α-l-araf(1
→
两个单元组成。
16.本发明的第二方面,提供一种多糖组合物,所述多糖组合物由接骨木多糖efp-2和黑枣多糖按重量比1:1组成。
17.优选的,所述接骨木多糖efp-2由如下方法制备而成:
18.以接骨木果实为原料,经水提、醇沉、脱脂脱蛋白处理,得到接骨木粗多糖;
19.将接骨木粗多糖采用deae-52柱层析,依次用去离子水和0.1、0.2、0.3、0.4、0.5mol/l的nacl溶液进行洗脱,收集0.2mol/l的nacl溶液洗脱得到的洗脱液,浓缩、干燥,得到efp-2组分;
20.再将efp-2组分通过sephadex g-100柱层析进行纯化,采用去离子水洗脱,收集洗脱液,冷冻干燥,即制备得到接骨木多糖efp-2。
21.更优选的,去离子水洗脱的流速为0.6ml/min。
22.优选的,所述黑枣多糖由如下方法制备而成:
23.以黑枣为原料,加水提取得到提取液;脱除提取液中的脂溶性物质和蛋白后进行醇沉,得到黑枣粗多糖;
24.将黑枣粗多糖采用deae-52柱层析,依次用去离子水和0.1、0.2、0.3、0.4、0.5mol/l的nacl溶液进行洗脱,收集0.4mol/l nacl洗脱得到的洗脱液;将洗脱液进行透析,透析液冷冻干燥,制备得到黑枣多糖。
25.本发明的第三方面,提供上述多糖组合物在制备抗氧化损伤的产品中的应用。
26.上述应用中,所述氧化损伤是由h2o2诱导引起的。
27.本发明的有益效果:
28.本发明首次从接骨木果实中分离得到接骨木多糖,该接骨木多糖具有较强的抗氧化活性,可作为一种新的抗氧化剂被开发利用。接骨木多糖为基础,本发明还将接骨木多糖与黑枣多糖进行复配,得到多糖组合物;所得到的多糖组合物在抗氧化损伤方面具有显著的协同增效作用。
附图说明
29.图1:从接骨木果中分离和纯化五种多糖组分;(a)接骨木多糖在deae纤维素-52柱上的洗脱曲线;(b)5个组分(efp-0,efp-1,efp-2,efp-3,efp-4)在sephadex g-100柱上的
洗脱曲线。
30.图2:从接骨木果中分离和纯化的五种多糖组分的红外光谱,a-e分别代表efp-0、efp-1、efp-2、efp-3和efp-4的红外光谱。
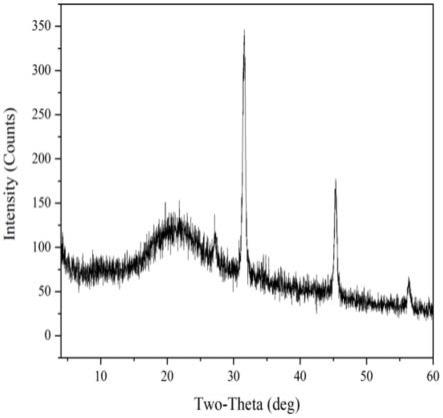
31.图3:efp-2的x射线衍射图。
32.图4:efp-2表面结构的扫描电镜照片。
33.图5:efp-2甲基化生产的总离子色谱图。
34.图6:efp-2的核磁共振光谱;(a)1h nmr;(b)13c nmr;(c)1h-1h cosy;(d)hsqc;(e)5-hmbc;(f)noesy。
具体实施方式
35.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
36.如前所述,接骨木是一种药食同用植物,是抗氧化剂的潜在来源。多糖是接骨木的重要活性物质之一,总糖含量在接骨木果实中占7.86~11.50%。接骨木果实产量较大,提取其中多糖用于抗氧化产品研究,具有广阔的市场前景。目前从接骨木中提取多糖并用于抗氧化性产品生产鲜有报道。
37.基于此,本发明对接骨木多糖的提取、纯化和结构鉴定进行研究。本发明首次以接骨木果实为原料,从中提取纯化得到接骨木多糖,并对接骨木多糖的结构组成进行了解析。
38.目前多糖的应用越来越广泛,但单一种类多糖在具体应用时,其功效受到限制。因此,多糖组合是当前研究的热点。发明人在多糖领域深耕多年,结合发明人前期对于黑枣多糖的研究,由此尝试将接骨木多糖和黑枣多糖进行组合使用,结果发现,由接骨木多糖和黑枣多糖组成的多糖组合物,在抗h2o2诱导的氧化损伤方面具有显著的协同增效作用,由此提出了本发明。
39.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
40.本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
41.实施例1:接骨木多糖的提取
42.(1)以接骨木果实为原料,将接骨木果实干燥、粉碎,得到接骨木粉。将接骨木粉和蒸馏水按料液比1g:20ml混合,热水回流提取两次,每次45min,合并两次提取液,用布氏漏斗加硅藻土趁热抽滤,在65℃条件下通过旋转蒸发仪浓缩,用95%的乙醇溶液醇沉,4000r/min,离心10min,收集沉淀,在室温下等待乙醇挥发完全,置于真空冻干机中冻干,得到冻干粉。
43.(2)将得到的冻干粉溶解,通过sevage试剂和石油醚进行脱脂脱蛋白,按照溶液和石油醚体积比为1:1萃取3-5次脱除脂溶性物质;用sevage法脱蛋白,萃取液和sevage试剂(氯仿和正丁醇体积比为4:1)体积比为4:1,萃取5-7次。再用4倍95%无水乙醇沉淀多糖,4℃冰箱静置12h后离心,沉淀用于冷冻干燥,即可得到脱脂脱蛋白的接骨木粗多糖,即为efp。
44.实施例2:接骨木多糖的分离纯化
45.取5.0g实施例1制备的efp溶于100ml去离子水中充分溶解,4000r/min下离心10分钟,用0.45μm的微孔滤膜过滤。将过滤后的粗多糖溶液缓慢加入到平衡后的deae-52纤维素离子交换柱(50mm
×
1000mm)中,分别用去离子水和0.1、0.2、0.3、0.4、0.5mol/l的nacl溶液进行洗脱。每管50ml,流速为5ml/min,每种收集50管。采用国标法(苯酚-硫酸法)在490nm处检测每管多糖含量,以管数为横坐标,吸光度值为纵坐标,绘制洗脱曲线(图1a),根据洗脱曲线峰值,分别合并峰值相对应的多糖洗脱液,进行旋蒸浓缩,透析(500-1000da)除nacl、冷冻干燥得到接骨木多糖各级组分(efp-0、efp-1、efp-2、efp-3、efp-4)。其中:
46.efp-0对应于去离子水洗脱得到的洗脱液;
47.efp-1对应于0.1mol/l的nacl溶液洗脱得到的洗脱液;
48.efp-2对应于0.2mol/l的nacl溶液洗脱得到的洗脱液;
49.efp-3对应于0.3mol/l的nacl溶液洗脱得到的洗脱液;
50.efp-4对应于0.4mol/l的nacl溶液洗脱得到的洗脱液。
51.将得到的接骨木多糖各级组分(efp-0、efp-1、efp-2、efp-3、efp-4)进一步的通过sephadex g-100柱层析进行纯化,具体如下:
52.称取50.0mg efp-0配成100ml溶液后,缓慢加入到sephadex g-100葡聚糖凝胶柱(16mm
×
2000mm),用去离子水洗脱,流速为0.6ml/min,每管10ml,收集30管,按上述方法进行检测,绘制多糖曲线,收集并冻干。
53.efp-1、efp-2、efp-3、efp-4均用上述方法进行纯化。efp-0、efp-1、efp-2、efp-3、efp-4五种组分在sephadex g-100柱上的洗脱曲线如图1b所示。
54.实施例3:接骨木多糖的结构鉴定
55.使用傅里叶变换红外光谱对多糖的官能团进行识别,将实施例2中经sephadex g-100柱层析纯化后的接骨木多糖组分efp-0、efp-1、efp-2、efp-3、efp-4分别压成薄片,以空气为采集背景,将薄片置于thermo nicolet is10傅立叶变换红外光谱(fourier transform infrared spectroscopy,ft-ir),设置中红外模式扫描范围为4000-400cm-1
,并使用omnic8.2及origin 2018软件进行分析。
56.接骨木多糖组分efp-0、efp-1、efp-2、efp-3、efp-4的红外光谱图如图2所示。3200-3400cm-1
左右主要是由多糖分子或分子间的o
–
h伸缩振动引起的,表明存在分子间氢键;2900-2800cm-1
左右归因于c
–
h、-ch
2-和-ch
3-不对称拉伸振动;在1400-1700cm-1
附近的吸收峰是由于-cooh弯曲振动或c-o的对称拉伸振动引起的,表明多糖中存在糖醛酸,并且含有-cooh基团;1000-1200cm-1
处的吸收峰与糖苷键的c-o-c伸缩有关,对于由不同单糖组成的多糖具有不同的光谱形状;在1000-1050cm-1
有吸收峰,表明这多糖组分中存在吡喃糖环,且1024cm-1
是c-o-c拉伸振动的峰值;在900cm-1
左右出现峰值表明多糖链中存在β-糖苷键;在850cm-1
左右出现有吸收峰表明多糖存在α-糖苷键。
57.在hpgpc中测定各组分的分子量。精密称取样品和标准品,样品配制成5mg/ml溶液,12000rpm离心10min,上清液用0.22μm的微孔滤膜过滤,然后将样品转置于1.8ml进样小瓶中。进样量为20μl,色谱柱:brt105-104-102串联凝胶柱(8
×
300mm);流速设置为0.6ml/min,柱温40℃;流动相为0.05mol/l nacl溶液。检测器示差使用检测器ri-10a。根据标准品曲线,得出计算公式进而计算出efp-0、efp-1、efp-2、efp-3和efp-4的分子量分别为:
4.0995
×
105、1.7981
×
106、7.0523
×
106、7.7638
×
106、4.3855
×
105、7.3173
×
105da。
58.通过hpaec分析样品的单糖组成。将10.0mg多糖在120℃下用10ml 3mol/l tfa水解3h,再通过旋转蒸发仪除去残留的tfa。准确吸取酸水解溶液转移至管中吹干,加入10ml去离子水用涡旋混匀,吸取100μl加入900μl去离子水,12000rpm离心5min。取上清液进行ic分析。色谱柱选用:dionexcarbopac
tm
pa20(3*150)进行分析;流动相分别为h2o和15mol/lnaoh:15mol/lnaoh&100mol/l naoac;流速为0.3ml/min;柱温30℃;进样量:5μl。
59.efp-0单糖组成包括阿拉伯糖、岩藻糖、葡萄糖、半乳糖、甘露糖、盐酸氨基葡萄糖,摩尔比为47.70:17.60:15.00:14.10:4.10:1.50;
60.efp-1单糖组成包括阿拉伯糖、半乳糖、葡萄糖、盐酸氨基葡萄糖、甘露糖,摩尔比为55.00:22.30:16.30:4.00:2.40;
61.efp-2单糖组成包括阿拉伯糖、半乳糖、葡萄糖、半乳糖醛酸、甘露糖和盐酸氨基葡萄糖,摩尔比为41.40:24.80:18.00:6.90:6.60:2.30;
62.efp-3单糖组成包括岩藻糖、半乳糖醛酸、阿拉伯糖、葡萄糖、半乳糖、甘露糖和盐酸氨基葡萄糖,摩尔比为24.10:22.70:19.20:15.40:10.10:7.50:1.10;
63.efp-4单糖组成包括半乳糖醛酸、阿拉伯糖、葡萄糖、半乳糖、甘露糖和盐酸氨基葡萄糖,摩尔比为30.60:23.20:19.40:16.10:8.70:2.00。
64.实施例4:接骨木多糖efp-2的结构鉴定
65.efp-2在接骨木的五种纯化多糖中的回收率最高,因此,进一步通过x射线衍射、扫描电镜、甲基化分析和核磁共振光谱分析对efp-2进行研究,具体如下:
66.通过x射线衍射测定多糖是无定形或结晶结构;采用x'pert pro x-ray diffractometer(panalytical,netherlands)在铜靶cu kα(λ=0.154 06nm)辐射40kv和40ma条件下测量efp-2的结晶性能。采用nai晶体闪烁计数器(scintillation counter)测量x-射线的强度,扫描范围为5
°‑
60
°
,步长0.02
°
,扫描速度4
°
/min。
67.利用扫描电子显微镜(sem)研究接骨木多糖的显微结构。取约5.0mg干燥后样本,粘附于含有双面粘合剂的导电碳膜上,置于离子溅射仪样品舱中,进行喷金40s左右。样品取出后,置入扫描电镜观察室,加速电压为2kv,进行观察。
68.将2-3mg efp-2样品加入1ml无水dmso,快速加入无水碱溶液、碘甲烷溶液,在磁力搅拌水浴30℃下反应60min,添加2ml超纯水终止甲基化反应。取甲基化后的多糖,加入1ml的2m三氟乙酸(tfa)水解90min,旋转蒸发仪蒸干。残基加入2ml双蒸水,60mg硼氢化钠还原8h,加入冰醋酸中和,加入1ml乙酸酐乙酰化100℃反应1h,冷却。然后加入3ml甲苯除去多余的醋酐。将乙酰化后的产物用3ml ch2cl2溶解后除去上层水溶液。之后,ch2cl2层以适量的无水硫酸钠干燥,定容10ml,放入液相小瓶。最后使用rxi-5sil ms色谱柱30m*0.25mm*0.25um;起始温度120℃,以3℃/min升温至250℃/min;保持5min;进样口温度为250℃,检测器温度为250℃/min,载气为氦气,流速为1ml/min。
69.在核磁共振光谱分析中,将40.0mg efp-2溶于d2o,装于核磁管中,置于700m hz布鲁克avance iii核磁共振波谱仪(德国布鲁克)中扫描得到核磁谱图。采用一维核磁共振谱(1h和
13
c)和二维核磁共振谱(相关谱[cosy]、异核单量子相干[hsqc]和异核多键相干[hmbc])分析多糖的结构特征。
[0070]
通过x射线衍射和电镜扫描得出efp-2具有有序的晶体构象,在500
×
放大倍数下
多糖结构呈现碎片状,但表面粗糙;1000
×
放大倍数下,多糖表面呈现团状或片状的聚集体,但整体无规整性;3000
×
放大倍数下,efp-2多糖表面为光滑的片状结构,结合较紧密,且表面分布(图3、图4)。
[0071]
在甲基化分析中,鉴定出十二种糖苷键类型(图5),1,4-glcp(34.90%)、1,4-manp(32.70%)和1,4,6-glcp(10.80%)是三种主要的糖苷键连接方式,还有少量的t-galp(5.10%)、t-manp(4.40%)、t-araf(2.50%)、t-glcp(2.40%)、1,4,6-galp(1.90%)、1,5-araf(1.90%)、1,3-galp(1.30%)、1,6-galp(1.00%)、1,3,6-galp(0.50%)残基。可以看出efp-2主链可能是由1,4-α-glcp,1,4-α-manp连接而成,并且1,4-α-glcp在c-6位置处产生支链。
[0072]
核磁共振光谱分析(图6)结合单糖组成、甲基化分析结果,确定efp-2是由
→
4)-manp(1
→
4)-β-d-glcp(1
→
和
→
4)-β-d-glcp(1
→
5)-α-l-araf(1
→
两个单元组成。
[0073]
实施例5:黑枣多糖的制备
[0074]
黑枣是由红枣黑变得到。所用的红枣购自山东国仁堂食品科技有限公司,品种为哈密大枣。挑选无病虫害、大小均匀的红枣清洗后,复水1h,按照每600g大枣加入150ml水加水装袋,在75℃温度条件下黑化55h,得到黑枣。
[0075]
以上述得到的黑枣作为原料,提取制备黑枣多糖,具体如下:
[0076]
(1)黑枣粗多糖的提取:将黑枣去核、烘干、粉碎,加入水(黑枣与水的重量比1:10),100℃水浴回流提取2次,每次1h,收集滤液,离心,取上清液;60℃下旋转浓缩后,静置,离心,弃沉淀,上清液按照溶液:石油醚=1:1萃取5次脱除脂溶性物质,萃取液用sevage法(氯仿:正丁醇=4:1,体积比)脱除蛋白7次;60℃下旋转浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,4℃放置12h后,抽滤得沉淀物;将沉淀物放置在自然环境下,待乙醇挥发干,即得黑枣粗多糖。
[0077]
(2)deae-52离子交换柱层析纯化黑枣粗多糖:
[0078]
①
deae-52纤维素预处理:取deae-52纤维素,用10倍体积的水浸泡24h,待其充分溶胀后,真空抽滤去除水分;使用0.05mol/l naoh浸泡1h,水洗至中性,再采用0.1mol/l hcl浸泡30min,水洗至中性,最后用0.1mol/l naoh处理30min,水洗至中性,将填料与水按1:2比例混合,充分搅拌除去气泡,准备装柱,选用柱型50
×
1000mm;
[0079]
②
装柱:将玻璃柱垂直固定于铁架台,检查装置气密性,将填料匀浆搅拌均匀,倒入柱床;装填完成后选择超纯水为流动相,5ml/min流速下洗脱,隔夜静置,直至柱材料液面不变;
[0080]
③
上样:取5.0g黑枣粗多糖,溶于100ml超纯水中得到多糖溶液,再离心并过0.45μm滤膜,将多糖溶液缓慢倒入柱中,连接蠕动泵,准备洗脱;
[0081]
④
洗脱:控制洗脱流速为5ml/min,依次用蒸馏水和不同浓度的nacl溶液(0.1、0.2、0.3、0.4、0.5mol/l nacl)进行梯度洗脱,收集0.4mol/l nacl洗脱得到的洗脱液。
[0082]
⑤
透析:透析袋在使用之前需要剪成小段,每段20cm,放于蒸馏水中煮沸30min之后蒸馏水洗干净,将洗脱液装于透析袋(截留分子量1.0
×
103da)中,用透析夹夹紧透析袋两端,在蒸馏水中4℃下透析48h,每6h换一次水。
[0083]
⑥
冷冻干燥:将透析液收集于离心管,-40℃预冻12h,再放于冷冻干燥机冷冻干燥72h,即制备得到黑枣多糖。
[0084]
实施例6:多糖组合物的制备
[0085]
将实施例2中经sephadex g-100柱层析纯化后的接骨木多糖组分efp-2和实施例5制备的黑枣多糖,按重量比1:1混合,即制备得到多糖组合物。
[0086]
试验例1:多糖对h2o2诱导的raw 264.7细胞活性的影响
[0087]
1、试验方法:
[0088]
以raw 264.7细胞(购自中国科学院细胞生物学研究所)为试验对象,将raw264.7细胞分为control组、h2o2处理组、接骨木多糖+h2o2处理组、黑枣多糖+h2o2处理组和多糖组合物+h2o2处理组。其中:
[0089]
control组:raw 264.7细胞正常培养;正常培养条件为:选用dmem培养基(添加10%胎牛血清及青霉素、链霉素各100u/ml),置于37℃、5%co2、饱和湿度条件下培养箱中培养。
[0090]
h2o2处理组:raw 264.7细胞正常培养24h后,加入终浓度为1.2mm的h2o2,继续培养4h。
[0091]
接骨木多糖+h2o2处理组:raw 264.7细胞正常培养24h后,加入终浓度为1.2mm的h2o2,同时加入终浓度为100μg/ml的接骨木多糖组分efp-2(实施例2中经sephadex g-100柱层析纯化),继续培养4h。
[0092]
黑枣多糖+h2o2处理组:raw 264.7细胞正常培养24h后,加入终浓度为1.2mm的h2o2,同时加入终浓度为100μg/ml的黑枣多糖(实施例5制备),继续培养4h。
[0093]
多糖组合物+h2o2处理组:raw 264.7细胞正常培养24h后,加入终浓度为1.2mm的h2o2,同时加入终浓度为100μg/ml的接骨木多糖组分efp-2(实施例2中经sephadex g-100柱层析纯化)和终浓度为100μg/ml的黑枣多糖(实施例5制备),继续培养4h。
[0094]
采用mtt试验测试各处理组的细胞存活率。
[0095]
2、试验结果:
[0096]
不同种类的多糖对h2o2诱导的raw 264.7细胞活性的影响结果见表1。
[0097]
表1:多糖对h2o2诱导的raw 264.7细胞活性的影响
[0098]
处理细胞存活率h2o2处理组12.1%接骨木多糖+h2o2处理组39.2%黑枣多糖+h2o2处理组31.4%多糖组合物+h2o2处理组61.3%
[0099]
由表1的结果可以看出:h2o2处理会导致raw 264.7细胞氧化损伤,细胞的存活率降低;接骨木多糖和黑枣多糖均能在一定程度上改善h2o2诱导的raw 264.7细胞损伤。而将接骨木多糖和黑枣多糖复配使用,在改善h2o2诱导的raw 264.7细胞损伤方面具有显著的协同增效作用。
[0100]
试验例2:斑马鱼氧化损伤试验
[0101]
1、试验方法:
[0102]
在斑马鱼氧化损伤试验中,对斑马鱼的质量控制参考《gb/t 39649-2020实验动物实验鱼质量控制》。实验设置control(空白对照组)、gsh组(阳性药谷胱甘肽对照组,100μm)和受试物组(200μg/l),其中受试物组分别为多糖组合物(实施例6制备)、接骨木多糖efp-2
和黑枣多糖(实施例5制备)。
[0103]
gsh组:称取gsh(glutathione)0.154g溶于5ml水中,配置成浓度为100mm的母液;使用时取10μl母液溶于10ml养鱼水中,浓度为100μm。
[0104]
受试物组:分别秤取0.0100g的多糖组合物、接骨木多糖efp-2和黑枣多糖,溶于10ml超纯水中,配置成浓度为1000μg/ml的母液;使用时取2ml母液,溶于8ml养鱼水中,配置成浓度为200μg/ml的工作液。
[0105]
给药后持续培养24h。其余操作参照标准《t/zhca保健食品抗氧化功能的斑马鱼模型快速检测方法(ros法)》进行。实验后,利用尼康荧光显微镜(ci-s)对各组仔鱼进行活体成像,每组拍摄图像不少于10尾鱼;利用imagej软件对图像灰度值进行提取,并计算ros清除率。
[0106]
2、试验结果:
[0107]
表2:斑马鱼氧化损伤实验中ros清除率
[0108][0109]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1