AIM2基因在不明原因反复自然流产诊断中的应用的制作方法
aim2基因在不明原因反复自然流产诊断中的应用
技术领域
1.本发明属于医药技术领域,涉及反复自然流产研究领域,尤其涉及aim2基因在不明原因反复自然流产诊断中的应用。
背景技术:
2.反复自然流产(recurrent spontaneous abortion,rsa)是指连续3次或3次以上在妊娠28周之前的胎儿丢失,是妊娠期间常见的并发症。rsa的发生率约占妊娠总数的3%~5%,严重威胁人类生殖健康。其中,严格排除了染色体异常、解剖结构异常、内分泌失调、生殖道感染等病因的rsa,临床上称为不明原因的反复自然流产(unexplained recurrent spontaneous abortion,ursa)。近年来,越来越多的证据表明ursa与免疫系统功能异常密切相关,但其致病机制尚不完全明确。
3.母-胎界面的微环境主要由胎盘滋养细胞、子宫蜕膜细胞、t细胞、nk细胞、巨噬细胞等免疫细胞组成。其中,滋养细胞源于胚胎外滋养层,其对子宫蜕膜和螺旋动脉的适度侵袭是胚胎植入、发育和妊娠成功的关键。滋养细胞的迁移和侵袭受到严格的调控,迁移和侵袭能力不足会导致胚胎着床失败、胎盘血管重塑障碍,引发胎儿发育迟缓、自然流产、死胎等不良妊娠结局。胎盘植入的过程类似于肿瘤细胞的侵袭行为,此过程依赖于大量的蛋白水解酶,特别是滋养细胞分泌的基质金属蛋白酶家族成员(matix metalloproteinases,mmps)。mmp2和mmp9是滋养细胞在妊娠早期分泌的2种主要的蛋白酶,通过降解ⅳ型胶原(子宫内膜细胞外基质和基底膜的主要成分)促进滋养细胞侵入过程。其中,mmp9主要降解细胞外基质,其在滋养细胞中的高表达有利于促进胚胎着床和胎盘形成。已有的研究表明,mmps表达及活性的改变,可能是先兆子痫、自然流产、胎膜早破、胎儿宫内窘迫等不良妊娠结局的重要诱因。研究指出mmp9及凝血酶敏感蛋白1(thrombospondin1,tsp1)的表达与流产密切相关。失调的mmps/timps促进子宫内膜基质过度降解,进而影响胎盘植入和胚胎着床,导致自然流产。最新的研究表明,rsa患者绒毛组织中mmp2和mmp9的表达水平显著低于正常妊娠患者,同时发现rsa患者出现bmal1的表达缺失,bmal1的缺失显著降低了htr-8/svneo细胞的迁移和侵袭能力,但过表达mmp2或mmp9可以逆转bmal1缺失引起的滋养细胞侵袭能力下降。此外,zong等发现ursa患者mmp9和吲哚胺2,3-双加氧酶(ido)的表达水平显著降低,导致滋养细胞增殖和迁移能力下降。
4.尽管mmp2和mmp9与反复自然流产的关系已被证实,但通过检测mmp2和mmp9以预防和诊断反复自然流产仍不够完善,分析其原因主要在于采集不同妊娠时间、不同组织样品的检测结果可能不一致,且mmps是外分泌蛋白酶存在降解的现象,可能导致出现漏诊、错诊的情况。
5.aim2是细胞内双链dna(double-stranded dna,dsdna)感受器之一,能够识别细菌或病毒来源的双链dna激活炎症小体。
技术实现要素:
6.本发明的一个目的是提供检测aim2蛋白或其编码基因的表达的物质的用途。
7.本发明提供的检测aim2蛋白或其编码基因的表达的物质在如下至少一种中的应用:
8.1)制备预测或辅助预测待检者是否为不明原因的反复自然流产患者的产品;
9.2)制备筛查或辅助筛查不明原因的反复自然流产患者的产品;
10.3)制备诊断或辅助诊断不明原因的反复自然流产患者的产品;
11.4)制备预警或辅助预警不明原因的反复自然流产患者的产品。
12.上述应用中,所述物质包括特异结合aim2蛋白的抗体或特异结合aim2基因的引物或探针。
13.上述应用中,所述应用的检测对象为离体胎盘或者外周血。
14.上述物质可以为包含特异结合aim2基因的引物或探针的aim2 qpcr检测试剂盒,如aim2实时荧光定量pcr检测试剂盒;用于检测aim2基因mrna的表达量。具体来说,特异结合aim2基因的引物包括正向引物和反向引物,正向引物的序列如序列1所示,反向引物的序列如序列2所示。
15.上述物质也可以为包含特异结合aim2蛋白的抗体的免疫检测试剂盒,如aim2免疫组化检测试剂盒或aim2蛋白质免疫印迹检测试剂。通过与aim2蛋白特异性结合的aim2抗体,可以准确高效的检测出待测的样本中aim2蛋白的表达水平,从而可以判断出aim2基因是否异常表达。aim2抗体为抗人aim2的多克隆抗体或单克隆抗体。
16.上述aim2蛋白或其编码基因作为靶点在开发预测、辅助预测、筛查、辅助筛查、诊断、辅助诊断、预警或辅助预警不明原因反复自然流产患者的产品中的应用也是本发明保护的范围。
17.上述aim2蛋白或其编码基因作为靶点在开发改善滋养细胞侵袭力产品中的应用也是本发明保护的范围。
18.上述aim2蛋白或其编码基因作为靶点在开发逆转不明原因反复自然流产产品中的应用也是本发明保护的范围。
19.本发明还有一个目的是提供一种产品。
20.本发明提供的产品,其包括检测aim2蛋白或其编码基因的表达的物质;
21.所述产品具有如下任一一种功能:
22.1)预测或辅助预测待检者是否为不明原因的反复自然流产患者;
23.2)筛查或辅助筛查不明原因的反复自然流产患者;
24.3)诊断或辅助诊断不明原因的反复自然流产患者;
25.4)预警或辅助预警不明原因的反复自然流产患者。
26.上述中,产品为试剂盒,具体可以为诊断试剂盒。
27.下述应用也是本发明保护的范围:
28.抑制aim2蛋白或其编码基因表达的物质在开发用于筛选改善逆转不明原因反复自然流产产品中的应用;
29.或,抑制aim2蛋白或其编码基因表达的物质在开发用于筛选促进滋养细胞系迁移的产品中的应用;
30.或,抑制aim2蛋白或其编码基因表达的物质在制备筛选改善逆转不明原因反复自然流产的细胞模型中的应用;
31.或,抑制aim2蛋白或其编码基因表达的物质在开发用于筛选促进滋养细胞系迁移的细胞模型中的应用;
32.或,aim2蛋白或其编码基因在制备改善逆转不明原因反复自然流产产品中的应用。
33.抑制aim2和mmp9蛋白或编码基因表达的物质在开发用于筛选改善逆转不明原因反复自然流产产品中的应用;
34.或,抑制aim2和mmp9蛋白或其编码基因表达的物质在开发用于筛选促进滋养细胞系迁移的产品中的应用;
35.或,抑制aim2和mmp9蛋白或其编码基因表达的物质在制备筛选改善逆转不明原因反复自然流产的细胞模型中的应用;
36.或,抑制aim2和mmp9蛋白或其编码基因表达的物质在开发用于筛选促进滋养细胞系迁移的细胞模型中的应用。
37.上述抑制aim2蛋白或其编码基因表达的物质,或者抑制aim2和mmp9蛋白或其编码基因表达的物质为干扰aim2蛋白或其编码基因表达的物质,可以为sirna,在本发明的实施例中具体为human aim2-sirna。
38.本发明的实验证明,与正常人相比,在不明原因反复自然流产患者绒毛组织中aim2基因的表达水平显著降低,因此,aim2基因的异常低表达可以作为检测不明原因反复自然流产的靶标。本发明研究了aim2信号参与调控滋养细胞mmp9的表达,证实aim2-mmp9信号轴参与调节妊娠过程中滋养细胞的侵袭能力,并与妊娠结局相关。不明原因反复自然流产的临床治疗可以着眼于aim2-mmp9信号轴为靶点,其中,明确胎盘aim2的表达情况可作为监测胎盘妊娠相关疾病的指标,通过调节aim2-mmp9信号轴可以改善滋养细胞侵袭力,逆转不良妊娠结局。本发明通过探讨aim2影响mmp9表达的研究为不明原因反复自然流产的临床诊疗提供新的研究思路。
附图说明
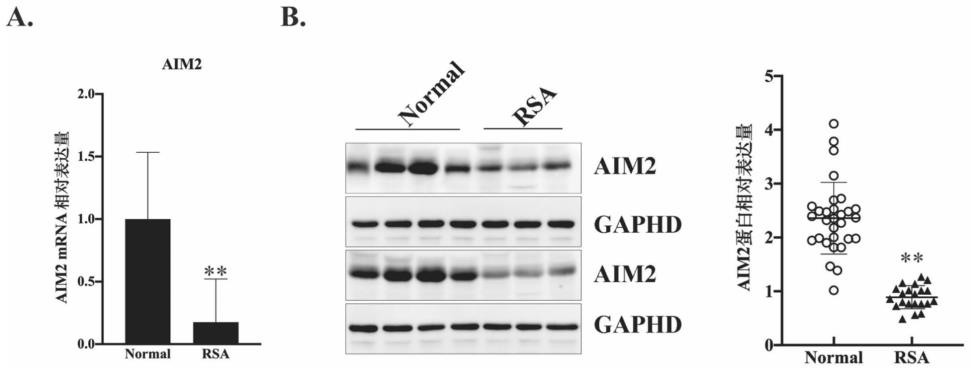
39.图1为人胎盘组织aim2 mrna(a)和蛋白(b)的表达情况。
40.图2为poly(da:dt)刺激对滋养细胞htr-8/svneo中aim2、mmp2和mmp9的mrna(a)和蛋白(b)表达的影响。
41.图3为沉默aim2基因抑制mmp9表达,a为qpcr检测结果,b为明胶酶谱实验检测mmp9酶活性,c为明胶酶谱实验mmp9酶活性的光密度值,d为western blot检测mmp9蛋白表达水平。
42.图4为aim2表达水平降低抑制滋养细胞迁移能力,a为细胞划痕实验检测htr-8/svneo细胞迁移能力,b为细胞相对迁移率分析。
具体实施方式
43.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
44.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
45.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的实施方式作进一步地描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
46.aim2 gene id:9447,更新日期:2022年6月12日;可以通过ensembl网站查找到aim2基因序列信息(https://asia.ensembl.org/homo_sapiens/gene/summary?db=core;g=ensg00000163568;r=1:159062484-159147096)。
47.实施例1、人胎盘组织aim2 mrna和蛋白水平的表达分析
48.实施例中临床样本的收集与知情同意;本技术对流产组织中滋养层上蛋白的特异性表达进行深入研究,因此涉及正常人流组织和ursa患者胎盘组织的筛选、收集与保存。
49.患者入组标准
50.ursa组:选取经临床诊断为不明原因反复自然流产患者21例,符合如下条件:
①
所有患者均无活产史,妊娠20周内自然流产2次或2次以上;
②
抗心磷脂抗体(aca)、抗精子抗体(asab)、抗双链dna抗体(dsdna)、抗核抗体(ana)、抗甲状腺过氧化物酶抗体(tpoab)和抗甲状腺球蛋白抗体(tgab)检测为阴性;
③
弓形虫、巨细胞病毒、风疹病毒、疱疹病毒检测为阴性;
④
经检查排除生殖系统解剖结构异常;
⑤
无内分泌疾病、无慢性感染性疾病;
⑥
夫妻abo血型抗体检测为阴性、女方rh血型为阳性;
⑦
夫妇双方染色体核型分析正常;
⑧
排除生殖道感染,白带化验正常、支原体、衣原体检测阴性;
⑨
无有害有毒物质及放射线接触史。
51.正常妊娠对照组:选取主动要求终止妊娠、人工流产的正常妊娠患者30例,符合如下条件:
①
无自然流产史,无死产死胎、先兆子痫、妊娠高血压等不良孕产史;
②
b超提示胚胎发育正常,要求终止妊娠;
③
本次妊娠期间无阴道流血、腹痛等流产征兆;
④
无生殖道感染,白带化验正常、支原体、衣原体检测阴性;
⑤
无有害有毒物质及放射线接触史。
52.实验手段:
53.提取ursa组和正常对照组胎盘组织中的总rna,以其中的mrna作为模板,采用oligo(dt)利用逆转录酶反转录成cdna,再以cdna为模板进行qpcr扩增,检测胎盘绒毛组织中aim2基因的差异性表达。
54.上述pcr扩增的正向引物的序列如序列1所示,反向引物的序列如序列2所示。
55.通过上述qpcr法分别检测并分析收集到的所有不明原因反复自然流产胎盘组织(n=21)和正常对照组(n=30)胎盘组织中aim2 mrna的表达水平;
56.免疫印迹法分析不明原因反复自然流产胚胎组织中aim2及其调控的mmp9蛋白的表达量,最终确定aim2蛋白在ursa胚胎组织中表达下调的比率及灵敏度,为后续医学检验试剂盒的研制和不明原因反复自然流产的临床诊断奠定理论基础。
57.具体如下:
58.一、qpcr检测aim2基因表达量
59.aim2 qpcr检测试剂盒组成:trizol溶液,75%乙醇,depc水,逆转录酶,dntp,sybr green pcr master mix,aim2正向引物(序列1)和aim2反向引物(序列2)。
60.qpcr具体步骤:
61.1)提取rna
62.离体胎盘组织用手术剪剪成尽量小的组织块,随后在液氮中充分磨碎,50g组织样
本中加入1ml trizol溶液,混匀后室温放置5min,加入0.2ml氯仿,剧烈震动30s后室温放置5min,4℃12000g离心15min,将分层液中的最上层转移至rnase-free ep管中,加入等体积异丙醇沉淀rna,轻柔混匀后室温放置10min,4℃12000g离心10min去上清。加入1ml 75%乙醇10000g离心5min弃上清,洗涤2次,超净台内室温风干10min,加入20μl depc水,得到rna。
63.2)逆转录
64.配制逆转录体积体系如下(takara,primescript rt reagent kit,rr037a):
65.10μl rna(总量为1μg rna)、1μlrt enzyme mix i、0.5μl 5
×
primescript buffer 2、0.5μl rt-primer mix、余量为水总体积为20μl。
66.上述体系混匀后置于37℃孵育15min,再于85℃反应5s,获得cdna,最后置于4℃保存。
67.3)定量pcr检测
68.20μl定量pcr检测体系(roche,faststart universal sybr green master(rox),4913914001):
69.5μl cdna(不超过50ng)、10μl faststart universal sybr green master(rox)、0.5μl上游引物(序列1所示的正向引物,终浓度为200nm)、0.5μl下游引物(序列2所示的反向引物,终浓度为200nm),余量为水。
70.荧光定量pcr仪运行扩增反应,通过abi7500软件读取数值并进行数据分析。
71.结果如图1a所示,与对照组相比,ursa组中患者胎盘组织中aim2的mrna表达水平显著低于正常妊娠对照组。
72.二、免疫印迹(western blot)检测aim2蛋白表达量
73.1)总蛋白的提取制备:将胚胎组织切成细小块,用胰酶消化获得单细胞悬液,置于pbs缓冲液中清洗,离心获得细胞沉淀,加入适量ripa裂解液,4℃裂解15min,离心取上清获得总蛋白,bca定量。
74.2)上样:往sds-page胶孔中加入20μg蛋白。
75.3)电泳:60v恒压条件进行浓缩胶电泳,120v恒压条件进行分离胶电泳,待蛋白条件位于分离胶2/3位置时,停止电泳。
76.4)转膜:将pvdf膜、滤纸、海绵浸泡在预冷的1
×
电转工作液中,取下sds-page胶放入到电转溶液中,并按照负极-海绵-滤纸-sds-page胶-pvdf膜-滤纸-海绵-正极的顺序摆放,尽量赶走气泡,组装后放入电转槽中,冰水浴下进行电转,90v恒压条件下转膜90min。
77.5)封闭:tbst洗三遍,每遍5min,加入5%脱脂牛奶,摇床室温封闭30min。
78.6)一抗孵育:按抗体说明书推荐比例稀释一抗(anti-human aim2 antibody,abcam,ab180665),摇床4℃孵育过夜。tbst洗三遍,每遍5min。
79.7)二抗孵育:按抗体说明书推荐比例稀释二抗(山羊抗兔igg h&l(hrp),abcam,ab205718),摇床室温孵育1h。tbst洗三遍,每遍10min。
80.8)显色:加入适量的ecl混合液,多功能成像分析仪检测目的条带。
81.检测结果如图1b所示(左图为免疫印迹结果,右图为根据免疫印迹结果制作的统计图),ursa患者胚胎组织中aim2的蛋白表达水平显著低于正常妊娠对照组组。
82.因此,可以通过检测待测胚胎组织中aim2基因或蛋白的表达来判断或辅助判断待测胚胎组织是否来源于ursa患者;aim2基因或蛋白的表达低的待测胚胎来源于ursa患者的
概率大于或候选大于aim2基因或蛋白的表达高的待测胚胎。
83.上述检测待测胚胎组织中aim2基因可采用pcr检测方式检测aim2基因的表达;
84.上述检测待测胚胎组织中aim2蛋白的表达可采用免疫印迹检测aim2蛋白的表达量的方式检测。
85.上述pcr检测的引物由序列1所示的引物和序列2所示的引物组成;
86.上述检测aim2蛋白的表达量的抗体包括特异结合aim2蛋白的抗体。
87.实施例2、poly(da:dt)刺激对滋养细胞htr-8/svneo中aim2、mmp2和mmp9表达的分析
88.利用人工合成的双链dna模拟物poly(da:dt)刺激人滋养细胞系htr-8/svneo,模拟反复自然流产发生期间外周血中释放出大量游离dna对滋养细胞的刺激,分析aim2能否参与调控mmps表达。
89.人滋养细胞系htr-8/svneo(北京北纳创联生物技术研究院,atcc bio-107448)用含10%胎牛血清和1%双抗的dmem/f12培养基培养。
90.实验步骤:
91.a)人滋养细胞培养:htr-8/svneo接种于细胞培养板,培养过夜。
92.b)人滋养细胞转染:第二天更换为opti-mem培养基培养,4小时后利用转染试剂lyovec转染1μg/ml poly(da:dt)(invivogen,tlrl-patc),以lyovec(invivogen,lyec-12)作为空白对照组,转染24小时和48小时后收集细胞及培养上清。
93.按照实施例1的方法对转染后人滋养细胞及培养上清进行定量pcr和western blot检测。
94.用于扩增aim2基因的引物为:aim2正向引物(序列1)和aim2反向引物(序列2);
95.用于扩增mmp2基因的引物为:mmp2正向引物(序列3)和mmp2反向引物(序列4);
96.用于扩增mmp9基因的引物为:mmp9正向引物(序列5)和mmp9反向引物(序列6)。
97.上述检测抗体的anti-mmp9(#13667)和anti-mmp2(#40994)抗体购自cell signaling technology公司。
98.定量pcr检测结果如图2a所示,poly(da:dt)能够同时激活aim2基因mrna和mmp9基因mrna上调表达,对mmp2基因mrna表达有一定的抑制作用;
99.western blot检测结果如图2b所示,可以看出,poly(da:dt)可以提高aim2蛋白和mmp9蛋白的表达,但对mmp2的蛋白表达水平无显著影响。
100.实施例3、沉默aim2基因用poly(da:dt)刺激htr-8/svneo可抑制mmp9表达
101.human aim2-sirna(sigma,4392420)、negative control sirna(sigma,silencer
tm select阴性对照1号,4390843);lipofectamine 3000(thermo fisher公司,l3000015)。
102.实验步骤:
103.a)aim2 sirna干扰:htr-8/svneo接种于细胞培养板,培养过夜。第二天更换为opti-mem培养基培养,4小时后进行转染,依据lipofectamine 3000试剂说明书,将脂质体分别与50nm human aim2-sirna(简称为siaim2)或negative control sirna(简称为sictrl)混合均匀,室温静置20min后,将脂质体-sirna复合物加入细胞中,转染6小时后更换新鲜培养基。培养24小时后,更换opti-mem培养4小时,得到转染aim2-sirna的htr-8/
svneo细胞或转染neg-sirna的htr-8/svneo细胞。
104.b)利用转染试剂lyovec向上述转染aim2-sirna的htr-8/svneo细胞或转染neg-sirna的htr-8/svneo细胞中再次转染1μg/ml poly(da:dt),以lyovec作为空白对照组,转染48小时后收集细胞及培养上清。
105.c)qpcr、western blot检测:对上述a和b得到的细胞进行qpcr、western blot检测,与实施例2的方法相同;
106.c)明胶酶谱实验:将等量的上述b得到细胞的总蛋白上样于含1%明胶的10%聚丙烯酰胺凝胶进行sds-page电泳,约1.5小时后将胶体置于洗脱液中震荡洗脱2-3次,每次15min,然后用漂洗液漂洗2次,每次20min。随后,将凝胶置于孵育液中37℃孵育48h,孵育结束后用0.05%考马斯亮蓝溶液染色1小时,再将凝胶依次置于脱色液a、b、c中分步脱色,脱色完成后得到蓝色背景上的明亮条带,拍照并用凝胶图像分析软件分析条带光密度值。
107.将转染aim2-sirna的htr-8/svneo细胞或转染neg-sirna的htr-8/svneo细胞采用qpcr检测,结果如图3a所示,可以看出,与转染neg-sirna的htr-8/svneo细胞相比,转染aim2-sirna的htr-8/svneo细胞中,siaim2特异性沉默aim2基因的表达。
108.将poly(da:dt)转染前后的细胞分别进行qpcr、western blot检测和明胶酶谱实验。
109.结果如图3b-3d所示,poly(da:dt)刺激htr-8/svneo细胞后mmp9的蛋白表达水平和明胶。
110.水解能力显著增强,但这种激活作用被aim2基因沉默所抑制。
111.以上结果证实了aim2信号参与调控滋养细胞mmp9的表达。
112.实施例4、沉默aim2基因抑制htr-8/svneo细胞迁移能力
113.为了进一步探究aim2表达水平降低与ursa的关系,利用划痕实验体外分析了aim2对滋养细胞迁移能力的影响。实验步骤:
114.a)细胞接种:将转染aim2-sirna的htr-8/svneo细胞或转染neg-sirna的htr-8/svneo细胞接种于12孔板。
115.b)细胞划痕:待细胞融合度约为70%密度时,使用100μl枪头在细胞平面进行划痕,pbs洗涤3次,更换opti-mem培养4小时。
116.c)转染:利用转染试剂lyovec转染1μg/ml poly(da:dt),以lyovec作为空白对照组,转染6小时后更换完全培养基继续培养。
117.d)显微观察记录:在倒置显微镜下拍摄同一划痕位置,并测量和记录各组细胞的划痕面积。
118.结果如图4所示,poly(da:dt)刺激能增强滋养细胞的迁移能力;但基因沉默aim2能够显著抑制htr-8/svneo细胞迁移。
119.由上述实验可知,正常妊娠组织中aim2高表达,而在ursa组织则检测到aim2 mrna水平和蛋白水平的下调。利用poly(da:dt)刺激人滋养细胞系htr-8/svneo能够同时激活aim2和mmp9上调表达;利用特异性sirna基因沉默aim2,随后利用poly(da:dt)刺激htr-8/svneo细胞后mmp9的蛋白表达水平和明胶水解能力显著增强,但这种激活作用被aim2基因沉默所抑制。
120.以上所述实施方式仅表达了本发明的几种实施方式,其描述较为具体和详细,但
并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1