一种增强白参菌多糖生物活性的复合改性方法及其在调节人体肠道菌群中的应用
1.本发明属于食用菌深加工技术领域,具体而言,涉及一种增强白参菌多糖生物活性的改性方法及其在调节人体肠道菌群中的应用。
背景技术:
2.白参菌又称裂褶菌,是我国传统的食药两用菌。在古代,白参菌主要用于小儿盗汗、妇科疾病、神经衰弱、头昏耳鸣等防治。近代研究发现,白参菌中含有多种生物活性物质,如多糖、多酚及麦角甾醇等。早在上世纪60年代,日本学者就通过菌丝深层发酵技术获得了白参菌胞外多糖并证实其具有抗肿瘤作用。随后,人们发现白参菌多糖还具有免疫调节、抗癌、抗病毒和抗氧化等多种生物功能。
3.由于天然存在的白参菌多糖分子量通常在百万以上,在水中很难完全溶解;另外,白参菌多糖分子量太大,其生物活性也比较低,因此白参菌多糖的应用受到极大限制。针对白参菌多糖生物活性低的问题,许多研究者尝试通过化学改性的方法增强其生物活性,如:2005年中国专利cn100439401c报道了一种利用有机溶剂-氢氧化钠-氯乙酸制备羧甲基裂褶菌多糖的方法,制备的改性多糖对荷瘤小鼠肿瘤抑制率可达50%以上;2018年中国专利cn107674129b报道了一种利用磷酸化试剂制备磷酸化裂褶菌多糖的方法;2021年中国专利cn114014948a公开了利用三氧化硫-吡啶和浓硫酸制备硫酸酯化裂褶多糖的方法及其在化妆品中的应用。但这些方法普遍存在衍生化试剂价格昂贵,有机试剂使用量大、取代度不高、活性不强等诸多问题。化学取代的原理是多糖表面的羟基被羧甲基、磷酸基和硫酸基等取代的过程,如果多糖溶解性差,其与水溶液或者有机溶剂接触面小,羟基基团没有完全暴露,将会导致化学改性的取代度不高的问题,而取代度不高将严重影响多糖的生物活性。因此,亟需开发一种操作简便、花费少、取代度高的复合改性方法并有效解决多糖的溶解性问题。
技术实现要素:
4.针对目前裂褶菌多糖分子量大、溶解性差、生物活性较弱等问题,本发明的第一个目的在于提供一种增强白参菌多糖生物活性的复合改性方法。
5.为了实现上述技术目的,发明人结合多年来的天然产物提取分离经验,并通过大量试验研究并不懈探索,最终获得了如下技术方案:一种增强白参菌多糖生物活性的复合改性方法,该方法包括如下步骤:
6.(1)将白参菌多糖粗品或精品与蒸馏水混合制成0.1~1.0g/ml的混合液,将混合液放入
60
co辐照装置中进行γ射线处理,辐照强度为0.5~20kgy;
7.(2)辐照完成后,取出混合液,按照5~15mol/l比例,加入固体氢氧化钠颗粒,充分搅拌溶解后,按照固液质量比1%~10%加入氯乙酸,分3~5次加完;将混合液置于40~75℃条件下,反应2~6h;完成后,调节溶液ph至7.0,加入3~5倍体积的无水乙醇,在4℃温度
下静置8~16h;离心后,收集沉淀,用体积分数80%~90%乙醇水溶液洗涤2-3次;收集沉淀复溶于蒸馏水,过透过率为8000~10000da的透析袋,将袋内溶液旋蒸干燥即得改性白参菌多糖。
8.需要说明的是,本发明的试验研究发现,多糖粗品的液体样品经过辐照后的效果显著优于多糖粉末固体样品辐照效果,原因在于辐照通过高能射线使水分子发生电离,产生羟基自由基(ho
·
),羟基自由基作用于糖苷键或者糖肽链,使得多糖链被打断、链接的蛋白质脱落等,最终导致多糖分子量变小、包裹的蛋白脱落、增加多糖分子比表面积,从而使多糖分子中更多的羟基基团暴露于水中。这些暴露后的羟基基团与氯乙酸等试剂发生反应,形成羧甲基基团,因此白参菌多糖粗品与水形成混合液后经过辐照有利于提高多糖的取代度。
9.进一步优选地,如上所述增强白参菌多糖生物活性的复合改性方法,其步骤(1)中的白参菌多糖粗品按如下方法制备而得:取白参菌子实体,烘干后粉碎,将子实体粉末加入2~10倍量的水浸泡8~16h,使粉末充分吸水膨胀,调节ph值为5.8~6.2,加入复合酶,酶的用量为每千克子实体原料加入木瓜蛋白酶100~400万u、纤维素酶4.5~30万u及果胶酶10~50万u,36~37℃条件下酶解3~5h;将酶解液采用多频超声装置提取1~3次,每次20~40min,所述多频超声装置的提取条件为:超声频率40khz和80khz交替使用,每次使用4~6min,共计20~40min,超声功率为450~600w,提取温度为25~35℃;提取结束后离心,收集上清液,旋转蒸发浓缩后加入3~5倍无水乙醇过夜沉淀,沉淀烘干得到多糖粗品。
10.进一步优选地,如上所述增强白参菌多糖生物活性的复合改性方法,其步骤(1)中所述的多糖混合液的浓度为0.1~0.2g/ml。
11.进一步优选地,如上所述增强白参菌多糖生物活性的复合改性方法,其步骤(1)中所述的辐照强度为1~6kgy。
12.进一步优选地,如上所述增强白参菌多糖生物活性的复合改性方法,其步骤(2)中加入所述固体氢氧化钠颗粒的比例为5~12mol/l。
13.进一步优选地,如上所述增强白参菌多糖生物活性的复合改性方法,其步骤(2)中按照固液质量比2%~6%加入氯乙酸。
14.进一步优选地,如上所述增强白参菌多糖生物活性的复合改性方法,其步骤(2)加入氯乙酸后的反应温度为50~65℃,反应时间2~4h。
15.另外,本发明的第二个目的在于提供上述制备方法得到的改性白参菌多糖在制备调节人体肠道菌群结构药品、食品或保健品中的应用,所述调节人体肠道菌群结构为极大刺激肠道中减肥高度相关的坦纳菌科(tannerellaceae)的生长,降低肠道中毛螺菌科(lachnospiraceae)和拟杆菌科(bacteroidaceae)等菌群的丰度。
16.与现有技术相比,本发明制备的白参菌改性多糖取代度较高,达到1.0以上,并具有如下的有益效果:
17.(1)本发明制备的白参菌改性多糖较未处理多糖的分子量显著降低,并且溶解性非常好,溶解率增加了50%以上。
18.(2)体外发酵试验显示,本发明制备的白参菌改性多糖能极大刺激肠道减肥高度相关的坦纳菌科(tannerellaceae)的生长,降低毛螺菌科(lachnospiraceae)、拟杆菌科(bacteroidaceae)等菌群的丰度。
19.(3)本发明制备的白参菌改性多糖还增加了发酵液中总scfas及乙酸、丙酸、丁酸等小分子有机酸的含量,改善了scfas介导的能量供应调控情况。
20.综上所述,本发明制备方法简便高效,制备的白参菌改性多糖溶解性较好,羧甲基取代度较高,并且具有调节人体肠道中有益菌群的作用。
附图说明
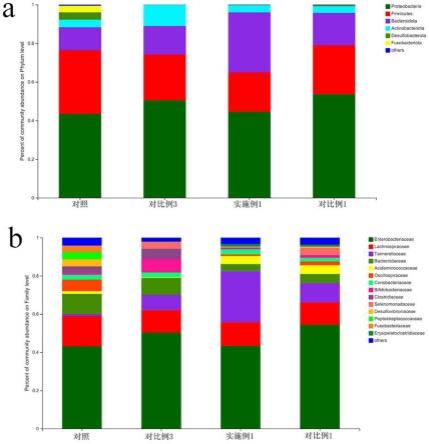
21.图1为各实验组肠道菌群在门和属水平上的差异性分析图。
具体实施方式
22.通过以下实施例对本发明进行详细描述,以使本发明的优点和特征能更易于被本领域技术人员理解,但并不以任何方式限制本发明。在不背离本发明的技术解决方案前提下,凡是利用本发明说明书内容所作的、本领域普通技术人员易于实现的任何改动或改变都将包括在本发明的专利保护范围内。
23.实施例1
24.取白参菌子实体,烘干后粉碎,将得到的子实体粉末加入10倍量的水浸泡过夜,使粉末充分吸水膨胀,调节ph值为6.0,加入复合酶,酶的用量为每千克子实体原料加入木瓜蛋白酶400万u、纤维素酶25万u及果胶酶30万u,37℃条件下酶解3h;将酶解液采用多频超声装置提取3次,每次20min,多频超声装置的提取条件为:超声频率40khz和80khz交替使用,每次使用5min,共计20min,超声功率为450w,提取温度为30℃;提取结束后离心,收集上清液,旋转蒸发浓缩后加入4倍无水乙醇沉淀过夜,沉淀烘干得到多糖粗品;将5g多糖粗品与50ml蒸馏水混合制成混合液,将混合液置于50ml离心管中,放入
60
co辐照装置中进行γ射线处理,辐照强度为3.0kgy;辐照完成后,取出混合液,按照6mol/l比例,加入固体氢氧化钠颗粒,充分搅拌溶解后,将混合液至于60℃条件下,分5次加入氯乙酸粉末,每次加入氯乙酸量为0.5g;反应温度60℃,反应时间3h;完成后,调节溶液ph至7.0,加入4倍无水乙醇,4℃过夜;离心后,收集沉淀,用90%乙醇水溶液洗涤3次;收集沉淀复溶于蒸馏水,过透过率为8000~10000da的透析袋,将袋内溶液旋蒸干燥即得改性白参菌多糖。
25.对比例1:未辐照处理
26.取白参菌子实体,烘干后粉碎,将得到的子实体粉末加入10倍量的水浸泡过夜,使粉末充分吸水膨胀,调节ph值为6.0,加入复合酶,酶的用量为每千克子实体原料加入木瓜蛋白酶400万u、纤维素酶25万u及果胶酶30万u,37℃条件下酶解3h;将酶解液采用多频超声装置提取3次,每次20min,多频超声装置的提取条件为:超声频率40khz和80khz交替使用,每次使用5min,共计20min,超声功率为450w,提取温度为30℃;提取结束后离心,收集上清液,旋转蒸发浓缩后加入4倍无水乙醇沉淀过夜,沉淀烘干得到多糖粗品;将5g多糖粗品与50ml蒸馏水混合制成混合液,按照6mol/l比例,加入固体氢氧化钠颗粒,充分搅拌溶解后,将混合液至于60℃条件下,分5次加入氯乙酸粉末,每次加入氯乙酸量为0.5g;反应温度60℃,反应时间3h;完成后,调节溶液ph至7.0,加入4倍无水乙醇,4℃过夜;离心后,收集沉淀,用90%乙醇水溶液洗涤3次;收集沉淀复溶于蒸馏水,过透析袋,将袋内溶液旋蒸干燥即得改性白参菌多糖。
27.对比例2:未进行透析处理
28.取白参菌子实体,烘干后粉碎,将得到的子实体粉末加入10倍量的水浸泡过夜,使粉末充分吸水膨胀,调节ph值为6.0,加入复合酶,酶的用量为每千克子实体原料加入木瓜蛋白酶400万u、纤维素酶25万u及果胶酶30万u,37℃条件下酶解3h;将酶解液采用多频超声装置提取3次,每次20min,所述多频超声装置的提取条件为:超声频率40khz和80khz交替使用,每次使用5min,共计20min,超声功率为450w,提取温度为30℃;提取结束后离心,收集上清液,旋转蒸发浓缩后加入4倍无水乙醇沉淀过夜,沉淀烘干得到多糖粗品;将5g多糖粗品与50ml蒸馏水混合制成混合液,将混合液置于50ml离心管中放入
60
co辐照装置中进行γ射线处理,辐照强度为3.0kgy;辐照完成后,取出混合液,按照6mol/l比例,加入固体氢氧化钠颗粒,充分搅拌溶解后,将混合液至于60℃条件下,分5次加入氯乙酸粉末,每次加入氯乙酸量为0.5g;反应温度60℃,反应时间3h;完成后,调节溶液ph至7.0,加入4倍无水乙醇,4℃过夜;离心后,收集沉淀,用90%乙醇水溶液洗涤3次;固体干燥即得改性白参菌多糖。
29.对比例3:使用氢氧化钠溶液和氯乙酸溶液作为溶剂
30.取白参菌子实体,烘干后粉碎,将得到的子实体粉末加入10倍量的水浸泡过夜,使粉末充分吸水膨胀,调节ph值为6.0,加入复合酶,酶的用量为每千克子实体原料加入木瓜蛋白酶400万u、纤维素酶25万u及果胶酶30万u,37℃条件下酶解3h;将酶解液采用多频超声装置提取3次,每次20min,所述多频超声装置的提取条件为:超声频率40khz和80khz交替使用,每次使用5min,共计20min,超声功率为450w,提取温度为30℃;提取结束后离心,收集上清液,旋转蒸发浓缩后加入4倍无水乙醇沉淀过夜,沉淀烘干得到多糖粗品;将5g多糖粗品与50ml蒸馏水混合制成混合液,将混合液置于50ml离心管中放入
60
co辐照装置中进行γ射线处理,辐照强度为3.0kgy;辐照完成后,取出混合液,加入50ml的12mol/l氢氧化钠溶液,充分搅拌混匀,将混合液至于60℃条件下,按照体积比1:1比例分批次加入8%氯乙酸溶液50ml,每次加入氯乙酸溶液量为10ml;反应温度60℃,反应时间3h;完成后,调节溶液ph至7.0,加入4倍无水乙醇,4℃过夜;离心后,收集沉淀,用90%乙醇水溶液洗涤3次;收集沉淀复溶于蒸馏水,过透析袋,将袋内溶液旋蒸干燥即得改性白参菌多糖。
31.对比例4:多糖粉末固体样品直接辐照处理
32.取白参菌子实体,烘干后粉碎,将得到的子实体粉末加入10倍量的水浸泡过夜,使粉末充分吸水膨胀,调节ph值为6.0,加入复合酶,酶的用量为每千克子实体原料加入木瓜蛋白酶400万u、纤维素酶25万u及果胶酶30万u,37℃条件下酶解3h;将酶解液采用多频超声装置提取3次,每次20min,多频超声装置的提取条件为:超声频率40khz和80khz交替使用,每次使用5min,共计20min,超声功率为450w,提取温度为30℃;提取结束后离心,收集上清液,旋转蒸发浓缩后加入4倍无水乙醇沉淀过夜,沉淀烘干得到多糖粗品;将多糖粗品放入
60
co辐照装置中进行γ射线处理,辐照强度为3.0kgy;辐照完成后,将5g辐照多糖粗品与50ml蒸馏水混合制成混合液,按照6mol/l比例,加入固体氢氧化钠颗粒,充分搅拌溶解后,将混合液至于60℃条件下,分5次加入氯乙酸粉末,每次加入氯乙酸量为0.5g;反应温度60℃,反应时间3h;完成后,调节溶液ph至7.0,加入4倍无水乙醇,4℃过夜;离心后,收集沉淀,用90%乙醇水溶液洗涤3次;收集沉淀复溶于蒸馏水,过透过率为8000~10000da的透析袋,将袋内溶液旋蒸干燥即得改性白参菌多糖。
33.实施例2:白参菌多糖改性后理化性质及生物活性效果实验
34.一、实验步骤
35.(1)溶解性实验:精确称取0.10g的多糖样品,置于装有20ml蒸馏水的烧杯中,将烧杯置于60℃恒温磁力搅拌器中,以60r/min转速进行匀速搅拌,直至多糖完全溶解。记录不同实施例制备的多糖的溶解时间,每个样品设3个重复。
36.(2)羧甲基取代度测定:取0.2g多糖样品完全溶解在50ml蒸馏水中,将ph调至8,然后滴入0.05mol/l硫酸标准溶液,直至溶液ph值为3.74,记录所用硫酸标准溶液的体积v(h2so4),取代度的计算公式如下:
[0037][0038][0039]
其中b为每克羧甲基化多糖样品消耗的h2so4,m为硫酸的摩尔浓度,mol/l;v为消耗标准硫酸的体积,ml;m为羧甲基多糖样品的质量,g。
[0040]
(3)对α-淀粉酶抑制活性测定:精密吸取20.0μl 4.0mg/ml多糖样品和20.0μlα-淀粉酶溶液(1.0u/ml)混合在1.5ml离心管中,在37℃条件下水浴10min。再加入0.5%淀粉溶液40.0μl,37℃条件下继续反应10min。最后加入dns试剂80.0μl,在沸水浴中加热5min后取出。在540nm波长处测量吸光值,以阿卡波糖作为阳性对照,每个样品设3个重复。α-淀粉酶抑制率按下列公式计算:
[0041][0042]
其中,a0为空白组吸光值,即pbs(ph=7.0)代替样品;a1为样品组反应吸光值;a2为对照组吸光值,即pbs代替α-淀粉酶溶液。
[0043]
(4)和α-糖苷酶抑制活性测定:精密吸取pbs(ph=6.8)120.0μl,4.0mg/ml多糖样品20.0μl和α-葡萄糖苷酶溶液(1000u/ml)20.0μl混合在1.5ml离心管中,在37℃条件下水浴10min。再加入20.0μl浓度为5mmol/l的pnpg,37℃下继续反应20min。最后加入80.0μl浓度为0.2mol/lna2co3溶液,充分混匀后在405nm波长处测定吸光值,以阿卡波糖作为阳性对照,每个样品设3个重复。α-葡萄糖苷酶抑制率按下列公式计算:
[0044][0045]
其中,a0为空白组吸光值,即pbs(ph=6.8)代替样品;a1为样品组反应吸光值;a2为对照组吸光值,即pbs代替α-葡萄糖苷酶溶液。
[0046]
(5)体外发酵实验:收集4名志愿者(两男两女)粪便,等量混合后,将1.0g新鲜粪便加入到10ml的0.1mol/l的磷酸盐缓冲液(ph 7.0)中,处理成10%(w/v)的粪便悬浊液。吸取500μl悬浮液分别接种于酵母浸粉-水解酪蛋白-脂肪酸(ycfa)培养基和添加千分之五多糖样品的ycfa培养基中,37℃厌氧培养24h。
[0047]
(6)微生物菌群结构及多样性分析:发酵产物委托公司进行肠道微生物测序(n=6)。基于otu可以进行多种多样性指数分析,基于otu聚类分析结果,可以对otu进行多种多样性指数分析以及对测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。
[0048]
(7)短链脂肪酸含量测定:发酵48h后取发酵上清液500μl,加入100μl巴豆酸偏磷
酸溶液,振荡混匀后-30℃酸化反应24h,随后将样品于4℃、10000r/min离心3min,上清液过0.22μm有机滤膜,进行gc-ms检测分析。
[0049]
二、结果分析
[0050]
(1)不同样品溶解性、取代度以及对α-淀粉酶和α-糖苷酶抑制活性。
[0051]
表1不同样品的溶解性、取代度以及对α-淀粉酶和α-糖苷酶抑制活性
[0052][0053]
实施例1、对比例1、对比例2、对比例3和对比例4获得的不同样品溶解性、取代度以及对α-淀粉酶和α-糖苷酶抑制活性如表1所示。实施例1和对比例4中多糖溶解性和取代度都优于对比例1,这表明辐照处理能有效增加多糖溶解性和取代度;但是实施例1中多糖溶解性和取代度高于对比例1,这表明多糖粗品的液体样品经过辐照后的效果显著优于多糖粉末固体样品辐照效果。相较于对比例1,实施例1多糖溶解性增加了50%以上;此外,实施例1多糖取代度比对比例3增加94.8%,这表明辐照处理造成了多糖降解,从而使得多糖的羟基基团暴露出来,与氯乙酸等试剂发生取代反应,显著增加了羧基取代度。实施例1多糖对α-淀粉酶和α-糖苷酶抑制活性显著高于对比例1、对比例3和对比例4,这表明羧基基团取代度越高,对酶的抑制活性越好。
[0054]
(2)人体肠道菌群体外发酵实验中不同样品肠道菌群组成以及短链脂肪酸含量
[0055]
各实验组肠道菌群在门分类水平上的组成如图1和表2所示。由图1a可知:小鼠的肠道菌群主要由4个门组成,即变形菌门(proteobacteria)、厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)、放线细菌门(actinobacteriota)等,其中的优势菌群是变形菌门、厚壁菌门和拟杆菌门。与对照组相比,实施例1、对比例1和对比例2中变形菌门含量大大增加,厚壁菌门含量显著减少,拟杆菌门含量显著增加,尤其是实施例1中拟杆菌门含量较对照组增加了1.61倍。各实验组肠道菌群在种水平上的差异性分析如图1b所示。与对照组相比,实施例1中lachnospiraceae菌、bacteroidaceae菌大量减少,减肥高度关联菌群tannerellaceae菌和acidaminococcaceae菌显著增加。与对比例1和对比例2相比,实施例1中tannerellaceae菌分别增加了2.12和1.63倍。
[0056]
在短链脂肪酸含量方面,实施例1中乙酸、丙酸、丁酸和总短链脂肪酸含量显著高于对照组、对比例3和对比例1,这表明本发明制备的白参菌多糖显著增加了人体肠道菌群发酵产物中的短链脂肪酸含量。
[0057]
表2不同实验组中肠道菌群组成以及短链脂肪酸含量
[0058][0059]
以上的研究结果显示,本发明制备的白参菌改性多糖取代度高、溶解性好,能有效抑制α-淀粉酶和α-糖苷酶活性,这表明白参菌改性多糖可能具有一定减肥功效;此外,本发明制备的白参菌改性多糖能够显著增加减肥高度关联菌群tannerellaceae菌,显著降低毛螺菌科(lachnospiraceae)、拟杆菌科(bacteroidaceae)等菌群的丰度;还能增加发酵液中总scfas及乙酸、丙酸、丁酸等小分子有机酸的含量,改善scfas介导的能量供应调控情况。结果表明,本发明制备的白参菌改性多糖可以作为潜在的健康补充剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1