一种抑制肉羊皮下脂肪细胞增殖和脂肪合成代谢的方法
1.本发明属于饲料活性物质开发技术领域,尤其涉及一种抑制肉羊皮下脂肪细胞增殖和脂肪合成代谢的方法。
背景技术:
2.在羊肉生产中,胴体中的皮下和肌内脂肪含量是评价肉品质的重要指标,其中皮下脂肪厚度影响羊的胴体品质,肌内脂肪含量影响羊肉品质。肉羊在生长过程中,脂肪沉积的先后顺序一般为器官周围脂肪、皮下脂肪和肌内脂肪。动物机体的脂肪形成需要摄入更多的能量物质,皮下脂肪的沉积既降低了肉羊屠体瘦肉率,又增加了肉羊饲养成本。因此,有效降低皮下脂肪的沉积是肉羊产业节本增效的关键点之一。
3.桑黄素(morin)是从植物中分离得到的天然活性物质,是植物中多酚类次级代谢产物,在自然界分布广泛。其分子式为c
15h10
o7,结构为含氧的杂环连接两个芳香环。有研究表明,桑黄素有良好的抗氧化和抗癌作用。同时,体内外实验表明桑黄素具有显著的抗炎作用。在一些动物模型中,桑黄素可抑制mmp-2和mmp-9的表达。此外,桑黄素具有抗氧化以及降低血糖等功能。临床上可用于抗病毒感染,治疗胃病、慢性炎症和冠心病。对伤寒杆菌、痢疾杆菌和金黄色葡萄球菌有抗菌作用。因此,桑黄素有广泛的市场前景,对其开发利用将有深远的意义。
4.目前,关于桑黄素在羊皮下脂肪细胞增殖和脂肪合成代谢中的应用尚不清楚,因此申请人对其展开研究。申请人发现桑黄素作为一种植物中的天然多酚类活性物质,具有抑制肉羊皮下脂肪细胞的增殖和脂质代谢的作用,为实现通过抑制皮下脂肪的生成、降低无效脂肪的积累、提高肉羊生产效率提供了一种有效方法。
技术实现要素:
5.本发明的目的在于提供一种抑制肉羊皮下脂肪细胞增殖和脂肪合成代谢的方法。
6.为实现上述目的,本发明提供了如下技术方案:
7.一种抑制肉羊皮下脂肪细胞增殖和脂肪合成代谢的方法,其特征在于,所述方法包括如下步骤:
8.(1)将肉羊皮下脂肪细胞接种于细胞培养器具中,加入细胞培养基;
9.(2)细胞贴壁后,将桑黄素加入细胞培养基中,进行进一步的细胞增殖培养或成脂培养。
10.桑黄素在制备抑制肉羊皮下脂肪细胞增殖的生物制剂中的应用。
11.桑黄素在制备促进肉羊皮下脂肪细胞凋亡的生物制剂中的应用。
12.桑黄素在制备抑制肉羊皮下脂肪细胞成脂过程的生物制剂中的应用。
13.桑黄素在制备促进肉羊皮下脂肪细胞中凋亡促进基因bax表达的生物制剂中的应用。
14.桑黄素在制备抑制肉羊皮下脂肪细胞中凋亡抑制基因bcl-2表达的生物制剂中的
应用。
15.桑黄素在制备促进脂肪细胞中脂肪分解关键基因ampkα表达的生物制剂中的应用。
16.桑黄素在制备促进脂肪细胞中脂肪甘油三酯脂肪酶和激素敏感脂肪酶基因表达的生物制剂中的应用。
17.桑黄素在制备抑制肉羊皮下脂肪沉积的饲料中的应用。
18.优选的,所述应用包括抑制肉羊皮下脂肪细胞增殖,促进肉羊皮下脂肪细胞凋亡,抑制肉羊皮下脂肪细胞脂肪生成。
19.本发明的有益效果是:
20.本发明桑黄素可以有效的抑制肉羊皮下脂肪细胞的增殖并且促进肉羊皮下脂肪细胞的凋亡;
21.同时,本发明发现桑黄素可以有效的抑制肉羊皮下脂肪细胞的脂肪合成代谢。
附图说明
22.图1为不同浓度桑黄素对肉羊前体皮下脂肪细胞凋亡的影响;
23.图2为不同浓度桑黄素对肉羊皮下脂肪细胞脂肪生成的影响。
具体实施方式
24.所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
25.实施例1
26.肉羊皮下脂肪细胞的分离与纯化
27.1.将肉羊背部的取样位置的毛清理干净,用碘酊和酒精消毒后通过外科手术取1cm3皮下脂肪组织块;
28.2.在超净台内将肉羊皮下脂肪组织可见的血管和结缔组织去除,用含2%双抗(青霉素、链霉素)的pbs冲洗数遍,边冲洗边将组织块剪成小块,冲洗干净后用一次性培养皿蘸取表面pbs液体多次,直至无水滴为止;
29.3.将处理后组织块用手术剪剪至糜状,用镊子贴到t25细胞培养瓶底壁,翻转培养瓶,缓缓加入5ml细胞培养液(dmem/f12+10%fbs+1%双抗),底壁朝上放入培养箱静置4h,轻轻翻转培养瓶,使培养液与组织块接触(若组织块漂浮,可适当延长翻转时间);
30.4.翻转培养瓶后静置培养3天后可见有细胞由组织块边缘游离,期间避免晃动培养瓶,以免组织块漂浮。待细胞铺至瓶底30%时,轻轻换液,尽量保留贴壁的组织块,然后根据细胞生长情况适时换液,细胞长至70%左右时即可消化传代。
31.实施例2
32.脂肪细胞的诱导与分化
33.1.肉羊皮下脂肪细胞用dmem/f12生长培养液(500ml dmem/f12培养液+50ml胎牛血清+5ml双抗)稀释后,以6
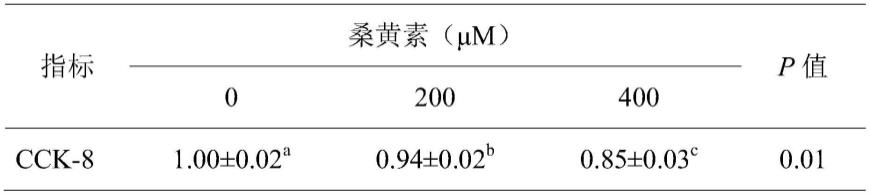
×
104个/cm2密度接种于培养瓶或培养板中,于37℃、通入5%co2的培养箱内培养,每2d换一次生长培养液;
34.2.待细胞汇合后,更换生长培养液为dmem/f12诱导分化培养液(dmem/f12生长培养液+10μg/ml牛胰岛素+0.5mm甲基异丁基黄嘌呤+1μm地塞米松),诱导前体脂肪细胞分化为脂肪细胞;
35.3.48h后(定为分化0d),更换诱导分化培养液为基础分化培养液(dmem/f12生长培养液+10μg/ml牛胰岛素)。
36.实施例3
37.测定不同浓度桑黄素对于肉羊皮下脂肪细胞增殖的影响
38.1.将5
×
104个细胞/cm2密度接种在96孔板中,并使用5个孔作为重复。
39.2.24h后,使用0,200μm,400μm桑黄素(dmso配置)处理细胞;
40.3.处理48h之后,除去上清液,并在37℃下将90μl无胎牛血清培养液加上10μl cck-8溶液加入到每个孔中2小时;
41.4.使用biotek elx808微板读数器(biotek)在450nm处测量吸光度,得到的结果如表1所示。
42.表1不同浓度桑黄素对肉羊前体皮下脂肪细胞增殖的影响
[0043][0044]
从表1中,可以看出添加200μm桑黄素时,相对od值为0.94,添加400μm桑黄素od值为0.85,p值小于0.05,差异具有统计学意义。上述结果说明添加200μm或者400μm的桑黄素对肉羊前体皮下脂肪细胞增殖有显著抑制作用。
[0045]
实施例4
[0046]
测定不同浓度桑黄素对于肉羊皮下脂肪细胞凋亡的影响
[0047]
1.5
×
104个细胞/cm2密度制作细胞爬片;
[0048]
2.使用0,200μm,400μm桑黄素(dmso配置)处理细胞;
[0049]
3.处理48h后,除去上清液,使用磷酸盐缓冲液冲洗细胞2次;
[0050]
4.使用hoechst33342活细胞染色液进行染色,染色细胞的图像由倒置荧光显微镜(leica)拍摄,得到的结果如图1所示。
[0051]
从图1结果可以看出,添加桑黄素至400μm使细胞核染色亮度增加,促进了肉羊前体皮下脂肪细胞的凋亡过程。
[0052]
实施例5
[0053]
测定不同浓度桑黄素对于肉羊皮下脂肪细胞中凋亡基因bax和bcl-2的影响
[0054]
1.将对数生长期的肉羊皮下脂肪细胞接种于6孔培养板中,过夜培养后,使用0,200μm,400μm桑黄素(dmso配置)处理细胞;
[0055]
2.使用trizol试剂(invitrogen)提取每个样品的总rna;
[0056]
3.使用nanodrop 2000光谱仪(thermo scientific)通过测量a260:a280比率(1.8-2.0)和在1%琼脂糖中进行电泳来分析rna纯度和完整性;
[0057]
4.用hiscript第一链cdna合成试剂盒(vazyme)合成cdna;
[0058]
5.设计并合成bax和bcl-2的实时荧光定量(q-pcr)引物,引物序列如下:
[0059]
6.使用chamq sybr color qpcr master mix(vazyme)荧光染料和lightcycler(roche)荧光定量仪进行q-pcr,条件如下:阶段1、95℃ 30s;阶段2、95℃ 10s和60℃ 30s,40个循环;阶段3、95℃ 15s,60℃ 60s和95℃ 15s;
[0060]
7.以β-actin为内参基因,用2-δδct
方法计算相对基因表达水平,得到的结果如表2所示。
[0061]
表2不同浓度桑黄素对于细胞凋亡相关基因相对表达量的影响
[0062][0063]
从表2中可以看出,使用桑黄素处理细胞后,上调了反应促凋亡过程的基因bax相对表达量,下调了抑制凋亡过程的基因bcl-2的相对表达量,这说明添加桑黄素促进肉羊皮下脂肪细胞的凋亡过程。
[0064]
实施例6
[0065]
测定不同浓度桑黄素对于肉羊皮下脂肪细胞中脂肪生产的影响
[0066]
1.将成脂分化后的肉羊脂肪细胞以5
×
104个细胞/cm2密度铺在6孔板中的盖玻片上,添加2ml生长培养基温育过夜;
[0067]
2.使用0,200μm,400μm桑黄素(dmso配置)处理细胞;
[0068]
3.处理48h后,使用油红o染色试剂盒对细胞进行染色;
[0069]
4.染色后,染色细胞使用荧光显微镜拍摄,得到的结果如图2所示。
[0070]
从图2中可以看出,添加桑黄素后,脂肪细胞中脂滴的数量明显减少,说明添加桑
黄素抑制了肉羊分化皮下脂肪细胞的脂肪生产过程。
[0071]
实施例7
[0072]
1.将对数生长期的肉羊皮下脂肪细胞接种于6孔培养板中,过夜培养后,使用0,200μm,400μm桑黄素(dmso配置)处理细胞;
[0073]
2.使用trizol试剂(invitrogen)提取每个样品的总rna;
[0074]
3.使用nanodrop 2000光谱仪(thermo scientific)通过测量a260:a280比率(1.8-2.0)和在1%琼脂糖中进行电泳来分析rna纯度和完整性;
[0075]
4.用hiscript第一链cdna合成试剂盒(vazyme)合成cdna;
[0076]
5.设计并合成ampkα,atgl和hsl的实时荧光定量(q-pcr)引物,引物序列如下:
[0077][0078]
6.使用chamq sybr color qpcr master mix(vazyme)荧光染料和lightcycler(roche)荧光定量仪进行q-pcr,条件如下:阶段1、95℃ 30s;阶段2、95℃ 10s和60℃ 30s,40个循环;阶段3、95℃ 15s,60℃ 60s和95℃ 15s;
[0079]
7.以β-actin为内参基因,用2-δδct
方法计算相对基因表达水平,得到的结果如表3所示。
[0080]
表3不同浓度桑黄素对脂质代谢相关基因相对表达量的影响
[0081][0082][0083]
从表3中可以看出,添加桑黄素后,上调了肉羊皮下脂肪细胞中促进脂肪分解的关键基因ampka,并且上调了脂肪分解相关酶脂肪甘油三酯脂肪酶(atgl)和激素敏感脂肪酶(hsl)的基因相对表达量。说明桑黄素可以抑制肉羊皮下脂肪细胞的脂肪合成代谢。
[0084]
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1