鉴别布鲁氏菌疫苗株A19的SNP分子标记、引物探针、试剂盒、方法和应用与流程
鉴别布鲁氏菌疫苗株a19的snp分子标记、引物探针、试剂盒、方法和应用
技术领域
1.本发明属于生物、分子标记技术领域,尤其是一种鉴别布鲁氏菌疫苗株a19的snp分子标记、引物探针、试剂盒、方法和应用。
背景技术:
2.布鲁氏菌在系统分类学属于变形菌门,α-变形菌纲,根瘤菌目,布鲁氏菌科,布鲁氏菌属。根据布鲁氏菌的宿主偏好、致病性以及生化特征不同,布鲁氏菌属目前包括12个种:羊种布鲁氏菌(b.melitensis)、牛种布鲁氏菌(b.abortus)、猪种布鲁氏菌(b.suis)、犬种布鲁氏菌(b.canis)、沙林鼠种布鲁氏菌(b.neotomae)、绵羊附睾种布鲁氏菌(b.ovis)、鲸种布鲁氏菌(b.ceti)、鳍种布鲁氏菌(b.pinnipediae)、田鼠种布鲁氏菌(b.microti)、人源布鲁氏菌(b.inopinata)、狒狒种布鲁氏菌(b.papionis)和赤狐种布鲁氏菌(b.vulpis)。感染人的布鲁氏菌主要包括羊种布鲁氏菌、牛种布鲁氏菌和猪种布鲁氏菌,对于人类公共卫生造成了严重威胁。不同种的基因组大小和组成相似,gc含量为55%~59%。
3.我国现行牛群的免疫常用牛种布鲁氏菌19号菌株活菌苗(a19菌苗),免疫后产生的抗体与自然感染野毒株产生的抗体难以鉴别,必然导致一些自然感染的病畜逃避检疫,使患病动物长期存在。寻找布鲁氏菌疫苗免疫与自然感染的鉴别诊断方法,一直是布病诊断学研究的热点和难点。从病原学方面鉴别诊断布鲁氏菌野毒株核酸,可以准确判断动物体是否带菌,为布病阳性动物的检疫淘汰提供支撑。利用比较基因组学分析疫苗株和野毒株在基因组水平的差异,有助于开发疫苗株和野毒株鉴别诊断的新方法。基于筛选得到的snp位点,设计引物和探针,建立实时荧光定量pcr(real-time pcr)方法,完全可以满足检验检疫、流行病学调查和疫情处置、人和动物布病诊断等多方面的需求。因此,开发可区分鉴别布鲁氏菌疫苗株a19的分子标记以及简便、快速、特异、而低成本的real-time pcr鉴定方法具有重要意义。
4.通过检索,尚未发现与本发明专利申请相关的专利公开文献。
技术实现要素:
5.本发明目的在于克服现有技术中的不足之处,提供一种鉴别布鲁氏菌疫苗株a19的snp分子标记、引物探针、试剂盒、方法和应用。
6.本发明解决其技术问题所采用的技术方案是:
7.一种用于鉴别布鲁氏菌疫苗株a19的snp分子标记,所述分子标记位于布鲁氏菌疫苗株a19的基因组gca_003290345.1的bab1-1763基因的第367位,多态性为a/c,布鲁氏菌疫苗株a19为t,布鲁氏菌野毒株或两株非a19布鲁氏菌疫苗株s2和m5为c;
8.其中,bab1-1763基因的基因序列如seq id no.1所示。
9.如上所述的用于鉴别布鲁氏菌疫苗株a19的snp分子标记的检测引物组,所述检测引物组为bsnp1f和bsnp1r,bsnp1f的核苷酸序列为seq id no.2,bsnp1r的核苷酸序列为
seq id no.3。
10.如上所述的检测引物组在鉴定布鲁氏菌疫苗株a19或在制备鉴定布鲁氏菌疫苗株a19的试剂盒中的应用。
11.如上所述的检测引物组的配套使用的探针组,其特征在于:所述探针组为bsnp1t和bsnp1c,bsnp1t的核苷酸序列为seq id no.4,bsnp1c的核苷酸序列为seq id no.5。
12.进一步地,所述探针为mgb探针,荧光基团选自fam、vic、hex、cy5、tet、joe、cy3、tamra、rox中的任一种;
13.或者,所述探针bsnp1c所示探针的5’端采用vic标记,bsnp1t所示探针的5’端采用fam标记,3’端采用bhq1标记。
14.如上所述的探针组在鉴定布鲁氏菌疫苗株a19或在制备鉴定布鲁氏菌疫苗株a19的试剂盒中的应用。
15.一种用于鉴别布鲁氏菌疫苗株a19的试剂盒,所述试剂盒包括引物组和探针组;
16.所述引物组为bsnp1f和bsnp1r,bsnp1f的核苷酸序列为seq id no.2,bsnp1r的核苷酸序列为seq id no.3;
17.所述探针组为bsnp1t和bsnp1c,bsnp1t的核苷酸序列为seq id no.4,bsnp1c的核苷酸序列为seq id no.5。
18.进一步地,所述试剂盒还包括用于real-time pcr检测的其他试剂,包括但不限于反应缓冲液、dntp、dna聚合酶、ddh2o、标准阳性质粒模板、阴性对照等。
19.一种如上所述的试剂盒鉴别布鲁氏菌疫苗株a19的方法,包括如下步骤:
20.(1)提取待测样品的基因组dna;
21.(2)以所述基因组dna为模板,利用引物组与探针组进行real-time pcr;
22.(3)根据扩增曲线判断待测样品是否为布鲁氏菌疫苗株a19。
23.进一步地,所述步骤(2)中,real-time pcr的反应程序包括:95℃,5-10分钟;95℃,10-30秒,62℃,20-30秒,35-45个循环;
24.或者,所述步骤(2)中,real-time pcr的反应体系中所示引物组的浓度为300-350nm,探针组的浓度为200-250nm;
25.或者,所述步骤(3)中若引物组与探针能够获得vic扩增曲线,则待测样品为布鲁氏菌疫苗株a19;若引物组与探针能够获得fam扩增曲线,则待测样品为布鲁氏菌野毒株或两株非a19布鲁氏菌疫苗株s2和m5。
26.本发明取得的优点和积极效果为:
27.1、本发明的snp分子标记及其检测引物对和探针对可进行布鲁氏菌疫苗株a19和野毒株、布鲁氏菌其他疫苗株快速同步检测和分析,有效提高了检测效能(保证了特异性,避免动物误杀,维护了养殖户和国家利益,为养殖场净化和建设无疫区/小区提供了精准的技术手段),可实现布鲁氏菌的快速检测和分型,对分离菌株进行简便和高效的鉴定,对于布鲁氏菌的快速识别和鉴定、布鲁氏菌病病原监测和流行病学分析具有重要的意义,为布鲁氏菌病防控提供高效的技术支撑。
28.2、本发明基于最小核心组分型技术进行布鲁氏菌疫苗株a19与其他疫苗株、野毒株的全基因组比对分析,分析覆盖了ncbi数据库所有公开的中国流行菌株、国际参考菌株和国际流行株,有效保证了筛选得到的snp位点的高特异性和准确性。
29.3、本发明基于筛选得到的snp分子标记,开发了一对用于鉴别布鲁氏菌疫苗株a19和野毒株的引物对和一对mgb探针,探针之间可相互验证,利用该引物对和探针对可实现布鲁氏菌疫苗株a19和野毒株、其他布鲁氏菌疫苗株的高效、准确的鉴别。
附图说明
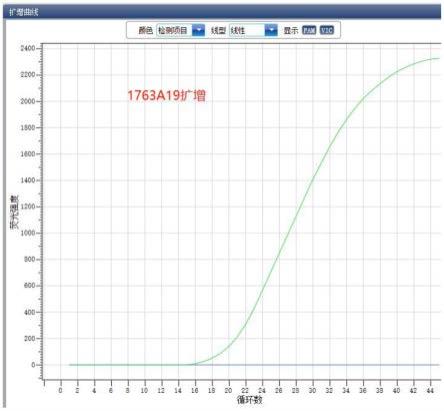
30.图1为本发明中用含有布鲁氏菌疫苗株a19的bsnp1基因的阳性质粒验证引物和探针特异性的评价结果图;
31.图2为本发明中用含有布鲁氏菌疫苗株s19的bsnp1基因的阳性质粒验证引物和探针特异性的评价结果图。
具体实施方式
32.下面详细叙述本发明的实施例,需要说明的是,本实施例是叙述性的,不是限定性的,不能以此限定本发明的保护范围。
33.本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
34.一种用于鉴别布鲁氏菌疫苗株a19的snp分子标记,所述分子标记位于布鲁氏菌疫苗株a19的基因组gca_003290345.1的bab1-1763基因的第367位,多态性为a/c,布鲁氏菌疫苗株a19为t,布鲁氏菌野毒株或两株非a19布鲁氏菌疫苗株s2和m5为c;
35.其中,bab1-1763基因的基因序列如seq id no.1所示。
36.如上所述的用于鉴别布鲁氏菌疫苗株a19的snp分子标记的检测引物组,所述检测引物组为bsnp1f和bsnp1r,bsnp1f的核苷酸序列为seq id no.2,bsnp1r的核苷酸序列为seq id no.3。
37.如上所述的检测引物组在鉴定布鲁氏菌疫苗株a19或在制备鉴定布鲁氏菌疫苗株a19的试剂盒中的应用。
38.如上所述的检测引物组的配套使用的探针组,其特征在于:所述探针组为bsnp1t和bsnp1c,bsnp1t的核苷酸序列为seq id no.4,bsnp1c的核苷酸序列为seq id no.5。
39.较优地,所述探针为mgb探针,荧光基团选自fam、vic、hex、cy5、tet、joe、cy3、tamra、rox中的任一种;
40.或者,所述探针bsnp1c所示探针的5’端采用vic标记,bsnp1t所示探针的5’端采用fam标记,3’端采用bhq1标记。
41.如上所述的探针组在鉴定布鲁氏菌疫苗株a19或在制备鉴定布鲁氏菌疫苗株a19的试剂盒中的应用。
42.一种用于鉴别布鲁氏菌疫苗株a19的试剂盒,所述试剂盒包括引物组和探针组;
43.所述引物组为bsnp1f和bsnp1r,bsnp1f的核苷酸序列为seq id no.2,bsnp1r的核苷酸序列为seq id no.3;
44.所述探针组为bsnp1t和bsnp1c,bsnp1t的核苷酸序列为seq id no.4,bsnp1c的核苷酸序列为seq id no.5。
45.较优地,所述试剂盒还包括用于real-time pcr检测的其他试剂,包括但不限于反应缓冲液、dntp、dna聚合酶、ddh2o、标准阳性质粒模板、阴性对照等。
46.一种如上所述的试剂盒鉴别布鲁氏菌疫苗株a19的方法,包括如下步骤:
47.(1)提取待测样品的基因组dna;
48.(2)以所述基因组dna为模板,利用引物组与探针组进行real-time pcr;
49.(3)根据扩增曲线判断待测样品是否为布鲁氏菌疫苗株a19。
50.较优地,所述步骤(2)中,real-time pcr的反应程序包括:95℃,5-10分钟;95℃,10-30秒,62℃,20-30秒,35-45个循环;
51.或者,所述步骤(2)中,real-time pcr的反应体系中所示引物组的浓度为300-350nm,探针组的浓度为200-250nm;
52.或者,所述步骤(3)中若引物组与探针能够获得vic扩增曲线,则待测样品为布鲁氏菌疫苗株a19;若引物组与探针能够获得fam扩增曲线,则待测样品为布鲁氏菌野毒株或除布鲁氏菌疫苗株外的疫苗株。
53.具体地,相关制备及检测实施例如下:
54.本发明首次基于最小核心组分型技术对布鲁氏菌全基因组信息进行系统的分析。具体从ncbi公开数据库下载牛种布鲁氏菌(共178株)公开的complete和scaffold基因组,基于blast方法,将a19疫苗株基因组gca_003290345.1(已公开。)作为参考基因组,与178株牛种布鲁氏菌的基因组依次比对,如相似度大于60%且比对序列超过原序列的70%,则认为该基因存在于该基因组中。按照此分析策略,搜索出在178株牛种布氏菌中存在的core gene。利用mummer程序,将core gene序列与178个基因组依次比对,查找snp位点,并构建snp矩阵。
55.将a19疫苗株基因组gca_003290345.1定义为group 1(疫苗组);将178株布鲁氏菌野毒株及两株非a19布鲁氏菌疫苗株s2(猪种)和m5(羊种)定义为group2。基于上一步获得的snp矩阵,共105789个snp,筛查可以区分两组菌株的单核苷酸多态性(single nucleotide polymorphism,snp)位点。可区分两组菌株的snp位点应具有在该位点组内各菌株间无差异,组间不同的特点。按照以上策略,最终筛选到可准确鉴定布鲁氏菌疫苗株a19的1个snp位点,并设计和筛选用于检测该snp分子标记的引物和探针。
56.更为具体地,相关制备及检测如下:
57.实施例1用于鉴定布鲁氏菌疫苗株a19的核心snp分子标记的获得
58.1、利用最小核心组分型方法对布鲁氏菌全基因组信息进行系统的分析
59.(1)从美国生物技术信息中心(national center for biotechnology information,ncbi)genbank数据库(http://www.ncbi.nlm.nih.gov/genome/)下载牛布鲁氏菌(共178株)公开的complete和scaffold基因组。
60.(2)基于blast方法,将布鲁氏菌疫苗株a19 gca_003290345.1的基因与178株布鲁氏菌的基因组依次比对,如相似度大于60%且比对序列超过原序列的70%,则认为该基因存在于该基因组中。按照此分析策略,搜索出在所有菌株中存在的core gene,共计2368个。
61.(3)利用mummer程序,将core gene序列与178个基因组依次比对,查找snp位点,并构建snp矩阵。将1株a19疫苗株定义为group 1(疫苗组);将178株布鲁氏菌野毒株及两株非a19布鲁氏菌疫苗株s2(猪种)和m5(羊种)定义为group2。基于上一步获得的snp矩阵,筛查可以区分两组菌株的snp位点。可区分两组菌株的snp位点应具有在该位点组内各菌株间无差异,组间不同的特点。按照以上策略,共筛选出1个候选靶基因snp位点。
62.(4)在候选snp位点上下游设计引物和探针,对不同的牛种布鲁氏菌野毒株和两株非a19布鲁氏菌疫苗株s2(猪种)和m5(羊种)进行扩增验证,经筛选,最终得到可准确区分布鲁氏菌疫苗株a19和不同布鲁氏菌野毒株和两株非a19布鲁氏菌疫苗株s2(猪种)和m5(羊种)的snp分子标记,该snp分子标记位于布鲁氏菌疫苗株a19的基因组gca_003290345.1的bab1-1763基因的第367位(bab1-1763基因的基因序列如seq id no.1所示序列),多态性为a/c,a19疫苗株为t,野毒株或其他疫苗株为c。
63.序列及snp位点(seq id no.1)如下:
64.》_1763(367碱基处,野生型c,a19疫苗株t)
65.atgctgtttcaatccgaaccatctgcttcgatatcgttttcacctgcgcacagcatcgatggcgatttcagccggggcctgctcctgaccgcagaccatgcccgccgcgatgttccgccggaatatggcacactgggtttgcggacaagtgaattcgaccggcatatcgcctatgatatcggcgttgaggccctcacccgcgaacttgccgcccgtcttgatgcacccgccgtgatgggaggcttttcacggcttctcatcgaccccaatcgcggtgaggacgatccgaccctcatcatgcaattgtcggacggtgcggttatttcctgcaattatcccatgtcggcggaagaacgtgaagaacggctggcgcgcttttatcgcccctatcacaatgccatagcggcagcgagcgcgcgcgtggcggctgaaagcggcaaggcgcccttcattgtttccatccattccttcacgccgcactggaagggcacggcgcggccctggcatatcggccttctctgggatcgcgacgaccgcgccgtgaagccgctgctttccatgctgcgcgaaaatcctgatctcgtggtcggggataatgaaccctatgacggcgccctgcgtaacgacgccatgtatcgccacgcaacggcacaaggctttgcccatgtcttgatcgaagtgcggcaagacctgatcgcagaaccttccggcgcgagcgaatgggcaaaacggcttgcccccttgctcgcaagggtcaacacgcttgatggaattcacgagatccgccatttcggttcccggacggattttgcgggttga
66.2、snp分子标记的检测引物、探针以及检测方法
67.上述实施例1中最终筛选得到的snp分子标记的检测引物和探针的核苷酸序列如seq id no.2-5所示:
68.seq id no.2bsnp1f:5
’‑
ggtgcggttatttcctgcaa-3’69.seq id no.3bsnp1r:5
’‑
ccgctatggcattgtgatagg-3’70.seq id no.4bsnp1t:5
’‑
tgaagaacggttggc-3’71.seq id no.54bsnp1c:5
’‑
tgaagaacggctggc-3’72.分别以含有布鲁氏菌疫苗株a19的bab1-1763基因的阳性质粒和含有布鲁氏菌野毒株的bab1-1763基因的阳性质粒为模板,采用如seq id no.2-5所示的引物和探针进行rt-pcr扩增。
73.rt-pcr的20μl反应体系为:2
×
rt-pcrmix 10μl,引物和探针混合液(seq id no.2-3所示引物和seq id no.4-5所示探针)2μl,去离子水6μl,阳性质粒模板dna 2μl。seq id no.2-3所示引物在反应体系中的终浓度为300nm,seq id no.4-5所示探针在反应体系中的终浓度为200nm。
74.rt-pcr的反应条件为:95℃,10分钟;95℃,15秒,62℃,30秒,40个循环。
75.阳性质粒模板的扩增曲线如图1、图2所示,利用该snp分子标记的检测引物和探针可对布鲁氏菌疫苗株a19和野毒株分别扩增得到特异性扩增曲线。若seq id no.2-3所示的引物组与seq id no.4所示的探针能够获得扩增曲线,则待测样品为布鲁氏菌疫苗株a19;若seq id no.2-3所示的引物组与seq id no.5所示的探针能够获得扩增曲线,则待测样品为牛种布鲁氏菌野毒株或非a19疫苗株。
76.实施例2 snp分子标记检测的特异性评价
77.以与布鲁氏菌存在血清学交叉反应或与布鲁氏菌种近缘的汉赛巴尔通体、霍乱弧菌、土拉弗朗西斯菌、大肠杆菌o:157、小肠结肠耶尔森菌o:9、金黄葡萄球菌以及其他种布鲁氏菌野毒株,多个疫苗株如s2(猪种),m5(羊种)等作为特异性对照作为待测样品,对实施例1筛选得到的snp分子标记及其引物对和探针对进行检测特异性评价,具体方法如下:
78.1、基因组dna的提取
79.采用北京天根生化试剂有限公司的细菌基因组dna提取试剂盒,严格按照试剂盒内的说明书对包括上述汉赛巴尔通体、霍乱弧菌、土拉弗朗西斯菌、大肠杆菌o:157、小肠结肠耶尔森菌o:9、金黄葡萄球菌在内的所有待测菌样品进行基因组dna的提取。
80.2、rt-pcr
81.分别以步骤1提取得到的各细菌的基因组dna为模板,利用seq id no.2-3所示引物和seq id no.4-5所示探针进行rt-pcr。
82.rt-pcr的20μl反应体系为:2
×
rt-pcr mix10μl,引物和探针混合液(seq id no.2-3所示引物和seq id no.4-5所示探针)2μl,去离子水6μl,基因组dna 2μl。seq id no.2-3所示引物在反应体系中的终浓度为300nm,seq id no.4-5所示探针在反应体系中的终浓度为200nm。
83.rt-pcr的反应条件为:95℃,10分钟;95℃,15秒,62℃,30秒,40个循环。
84.3、根据rt-pcr扩增曲线,分析结果。
85.结果显示,布鲁氏菌疫苗株a19的扩增曲线荧光信号为vic,对应snp位点为t,布鲁氏菌疫苗株s2(猪种)和m5(羊种)扩增曲线荧光信号为fam,对应snp位点为c,各标准株和野毒株的扩增曲线荧光信号为fam,对应snp位点为c。其它非布鲁氏菌样品均没有扩增,表明本发明的snp分子标记及其检测引物和探针对于布鲁氏菌具有较高的特异性。
86.实施例3 snp分子标记在鉴别布鲁氏菌疫苗株a19和地方布鲁氏菌菌株中的应用
87.利用实施例1筛选得到的snp分子标记及其引物(seq id no.2-3)和探针(seq id no.4-5)对布鲁氏菌疫苗株a19、布鲁氏菌标准株、120株地方分离的布鲁氏菌野毒株及布鲁氏菌疫苗株s2(猪种),m5(羊种)进行区分鉴别,基因组dna的提取和rt-pcr方法同实施例2。
88.鉴定结果如表1、表2和表3所示,布鲁氏菌疫苗株a19的扩增曲线荧光信号为seq id no.4所示探针标记的荧光(vic),对应snp位点为t,各标准株的扩增曲线荧光信号为seq id no.5所示探针标记的荧光(fam),对应snp位点为c,120株野毒株的扩增曲线荧光信号为fam,对应snp位点为c,布鲁氏菌疫苗株s2(猪种)和m5(羊种)扩增曲线荧光信号为fam,对应snp位点为c。
89.以上结果表明,本发明的snp分子标记可实现布鲁氏菌疫苗株a19和地方布鲁氏菌菌株的特异性区分鉴别,特异度为100%。
90.表1布鲁氏菌野毒株扩增结果
[0091][0092][0093]
表2布鲁氏菌野毒株和疫苗株扩增结果
[0094][0095]
[0096]
表3布鲁氏菌标准株扩增结果
[0097][0098][0099]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1