嗜酸乳杆菌LA18及其在制备调节肠道菌群或免疫调节的产品方面的应用的制作方法
嗜酸乳杆菌la18及其在制备调节肠道菌群或免疫调节的产品方面的应用
技术领域
1.本发明属于微生物技术领域,具体涉及嗜酸乳杆菌la18及其在制备调节肠道菌群或免疫调节的产品方面的应用。
背景技术:
2.嗜酸乳杆菌(lactobacillus acidophilus)是乳酸菌中最具知名度的菌种之一,是一种具有重要商业意义的益生菌,最初从人类胃肠道中分离出来,已广泛使用于发酵食品和功能食品中,在美国生产的酸奶中有80%含有嗜酸乳杆菌,市场应用前景广阔。
3.阿克曼菌属(akkermansia)作为二代益生菌之一,被认为是与免疫调节相关的有益菌。多项研究证实,阿克曼菌属与机体健康和疾病紧密相关,有助于缓解疾病,增强机体免疫力,表明阿克曼菌属与宿主之间存在复杂的关系。
4.phocaeicola vulgatus菌是人体肠道中可以产生琥珀酸和丙酸短链脂肪酸相关的菌种,该菌种目前尚无通用的中文名称。短链脂肪酸作为肠道微生物的最终代谢产物,能通过降低肠道中的ph值,抑制病原菌生长,促进有益菌的增殖,从而起到平衡肠道微生态环境;短链脂肪酸为肠粘膜细胞提供能量来源,促进肠上皮细胞增殖,有利于维护肠道屏障,抵抗炎症发生。因此,phocaeicola vulgatus菌对维护肠屏障的完整性和肠道免疫系统的构建有重要作用。
5.目前尚未见有关嗜酸乳杆菌(lactobacillus acidophilus)可调节phocaeicola vulgatus菌和阿克曼菌属(akkermansia)的丰度的报道。
技术实现要素:
6.基于本领域存在的上述空白,本发明的目的在于提供一种嗜酸乳杆菌la18、其在制备调节肠道菌群或免疫调节产品方面的应用及产品。
7.本发明的目的通过下述技术方案实现:一种嗜酸乳杆菌(lactobacillus acidophilus)菌株la18,其特征在于,其保藏编号为cctcc no: m 2022572。
8.保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18在制备调节肠道菌群或免疫调节或调节短链脂肪酸含量的产品方面的用途。
9.调节肠道菌群指提高或降低肠道菌群的丰度。
10.所述肠道菌群选自:phocaeicola vulgatus菌和/或阿克曼菌属。
11.所述免疫调节指降低促炎因子il-1β、il-6或tnf-α的水平或提升细胞因子il-10的水平。
12.所述短链脂肪酸包括:乙酸、丙酸、戊酸、己酸、丁酸。
13.一种调节肠道菌群或免疫调节或调节短链脂肪酸含量的药物,包括药效活性成分;其特征在于,所述药效活性成分包括:保藏编号为cctcc no: m 2022572的嗜酸乳杆菌
(lactobacillus acidophilus)菌株la18。
14.所述的一种调节肠道菌群或免疫调节或调节短链脂肪酸含量的药物还包括:药学上可接受的辅料。
15.一种食品,其特征在于,包括:保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18。
16.所述的一种食品还包括:食品添加剂。
17.本发明提供一种具有调节肠道和免疫力的嗜酸乳杆菌la18,其分类命名为嗜酸乳杆菌 lactobacillus acidophilus,该菌株于2022年05月09日保藏于中国典型培养物保藏中心(cctcc),地址为中国、武汉、武汉大学,保藏编号为cctcc no: m 2022572。经实验验证,该嗜酸乳杆菌la18具有较高的人工胃液、肠液的耐受性,并对链霉素、四环素等众多抗生素敏感,说明该菌株无耐药性,对人体安全。同时,嗜酸乳杆菌la18能有效抑制金黄色葡萄球菌、大肠杆菌和沙门氏菌,并显著降低这几类病原菌对ht-29细胞的粘附性。此外,嗜酸乳杆菌la18还可调节阿克曼菌属(akkermansia)、phocaeicola vulgatus菌等肠道有益菌群的丰度,并通过改变il-1β、il-6、tnf-α、il-10的水平来对机体进行免疫调节。
18.本发明的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18的保藏信息如下:保藏编号:cctcc no: m 2022572;分类命名:嗜酸乳杆菌;拉丁名:lactobacillus acidophilus;保藏单位:中国典型培养物保藏中心;保藏单位地址:中国、武汉、武汉大学保藏日期:2022年5月9日。
附图说明
19.图1为本发明实验例1的嗜酸乳杆菌la18在平板上的菌落形态图。
20.图2为本发明实验例1的嗜酸乳杆菌la18经革兰氏染色后的菌体形态图。
21.图3为本发明实验例1的嗜酸乳杆菌la18电镜图。
22.图4为本发明实验例4的嗜酸乳杆菌la18对病原菌黏附ht-29细胞的抑制作用。
23.图5为本发明实验例6的肠道微生物α多样性的shannon指数与simpson指数。
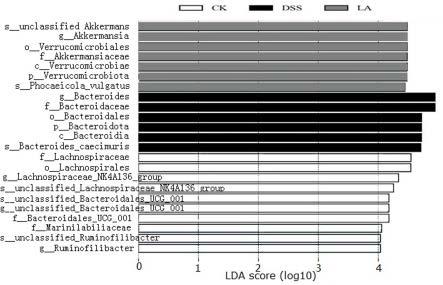
24.图6为本发明实验例6的lefse分析得微生物分类差异结果,图中横坐标为lds得分的log10数值,纵坐标为各菌属或菌种名称;顶部的标记含义列示如下:ck为空白对照组小鼠,dss为dss模型组小鼠,la为经嗜酸乳杆菌la18处理后的dss模型小鼠。
25.图7为本发明实验例7的小鼠结肠组织炎症细胞因子检测分析结果。
26.图5和图7中横坐标的标记含义列示如下:ck为空白对照组小鼠,dss为dss模型组小鼠,la为经嗜酸乳杆菌la18处理后的dss模型小鼠。
具体实施方式
27.下面结合实施例和实验例对本发明作进一步详细的描述,但本发明的实施方式不限于此。实验例中未作详细描述的内容属于本领域专业技术人员公知的现有技术。
28.第1组实施例、本发明的嗜酸乳杆菌菌株la18
本组实施例提供一种嗜酸乳杆菌(lactobacillus acidophilus)菌株la18,其特征在于,其保藏编号为cctcc no: m 2022572。
29.任何利用、使用、销售、许诺销售、生产、制备、培养、扩繁、发酵保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18的行为均落入本发明的保护范围。
30.本领域技术人员根据本发明的教导和启发,出于实际生产需要,结合微生物工艺领域常用技术手段选择合适的辅料加以调配,将本发明保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18制成各种符合各类符合工艺生产要求的剂型产品,例如,粉剂、片剂、液体剂;还可制成食品,例如,发酵乳制品、发酵豆制品、发酵果蔬制品、发酵肉制品、发酵饮料、益生菌发酵剂、益生菌固体饮料等。所述发酵乳制品包括常温酸奶、低温酸奶、搅拌型酸奶、凝固型酸奶、饮用性酸奶、乳酪、乳酸菌饮料等。
31.本文中,发明内容、具体实施方式部分记载的嗜酸乳杆菌、嗜酸乳杆菌菌株、la18、菌株la18、lactobacillus acidophilus、嗜酸乳杆菌la18、嗜酸乳杆菌la18菌株均指代本发明的保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18。
32.第2组实施例、本发明菌株la18的用途本组实施例提供保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18在制备调节肠道菌群或免疫调节或调节短链脂肪酸含量的产品方面的用途。
33.在一些实施例中,调节肠道菌群指提高或降低肠道菌群的丰度。
34.在另一些实施例中,所述肠道菌群选自:phocaeicola vulgatus菌和/或阿克曼菌属(akkermansia)。
35.在具体的实施例中,所述免疫调节指降低促炎因子il-1β、il-6或tnf-α的水平或提升细胞因子il-10的水平。
36.在一些实施例中,所述短链脂肪酸包括:乙酸、丙酸、戊酸、己酸、丁酸。
37.在一些实施例中,所述产品可以是药物。所述药物的药效成分包括保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18。
38.所述药物还可包括药用辅料。
39.在具体的实施例中,所述药用辅料选自:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂、反絮凝剂、助滤剂、释放阻滞剂。
40.根据本发明的内容,出于实际生产应用中的不同需求,再结合药物制备领域的常规技术手段(例如,《制剂技术百科全书》、《药物制剂技术》等),本领域技术人员可对上述药用辅料进行选择和调配,并将cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18制成不同的剂型,例如粉剂、片剂、注射剂、口服液等。
41.第3组实施例、本发明的药物本组实施例提供一种调节肠道菌群或免疫调节或调节短链脂肪酸含量的药物。本
组所有的实施例都具备如下共同特征:所述药物包括药效活性成分;所述药效活性成分包括:保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18。
42.在进一步的实施例中,所述的一种调节肠道菌群或免疫调节或调节短链脂肪酸含量的药物还包括:药学上可接受的辅料。
43.在具体的实施例中,所述药学上可接受的辅料选自:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂、反絮凝剂、助滤剂、释放阻滞剂。
44.根据本发明的内容,出于实际生产应用中的不同需求,再结合药物制备领域的常规技术手段(例如,《制剂技术百科全书》、《药物制剂技术》等),本领域技术人员可对上述药用辅料进行选择和调配,并将cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18制成不同的剂型,例如粉剂、片剂、注射剂、口服液等。
45.第4组实施例、本发明的食品本组实施例提供一种食品。本组所有的实施例都具备如下共同特征:所述食品包括:保藏编号为cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18。
46.在进一步的实施例中,所述的一种食品还包括:食品添加剂。
47.在另一些实施例中,所述食品添加剂选自:漂白剂、防腐剂、抗氧化剂、着色剂、甜味剂、酸味剂、增味剂、护色剂等。
48.根据本发明的内容,出于实际生产应用中的不同需求,再结合食品生产加工工艺领域的常规技术手段(例如,《食品生产概论》、《食品与食品生产百科全书》、《食品加工技术》等),本领域技术人员可对上述食用辅料进行选择和调配,并将cctcc no: m 2022572的嗜酸乳杆菌(lactobacillus acidophilus)菌株la18制成不同的剂型,例如发酵乳制品、发酵豆制品、发酵果蔬制品、发酵肉制品、发酵饮料、益生菌发酵剂、益生菌固体饮料等。所述发酵乳制品包括常温酸奶、低温酸奶、搅拌型酸奶、凝固型酸奶、饮用性酸奶、乳酪、乳酸菌饮料等。
49.实验例1、嗜酸乳杆菌la18的分离筛选与鉴定(1)菌株的分离筛选采集符合条件(健康且未食用过任何益生菌产品)的湖北恩施地区婴幼儿粪便,置于无菌取样管中冰盒运输,在无菌条件下用0.85%生理盐水梯度稀释,选取合适稀释梯度在lbs琼脂平板上涂布,37℃培养48-72小时。通过肉眼观察其菌落形态挑取疑似单菌落,对其镜检观察并进行初步筛选和纯化培养。纯化后使用mrs液体厌氧管37℃培养8-12小时,离心去上清后重悬于无菌30%甘油水溶液中,保存于武汉微康益生菌研究院菌种库。
50.lbs培养基配方(g/l):酵母浸粉5.0g、胰蛋白胨10.0g、磷酸二氢钾6.0g、硫酸亚铁0.034g、硫酸镁0.575g、葡萄糖20.0g、乙酸钠25.0g、柠檬酸铵2.0g、硫酸锰0.12g、调ph值5.5后,添加吐温-80 1ml、冰乙酸1.3ml,加热搅拌溶解于1000ml蒸馏水中,118℃高压灭菌15min。固体培养基添加琼脂15.0g。
51.mrs培养基配置方法参照gb4789.35-2016,固体培养基添加1.5%琼脂;(2)形态学特征和16s rdna鉴定嗜酸乳杆菌la18的菌落、菌体形态和电镜照片分别见图1、图2和图3。嗜酸乳杆菌la18在mrs固体平板上单菌落呈圆形,中等大小,边缘整齐,瓷白色,是典型的嗜酸乳杆菌特征。菌体形态为革兰氏阳性杆菌,短杆状,单个或成对排列,杆末端呈圆形。
[0052] 对筛选的目的菌株液体扩培,收集菌体,提取基因组dna,采用发明专利申请202210478937.4记载的通用引物27f和1492r进行pcr扩增反应。pcr扩增程序为:94℃预变性5 min,94℃变性30s,55℃退火30s,72℃延伸 90s,共35个循环,最后在72℃延伸10min。随后对pcr扩增产物的含量和纯度进行检测,检测合格后送往武汉金开瑞生物工程有限公司进行测序,根据测序结果利用ncbi数据库中的blast工具进行同源性比对,鉴定所得菌株为嗜酸乳杆菌,将该菌株命名为la18并送保藏,其保藏信息如下:保藏编号:cctcc no: m 2022572;分类命名:嗜酸乳杆菌;拉丁名:lactobacillus acidophilus;保藏单位:中国典型培养物保藏中心;保藏单位地址:中国、武汉、武汉大学保藏日期:2022年5月9日。实验例2、嗜酸乳杆菌la18耐受模拟消化液模拟人工胃液:将pbs调节ph至3后灭菌,加入0.3%胃蛋白酶,充分溶解后用微孔滤膜过滤除菌备用;模拟人工肠液:将pbs调节ph至8后灭菌,加入0.1%胰蛋白酶,充分溶解后用微孔滤膜过滤除菌备用;将保存的菌活化两次,分别取1ml培养12h的菌液离心(10000
×
g,5min,4℃),pbs清洗两次,将菌体分别加入到10ml模拟人工胃液和肠液中,然后置于37℃孵育3h,分别于0h、3h时间点取样在mrs固体培养基中稀释涂布,平行三次,培养箱37℃培养48h后计数。
[0053]
嗜酸乳杆菌la18在人工胃液和人工肠液中的耐受结果见表1。由表1可知,该菌株在人工胃液、肠液中处理3h后保持非常高的存活率,表明该菌株具有良好的耐受胃肠液的能力。
[0054]
实验例3、嗜酸乳杆菌la18对病原菌的抑制能力采用牛津杯打孔法测定嗜酸乳杆菌la18拮抗致病菌的能力。嗜酸乳杆菌菌株接种于mrs液体培养基中,37℃恒温静置过夜培养,制备拮抗菌液。将致病菌株大肠杆菌、沙门氏菌、金黄色葡萄球菌分别接种于液体牛肉膏蛋白胨培养基中,37℃、转数250rpm、恒温摇床过夜培养,然后制备病原菌液。将mrs固体培养基冷却至55℃左右,与病原菌悬液按一定比例混匀,使体系病原菌活菌数在107cfu/ml 数量级,然后迅速倾注于预先放置牛津杯的平板中,待培养基冷却凝固后,取出牛津杯,于每孔注入200μl拮抗菌液(保证菌液浓度为
108cfu),将平皿轻盖后正置于37℃恒温培养箱,培养适宜时间后观察,并用游标卡尺测量抑菌圈直径。以等体积的mrs培养基作为对照。每个样品重复3次,结果如表2所示。
[0055]
由表2可得,嗜酸乳杆菌la18对金黄色葡萄球菌、大肠杆菌和沙门氏菌的生长有非常强的抑制作用,尤其对金黄色葡萄球菌的抑制作用最强。
[0056]
实验例4、嗜酸乳杆菌la18对病原菌黏附ht-29细胞的抑制作用将瓶中培养好的ht-29细胞解析下来制备成5
×
105/ml的细胞悬液,接入到12孔细胞培养板中培养至长成单层细胞,待细胞达到80%-90%融合时,进行试验。采用竞争、排斥和置换试验来研究乳杆菌对病原菌的黏附抑制作用。
[0057]
竞争试验:将培养好的单层细胞用pbs清洗两次后,每孔中加入800μl的dmem培养液(不含抗生素),然后每个孔中加入100μl的实验菌株菌悬液(5
×
107cfu/孔)和100μl的病原菌(5
×
107cfu/孔),在37℃、5%co2/rh90%的二氧化碳培养箱中分别培养90min;排斥实验:将培养好的单层细胞用pbs清洗两次后,每孔中加入900μl的dmem培养液(不含抗生素),然后每个孔中加入100μl的实验菌株菌悬液(5
×
107cfu/孔),在37℃、5%co2/rh90%的二氧化碳培养箱中分别培养90min后,用1mlpbs清洗2次,除去未黏附的菌体细胞。然后加入100μl的病原菌(5
×
107cfu/孔)和0.9ml的dmem培养液(不含抗生素),在37℃、5%co2/rh90%的二氧化碳培养箱中继续培养90min;置换试验:将培养好的单层细胞用pbs清洗两次后,每孔中加入900μl的dmem培养液(不含抗生素),然后每个孔中加入100μl的病原菌(5
×
107cfu/孔),在37℃、5%co2/rh90%的二氧化碳培养箱中分别培养90min后,用1mlpbs清洗2次,除去未黏附的菌体细胞。然后加入100μl的实验菌株菌悬液(5
×
107cfu/孔)和900μl的dmem培养液(不含抗生素),在37℃、5%co2/rh90%的二氧化碳培养箱中继续培养90min。
[0058]
试验结束后,用1mlpbs溶液清洗ht-29单层细胞3次,加入1%胰蛋白酶-edta 37℃孵育3-5分钟以进行裂解。处理后的含有菌体的细胞裂解液经适当稀释后涂布于lb琼脂平板,37℃培养24h后计数。对照组中只加入病原菌。每个实验做3个平行,3次重复。
[0059]
嗜酸乳杆菌la18对金黄色葡萄球菌、大肠杆菌、沙门氏菌的抑制作用如图4所示,在竞争黏附实验中,la18和病原菌同时接触ht-29细胞,有同等机会进行黏附,对3种病原菌对ht-29细胞的黏附有一定抑制作用,抑制率从15.73%到71.31%不等;在排斥黏附实验中,嗜酸乳杆菌la18与ht-29细胞预先接触,对3种病原菌黏附都有排斥作用,抑制率在37.85%到78.5%;在置换黏附实验中,病原菌与ht-29细胞预先接触,后添加嗜酸乳杆菌la18,其抑制率在11.36%到60.81%。嗜酸乳杆菌la18通过排除、竞争和置换对大肠杆菌具有最好的抑制能力,同时对金黄色葡萄球菌、沙门氏菌也有一定的抑制作用。
[0060]
实验例5、嗜酸乳杆菌la18的抗生素敏感性试验
采用k-b(药敏纸片琼脂扩散法)进行抗生素敏感性试验。将待测菌经活化后,制备菌悬液并调整菌悬液浓度为108cfu/ml,取200μl菌悬液于mrs固体平板表面,用无菌棉签将菌液均匀涂布在平板上,用无菌镊子将按抗生素药敏纸片贴在mrs固体培养基上,做好标记,37℃培养24h后,用游标卡尺测定抑菌圈的直径,抑菌圈的边缘以肉眼看不到嗜酸乳杆菌明显生长为界限。嗜酸乳杆菌la18菌株对12种常用抗生素敏感性结果,见表3,嗜酸乳杆菌la18对这些药物敏感,说明该菌株安全,可潜在的用于生物制品或膳食补充剂。
[0061]
实验例6、嗜酸乳杆菌la18对小鼠肠道菌群的调节能力动物模型采用dss诱导的方法。实验取30只6-8周龄c57bl/6雄性小鼠。动物饲养室温温度 23
±
2℃,湿度 50%
±
10%,人工光照12h/d,自由饮食。所有小鼠分为3组,每组10只,依次为正常组(ck)、模型组(dss)、嗜酸乳杆菌处理组(la)。具体实验流程如下,一周的适应性喂养,第二周除正常组外,所有小鼠自由饮用3.5%dss溶液7天,dss溶液每2天更换一次以保证dss溶液浓度和质量,同时给实验组每天定时灌胃0.2ml相应溶液,正常组(ck)灌胃pbs、模型组(dss)灌胃pbs、嗜酸乳杆菌处理组(la18)灌胃含5
×
109cfu/ml 嗜酸乳杆菌la18的pbs。各给菌灌胃剂量均为5
×
109cfu/ml,其余均自由饮用3.5%dss 7d,之后更换正常饮水。每日固定时间灌胃一次,连续灌胃14d,每次灌胃体积0.2ml;正常组和模型组每天灌胃等体积的pbs。实验结束后,以颈椎脱臼法处死小鼠,腹部消毒后解剖,取各组小鼠盲肠内容物。
[0062]
对小鼠盲肠内容物进行16s测序和分析,结果显示,如图5所示,与正常组相比,dss组的肠道微生物α多样性中的shannon指数与simpson指数均有降低,说明dss会造成小鼠肠道菌群α多样性指数的下降;与dss组相比,la组的肠道微生物α多样性中的shannon指数与simpson指数均有升高,说明嗜酸乳杆菌la18干预会造成小鼠肠道菌群α多样性指数的升高,证明补充嗜酸乳杆菌la18可提高肠道微生物群落多样性。
[0063]
使用lefse(linear discriminant analysis effect size,线性判别分析)对各处理组的菌群分类群相对丰度进行差异分析从而找到组间在丰度上有显著差异的物种。结果显示,如图6所示,与正常组相比,在dss组中,bacteroidales拟杆菌目bacteroidaceae拟杆菌科bacteroides拟杆菌属bacteroides_caecimuris种、bacteroides_caecimuris菌等有害菌群相对丰度有显著差异。而在嗜酸乳杆菌la18组中,verrucomicrobiales(疣微菌目)akkermansiaceae科akkermansia(阿克曼氏菌属)unclassified_akkermansia种和phocaeicola_vulgatus种,phocaeicola vulgatus种是文献《gut-brain signaling in energy homeostasis: the unexpected role of microbiota-derived succinate》已经报道的,可以高效产琥珀酸和丙酸相关短链脂肪酸菌种。
[0064]
以上α多样性指数和微生物分类分析结果显示,dss会降低肠道微生物的多样性,富集有害菌群,进而导致肠道菌群的紊乱;而嗜酸乳杆菌la18干预可以恢复肠道微生物的多样性,抑制病原菌富集,促进有益菌富集,进而调控肠道菌群恢复稳态。
[0065]
实施例7、嗜酸乳杆菌la18对小鼠粪便中短链脂肪酸含量的影响动物实验处理方法同实验例6,第14天收集不同组小鼠粪便,利用gc-ms测定小鼠粪便中短链脂肪酸含量。实验结果如表4所示。
[0066]
如表4所示,实验结果表明,与对照组相比,造模组小鼠粪便中各短链脂肪酸含量(乙酸、丙酸、戊酸、己酸和丁酸)均下降;造模组相比,通过益生菌干预后,la18组小鼠粪便中各短链脂肪酸含量(乙酸、丙酸、戊酸、己酸和丁酸)显著上调。与对照组相比,嗜酸乳杆菌la18组小鼠粪便中短链脂肪酸(乙酸、丙酸、戊酸、己酸和丁酸)的含量均高于对照组。说明嗜酸乳杆菌la18摄入后,可以显著增加粪便中短链脂肪酸含量。
[0067]
实验例8、嗜酸乳杆菌la18的免疫调节功能动物模型同实验例6,实验结束后,以颈椎脱臼法处死小鼠,腹部消毒后解剖,取各组小鼠结肠组织,采用酶联免疫吸附法(elisa)测定小鼠结肠组织中炎症因子tnf-α、il-6、
il-1β、il-10的含量。
[0068]
结果如图7所示,检测结果表明,与对照组(ck)相比,模型组(dss)结肠组织中促炎因子il-1β、il-6和tnf-α的含量显著升高(p<0.05),降炎因子il-10的含量显著降低(p《0.05)。与模型组(dss)相比,嗜酸乳杆菌组(la)结肠组织中il-1β、il-6和tnf-α含量显著下降(p《0.05),嗜酸乳杆菌组(la)结肠组织中il-10含量显著提高(p《0.05);实验结果表明,嗜酸乳杆菌la18能够调节小鼠肠道免疫能力,降低小鼠结肠组织中促炎因子的含量,提高降炎因子的含量,从而缓解结肠炎小鼠肠道炎症。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1