一种降低AAV病毒载体生产中质粒残留的方法与流程
一种降低aav病毒载体生产中质粒残留的方法
技术领域
1.本发明涉及生物医学技术领域,具体地,涉及一种降低aav病毒载体生产中残留质粒的方法。
背景技术:
2.基因治疗是指使用基因修复的方法治疗人类疾病,即将外源基因通过基因转移技术将其插入病人的适当的受体细胞中,它包括引入一个缺陷基因的健康拷贝或纠正一个突变基因以恢复它的生物学功能。在基因治疗中,病毒载体技术是目前主要的基因导入方式,该技术的进步很大程度上驱动着基因治疗领域的发展,非病原性和非包膜复制缺陷型细小病毒的腺相关病毒(aav)载体由于其非致病性,已被公认为治疗基因体内递送的主要载体,已成为一种安全有效的基因递送工具,因此需要规模化生产,在aav病毒载体规模化生产过程中,要求aav病毒载体需要去除与产品和生产过程中有关的杂质,实施最小化/控制生产相关性杂质的生成的策略包括对重组腺病毒载体(raav)的构建,重组腺病毒载体(raav)的构建通常涉及rep和cap基因的剔除和将感兴趣的转基因插入itr元件之间,产生的载体质粒随后与一个表达aav的rep和cap基因的包装质粒一起共转染到组织培养细胞中,质粒转染的组织培养细胞被感染ad以提供辅助功能以有效复制aav和基因表达。目前,主要使用转基因表达盒替换rep和cap基因,然后在aav生产过程中使用辅助质粒反式提供rep和cap orf,以便于将重组aav(raav)载体用于基因治疗,peimax与三质粒复合物瞬时转染方案也已用于hek293人胚肾细胞中生产临床级aav,其中aav生产相关残留质粒包括三种:第一种为paav(包含转基因表达盒),第二种为prc,即编码aav调节蛋白和结构/衣壳蛋白,第三种是phelper,提供了aav复制必不可少的辅助病毒元件。然而,这种方法会给后续的纯化过程带来一定程度的挑战,使用这种瞬时转染方法,必须从aav载体产物中去除掉以上三种不同质粒,以避免质粒污染导致遗传毒性的发生。
3.目前,针对aav载体生产中残留质粒的主要解决方法如下:对于aav载体生产中的残留质粒或宿主细胞来源的dna,传统载体生产工艺是在病毒收获前的4h补加终浓度为25u/ml的benzonase核酸内切酶或补加50u/ml的dnaseⅰ37℃孵育2h;超级核酸酶(benzonase nuclease)是来源于serratia marcescens,经过基因工程改造的核酸酶,它能够在非常广泛的条件下降解所有形式的dna(双链,单链,线状,环状)和rna,它能将核酸完全消化成3-8个碱基长度的5’单磷酸寡核苷酸,超级核酸酶适用于去除蛋白质产品中的污染,符合fda关于核酸污染去除的规程,虽然这种方法可以去除部分aav病毒载体的残留质粒,但是该降低aav病毒载体生产中残留质粒的方法对残留质粒降低的污染比例低,病毒滴度比较低,生产成本比较高,生产工艺有待优化,而且应用于商业化过程中,aav病毒载体质量仍存在很大的改进空间。
技术实现要素:
4.为了解决上述问题,本发明的目的在于提供一种降低aav病毒载体生产中残留质
qpcr体系为2ul aav稀释样本+0.5ul引物+5ul kapa sybr fast enzyme+2.5ul uv h2o;
25.病毒滴度计算公式如下:
26.aav titer(vg/ml)=$(已知aav滴度)$/power(2,待测样本平均ct
目的基因引物-$已知样本平均ct
目的基因引物
$)。
27.作为降低aav病毒载体生产中残留质粒的方法的一个方面,其中s33中aav病毒质粒污染计算公式如下:
28.质粒污染(%)=power(2,(平均ct
目的基因引物-平均ct
质粒bb引物
))。
29.采用上述技术方案,本发明具有以下优点:
30.本发明提供了一种降低aav病毒载体生产中残留质粒的方法,通过在病毒收获提前一天加5u/ml benzonase核酸内切酶、收获前2h在培养基中添加高分子聚合物、离子化合物及表面活性剂,更好地发挥benzonase核酸内切酶活性,以达到降低aav病毒载体生产中质粒残留比例的目的,解决了传统降低aav载体生产中残留质粒方法中存在的残留质粒降低的污染比例低,病毒滴度比较低,生产成本比较高,生产工艺落后,aav病毒载体质量有待提高的技术问题,一方面降低aav病毒载体规模化生产的成本,另一方面提高aav相关基因治疗产品的安全性,提高患者的可接受度,加快临床转化进程。
附图说明
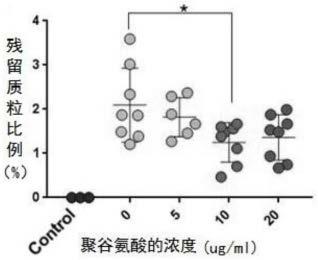
31.图1a为本发明不同浓度聚谷氨酸对aav病毒载体中aav滴度的影响;
32.图1b为本发明不同浓度聚谷氨酸对aav病毒载体中残留质粒比例的影响;
33.图2a为测试添加2mm mgcl2对aav病毒载体中aav滴度的影响;
34.图2b为测试添加2mm mgcl2对aav病毒载体中残留质粒的影响;
35.图3a为测试添加1mm triton x-100对aav病毒载体中aav滴度的影响;
36.图3b为测试添加1mm triton x-100对aav病毒载体中残留质粒的影响。
具体实施方式
37.以下结合说明书附图对本发明的技术方案进行具体描述,需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
38.在一个具体的实施例中,在aav病毒载体构建过程中,在构建aav病毒载体质粒时,首先利用kapa hifi pcr扩增试剂盒,以感兴趣的目的基因或现有为模板,获得相关dna片段;然后使用nebuilder hifi dna assembly kit试剂盒将各个片段进行组装,所有载体序列都利用核酸内切酶、桑格测序和牛津纳米孔测序进行验证。
39.在又一个具体的实施例中,aav病毒载体的包装生产采用三质粒系统,包括:(1)腺病毒辅助质粒phelper(cell biolabs);(2)顺式质粒paav-transgen;(3)反式质粒paav-r2c6/paav-r2c8,包含rep和cap基因;转染时各质粒之间用量的比例为2:1:1(即每盘20μg辅助质粒,10μg顺式质粒paav,10μg反式质粒paav-r2c8),同时质粒总量与peimax的比例为1:
2,具体实验细节如下:
40.day 0:293t细胞汇合度约为80-90%时开始进行peimax-dna病毒包装,病毒包装前更换培养基为无血清培养基(3.0dmem)12ml每盘,加入含peimax-dna复合物的无血清培养基(3.0dmem)6ml,每盘培养基共18ml,peimax转染后5-8h加10%fbs(gibco)。
41.day2/3:每盘添加10ml新鲜培养基(opti-mem)。
42.day4:每盘加入终浓度为5u/ml benzonase(用培养基稀释),孵育18h。
43.day5:每盘加入3ml 5m nacl(终浓度为500mm)及不同浓度离子聚合物、mgcl2、triton x-100孵育2h,收集含病毒的培养基至175ml无菌离心瓶中(5盘/瓶),离心5300rpm/min,20min,上清转移至500ml 0.22μm的pes滤器(nalgene)过滤,弃掉瓶底的细胞沉淀。滤器放入4℃冰箱过夜,液体自重过滤至瓶底。
44.day6:aav切向流过滤浓缩(tff,300kda mwco)、碘克沙醇密度梯度超速离心纯化及15ml浓缩柱(ufc910096,millipore)浓缩清洗aav,分装标识后冻存于-80℃冰箱。
45.在再一个具体的实施例中,一种降低aav病毒载体生产中残留质粒的方法,包括以下步骤:
46.s1.在病毒收获提前一天添加终浓度5u/ml的benzonase核酸内切酶;
47.s2.在病毒收获前2h,在培养基中添加高分子聚合物、离子化合物以及表面活性剂,来更好地发挥benzonase核酸内切酶活性,以达到降低生产相关质粒残留比例的目的。其中,离子聚合物包括阴离子聚合物、中性不带电荷聚合物和阳离子聚合物。
48.阴离子聚合物包括聚谷氨酸钠(pga)、肝素,与pei竞争结合释放带负电荷的dna,使dna暴露出来而被benzonase降解以达到降低质粒污染的目的。阴离子聚合物还可以是聚天冬氨酸、聚丙烯酸等多种阴离子聚合物,其中,聚谷氨酸钠(pga)分子量可为15-50kda、50-100kda、≥750kda等多种相对分子质量。
49.中性不带电荷聚合物采用peg-200、peg-1000、peg-4000、peg-6000、peg-8000、peg-20000中的一种或多种;
50.阳离子聚合物包括聚乙烯胺、硫酸鱼精蛋白(ps)、聚赖氨酸、聚-l-鸟氨酸和聚-l-精氨酸等。
51.离子化合物包括氯化镁或氯化锰,表面活性剂包括曲拉通(triton x-100)。
52.另外,aav血清型包括aav6、aav8、还可以是aav2、aa5、aav9等各种其他血清型载体。
53.s3.通过qpcr检测残留质粒比例。
54.s3具体包括以下步骤:
55.s31.对aav病毒样本进行梯度稀释处理;
56.s31具体包括以下步骤:
57.s311.10倍稀释:碘克沙醇纯化过的病毒使用无菌水作为稀释液稀释10倍,加热至98℃,保持加热时间5min,加样方法为:2ul aav+18ul h2o;
58.s312.5倍稀释:上述10倍稀释后aav病毒样本进行接下来的连续5倍梯度稀释,共稀释3次,加样方法为:4ul aav+16ul h2o;
59.s313.c)对于未纯化过的病毒含有fbs蛋白,可能影响dna聚合酶活性,必须进行pk蛋白酶处理(56℃60min;95℃10min),然后依次重复步骤s311和s312,进行操作处理。
60.s32.aav病毒样本qpcr检测并计算病毒滴度;s32包括以下步骤:
61.s321.使用已知滴度的aav病毒载体依照上述s31进行稀释处理,作为病毒滴度检测的正对照,每个样本4个梯度,使用相应目的基因引物、质粒bb引物分别检测病毒滴度和病毒残留质粒污染情况。
62.s322.使用10ul qpcr体系对病毒滴度检测并计算。其中:10ul qpcr体系采用2ul aav稀释样本+0.5ul引物+5ul kapa sybr fast enzyme+2.5ul uv h2o样本+0.5ul引物+5ul kapa sybr fast enzyme+2.5ul uv h2o
63.aav病毒样本qpcr病毒滴度计算公式如下:
64.aav titer(vg/ml)=$(已知aav滴度)$/power(2,待测样本平均ct
目的基因引物-$已知样本平均ct
目的基因引物
$)。
65.s33.对aav病毒质粒污染进行计算。质粒污染的检测方法:首先,利用primer3设计针对aav目的基因序列以及质粒骨架基因序列-200bp的引物,即分别为目的引物和质粒骨架引物(简称bb)以便于aav载体中残留质粒污染比例的分析,残留质粒比例的计算公式如下:
66.质粒污染(%):=power(2,(平均ct
目的基因引物-平均ct
质粒bb引物
))。
67.在一个具体的实施例中,基于peimax与三质粒形成复合物瞬时转染用于hek293人胚肾细胞中生产临床级aav这样一种方案,我们提出假说:peimax将质粒dna缩合成带正电荷的微粒,使用阴离子聚合物与pei竞争结合释放带负电荷的dna,使dna暴露出来而被benzonase降解以达到降低质粒污染的目的,本发明中,为了测试不同浓度(5、10、20、40ug/ml)阴离子聚合物pga(聚谷氨酸)对aav载体中残留质粒的影响,即在病毒收获前一天加5u/ml benzonase核酸内切酶、收获前2h在培养基中添加阴离子聚合物四梯度pga,收获病毒后通过qpcr检测残留质粒比例;具体的测试过程如图1a、图1b所示,如图1a中横坐标代表pga(聚谷氨酸)的浓度,纵坐标代表病毒载体滴度;如图1b中横坐标代表pga(聚谷氨酸)的浓度,纵坐标代表残留质粒比例;从图1a、图1b中的测试结果可以看出,在pga(聚谷氨酸)为10ug/ml时,pga降低残留质粒效果最好,且显著提高了病毒载体滴度。
68.另外,为了进一步测试不同离子化合物和表面活性剂对残留质粒污染比例的影响,根据商品化benzonase核酸内切酶提供的最佳作用条件说明,分别测试了在病毒收获前2h在培养基中添加离子化合物氯化镁(mgcl2)对残留质粒污染比例的影响具体如图2a、图2b所示及表面活性剂曲拉通(triton x-100)对残留质粒污染比例的影响具体如图3a、图3b所示。
69.2mm mgcl2降低残留质粒比例的具体过程如下:测试添加2mm mgcl2对aav载体中残留质粒的影响,即在病毒收获前一天加5u/ml benzonase核酸内切酶、收获前2h在培养基中添加2mm mgcl2,收获病毒后通过qpcr检测残留质粒比例,图2a中横坐标代表mgcl2的浓度(mm),纵坐标代表病毒载体滴度;图2b中横坐标代表mgcl2的浓度(mm),纵坐标代表残留质粒比例;从图2a、图2b中可以看出:2mm mgcl2比不添加mgcl2组可降低残留质粒比例-~1.5倍,且载体滴度无差异。
70.1mm triton x-100可降低残留质粒比例的具体过程如下:测试添加1mm triton x-100对aav载体中残留质粒的影响,即在病毒收获前一天加5u/ml benzonase核酸内切酶、收获前2h在培养基中添加1mm triton x-100,收获病毒后通过qpcr检测残留质粒比例。图
3a中横坐标代表triton x-100的浓度(mm),纵坐标代表病毒载体滴度;图3b中横坐标代表triton x-100的浓度(mm),纵坐标代表残留质粒比例;从图3a、图3b中可以看出,1mm triton x-100比不添加triton x-100组可降低残留质粒比例-~1.5倍,且载体滴度无差异。
71.最后,需要指出的是,虽然本发明已参照当前的具体实施例来描述,但是本技术领域中的普通技术人员应当认识到,以上的实施例仅是用来说明本发明,而并非用作为对本发明的限定,在不脱离本发明构思的前提下还可以作出各种等效的变化或替换,因此,只要在本发明的实质精神范围内对上述实施例的变化、变型都将落在本发明的权利要求书范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1