一种无血清培养基及其在培养肌肉干细胞中的用途和方法与流程
1.本发明涉及生物领域,特别是涉及一种无血清培养基及其在培养肌肉干细胞中的用途和方法。
背景技术:
2.细胞培养肉作为一种可持续、合乎道德以及更加健康的新型肉类来源,在近些年得到的广泛的关注和研究。一般来讲,细胞培养肉是从动物身上分离得到肌肉干细胞,通过体外培养、增殖、扩大、分化等过程最终形成新型肉品。对比传统的养殖业,细胞培养肉不仅减少了环境的压力,而且能够有效控制养殖过程中存在的抗生素使用过度及动物福利等问题。
3.肌肉干细胞作为细胞培养肉的种子细胞,是一类具有分化能力的干细胞,位于肌肉基底膜附近,含量极少。肌肉干细胞一般处于静息状态,在一定刺激的条件下(如肌肉损伤等),肌肉细胞会被激活,能够进行增殖及分化。肌肉干细胞在分化过程中,肌肉细胞互相融合形成多核细胞,进一步地,多核细胞按照一定的方向定向排列,最终形成肌纤维束,补充损伤的肌肉,发挥一定的生物学功能。
4.目前细胞培养基一般是基础培养基加血清的组合方式,由于细胞培养肉行业的低成本、大规模培养细胞的产业化需求和食品安全性的特殊要求,无血清培养基的开发势在必行。目前,细胞培养肉领域内在无血清培养基开发上已经取得较大进展,但也同时存在诸多问题。举例来说,适合牛肌肉干细胞生长的无血清培养基成分多且复杂,比如美国mosa meat公司开发的无血清培养基具有15种以上成分,并且仅能维持细胞较少次数传代培养(wo2021158103a1);江南大学的生长因子组合物,在小体系96孔板中具有比较好的增殖效果(cn112553147a),但是否支持细胞长时间传代培养尚不明确。同时,stout aj等人在研发适用于牛肌肉卫星细胞的beefy 9无血清培养基的文章中指出,肌肉细胞在无血清培养过程中需要对培养皿进行基质蛋白包被才能更好地满足细胞贴壁及增殖(stout aj,mirliani ab,rittenberg ml,et al.simple and effective serum-free medium for sustained expansion of bovine satellite cells for cell cultured meat.commun biol.2022;5(1):466.),例如玻连蛋白(vitronectin,vtn)或者核纤层蛋白(lamin)等。这不仅增加了扩大培养条件下的成本问题,也增加了实验操作的复杂性。基于这些局限性,本专利介绍了一种能够满足特定的肌肉干细胞多代次生长的成分简单且不需要基质蛋白包被的无血清培养基,为下一步规模化应用提供良好基础。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种优化的无血清培养基及其在培养肌肉干细胞中的用途和方法,用于解决现有技术中的问题。
6.为实现上述目的及其他相关目的,本发明提供本发明提供一种无血清培养基,以无血清培养基的总体积为基准,所述无血清培养基包括以下成分:
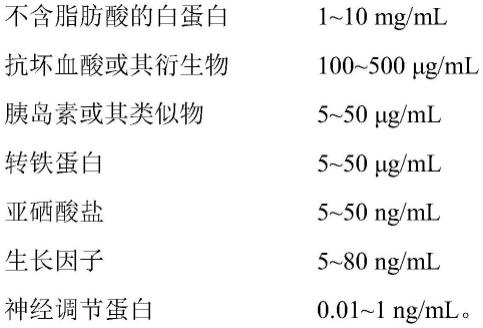
7.基础培养基
[0008][0009]
优选的,所述基础培养基可以为mem、dmem、dmem/f12、rpmi1640、f12中的一种或几种。在一较佳实施例中所述液体基础培养基为dmem/f12。
[0010]
优选的,所述抗坏血酸选自l-抗坏血酸。
[0011]
优选的,所述抗坏血酸衍生物选自抗坏血酸钠盐。
[0012]
优选的,所述抗坏血酸衍生物选自2-磷酸-l-抗坏血酸钠盐。
[0013]
本发明还提供所述无血清培养基在培养肌肉干细胞中的用途。
[0014]
本发明还提供一种肌肉干细胞的培养方法,包括以下步骤:在培养容器中接种细胞,并用所述无血清培养基培养。
[0015]
如上所述,本发明的无血清培养基及其在培养肌肉干细胞中的用途和方法,具有以下有益效果:所述无血清培养基能长时间多代次培养肌肉干细胞,进而显著降低细胞培养肉开发及生产过程中血清带来的成本问题,可作为细胞培养肉降低成本的重要考量。
附图说明
[0016]
图1显示为p1代牛肌肉干细胞两种无血清培养基中的生长情况比较图。
[0017]
图2显示为牛肌肉干细胞长期在sfm-ceb无血清培养基中培养的结果图。
[0018]
图3显示为牛肌肉干细胞在sfm-ceb无血清培养基条件下pax7的表达情况。
[0019]
图4显示为牛肌肉干细胞在无蛋白包被培养皿中的生长情况。
具体实施方式
[0020]
本发明提供一种无血清培养基,以无血清培养基的总体积为基准,所述无血清培养基包括以下成分:
[0021]
基础培养基
[0022][0023]
所述基础培养基可以为mem、dmem、dmem/f12、rpmi1640、f12中的一种或几种。在一较佳实施例中所述液体基础培养基为dmem/f12。
[0024]
所述无血清培养基中创新性的加入不含脂肪酸的白蛋白(bsa-fatty acid free)。
[0025]
白蛋白是一类常见的载体蛋白和渗透压维持分子,对于保障细胞稳态和增殖发挥重要功能。所述不含脂肪酸的白蛋白选自不含脂肪酸的牛血清白蛋白或不含脂肪酸的人血清白蛋白。所述不含脂肪酸的白蛋白中脂肪酸的质量含量为0.02%以下,脂肪酸几乎可忽略。在一较佳实施例中,所述不含脂肪酸的白蛋白中脂肪酸的含量为0。本发明发现含高脂肪酸的白蛋白或低脂肪酸的白蛋白所配制的无血清培养基培养细胞时,细胞贴壁及生长能力大大降低,不能满足长期细胞的正常存活,表现在p1代细胞出现不增殖等现象。
[0026]
不含脂肪酸的白蛋白的浓度根据实际需要,可以选自以下任一范围:1~3mg/ml、3~5mg/ml、5~7mg/ml、7~10mg/ml。
[0027]
在一种实施方式中,所述抗坏血酸选自l-抗坏血酸。抗坏血酸具有抗氧化作用,能够抑制细胞衰老,促进细胞生长。
[0028]
抗坏血酸衍生物例如为抗坏血酸葡糖苷、乙基维生素c、3-o-乙基抗坏血酸、抗坏血酸磷酸镁、抗坏血酸磷酸钠、l-抗坏血酸2-磷酸倍半镁盐水合物、抗坏血酸四异棕榈酸盐、抗坏血酸棕榈酸酯、抗坏血酸2磷酸6棕榈酸酯、酯化型维他命c等。
[0029]
在一较佳实施方式中,所述抗坏血酸衍生物选自抗坏血酸钠盐。在一种实施方式中,所述抗坏血酸衍生物选自l-抗坏血酸-2-磷酸三钠盐。所述抗坏血酸衍生物的浓度选自以下任一范围:100~200μg/ml、200~300μg/ml、300~400μg/ml、400~500μg/ml。
[0030]
所述胰岛素类似物例如选自赖脯胰岛素、门冬胰岛素、甘精胰岛素或地特胰岛素中的一种或多种。
[0031]
在一种实施方式中,所述胰岛素的浓度选自以下任一范围:5~10μg/ml、10~20μg/ml、20~30μg/ml、30~40μg/ml、40~50μg/ml。
[0032]
在一种实施方式中,所述转铁蛋白的浓度选自以下任一范围:5~10μg/ml、10~20μg/ml、20~30μg/ml、30~40μg/ml、40~50μg/ml。
[0033]
所述亚硒酸盐选自亚硒酸钠、亚硒酸钾、亚硒酸铁、亚硒酸锌或亚硒酸锰。
[0034]
在一种实施方式中,所述亚硒酸盐的浓度选自以下任一范围:5~10ng/ml、10~20ng/ml、20~30ng/ml、30~40ng/ml、40~50ng/ml。
[0035]
所述生长因子是一类通过与特异的、高亲和的细胞膜受体结合,调节细胞生长与
其他细胞功能等多效应的多肽类物质,对人体的免疫、造血调控、肿瘤发生、炎症与感染、创伤愈合、血管形成、细胞分化、细胞凋亡、形态发生、胚胎形成等方面产生着重要的调控作用。生长因子广泛存在于机体的各种组织内,包括成熟组织和胚胎组织,通过自分泌或旁分泌方式调节各种细胞的增殖和分化,并且许多体外培养的细胞也能释放生长因子。生长因子例如为成纤维细胞生长因子(fibroblast growth factor,fgf)、血小板衍生生长因子(platelet-derived growth factor,pdgf)、转化生长因子(transforming growth factor,tgf)、血管内皮生长因子(vascular endothelial growth factor,vegf)、表皮生长因子(epidermal growth factor,egf)、胰岛素样生长因子(insulin-like growth factor,igf)、集落刺激因子(colonystimulating factor,csf)以及生长激素释放抑制因子(somatostatin,srih)等。在本技术中,上述生物活性物质组合物中所述的成纤维细胞生长因子、血小板衍生生长因子、转化生长因子对于生物活性物质组合物或无血清培养基或组合物的活性是必须的,它们与生物活性物质组合物中其它成分一起发挥活性,实现细胞/或组织培养、组织修复。
[0036]
在一种实施方式中,所述生长因子选自成纤维细胞生长因子或转化生长因子中的一种或多种。
[0037]
所述成纤维细胞生长因子是指能够促进细胞的生长的一类的活性蛋白质或多肽类物质。所述成纤维细胞生长因子例如为fgf1,fgf2,fgf4,fgf7,fgf10,fgf18或成纤维生长因子合成肽等。
[0038]
在一种实施方式中,所述成纤维细胞生长因子的浓度选自以下任一范围:5~10ng/ml、10~20ng/ml、20~30ng/ml、30~40ng/ml、40~50ng/ml、50~60ng/ml、60~70ng/ml、70~80ng/ml。
[0039]
在一种实施方式中,所述转化生长因子的浓度选自以下任一范围:0.01~0.05ng/ml、0.05~0.1ng/ml、0.1~0.2ng/ml、0.2~0.4ng/ml、0.4~0.6ng/ml、0.6~0.8ng/ml、0.8~1.0ng/ml。
[0040]
在一种实施方式中,所述神经调节蛋白的浓度选自以下任一范围:0.01~0.05ng/ml、0.05~0.1ng/ml、0.1~0.2ng/ml、0.2~0.4ng/ml、0.4~0.6ng/ml、0.6~0.8ng/ml、0.8~1.0ng/ml。
[0041]
本发明还提供所述无血清培养基在培养肌肉干细胞中的用途。
[0042]
所述肌肉干细胞选自所述非人类动物的肌肉干细胞。所述非人类动物为哺乳动物、鸟类、鱼类。哺乳动物例如为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述非人类动物例如为鸡、猪、牛、鱼、鸭、鹅、兔、马、驴、鹿。
[0043]
本发明还提供一种肌肉干细胞的培养方法,包括以下步骤:在细胞培养容器中接种细胞,并用所述无血清培养基培养。
[0044]
本发明的培养方法在无蛋白包被的培养容器中可以正常增殖,相比必须在培养容器中包被蛋白的培养方式,本发明的方法大大减少细胞培养成本及操作复杂性。
[0045]
当然,在另一种实施方式中,所述培养方法也可以包括在接种细胞前用核纤层蛋白包被细胞培养容器。所述核纤层蛋白包被细胞培养容器的方法为现有技术中的常规方法。在一种实施方式中,所述核纤层蛋白的包被浓度为1~5μg/cm2。包被细胞培养容器的时间可以根据温度选择。例如2-8℃包被过夜,或30~39℃孵育1~2.5小时。包被的目的在于
能够使得细胞在接种时能够更好地贴壁。
[0046]
在一种实施方式中,培养肌肉干细胞的条件为4%~6%的co2、35~38℃。
[0047]
所述培养方法培养至p10代获得的肌肉干细胞仍表达肌肉干细胞标志性蛋白pax7。
[0048]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0049]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0050]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0051]
实施例1
[0052]
使用牛原代肌肉干细胞用于无血清培养基的研究和开发。
[0053]
1.平板包被:使用2.5μg/cm2的核纤层蛋白进行平板包被,将包被溶液加入到24孔板中,置于37度孵育2小时,平板包被的目的在于,能够使得原代细胞在接种时能够更好地贴壁;
[0054]
2.配制培养基:按照表1-1和表1-2进行四种无血清培养基的配制,标记为sfm-beefy 9(sfm-beefy9为文献报道的无血清培养基,培养基的所有组分按照文献报道的供货商及货号进行购买使用,参考文献如前所述),sfm-ceb,sfm-bsa-low fatty acid(fatty acid≤0.005%w/w),sfm-bsa(未进行fatty acid去除工艺处理,未检测bsa中fatty acid含量,所以含量不确定,一般认为未经工艺去除的过程,则试剂中会含有较多量的fatty acid),存放至4度冰箱,并于一周内使用完毕;
[0055]
表1-1
ceb组细胞有比较明显的生长和增殖,说明了该无血清培养基能够维持细胞的正常生长;
[0063]
6.细胞传代:待p1细胞密度增长至90%-100%时,细胞可进行传代操作,传代过程中使用的培养基为dmem+20%fbs+10ng/ml fgf2,接种细胞仍为24孔板每孔2*104个细胞,并标记为p2,待细胞贴壁之后进行换液操作,分别换为对照组及sfm-ceb培养基。由于sfm-beefy 9、sfm-bsa-low fatty acid、sfm-bsa并不能满足细胞的正常增殖,所以在p1之后舍弃这三组,未继续进行实验。
[0064]
实施例2细胞长时间培养
[0065]
按照常规的细胞培养方法进行培养观察细胞是否能够长时间增殖和传代。如图2所示,与对照组(正常血清+生长因子组)相比较,细胞能够在sfm-ceb无血清培养基中长时间进行培养,可多次传代至p10。可以确定牛肌肉干细胞能够在sfm-ceb无血清培养基中长时间增殖及传代,sfm-ceb无血清培养基适用于牛肌肉干细胞增殖生长。
[0066]
实施例3细胞干性鉴定
[0067]
细胞增殖至p10代时进行干性鉴定。使用的蛋白标志物为肌肉干细胞经典的蛋白标志物pax7,细胞在培养皿密度达到90%时进行细胞传代,细胞计数之后取2*104细胞铺至有玻片的24孔板内,待细胞贴壁之后进行蛋白免疫荧光检测,使用现有技术中经典的免疫荧光操作步骤进行抗体的孵育及染色,最终在荧光显微镜下进行荧光镜检,结果如图3所示,sfm-ceb组与对照组细胞均有较强的pax7表达,可以确定在无血清培养条件下,细胞在增殖的同时仍保持一定的干性。
[0068]
实施例4
[0069]
1.验证细胞在sfm-ceb的培养体系下,是否能够在不具有基质蛋白包被的培养皿中正常生长。取p8代细胞进行实验,首先对平板进行选择性包被,接着细胞进行细胞计数,取6*105个细胞均分为3份,每份2*104个细胞,接种至24孔板3个孔,标记为对照组(ctrl)、实验组1(sfm-ceb(with coating))、实验组2(sfm-ceb(without coating))、对照组使用的培养基为:dmem+20%fbs+10ng/ml fgf2。细胞贴壁之后,向三个孔内加入对应的培养基,进行培养。
[0070]
2.细胞观察:细胞在生长过程中进行拍照记录。细胞传代,待细胞密度增长至90%-100%时,可进行传代操作。
[0071]
3.细胞传代:传代过程中使用的培养基为dmem+20%fbs+10ng/ml fgf2,接种细胞仍为24孔板每孔2*104个细胞,并标记为p9,待细胞贴壁之后进行换液操作,分别换为对照组及sfm-ceb培养基。连续培养三代,即p8,p9,p10,结果如图4所示。可以看到,和对照组(ctrl)及核纤层蛋白包被组相比,未进行包被的细胞也能够较好进行增殖及传代。说明在sfm-ceb的无血清培养体系可以支撑细胞在无蛋白包被的培养皿中进行正常增殖,这将大大减少细胞培养成本及操作复杂性。
[0072]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1