PD-1蛋白表达载体及其应用的制作方法
pd-1蛋白表达载体及其应用
技术领域
1.本发明涉及分子生物技术领域,具体而言,涉及一种pd-1蛋白表达载体及其应用。
背景技术:
2.程序性细胞死亡蛋白(pd-1)是一种具有268个氨基酸的i型膜蛋白,属于cd28家族成员,其基因位于2号染色体上,主要在t细胞和pro-b细胞上表达。
3.pd-1的结构主要包括胞外免疫球蛋白可变区(igv)结构、疏水的跨膜区以及胞内区,胞内区尾部有2个独立的酪氨酸残基,氮端的酪氨酸残基参与构成一个免疫受体酪氨酸抑制基序(immunoreceptor tyrosine based inhibitory motif,itim),碳端酪氨酸残基则参与构成一个免疫受体酪氨酸转换基序(immunoreceptor tyrosine based switch motif,itsm)。
4.pd-l1和pd-l2是pd-1的两个糖蛋白配体,其中,pd-l1是肿瘤细胞产生的配体蛋白,能够和t淋巴细胞的pd-1相结合。肿瘤细胞的pd-l1与t细胞上的pd-1结合后,促使pd-1的itsm结构域中的酪氨酸发生磷酸化,进而引起下游蛋白激酶syk和pi3k的去磷酸化,抑制下游akt、erk等通路的活化,最终抑制t细胞活化所需基因及细胞因子的转录和翻译,发挥负向调控t细胞活性的作用。
5.目前常见抗肿瘤药物的研究聚焦于靶向pd-1单克隆抗体,但是单抗药物具有免疫原性,个体差异性以及适应症有限等局限性。
6.此外,蛋白类药物在体内存在半衰期,因而在治疗期间,需要多次给药,这也会降低患者依从性,影响治疗效果。
7.因此,如何提高药物的治疗效果,扩大药物的适应症范围是开发肿瘤药物的难点。
技术实现要素:
8.为了解决上述问题,本发明的第一目的在于提供一种pd-1蛋白表达载体,包括aav载体,aav载体的多克隆位点的酶切位点间插入有pd-1基因片段,以实现通过表达载体在人体内长期表达pd-1蛋白,pd-1蛋白和肿瘤细胞的pd-l1特异性结合,从而降低肿瘤细胞对t细胞的负调节作用,提高t淋巴细胞对肿瘤细胞生长的抑制作用。
9.本发明的一种实现方式中,pd-1基因片段的序列如seq id no.1所示。
10.本发明的一种实现方式中,多克隆位点的酶切位点为限制性内切酶not i和ecor i的酶切位点。
11.本发明的第二目的在于提供一种包含上述pd-1蛋白表达载体的转化体。
12.本发明的一种实现方式中,转化体包括宿主细胞以及转化到宿主细胞的表达载体。
13.本发明的一种实现方式中,宿主细胞为大肠埃希氏杆菌细胞、hek293细胞、hela细胞或vero细胞。
14.本发明的第三目的在于提供一种药物组合物,药物组合物包括:
15.上述pd-1蛋白表达载体,以及药学上或生理学上可接受的药物载体。
16.本发明的一种实现方式中,药物载体包括填充剂、稀释剂和赋形剂中的至少一种。
17.本发明的第四目的在于提供上述pd-1蛋白表达载体、上述转化体或上述药物组合物在制备癌症治疗药物中的应用。
18.本发明的一种实现方式中,癌症为非小细胞肺癌。
19.本发明公开的pd-1蛋白表达载体,能够在人体内长期表达pd-1蛋白,pd-1蛋白和肿瘤细胞的pd-l1特异性结合,从而降低肿瘤细胞对t细胞的负调节作用,提高t淋巴细胞对肿瘤细胞生长的抑制作用;本发明的pd-1蛋白表达载体,使用aav作为载体,受体为硫酸乙酰肝素蛋白聚糖(hspg),以及共受体αβ5整合素和成纤维细胞生长因子受体(fgfr),在多种细胞表面存在,使得aav能够感染多种不同的组织和细胞,并能感染分裂期和非分裂期的细胞;本发明的pd-1蛋白表达载体采用aav作为载体,aav不会像腺病毒、慢病毒等载体产生强烈的t细胞反应,是nih认定的唯一一种生物安全i类病毒,为最安全的病毒;本发明的pd-1蛋白表达载体通过基因工程技术,使得病毒失去了整合位点,不与宿主细胞染色体整合,安全性高,几乎不会导致与腺相关病毒有关的人类疾病;本发明的pd-1蛋白表达载体通过形成首尾相接的环状高分子量多聚体的形式存在,这种结构使得外源基因长时间表达,使得病人使用更便利,频率更低,依从性增加,同时减少病人的用药成本。
附图说明
20.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
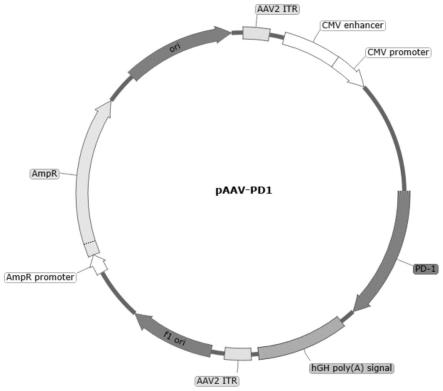
21.图1为本发明实施例1构建的pd-1蛋白表达载体的结构示意图。
具体实施方式
22.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
23.因此,旨在本发明覆盖落入所附权利要求的范围及其等同范围中的此类修改和变化。本发明的其它对象、特征和方面公开于以下详细描述中或从中是显而易见的。本领域普通技术人员应理解本讨论仅是示例性实施方式的描述,而非意在限制本发明更广阔的方面。
24.如上文,目前已知的针对pd-1/pd-l1相互作用的抗肿瘤药物为单克隆抗体药物,但是单抗药物具有免疫原性,个体差异性以及适应症有限等局限性。
25.此外,蛋白类药物在体内存在半衰期,因而在治疗期间,需要多次给药,这也会降低患者依从性,影响治疗效果。
26.非小细胞型肺癌包括鳞状细胞癌(鳞癌)、腺癌、大细胞癌,与小细胞癌相比其癌细胞生长分裂较慢,扩散转移相对较晚。非小细胞肺癌约占所有肺癌的80%,约75%的患者发
现时已处于中晚期,5年生存率很低。非小细胞肺癌pd-1类药物用药频率高,然而对非小细胞肺癌患者来说,药物应用便利性差、患者顺应性低,并且经济成本高。
27.为了至少部分解决上述技术问题的至少一个,本发明的第一方面提供了一种pd-1蛋白表达载体,如图1所示,包括aav载体,且aav载体的多克隆位点的酶切位点间插入有pd-1基因片段。本发明的pd-1蛋白表达载体是一种重组avv载体,其中,腺相关病毒(adeno-associated virus,aav)是一类微小、无包膜的具有二十面体的细小单链dna病毒,重组aav载体是在非致病的野生型aav基础上改造而成的基因载体。
28.如本文所用,术语“重组aav载体”、“重组aav载体”、“重组aav”、“重组aav病毒”、“重组aav病毒粒”、“重组aav病毒颗粒”或“aav基因表达载体”在本文中可以互换使用,其意指aav病毒衣壳包裹的基因组dna中含有异源多核苷酸。该载体可以剔除基因组中的rep和cap基因,而代之以表达目的基因的异源多核苷酸,通过感染、转化、转导或转染入宿主细胞而使携带的遗传物质元件在宿主细胞中表达。载体可以包含用于控制表达的多个元件,包括但不限于启动子序列、转录起始序列、增强子序列、内含子、kozak序列、治疗基因、polya序列、选择元件和报道基因。另外,载体还可以包含复制起点。
29.重组aav病毒的组装必须依赖于三种成分,即:转移载体,由转基因表达读框以及两侧的野生型aav的itr区(可以为完整的itr,也可以为不完整的itr)组成;aav的cap和rep编码序列;辅助病毒功能。aav载体具有相对成熟的组装系统,便于规模化生产。目前国内外常用的aav载体组装系统主要包括三质粒共转染系统、腺病毒为辅助病毒系统、单纯疱疹病毒为辅助病毒的包装系统以及基于杆状病毒的包装系统。其中,三质粒转染组装系统因安全性高,是应用最为广泛的aav载体组装系统,也是目前国际上主流的生产系统。具体而言,三质粒转染组装系统一般包含三种质粒:重组aav转移质粒,其中仅保留基因组两端的itr序列(可以为完整的itr,也可以为不完整的itr),剔除了野生型aav的rep及cap基因,而代之以表达目的基因的异源多核苷酸;重组aav辅助质粒,其为克隆的itr缺失的野生型aav的基因组,以反式方式提供rep和cap基因编码蛋白的功能;以及adv辅助病毒质粒,其中包含起辅助功能的基因e2a、e4orf6和va rna。e1a和e1b55k可由所要转染的细胞,例如hek293细胞提供。
30.本发明的pd-1蛋白表达载体,能够在人体内长期表达pd-1蛋白,pd-1蛋白和肿瘤细胞的pd-l1特异性结合,从而降低肿瘤细胞对t细胞的负调节作用,提高t淋巴细胞对肿瘤细胞生长的抑制作用;本发明的pd-1蛋白表达载体,使用aav作为载体,受体为硫酸乙酰肝素蛋白聚糖(hspg),以及共受体αβ5整合素和成纤维细胞生长因子受体(fgfr),在多种细胞表面存在,使得aav能够感染多种不同的组织和细胞,并能感染分裂期和非分裂期的细胞;本发明的pd-1蛋白表达载体采用aav作为载体,aav不会像腺病毒、慢病毒等载体产生强烈的t细胞反应,是nih认定的唯一一种生物安全i类病毒,为最安全的病毒;本发明的pd-1蛋白表达载体通过基因工程技术,使得病毒失去了整合位点,不与宿主细胞染色体整合,安全性高,几乎不会导致与腺相关病毒有关的人类疾病;本发明的pd-1蛋白表达载体通过形成首尾相接的环状高分子量多聚体的形式存在,这种结构使得外源基因长时间表达,使得病人使用更便利,频率更低,依从性增加,同时减少病人的用药成本。
31.一些实施方案中,本发明采用的aav载体为paav-mcs2载体,用于插入pd-1基因片段,其中paav-mcs2的制备方法为本领域常见的制备方法,或者可以通过市售获得。
32.可以使用本领域已知的任何合适的基因工程技术来实现pd-1蛋白表达载体的生成,其包括但不限于dna同源重组、限制性内切核酸酶消化、连接、转化、质粒纯化和dna测序的标准技术,例如sambrook等人(molecular cloning:a laboratory manual.cold spring harbor laboratory press,n.y.(1989))的技术。
33.一些实施方案中,aav载体多克隆位点的酶切位点为本领域常见酶切位点,只要能将编码pd-1蛋白的核酸克隆到paav-mcs2载体即可。
34.一些具体实施方案中,aav载体多克隆位点的酶切位点为限制性内切酶noti和ecor i的酶切位点。
35.一些实施方案中,pd-1基因片段为编码pd-1蛋白的cdna,序列如seq id no.1所示:
36.seq id no.1:
37.atgcagatcccacaggcgccctggccagtcgtctgggcggtgctacaactgggctggcggccaggatggttcttagactccccagacaggccctggaacccccccaccttctccccagccctgctcgtggtgaccgaaggggacaacgccaccttcacctgcagcttctccaacacatcggagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggacaagctggccgccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtcacacaactgcccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgacagcggcacctacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagcctgcgggcagagctcagggtgacagagagaagggcagaagtgcccacagcccaccccagcccctcacccaggtcagccggccagttccaaaccctggtggttggtgtcgtgggcggcctgctgggcagcctggtgctgctagtctgggtcctggccgtcatctgctcccgggccgcacgagggacaataggagccaggcgcaccggccagcccctgaaggaggacccctcagccgtgcctgtgttctctgtggactatggggagctggatttccagtggcgagagaagaccccggagccccccgtgccctgtgtccctgagcagacggagtatgccaccattgtctttcctagcggaatgggcacctcatcccccgcccgcaggggctcagctgacggccctcggagtgcccagccactgaggcctgaggatggacactgctcttggcccctctga。
38.可以理解的是,上述核酸序列作为一种用于编码pd-1蛋白的基因片段序列的具体方式,并不构成对本发明pd-1基因片段的限制。
39.进一步,pd-1基因片段还可以是图1所示序列的同系物,该同系物可以利用常见的真核启动子进行表达,且在该序列的同系物之前的启动子可以通过一个或者多个核酸的替代、插入或者缺失而变化,但是这些改变对启动子功能没有影响,而且通过改变启动子的序列,甚至来源自不同物种的启动子的更换,可提高pd-1蛋白的表达水平。
40.pd-1基因片段同系物还包括一类具有在标准条件下能够与pd-1基因片段的多聚核酸进行杂交的碱基序列的多聚核酸,该杂交可根据《分子克隆实验指南》(molecular cloning/a laboratory manaul)记载的分子生物学通用方法进行。
41.进一步,为了将pd-1基因片段插入aav载体,pd-1基因片段的一端连接有5
’‑
cctcagc,3
’‑
ggagtcg,另一端连接有5
’‑
gaattc,3
’‑
cttaag,以实现通过限制性内切酶noti和ecor i进行pd-1基因片段和aav载体的重组。
42.本发明的第二方面提供了一种包含上述pd-1蛋白表达载体的转化体。
43.一些实施方案中,上述转化体包括宿主细胞以及转化到宿主细胞的pd-1蛋白表达载体。该宿主细胞通过表达载体或其基因组中的核酸,能够获得包含上述pd-1蛋白的表达产物。
44.具体地,通过将上述pd-1蛋白表达载体包装到相应的宿主细胞中制备得到含有pd-1蛋白表达载体的细胞,以使得的宿主细胞能够表达pd-1蛋白。
45.一些具体实施方案中,宿主细胞为大肠埃希氏杆菌细胞、hek293细胞、hela细胞或vero细胞。其中较佳的选择为真核细胞,更佳的选择为hek293细胞,更佳的为稳定性良好的传代10-30代的hek293细胞。hek293细胞为本领域常见的市售细胞。
46.本发明的第三方面提供了一种药物组合物,药物组合物包括:
47.上述pd-1蛋白表达载体,以及药学上或生理学上可接受的药物载体。其中,药物载体,是指能改变药物进入受试者体内的方式和在体内的分布、控制药物的释放速度并将药物输送到靶向器官的体系。
48.合适的药学上可接受的载体可以本领域普通技术人员所熟知的方式获得。例如,在remington’s pharmaceutical sciences中可找到关于药学上可接受的载体的充分说明。在组合物中药学上可接受的载体可含有液体,如水、磷酸盐缓冲液、ringer溶液、生理盐水、平衡盐溶液、甘油或山梨醇等。另外,这些载体中还可能存在辅助性的物质,如润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质和稳定剂,如白蛋白等。
49.一些具体实施方案中,上述药物载体包括填充剂、稀释剂和赋形剂中的至少一种。
50.可以理解的是,本发明提供的药物组合物通过药物载体将pd-1蛋白表达载体输送至受试者体内后,能够在受试者体内长期表达
51.本发明的第四方面提供了一种上述pd-1蛋白表达载体、上述转化体或上述药物组合物在制备癌症治疗药物中的应用。
52.一些实施方案中,癌症包括非小细胞肺癌。
53.本发明的第五方面提供了一种pd-1蛋白表达载体的构建方法,该方法包括:获取pd-1基因片段,采用pcr扩增pd-1基因片段,在aav载体上插入pcr扩增片段以得到pd-1蛋白表达载体。
54.一些具体实施方案中,pd-1基因片段可以通过逆转录人工提取,也可以直接人工合成。
55.一些具体实施方案中,pcr扩增引物包括seq id no.2所示序列的上游引物和seq id no.3所示序列的下游引物;
56.seq id no.2:5
’‑
cctcagcatgcagatcc-3’;
57.seq id no.3:3
’‑
cttggcccctctgacttaag-5’。
58.如本文,术语“引物”指寡核苷酸,无论其是在经纯化的限制性消化物中天然存在或是合成产生的,寡核苷酸当置于诱导与核酸链互补的引物延伸产物合成的条件下时(例如,存在核苷酸和诱导剂诸如dna聚合酶和在合适的温度和ph下),寡核苷酸能够作为合成的起始点而起作用。引物优选是单链的,以用于扩增的最大效率,但可选地也可以是双链的。如果是双链的,则在用于制备延伸产物前,首先将引物处理以分开其链。优选地,引物是寡脱氧核糖核苷酸。引物应足够长,以在诱导剂存在的情况下引发延伸产物的合成。引物的精确长度将取决于许多因素,包括温度、引物来源和方法的使用。例如,在一些实施方案中,引物范围为10-100或更多个核苷酸(例如10-300、15-250、15-200、15-150、15-100、15-90、20-80、20-70、20-60、20-50个核苷酸等)。
59.下面将结合实施例对本发明的实施方案进行详细描述。
60.实施例1
61.1、获取pd-1基因片段
62.本实施例构建包含seq id no.1所示序列的dna模板,通过引物5
’‑
cctcagcatgcagatcc和3
’‑
cttggcccctctgacttaag进行pcr反应,获得扩增的pd-1基因片段溶液。
63.pcr反应体系为:在50ul的反应体系中,加入1ul的上述pcr富集的核苷酸序列、加入上述引物各1ul、加入dntp 4ul、加入5x缓冲液10ul、加入taq酶1ul,加入双蒸水补充体系到50ul。pcr反应程序为:(1)95℃预变性5分总;(2)93℃变性45秒;(3)56℃退火30秒;(4)72℃延伸40秒,程序(2)-(4)重复30个循环;(5)72℃延申10分钟。pcr结束后,通过凝胶电泳回收后进行纯化收集pcr扩增片段,以得到pd-1基因片段溶液。其中,所用的pcr试剂盒可以为天根生化科技的dp219-03试剂盒。
64.2、构建pd-1蛋白的表达载体
65.对本实施例1获得的pd-1基因片段溶液和paav-mcs2质粒进行not i和ecor i(购自newengland)两种酶酶切,酶切的体系为:pd-1基因片段溶液/质粒4ul、not i和ecor i各1ul、10x缓冲液2ul、双蒸水12ul,酶切条件为37℃水浴4小时。将双酶切后的产物用t4连接酶(购自invitrogen)进行连接反应,反应体系为:加入酶切后的pd-1蛋白表达载体10ul、加入酶切后的paav-mcs2质粒1ul、t4连接酶1ul、10x缓冲液2.5ul、双蒸水10.5ul,连接条件为16℃过夜,以得到如图1所示的pd-1蛋白表达载体aav-pd-1。
66.3、表达载体的包装、纯化与滴度检测
67.以hek293细胞作为包装细胞,用含10%胎牛血清的dmem培养基进行细胞培养。细胞生成融合度到80%-85%时,用lipo3000转染法将所构建的三个质粒paav-pd1、paav-rc(购自invitrogen)、paav-helper(购自invitrogen)共转染hek293细胞(购自atcc),三质粒总量为10.5ug(其中xxx载体:paav-rc载体:paav-helper载体的加入量比例为1:1:1.5),转染试剂lipo3000的加入量为21ul,将两种溶液混合到dmem中,补足总体积为1ml,静置15分钟;即开始转染。
68.每个10cm培养皿加入静置后的混合液1ml,放入二氧化碳培养箱中培养,其中条件为5%co2、37℃培养24小时,更换新鲜的培养基,继续培养48小时后收集细胞。将细胞放入-80冰箱反复冻融三次,然后加入dnase i和rnase a,终浓度为0.1mg/ml,37℃水浴30分钟,3000g离心30分钟,收集上清到50ml离心管中,再用0.45um的过滤器进行过滤,重新收集上清,获得病毒粗提液。
69.参照文献(hum gene ther.2001jan 1,12(1):71-6),对病毒提取液进行纯化。层析柱加入2ml肝素-琼脂糖后,用50ml的1xpbs平衡,将病毒粗提液过柱,用25ml的0.15m的nacl溶液洗涤柱子2次,再用15ml的0.4m的nacl溶液洗脱病毒,将病毒液用浓缩柱进行浓缩后置与-80℃下备用。
70.使用qpcr的方法对aav-pd-1病毒滴度进行检测,检测得到的aav的滴度为4.3x10
13
v.g/ml。
71.实施例2
72.本实施例使用的raji细胞购自中科院细胞库,pd-1蛋白(货号:10377-h08h-b)和抗pd-1抗体(anti-pd-1)购自上海义翘神州(货号:10377-mm23),人外周血细胞(pbmc)购自
妙顺生物技术(上海)有限公司。aim-v,dmem/f12,胎牛血清,pbs采购自thermo公司。t细胞分选试剂盒采购自miltenyi公司。
73.raji细胞培养:raji细胞使用含10%胎牛血清的dmem/f12进行培养,培养条件为37℃,5%co2,其中,raji细胞不表达pd-1。
74.人t细胞培养:按照t细胞分选试剂盒对人外周血细胞进行分离,分离出的t细胞进行培养,培养条件为37℃,5%co2,其中,人t细胞表达pd-1。
75.在96孔板上进行细胞培养,加入anti-pd-1抗体并进行分析。将培养的raji细胞和人t细胞接种到96孔板中,每个孔接种细胞数为25000个/孔。具体接种情况如下表所示:
76.其中每孔培养基加入量为100ul
77.a1、b1、c1加入:10%血清的dmem/f12;
78.a2、b2、c2加入:aim-v培养基;
79.a3、b3、c3加入:10%血清的dmem/f12和raji细胞;
80.a4、b4、c4加入:10%血清的dmem/f12和raji细胞和此次构建包装的raav病毒2.5*106;
81.a5、b5、c5:aim-v培养基和人t淋巴细胞;
82.a6、b6、c6:pd-1蛋白提前包被,然后加入10%血清的dmem/f12;
83.按照以上条件加入后,将孔板放入在37℃,5%co2培养箱中培养2小时,向以上每个孔中加入体积为10ul的1ng/ml的anti-pd-1,再放入培养箱中培养16小时,清洗后用酶标仪检测发光强度。
84.检测结果如表1所示:
85.表1
[0086] 123456a000.82338.62462.831130.672b001.13947.29779.362206.376c000.36243.82073.735163.284
[0087]
根据表1可知,加入本发明构建的pd-1蛋白表达载体,即插入有pd-1基因的重组aav载体后,不表达pd-1的raji细胞能够表达出pd-1并与anti-pd-1结合,且本发明构建的pd-1蛋白表达载体能够在细胞中表达一定量的pd-1蛋白,表达量能达到相同条件下人t淋巴细胞表达量的一半以上。
[0088]
以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0089]
以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1