一类七元环拟糖类化合物及其制备方法和应用
本发明涉及一类七元环拟糖分子化合物(包含七元环氧糖和七元环氮杂糖)及七元环氮杂糖可药用盐的合成方法,以及其作为糖苷酶抑制剂,治疗新冠病毒等引发疾病的用途,属于糖化学和药物化学领域。
背景技术:
1、拟糖分子,可以是区别于自然界中存在的五元或六元氧糖的七元、八元环的氧糖。也可以是一类糖环上氧原子被杂原子如氮原子取代的化合物,其结构主要呈五元或六元的单环,也有五元并五元或五元并六元的稠环等称为氮杂糖(azasugar),又称亚氨基糖(iminosugar)。以六元环结构为例,氧糖与拟糖分子如下所示。
2、
3、拟糖分子作为糖苷酶抑制剂,常用于治疗由糖代谢紊乱引发的疾病,如:抗病毒感染(包括抗艾滋病)、抗肿瘤、抗癌、抗糖尿病和免疫抑制等(叶新山等,中国药物化学杂志,2015,25,397-406)。
4、2014年sergio d.rosenzweig等发现两名甘露糖寡糖葡萄糖苷酶缺乏的兄妹,身体在伴有低丙种球蛋白血症的状况下却表现出较正常同龄人低的病毒感染易感性现象。结合二人有糖苷酶抑制剂的治疗,机体细胞出现病毒复制和病毒进入受损的情况。rosenzweig等提出以糖苷酶的抑制剂作为保护病毒患者免疫系统和降低感染易感性,是非常新颖的一种抗病毒策略(sergio d.rosenzweig等engl.j.med.2014,370,1615–1625)。随后,英国科学家针对病毒需要宿主内质网蛋白折叠机制才能正确折叠一个或多个糖蛋白后,进而形成完整病毒形态的过程,采用糖苷酶抑制剂影响病毒在人体内的复制,从而降低病毒危害的抗病毒策略,利用具有葡萄糖立体化学特性的拟糖类化合物,其中dnj为天然氮杂糖脱氧野尻霉素。mon-dnj靶向内质网中α-葡萄糖苷酶i和ii(α-glu i和α-glu ii)进而影响病毒糖蛋白的折叠,能表现出抗登革热病毒、流感病毒h1n1和h3n2、丙型肝炎病毒和人类免疫缺陷病毒等的活性,目前作为治疗登革热病毒的候选药物进行临床研究(nicolezitzmann等biochemical society transactions,2017,45,571–582)。下述为烷基化修饰的拟糖类化合物。
5、
6、2019年以来,新型冠状病毒引发危害人类的新型冠状病毒肺炎(covid-19),在全球已造成了数百万人的死亡。我国研发的疫苗在国内外能有效地防范新型冠状病毒的肆虐,已取的了世人瞩目的成效。开发小分子抗新冠病毒的药物,仍然是疫苗之外,治疗新冠肺炎的必然补充。根据糖苷酶抑制剂对病毒复制的影响,拟糖类化合物可作为先导化合物对抗新冠病毒活性进行更深入系统的研究具有非常重要的现实意义。
7、其特点在于干扰病毒糖蛋白和阻断病毒s蛋白n-连接糖基化合成。内质网中糖蛋白合成及正确折叠的生物学机制,前体聚糖glc3man9glcnac2被添加到肽中并进行转译,α-葡萄糖苷酶-i(α-glu-i)对末端葡萄糖残基切割的产物,即可与马来酸丁酯结合转运出内质网,也可被和α-葡萄糖苷酶-ii(α-glu-ii)进一步修饰,成为钙连蛋白/钙网蛋白(calnexin/calreticulin)的底物。α-glu-ii在释放calnexin/calreticulin时,可以清除残余的葡萄糖。此时,正确折叠的蛋白质被输出到高尔基进行进一步加工,而错误折叠的蛋白质可由尿苷二磷酸葡萄糖﹕糖蛋白葡糖基转移酶(uggt)在折叠时的“第二次机会”进行表皮糖基化;或是由内质网-甘露糖苷酶i(er-man i)引导到内质网关联降解(erad)途径,该酶从聚糖的b臂去除甘露糖残基。内质网降解促进α-甘露糖苷酶样应激蛋白1-3(edem1-3)然后作用于聚糖的c-臂,随后通过与膜生成衔接蛋白lin-12样抑制子/增强子(sel1l)的相互作用,内质网凝聚素-9/x蛋白反式激活基因(os-9/xtp3-b)介导的底物向泛素连接酶(hrd1)递送待泛素化的复合物。聚糖酶(pngase)再将多糖从蛋白质中分离出来,两个片段多糖和蛋白质都将被降解。现有技术中有多篇文献对此有记载。如elizabeth c.clarke等the iminosugars celgosivir,castanospermine and uv-4inhibit sars-cov-2replication,glycobiology,2020,1–7;dominic s.alonzi等iminosugar antivirals:the therapeutic sweet spot,biochemical society transactions(2017)45 571–582;aitor casas-sanchez等protein glycosylation is essential for sars-cov-2
8、infection(https://doi.org/10.1101/2021.02.05.429940)。因此糖苷酶抑制机制可成为潜在的预防和/或治疗covid-19的药物
9、七元环氧糖作为人工合成的拟糖分子,其抑制凝集素fimhld作用非常显著(beaternst等chemical science,2018,9,646–654),其作为糖苷酶抑制剂的生物活性尚未得到认知。抑制糖苷酶的生物活性已有较多报道(a.somsak,l.等current pharmaceuticaldesign 2003,9,1177–1189.b.stutz,a.e.等current topics in medicinal chemistry2003,3,513–523.c.zhang yongmin等journal of the american chemical society,2009,131,5390–5392.d.journal of the american chemical society,2010,132,1804–1806.e.organic&biomolecular chemistry,2015,13,3446–3456.),七元环氮杂糖烷基取代衍生物的相关活性至今未见报道。
10、有关七元环拟糖类分子报道的合成方法较多(a.wong c.-h.等angew.chem.,int.ed.,1999,38,2300–2324.b.le merrer yves等tetrahedron letters,1998,385–388.c.bleriot yves等heterocycles,2004,64,65–74;organic&biomolecularchemistry,2004,2,1492–1499;tetrahedron:asymmetry,2005,16,313–319;organic&biomolecular chemistry,2006,4,1653–1662.d.beat ernst等chemical science,2018,9,646–654),所报道的合成方法均要经过多步合成来实现。几乎所有这些己知合成方法多存在操作条件苛刻、实验步骤冗长、选择性和收率较低等缺点。
技术实现思路
1、本发明的目的之一在于提供了一种化合物或其立体异构体、水合物、溶剂化物、药学上可接受的盐、代谢物或前药及其制备方法。
2、本发明的另一目的在于提供了制备上述化合物的方法。
3、本发明还有一目的在于提供了含有上述化合物或其立体异构体、水合物、溶剂化物、药学上可接受的盐、代谢物或前药的组合物。
4、本发明还有一目的在于提供了上述化合物或其立体异构体、水合物、溶剂化物、药学上可接受的盐、代谢物或前药用于防治病毒方面的用途。
5、为达到上述目的,本发明提供了下述技术方案:
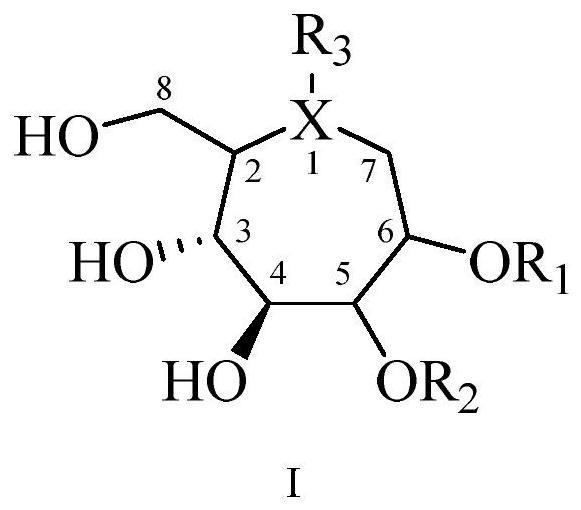
6、具有下述式i的通式化合物:
7、
8、所述式i化合物的2,5,6位碳的立体构型为2r、5r、6r,2s、5r、6r,2r、5s、6s,2s、5s、6s。
9、x为n、o或s,当x为o或s时,r3表示无取代;
10、r1和r2各自独立地选自氢、氘、任意取代或未取代的烷基、任意取代或未取代的烯基、任意取代或未取代的环烷基、任意取代或未取代的芳基、任意取代或未取代的杂芳基、中的一个或多个,r4表示烷基;
11、r3选自氢、氘、任意取代或未取代的烷基、任意取代或未取代的烯基、任意取代或未取代的环烷基、任意取代或未取代的芳基、任意取代或未取代的杂芳基中的一个或多个。
12、此处用到的术语“烷基”是包括具有特定数目碳原子的支链和直链饱和烃基。例如“c1-10烷基”(或亚烷基)目的是c1、c2、c3、c4、c5、c6、c7、c8、c9和c10烷基。另外,例如“c1-6烷基”表示具有1到6个碳原子的烷基。烷基可为非取代或取代的,以使一个或多个其氢原子被其它化学基团取代。烷基的实施例包括但不限于甲基(me)、乙基(et)、丙基(如正丙基和异丙基)、丁基(如正丁基、异丁基、叔丁基)、戊基(如正戊基、异戊基、新戊基)及其类似物。如无特殊说明,所提到的具体烷基包括其所有的同分异构体。
13、“烯基”是既包括直链或支链结构的烃,且具有一个或多个出现在链中任何稳定点的碳-碳双键。例如“c2-6烯基”(或亚烯基)目的是包括c2、c3、c4、c5和c6烯基。烯基的实例包括但不限于乙烯基、1-丙烯基,2-丙烯基、2-丁烯基、3-丁烯基、2-戊烯基、3-戊烯基、4-戊烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、2-甲基-2-丙烯基、4-甲基-3-戊烯基及其类似物。
14、此处用到的术语“取代的”指的是在指定原子或基团上的任意一个或多个氢原子以选择的指定基团取代,前提是不超过指定原子的一般化合价。如果没有其它说明,取代基命名至中心结构。例如,可以理解的是当(环烷基)烷基是可能的取代基,该取代基至中心结构的连接点是在烷基部分中。此处使用的环双键是形成于两个临近环原子之间的双键(如c=c、c=n或n=n)。当提到取代时,特别是多取代时,指的是多个取代基在指定基团上的各个位置上取代,如二氯苄基指的是2,3-二氯苄基、2,4-二氯苄基、2,5-二氯苄基、2,6-二氯苄基、3,4-二氯苄基和3,5-二氯苄基。
15、取代基和变量的组合是允许的,仅当这些组合产生稳定的化合物或有用的合成中间体。稳定的化合物或稳定结构暗示所述化合物以有用的纯度从反应混合物分离出来时是足够稳定的,随之配制形成有效的治疗试剂。
16、术语“杂芳基”指的是取代和非取代芳香5或6元单环基团,9-或10-元双环基团,和11到14元三环基团,在至少一个环中具有至少一个杂原子(o,s或n),所述含杂原子的环优选具有1、2或3个选自o、s和n中的杂原子。含杂原子的杂芳基的每个环可含一个或两个氧或硫原子和/或由1到4个氮原子,前提是每个环中杂原子的总数是4或更少,且每个环具有至少一个碳原子。完成双环和三环基团的稠合环可仅含有碳原子,并可以是饱和、部分饱和或不饱和。氮可任选被氧化及被季铵化。双环或三环的杂芳基必须包括至少一个全芳香环,氮其它稠合环可为芳香性或非芳香性的。杂芳基可在任何环的任何可利用氮或碳原子上连接。
17、示例性单环杂芳基包括吡咯基、吡唑基、吡唑啉基、咪唑基、噁唑基、异噁唑基、噻唑基、噻二唑基、呋喃基、噻吩基、噁二唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基及其类似物。
18、示例性双环杂芳基包括吲哚基、苯并噻唑基、苯并二氧杂环戊烯基、苯并噁唑基、苯并噻吩基、喹啉基、四氢异喹啉基、异喹啉基、苯并咪唑基、苯并呋喃基、吲哚嗪基、苯并呋喃基、色酮基、香豆素基、苯并呋喃基、噌啉基、喹喔啉基、吲唑基、吡咯并吡啶基、氟代吡啶基、二氢异吲哚基、四氢喹啉基及其类似物。
19、如果没有其它说明,本发明的化合物理解为包括游离态和其盐。术语“盐”表示以无机和/或有机酸和碱形成酸式和/或碱式盐。另外,术语“盐可包括两性离子(内盐),如当式i化合物含有碱性片段如胺或吡啶或咪唑环,和酸式片段如羧酸。药物上可接受的(即非毒性、生理学上可接受的)盐是优选的,如可接受的金属和胺盐,其中阳离子没有显著贡献毒性或盐的生物活性。然而,其它盐可是有用的,如在制备过程中采用分离或纯化步骤,因此也包含于本发明范围中。
20、优选地,c1-c10烷基指的是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基及其同分异构体;c2-c5烯基指的是乙烯基、丙烯基、烯丙基、丁烯基、戊烯基及其同分异构体。
21、当提到取代基为烯基、烷基、芳基、苄基、环烷基时,或这些取代基具体的为某个具体的烯基、烷基、芳基、苄基、环烷基时,指的是一个到三个上述取代基。如氯苄基指的是一个到三个氯取代的苄基。
22、本技术还提供了所述化合物的制备方法,包括下述步骤:
23、将化合物1(d-阿拉伯糖),经乙酰氯和甲醇反应,生成d-阿拉伯糖异头碳羟基甲基保护的化合物2。化合物2经氢化钠催化,与苄溴反应,生成羟基被苄基保护的化合物3。
24、
25、化合物3经乙酸和硫酸溶液反应,生成异头碳羟基游离的化合物4。
26、化合物4经维蒂希-霍纳尔反应,生成具有端基烯的化合物5。
27、
28、化合物5经氢化钠催化,与溴丙烯反应,生成具有两个端基烯的化合物6。化合物6经烯烃复分解,生成具有一个环内双键、七元环氧糖结构的化合物7。
29、
30、化合物7经双羟基化,生成具有两个羟基七元环氧糖结构的化合物8。化合物8经脱保护试剂进行脱保护反应,生成化合物9;
31、所述脱保护所用试剂为钯炭/氢气,所述钯碳与所述中间体的质量比为5:100-20:100比例范围;
32、所述化合物9中的r1和r2为氢;
33、
34、化合物8进行乙酰化反应,再经脱保护试剂进行脱保护反应,生成化合物11;
35、所述脱保护所用试剂为钯炭/氢气,所述钯碳与所述中间体的质量比为5:100-20:100比例范围;
36、所述化合物11中的r1和r2为乙酰基。
37、
38、化合物8与c1-18的直链烷基卤代烃(r-x)经氢化钠催化反应,再经脱保护试剂进行脱保护反应,生成化合物13;
39、所述脱保护所用试剂为钯炭/氢气,所述钯碳与所述中间体的质量比为5:100-20:100比例范围;
40、所述化合物13中的r1和r2为c1-18的直链烷基;
41、所述化合物13中的r1为氢,r2为c1-18的直链烷基;
42、所述化合物13中的r1为c1-18的直链烷基,r2为氢。
43、
44、化合物5经光延反应,生成羟基构型翻转的化合物14。
45、
46、化合物5经氯铬酸吡啶嗡盐氧化,生成具有酮羰基的化合物15。化合物15与烯丙基胺进行还原胺化反应,生成具有两个端基烯的化合物16。
47、
48、化合物16与氯甲酸苄酯反应,生成化合物17。化合物17经烯烃复分解,生成具有一个环内双键、七元环氮杂糖结构的化合物18。
49、
50、化合物18经双羟基化,生成具有两个羟基七元环氮杂糖结构的化合物19。化合物19与c1-18的直链烷基卤代烃(r-x)经氢化钠催化反应,生成化合物20。
51、
52、化合物20经脱保护试剂进行脱保护反应,生成化合物21;
53、所述脱保护所用试剂为钯炭/氢气,所述钯碳与所述中间体的质量比为5:100-20:100比例范围;
54、所述化合物21中的r1为c1-18的直链烷基。
55、
56、化合物16与c1-18的直链烷基卤代烃(r-x)经氢化钠催化反应,生成化合物22;
57、所述化合物22中的r3为c1-18的直链烷基。
58、
59、化合物22经烯烃复分解,生成具有一个环内双键、七元环氮杂糖结构的化合物23;
60、所述化合物23中r3为c1-18的直链烷基。
61、
62、化合物23经双羟基化,生成具有两个羟基七元环氮杂糖结构的化合物24,再经脱保护试剂,进行脱保护反应,生成化合物25;
63、所述脱保护所用试剂为钯炭/氢气,所述钯碳与所述中间体的质量比为5:100-20:100比例范围;
64、所述化合物25中r3为c1-18的直链烷基。
65、
66、所述各步骤反应是在二氯甲烷、氯仿、四氢呋喃、乙醚、乙酸乙酯、乙酸、水、二氧六环、甲醇、乙醇、乙腈、甲酰胺和n,n-二甲基甲酰胺至少一种溶剂中进行,所述溶剂,除水以外,根据反应条件的需要可以是无水级别的溶剂;所述反应的温度为-40℃至140℃。
67、任一上述的式i所示的化合物及其可药用的盐也属于本发明的保护范围之内。
68、上述盐是药学上可接受的盐。
69、本发明的药物组合物包括药学上可按受的载体(如稀释剂,赋形剂)以及任选的其他添加剂。药物组合的制备方法为药学上的常规方法。
70、本发明所述的化合物或其药学上可接纳的盐可以利用各种给药途径给药,包括但不限于口服、吸入、直肠、透皮、经粘膜肠内给药,以及皮下、肌肉或静脉注射给药。
71、本发明所述化合物或它们在药学上可以接受的简单衍生物,可以单独给药,和/或与已知其他抗病毒药物一起给药。
72、实施例
73、下面通过实施例对本发明作进一步说明。应该理解的是,本发明实施例所述方法仅仅是用于说明本发明,而不是对本发明的限制,在本发明的构思前提下对本发明制备方法的简单改进都属于本发明要求保护的范围。实施例中用到的所有原料和溶剂均为市售相应纯度产品。
74、本发明通式i所示化合物的合成路线一:
75、
76、本发明通式i所示化合物的合成路线二:
77、
78、本发明通式i所示化合物的合成路线三:
79、
80、需要指出的是本发明式i化合物合成路线对烷基化的氧糖、氮杂糖选用了代表性的烷基,如当r1、r2、r3、r4为只含碳链的直链或支链取代基时,本领域的普通技术人员在阅读了本说明书后,按照本实施例的操作方法很容易获得氧原子或氮原子的取代基为不同长度的碳链(例如1-18个碳原子),这些都是本领域的技术人员无需付出任何创造性的劳动都可实现的,所以本发明的保护范围绝不囿于本实施例所公开的范围。
81、[中间体制备实施例1]化合物4的合成
82、将乙酰氯(0.12ml,1.66mmol)溶于甲醇(5ml)中,在氮气保护下,于室温滴加到盛有d-阿拉伯糖(0.5g,3.38mmol)和甲醇(10ml)悬浮液伴有搅拌的反应瓶中。保持搅拌,直到薄层层析(二氯甲烷/甲醇2:1)检测起始材料消失。反应混合物用固体碳酸氢钠中和至ph7,过滤并减压浓缩。然后用丙酮(30ml)稀释所得残余物,过滤所得悬浮液以去除过量的碳酸氢钠,并在减压下浓缩得到化合物2粗品。将化合物2粗品(0.55g,3.38mmol)装入反应瓶,加入无水四氢呋喃(12ml)搅拌溶解,以冰浴将反应溶液的温度控制为0℃,分批加入氢化钠(0.81g,20.3mmol),随后加入催化量的四丁基碘化铵(15mg)。保持反应温度为0℃,滴加苄基溴(1.4毫升,10.6mmol),滴加完毕反应自然升至室温,搅拌过夜。反应结束,滴加甲醇(5ml)淬灭反应,反应液浓缩后以二氯甲烷(150ml)和水(150ml)萃取。二氯甲烷层经无水硫酸镁干燥,过滤,减压浓缩,得到化合物3粗品。将化合物3粗品溶解于乙酸(20ml)和1m硫酸(10ml)中,在100℃下搅拌5h。然后将反应混合物冷却至室温,用固体碳酸氢钠中和并过滤。所得溶液用二氯甲烷萃取(2×50ml),合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯4:1)纯化,得到无色油状化合物4(1.2g,48%)。波谱数据与文献(bleriot yves等tetrahedron:asymmetry.,2002,13,2553–2565.)报道相同。
83、1h nmr(400mhz,cdcl3)δ7.44-7.22(m,30h,6×ph),5.45-5.26(m,2h),4.66(d,j=11.6hz,1h),4.61-4.44(m,11h),4.16(t,j=4.6hz,1h),4.09(q,j=4.2hz,1h),4.02(t,j=4.6hz,1h),3.98(d,j=1.7hz,1h),3.94(d,j=2.7hz,1h),3.83(d,j=9.4hz,1h),3.55(dddd,j=14.1,10.1,
84、9.3,4.9hz,4h),3.12(s,1h).
85、[中间体制备实施例2]化合物5的合成
86、氮气保护下,冰浴0℃,将正丁基锂(13.1ml,2.5m己烷溶液,32.8mmol)滴加到盛有甲基三苯基溴化膦(11.7g,32.8mmol)和无水四氢呋喃(150ml),并伴有搅拌的反应瓶中。滴加完毕后,继续搅拌0.5h后,控制温度在0.5℃下,滴加化合物4(6.9g,16.4mmol)无水四氢呋喃(70ml)溶液至反应瓶中。滴加完毕后,将反应体系加热至90℃回流3小时。反应结束后,在0℃缓慢加入水淬灭反应。所得溶液用乙酸乙酯萃取(2×100ml),合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯6:1)纯化得到无色油状化合物5(6.24g,91%)。波谱数据与文献(bleriot yves等org.biomol.chem.,2004,2,p.1492–1499.)报道相同。
87、1h nmr(400mhz,cdcl3)δ7.43-7.18(m,15h,3×ph),5.96(ddd,j=16.7,11.0,7.5hz,1h),5.41-5.25(m,2h),4.74-4.46(m,5h),4.37(d,j=11.9hz,1h),4.16-3.97(m,2h),3.72-3.54(m,3h).
88、[中间体制备实施例3]化合物6的合成
89、在反应瓶中加入化合物5(1.3g,3.11mmol)、四丁基碘化铵(0.3g,0.31mmol)和无水n,n-二甲基甲酰胺(50ml),0℃搅拌下逐份加入氢化钠(0.49g,12.44mmol)。加毕持续搅拌0.5小时,在0℃下向反应中滴加3-溴丙烯(1.07ml,12.44mmol),滴加完毕后,室温下搅拌反应过夜。反应结束后,在0℃下加入甲醇(40ml)淬灭反应,所得溶液用乙酸乙酯萃取(2×100ml)。合并有机相经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析(石油醚/乙酸乙酯10:1)纯化得到无色油状化合物6(1.48g,100%)。
90、1h nmr(600mhz,cdcl3)δ7.41–7.27(m,15h),5.97–5.89(m,1h),5.88–5.79(m,1h),5.33(d,j=17.3hz,1h),5.31–5.27(m,1h),5.22(ddd,j=12.6,3.3,1.6hz,1h),5.11(dd,j=10.4,1.6hz,1h),4.70(d,j=11.3hz,1h),4.66(d,j=8.2hz,1h),4.64(d,j=8.7hz,1h),4.57(d,j=12.2hz,1h),4.55(d,j=2.6hz,1h),4.53–4.47(m,1h),4.37(d,j=11.8hz,1h),4.14–4.04(m,2h),3.92–3.84(m,1h),3.78(dt,j=4.8,2.7hz,1h),3.73(dd,j=6.1,4.2hz,1h),3.67(dd,j=11.2,5.5hz,1h).13c nmr(151mhz,cdcl3)δ138.69,138.65,138.53(3×cipso),136.24(=ch),135.31(=ch),128.42,128.42,128.35,128.35,128.29,128.29,128.22,128.22,128.11,128.11,127.82,127.82,127.62,127.60,127.55(15aromatic c),118.57(=ch2),116.62(=ch2),81.47(-ch),80.59(-ch),78.18(-ch),74.93(-ch2),73.38(-ch2),71.26(-ch2),70.68(-ch2),69.24(-ch2).esi-hrms:calcd forc30h34o4na(m+na+):481.2349.found:481.2340.
91、[中间体制备实施例4]化合物7的合成
92、在反应瓶中,将化合物6(1.3g,2.84mmol)溶解于二氯甲烷(500ml)中,并通过鼓泡氮气将溶液脱气30min。加入grubbs催化剂1st(10%mol,0.5g),氮气保护下,45℃回流搅拌反应至薄层层析检测(石油醚/乙酸乙酯5:1)原料完全消失。添加过量的醋酸铅,淬灭反应。减压下浓缩反应混合物,并通过快速柱色谱(石油醚/乙酸乙酯15:1)纯化得到无色油状化合物7(1.03g,86%)。
93、1h nmr(600mhz,cdcl3)δ7.42–7.15(m,15h),5.86–5.76(m,2h),4.76(d,j=11.2hz,1h),4.72(d,j=12.0hz,1h),4.67(d,j=11.9hz,1h),4.56(s,2h),4.46(dd,j=13.9,6.4hz,1h),4.46–4.38(m,1h),4.35(ddd,j=6.5,3.7,1.3hz,1h),4.21–4.11(m,1h),3.80(ddd,j=7.7,6.5,2.9hz,1h),3.69(ddd,j=15.6,9.8hz,2h),3.64–3.56(m,1h).13cnmr(151mhz,cdcl3)δ138.69,138.35,138.33(3×cipso),131.45(=ch),129.24(=ch),128.46,128.46,128.46,128.46,128.44,128.44,128.11,128.11,127.88,127.88,127.86,127.86,127.76,127.68,127.67(15aromatic c),80.81(-ch),80.68(-ch),78.85(-ch),73.89(-ch2),73.41(-ch2),72.14(-ch2),70.61(-ch2),67.79(-ch2).esi-hrms:calcd forc28h30o4na(m+na+):453.2036.found:453.2029.
94、[中间体制备实施例5]化合物8的合成
95、化合物7(0.68g,1.58mmol)以丙酮/水溶液体积比为8:1(5ml)于反应瓶中溶解,加入n-甲基氧化吗啉(0.74g,6.33mmol)和oso4(0.25ml,2.5%wt叔丁醇溶液),室温下搅拌反应过夜。反应结束后,加入过量硫代硫酸钠(500mg)终止反应。反应混合物用乙酸乙酯萃取(2×150ml)并用盐水(150ml)清洗。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析(石油醚/乙酸乙酯2:1)纯化得到无色油状化合物8a(110mg,16%)。进一步洗脱得到无色油状化合物8b(196mg,27%)。
96、化合物8a1h nmr(600mhz,cdcl3)δ7.52–7.00(m,15h),4.92(d,j=11.5hz,1h),4.78(d,j=11.1hz,1h),4.65(d,j=11.5hz,1h),4.62–4.51(m,4h),4.24–4.16(m,2h),4.03–3.97(m,1h),3.91(dd,j=8.5,2.3hz,1h),3.78–3.71(m,2h),3.70–3.60(m,2h),3.24(br,1h),2.67(br,1h).13c nmr(151mhz,cdcl3)δ138.14,137.98,137.90(3×cipso),128.79,128.79,128.58,128.58,128.51,128.51,128.20,128.19,128.02,127.99,127.99,127.97,127.97,127.80,127.80(15aromatic c),80.59(-ch),80.56(-ch),80.44(-ch),75.23(-ch),74.43(-ch2),73.59(-ch2),72.13(-ch2),71.10(-ch2),70.65(-ch2),70.08(-ch).esi-hrms:calcd for c28h32o6na(m+na+):487.2091.found:487.2087.
97、化合物8b 1h nmr(600mhz,cdcl3)δ7.52–6.98(m,15h),4.61–4.52(m,3h),4.49(d,j=12.1hz,1h),4.45(d,j=11.7hz,1h),4.38(d,j=11.7hz,1h),4.17(dd,j=13.2,2.9hz,1h),4.09(d,j=4.8hz,1h),4.05(s,1h),3.88(s,1h),3.79(dd,j=10.5,5.5hz,1h),3.73(t,j=4.7hz,1h),3.68(br,1h),3.64(dd,j=13.1,0.8hz,1h),3.55(dd,j=9.9,6.1hz,1h),3.43(dd,j=9.9,5.4hz,1h),3.24(br.1h).13c nmr(151mhz,cdcl3)δ138.17,137.63,137.53(3×cipso),128.70,128.70,128.54,128.54,128.49,128.49,128.25,128.19,128.19,128.03,128.00,128.01,128.01,127.94,127.82(15aromatic c),85.55(-ch),84.61(-ch),75.73(-ch),74.91(-ch),74.44(-ch2),73.40(-ch2),72.42(-ch2),72.25(-ch2),71.55(-ch2),69.98(-ch).esi-hrms:calcd for c28h32o6na(m+na+):487.2091.found:487.2087.
98、[中间体制备实施例6]化合物10的合成
99、在反应瓶中将化合物8b(232mg,0.43mmol)溶解于吡啶(4ml)中,加入过量乙酸酐(2ml),室温搅拌反应过夜。反应结束后,减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯10:1)纯化得到无色油状化合物10(143mg,47%)。
100、1h nmr(600mhz,cdcl3)δ7.35–7.22(m,13h),7.15–7.10(m,2h),5.73(t,j=1.9hz,1h),5.22–5.17(m,1h),4.76(d,j=11.3hz,1h),4.69(d,j=11.1hz,1h),4.57–4.52(m,3h),4.40(d,j=11.1hz,1h),3.95(dd,j=12.7,6.7hz,1h),3.79(ddd,j=15.6,9.8,6.5hz,3h),3.63(t,j=5.2hz,2h),3.60–3.54(m,1h),2.13(s,3h),2.05(s,3h).13c nmr(151mhz,cdcl3)δ170.57(c=o),170.50(c=o),138.22,138.14,137.86(3×cipso),128.47–127.71(15aromatic c),81.61(-ch),80.68(-ch),77.76(-ch),74.35(-ch),73.49(-ch2),72.81(-ch2)),71.02(-ch2),70.75(-ch2),70.45(-ch2),67.81(-ch),21.14(-ch3),21.03(-ch3).esi-hrms:calcd for c32h36o8na(m+na+):571.2302.found:571.2294.
101、[中间体制备实施例7]化合物12的合成
102、在反应瓶中,加入化合物8a(196mg,0.422mmol)、四丁基碘化铵(15.6mg,0.1mmol)和无水n,n-二甲基甲酰胺(50ml),在0℃搅拌下,分批加入氢化钠(11mg,0.465mmol)。加毕反应0.5小时后,在0℃下向反应中滴加溴化正庚烷(66.3l,0.422mmol),滴加完毕后,室温下搅拌反应过夜。反应结束后,0℃下加入甲醇(5ml)淬灭反应,所得溶液用乙酸乙酯(2×50ml)萃取。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯5:1)纯化得到黄色油状化合物12a(50mg)。进一步洗脱得到黄色油状化合物12b(52mg)和黄色油状化合物12c(38mg)。
103、化合物12a 1h nmr(600mhz,cdcl3)δ7.41–7.23(m,13h),7.17(d,j=6.8hz,2h),4.79(dd,j=11.3,6.8hz,1h),4.71(t,j=10.9hz,1h),4.67(d,j=11.0hz,1h),4.61–4.49(m,2h),4.49–4.40(m,1h),4.00(t,j=6.0hz,1h),3.93(td,j=9.9,4.7hz,1h),3.80–3.73(m,4h),3.69(d,j=10.2hz,1h),3.67–3.50(m,4h),3.50–3.43(m,2h),1.55(dd,j=13.4,6.8hz,4h),1.42–1.20(m,16h),0.89(dt,j=9.5,6.0hz,6h).13c nmr(151mhz,cdcl3)δ138.87,138.68,138.51(3×cipso),128.69–127.57(15aromatic c),82.30,82.09,80.22,78.78,78.48,77.61,73.84,73.55,72.98,71.66,71.20,70.85,70.66,70.10,32.17–22.78(-ch2 aliph),14.25(-ch3 aliph),14.22(-ch3 aliph).esi-hrms:calcd for c42h60o6na(m+na+):683.4282.found:683.4257.
104、化合物12b 1h nmr(600mhz,cdcl3)δ7.55–7.10(m,15h),4.91(d,j=11.5hz,1h),4.73(d,j=11.0hz,1h),4.71–4.65(m,1h),4.57(dt,j=16.9,9.6hz,3h),4.02(dd,j=13.7,5.5hz,2h),3.87–3.80(m,1h),3.76(dd,j=12.7,3.5hz,1h),3.72–3.66(m,1h),3.64(dd,j=10.2,4.6hz,1h),3.60–3.53(m,1h),3.46(dd,j=6.8,2.5hz,1h),2.73(br,1h),1.59–1.47(m,2h),1.40–1.20(m,10h),0.89(t,j=6.9hz,3h).13c nmr(151mhz,cdcl3)δ138.33–138.24(3×cipso),128.71–127.09(15aromatic c),82.41(-ch),81.37(-ch),79.51(-ch),78.30(-ch),75.04(-ch2),74.19(-ch2),73.64(-ch2),71.69(-ch),71.49(-ch2),70.97(-ch2),70.71(-ch2),31.96,30.20,29.25,26.24,22.76(-ch2 aliph),14.23(-ch3 aliph).esi-hrms:calcd for c35h46o6na(m+na+):585.3187.found:585.3181.
105、化合物12c 1h nmr(600mhz,cdcl3)δ7.42–7.00(m,15h),4.66(t,j=4.2hz,2h),4.58(d,j=12.2hz,1h),4.55–4.48(m,2h),4.34(d,j=11.1hz,1h),4.20–4.15(m,1h),4.08(d,j=5.9hz,1h),4.06(d,j=5.8hz,1h),3.99(dd,j=7.0,3.9hz,1h),3.83–3.79(m,1h),3.78–3.75(m,1h),3.70–3.51(m,2h),3.38(dd,j=15.5,6.8hz,1h),2.23(br,1h),1.63(dd,j=14.3,7.2hz,2h),1.52(dd,j=8.9,4.9hz,2h),1.40–1.16(m,8h),0.87(dd,j=14.3,7.3hz,3h).13c nmr(151mhz,cdcl3)δ138.46,138.41,138.21(3×cipso),128.57–127.65(15aromatic c),81.69(-ch),81.19(-ch),81.02(-ch),79.06(-ch),73.52(-ch2),73.44(-ch2),73.36(-ch2),71.95(-ch2),71.38(-ch),71.21(-ch2),69.22(-ch2),31.90,30.19,29.25,26.16,22.73(-ch2 aliph),14.22(-ch3 aliph).esi-hrms:calcd forc35h46o6na(m+na+):585.3187.found:585.3184.
106、[中间体制备实施例8]化合物14的合成
107、在反应瓶中加入化合物5(100mg,0.239mmol)、4-硝基苯甲酸(160mg,0.957mmol)和三苯基膦(251mg,0.957mmol),以无水四氢呋喃(5ml)搅拌溶解,氮气保护下,0℃,滴加偶氮二羧酸二乙酯(140mg,0.957mmol)。反应结束后,减压除去溶剂,将所得反应粗品溶解在甲醇/水(4ml/0.4ml)混合溶剂中,加入氢氧化钠(29mg,0.719mmol),反应溶液回流1h,冷却后,用二氯甲烷萃取(2×20ml),合并有机相经无水硫酸镁干燥,过滤并减压浓缩,得到无色油状化合物14(39mg,91%)。
108、1h nmr(400mhz,cdcl3):7.39-7.28(m,15h,3×ph),5.91(ddd,j=17.5,10.3,7.4hz,1h),5.40(dd,j=17.5,10.3hz,2h),4.91(d,j=11.2hz,1h,chph),4.64(dd,j=11.8,11.2hz,2h,2×chph),4.47(dd,j=11.9hz,2h,2×chph),4.43(d,j=11.8hz,1h,chph),4.15(t,j=7.4,6.5hz,1h),3.97(ddd,j=5.5,3.5,2.6hz,1h),3.66(dd,j=6.5,2.6hz,1h),3.48(ddd,j=6.2,5.5,3.4hz,2h),2.51(br,1h,oh).
109、[中间体制备实施例9]化合物15的合成
110、在反应瓶中加入化合物14(5.71g,13.66mmol)、分子筛(9.3g)、无水二氯甲烷(230ml)。在氮气保护下,加入的氯铬酸吡啶嗡盐(8.84g,41mmol),室温搅拌反应。反应结束后,通过快速柱层析法(石油醚/乙酸乙酯6:1)洗脱,得到无色油状化合物15(4.95g,90%)。波谱数据与文献(bleriot yves等org.biomol.chem.,2004,2,p.1492–1499.)报道相同。
111、1h nmr(400mhz,cdcl3)δ7.41-7.14(m,15h,3×ph),5.99-5.82(m,1h),5.45-5.24(m,2h),4.58(dd,j=11.8,3.0hz,2h),4.54-4.48(m,2h),4.43(d,j=11.9hz,1h),4.34(d,j=4.9hz,2h),4.30(dd,j=11.6,3.5hz,1h),4.18(dd,j=7.8,3.5hz,1h),4.00(d,j=3.6hz,1h).
112、[中间体制备实施例10]化合物16的合成
113、在反应瓶中加入化合物15(3.83g,9.21mmol)、分子筛(9g)、无水二氯甲烷(80ml)。氮气保护,室温,搅拌下加入烯丙基胺(8ml,105.81mmol)和乙酸(2.8ml,48.81mmol)。加毕反应0.5h后,分批加入氰基硼氢化钠(3.1g,48.81mmol),室温搅拌过夜。反应结束后,滴加1m氢氧化钠(55ml)淬灭反应。所得溶液用二氯甲烷萃取(2×100毫升)。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯10:1)纯化无色油状化合物16a(2.04g,42%)和无色油状化合物16b(2.16g,51%)。波谱数据与文献(bleriot yves等org.biomol.chem.,2004,2,p.1492–1499.)报道相同。
114、化合物16a1h nmr(400mhz,cdcl3)δ7.38-7.30(m,15h,3×ph),5.94-5.82(m,2h),5.41(m,),5.37(m,1h),5.16(ddd,j=17.1,3.3,1.6hz,1h),5.06(ddd,j=10.0,2.8,1.4hz,1h),4.93(d,j=11.2hz,1h,chph),4.66(d,j=11.6hz,1h,chph),4.60(d,j=11.2hz,1h,chph),4.47(d,j=12.0hz,1h,chph),4.43(d,j=12.0hz,1h,chph),4.42(d,j=11.6hz,1h,chph),4.25(dd,j=7.5,7.0hz,1h),3.77(dd,j=7.0,3.3hz,1h),3.53(dd,j=9.2,5.0hz,1h),3.48(dd,j=9.2,7.3hz,1h),3.37(ddt,j=12.6,6.0,1.4hz,1h),3.20(ddt,j=13.7,6.0,1.4hz,1h),2.98(ddd,j=7.3,5.0,3.3hz,1h).
115、化合物16b 1h nmr(400mhz,cdcl3)δ7.38-7.30(m,15h,3×ph),5.95(m,j=18.1,10.5,7.5hz,1h),5.83(m,1h),5.35(m,1h),5.32(m,1h),5.14(app.dq,j=17.1,1.6hz,1h),5.06(app.dq,j=10.2,1.4hz,1h),4.81(d,j=11.4hz,1h,chph),4.68(d,j=11.4hz,1h,chph),4.67(d,j=11.8hz,1h,chph),4.57(d,j=12.0hz,1h,chph),4.49(d,j=12.0hz,1h,chph),4.42(d,j=11.8hz,1h,chph),4.22(dd,j=7.5,4.8hz,1h),3.69(dd,j=9.6,4.1hz,1h),3.65(m,2h),3.23(ddt,j=15.1,6.2,1.4hz,1h),3.13(ddt,j=13.9,5.6,1.4hz,1h),3.03(m,1h).
116、[中间体制备实施例11]化合物17的合成
117、0℃,将氯甲酸苄酯(2ml,14.54mmol)滴加到盛装水/乙酸乙酯混合物溶剂(800ml,1:1,v/v)溶解化合物16a(5.54g,12.12mmol)和碳酸氢钾(21.8g,218.16mmol)的反应瓶中,室温搅拌过夜,分离有机相,分别用1m盐酸溶液和盐水洗涤。有机相以无水硫酸镁干燥,减压过滤并浓缩滤液。通过快速柱层析法(石油醚/乙酸乙酯15:1)纯化得到无色油状化合物17a(6.35g,89%)。相同反应操作步骤,以化合物16b(4.08g,8.92mmol)合成得到无色油状化合物17b(4.6g,87%)。波谱数据与文献(bleriot yves等org.biomol.chem.,2004,2,p.1492–1499.)报道相同。
118、化合物17a 1h nmr(400mhz,cdcl3)δ7.38-7.29(m,40h,8×ph),6.00-5.73(m,4h),5.37-4.98(m,12h),4.90-4.32(m,14h),4.15-3.51(m,12h).
119、化合物17b 1h nmr(400mhz,cdcl3)δ7.41-7.30(m,40h,8×ph),6.02-5.78(m,4h),5.40-5.01(m,12h),4.88-4.33(m,14h),4.10-3.68(m,12h).
120、[中间体制备实施例12]化合物18的合成
121、在反应瓶中,将化合物17a(330mg,0.558mmol)溶解于二氯甲烷(140ml)中,并通过鼓泡氮气将溶液脱气30min。加入grubbs催化剂1st(10%mol,140mg),氮气保护下,45℃回流搅拌反应至薄层层析检测(石油醚/乙酸乙酯5:1)原料完全消失。添加过量的醋酸铅,淬灭反应。减压下浓缩反应混合物,并通过快速柱色谱(石油醚/乙酸乙酯15:1)纯化得到无色油状化合物18a(306mg,98%)。相同反应操作步骤,以化合物17b(0.98g,1.66mmol)合成得到无色油状化合物18b(0.91g,98%)。波谱数据与文献(bleriot yves等org.biomol.chem.,2004,2,p.1492–1499.)报道相同。
122、化合物18a 1h nmr(400mhz,cdcl3)δ7.38-7.25(m,40h,8×ph),5.79-5.68(m,4h),5.17(m,4h,2×ch2ph),4.98(d,j=11.3hz,1h,chph),4.95(d,j=11.1hz,1h,chph),4.82(d,j=11.6hz,1h,chph),4.75(d,j=11.7hz,1h,chph),4.70(d,j=11.6hz,1h,chph),4.68(d,j=11.7hz,1h,chph),4.60(m,1h),4.54(d,j=11.3hz,1h,chph),4.51(d,j=11.1hz,1h,chph),4.50(d,j=12.0hz,1h,chph),4.49(d,j=12.0hz,1h,chph),4.47(m,1h),4.34-4.26(m,4h),3.92-3.73(m,6h),3.65(dd,j=10.2,2.9hz,1h),3.58(dd,j=10.2,3.2hz,1h).
123、化合物18b 1h nmr(400mhz,cdcl3)δ7.37-7.25(m,40h,8×ph),6.06(ddd,j=11.5,6.1,2.1hz,1h),5.92(ddd,j=11.7,6.1,2.2hz,1h),5.77(m,2h),5.18(s,2h,ch2ph),5.14(d,j=12.4hz,1h,chph),5.02(d,j=12.4hz,1h,chph),5.01(m,1h,),4.86(m,1h),4.65-4.50(m,12h,6×ch2ph),4.40(m,1h),4.30(m,1h),4.27(m,1h),4.23(m,1h),4.08(dd,j=4.3,6.9hz,1h),4.05(dd,j=4.4,6.8hz,1h),3.90-3.80(m,2h),3.87(dd,j=7.0,9.6hz,1h),3.83(dd,j=7.3,9.4hz,1h),3.74(dd,j=8.2,9.6hz,1h),3.67(dd,j=7.6,9.4hz,1h).
124、[中间体制备实施例13]化合物19的合成
125、化合物18a(2.0g,3.54mmol)以丙酮/水溶液体积比为8:1(20ml)于反应瓶中溶解,加入n-甲基氧化吗啉(1.7g,14.16mmol)和oso4(0.7ml,2.5%wt叔丁醇溶液),室温下搅拌反应过夜。反应结束后,加入过量硫代硫酸钠(500mg)终止反应。反应混合物用乙酸乙酯萃取(2×150ml)并用盐水(150ml)清洗。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析(石油醚/乙酸乙酯2:1)纯化得到无色油状化合物19a(1.58g,75%)。进一步洗脱得到无色油状化合物19b(210mg,15%)。相同反应操作步骤,以化合物18b(1.22g,2.16mmol)合成得到无色油状化合物19c(660mg,51%)和无色油状化合物19d(340mg,26%)。波谱数据与文献(bleriot yves等org.biomol.chem.,2006,4,p.1653–1662.)报道相同。
126、化合物19a 1h nmr(c400 mhz,dcl3)δ7.40-7.27(m,40h,8×ph),5.27(d,j=12.5hz,1h,chph),5.21(d,j=12.5hz,1h,chph),5.17(d,j=12.4hz,1h,chph),5.13(d,j=12.4hz,1h,chph),4.74(m,1h),4.74(d,j=10.5hz,2h,2×chph),4.69(d,j=8.6hz,1h,chph),4.66-4.48(m,7h),4.38(app.t,1h),4.30(app.t,j=6.1hz,1h),4.18(d,j=8.8hz,1h),4.09-4.01(m,4h),3.93(m,2h),3.88-3.78(m,3h),3.71(dd,j=9.0,5.5hz,1h),3.62(dd,j=9.1,5.6hz,1h),3.32-3.22(m,2h),2.98(d,j=8.8hz,1h),2.96(d,j=8.8hz,1h).
127、化合物19b 1h nmr(400mhz,cdcl3)δ7.37-7.24(m,40h,8×ph),5.22(d,j=12.4hz,1h,chph),5.17(d,j=12.4hz,1h,chph),5.16(d,j=12.3hz,1h,chph),5.08(d,j=12.3hz,1h,chph),4.75(m,j=4.6hz,1h),4.66-4.50(m,9h),4.46(d,j=12.0hz,1h,chph),4.41(d,j=12.0hz,1h,chph),4.27(m,1h),4.19(m,1h),4.18(dd,j=7.4,5.2hz,1h),4.14(m,2h),4.11(dd,j=7.4,5.1hz,1h),4.03(m,3h),3.93(m,1h),3.79(dd,j=9.7,8.7hz,1h),3.73(dd,j=9.5,8.9hz,1h),3.64(dd,j=8.7,5.0hz,1h),3.50(dd,j=8.9,5.3hz,1h),3.35-3.28(m,3h),2.81(d,j=11.4hz,1h).
128、化合物19c 1h nmr(400mhz,cdcl3)δ7.39-7.26(m,40h,8×ph),5.24(d,j=12.3hz,1h,chph),5.22(d,j=12.5hz,1h,chph),5.18(d,j=12.5hz,1h,chph),5.16(d,j=12.3hz,1h,chph),5.06(d,j=11.1hz,1h,chph),5.04(d,j=11.1hz,1h,chph),4.98(d,j=10.9hz,1h,chph),4.96(d,j=11.2hz,1h,chph),4.64(d,j=11.1hz,1h,chph),4.58(d,j=11.2hz,1h,chph),4.53(d,j=11.2hz,1h,chph),4.48(d,j=12.0hz,1h,chph),4.47(d,j=10.9hz,1h,chph),4.43(d,j=11.7hz,1h,chph),4.38(dd,j=4.8hz,j=15.9hz,1h),4.36(d,j=10.7hz,1h,chph),4.35(m,1h),4.33(d,j=12.0hz,1h,chph),4.25(dd,j=15.7,5.1hz,1h),4.13(app.t,j=4.1hz,1h),4.09(dt,j=9.2,2.4,2.1hz,1h),4.01(app.t,j=4.0hz,1h),3.83(dd,j=9.8,2.9hz,1h),3.86-3.73(m,5h),3.68(dd,j=9.8,2.6hz,1h),3.62-3.55(m,3h),3.31(d,j=16.4hz,1h),3.27(dd,j=15.7hz,1h).
129、化合物19d 1h nmr(400mhz,cdcl3)δ7.39-7.23(m,40h,8×ph),5.17(s,2h,ch2ph),5.16(d,j=12.3hz,1h,chph),5.10(d,j=12.3hz,1h,chph),4.89(d,j=10.9hz,1h,chph),4.88(d,j=11.2hz,1h,chph),4.83(d,j=11.3hz,2h,2×chph),4.65(d,j=11.6hz,1h,chph),4.60(d,j=11.3hz,1h,chph),4.52(d,j=11.2hz,1h,chph),4.52(d,j=10.9hz,1h,chph),4.47(d,j=12.2hz,1h,chph),4.46(d,j=10.9hz,1h,chph),4.40(d,j=12.1hz,1h,chph),4.38(d,j=12.2hz,1h,chph),4.28-4.23(m,3h),4.23-4.20(m,3h),4.15(m,1h),3.83-3.66(m,6h),3.65(dd,1h),3.61(m,1h),3.55(dd,1h),3.37(dd,1h),3.29(dd,1h).
130、[中间体制备实施例14]化合物20的合成
131、在反应瓶中加入化合物19a(64mg,0.093mmol)、四丁基碘化铵(3mg,0.009mmol)和无水n,n-二甲基甲酰胺(3ml),在0℃搅拌下,分批加入氢化钠(11mg,0.279mmol)。加毕反应0.5小时后,在0℃下向反应中滴加溴化正庚烷(16l,0.1mmol),滴加完毕后,室温下搅拌过夜。0℃,添加另一批nah(11mg,0.279mmol),加毕反应0.5h后,滴加bnbr(22l,0.188mmol),室温下搅拌过夜。0℃下加入甲醇(4ml)淬灭反应,所得溶液用二氯甲烷萃取(2×50ml)。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯6:1)纯化得到黄色油状化合物20a(59mg,81%)。相同反应操作步骤,分别以化合物19b(28mg,0.04mmol)、19c(50mg,0.072mmol)和19d(27mg,0.04mmol)合成得到黄色油状化合物20b(7mg,23%)、黄色油状化合物20c(12mg,21%)和黄色油状化合物19d(28mg,89%)。
132、化合物20a 1h nmr(600mhz,cdcl3)δ7.55–7.04(m,50h),5.21(d,j=12.3hz,1h),5.18–5.07(m,3h),4.92–4.84(m,1h),4.74–4.37(m,18h),4.17(d,j=11.4hz,1h),4.08(dt,j=22.7,9.8hz,2h),3.97(d,j=12.7hz,1h),3.79(d,j=11.0hz,2h),3.75–3.59(m,7h),3.56–3.42(m,5h),3.39(ddd,j=13.2,11.4,6.8hz,3h),3.32–3.24(m,1h),1.61–1.52(m,4h),1.45(dd,j=12.9,7.8hz,3h),1.30(ddd,j=36.0,19.3,10.4hz,20h),0.88(dt,j=14.8,6.7hz,6h).13c nmr(151mhz,cdcl3)δ156.22,156.20(2×c=o),138.70–136.68(10×cipso),128.61–127.61(50aromatic c),82.03(-ch),81.88(-ch),81.58(-ch),81.45(-ch),80.54(-ch),80.40(-ch),78.74(-ch),78.13(-ch),73.67(-ch2),73.56(-ch2),73.48(-ch2),73.37(-ch2),73.15(-ch2),73.12(-ch2),72.94(-ch2),72.81(-ch2),71.10(-ch2),70.37(-ch2),70.09(-ch2),67.71(-ch2),67.67(-ch2),65.34(-ch2),64.83(-ch2),54.85(-ch),54.61(-ch),40.89(-ch2),40.49(-ch2),31.99,31.97,30.23,30.08,29.92,29.83,29.50),29.30,29.22,26.31,26.17,22.77,22.76(-ch2 aliph),14.25(-ch3 aliph).esi-hrms:calcd for c50h60no7(m+h+):786.4364.found:786.4366.
133、化合物20b 1h nmr(600mhz,cdcl3)δ7.58–7.00(m,50h),5.20(d,j=12.3hz,1h),5.16(d,j=12.3hz,1h),5.11(dd,j=12.2,7.6hz,1h),4.87(s,1h),4.74–4.34(m,12h),4.20(d,j=10.7hz,1h),4.04(ddd,j=31.4,20.9,11.0hz,2h),3.74–3.60(m,6h),3.57–3.38(m,5h),1.50–1.39(m,3h),1.36–1.17(m,20h),0.88(dd,j=8.6,5.5hz,6h).13c nmr(151mhz,cdcl3)δ156.24,156.17(2×c=o),138.91–136.69(10×cipso),128.70–127.29(50aromatic c),82.06(-ch),82.04(-ch),81.84(-ch),81.68(-ch),81.58(-ch),81.33(-ch),77.75(-ch),77.26(-ch),73.55(-ch2),73.39(-ch2),73.08(-ch2),73.04(-ch2),72.98(-ch2),72.85(-ch2),72.04(-ch2),71.92(-ch2),71.60(-ch2),67.75(-ch2),67.71(-ch2),65.38(-ch2),64.82(-ch2),54.97(-ch),54.75(-ch),32.00,30.25,30.20,29.85,29.29,26.35,22.79(-ch2 aliph),14.25(-ch3aliph).esi-hrms:calcd for c50h60no7(m+h+):786.4364.found:786.4344.
134、化合物20c 1h nmr(600mhz,cdcl3)δ7.39–7.18(m,30h),7.18–7.03(m,2h),4.98–4.91(m,1h),4.88(d,j=12.4hz,1h),4.73–4.63(m,2h),4.57(d,j=10.9hz,1h),4.53–4.41(m,3h),4.38–4.23(m,3h),4.05(s,1h),4.00(s,1h),3.91(d,j=6.7hz,2h),3.82(d,j=6.4hz,1h),3.74(dd,j=19.5,9.9hz,1h),3.61(d,j=7.0hz,1h),3.54–3.48(m,1h),3.44(t,j=7.6hz,1h),3.35–3.23(m,2h),1.43(dd,j=13.2,6.9hz,2h),1.37–1.14(m,14h),0.94–0.81(m,5h).esi-hrms:calcd for c50h59no7na(m+na+):808.4184.found:808.4156.
135、化合物20d 1h nmr(600mhz,cdcl3)δ7.45(dd,j=11.1,7.3hz,2h),7.40–7.19(m,21h),7.15(ddd,j=9.1,7.2,2.8hz,2h),5.19(dd,j=26.7,12.3hz,1h),5.09(t,j=11.7hz,1h),4.98–4.76(m,4h),4.59(dd,j=11.8,3.1hz,1h),4.44(dd,j=21.3,11.4hz,2h),4.37(d,j=12.3hz,1h),4.34–4.17(m,3h),4.09(d,j=26.4hz,1h),3.81(d,j=12.8hz,1h),3.69–3.56(m,2h),3.55–3.43(m,2h),3.37–3.11(m,3h),1.66–1.54(m,3h),1.48–1.41(m,1h),1.39–1.17(m,9h),0.94–0.87(m,3h).13c nmr(151mhz,cdcl3)δ156.28,156.15(2×c=o),139.44–136.53(10×cipso),128.66–127.38(50aromatic c),82.46(-ch),82.34(-ch),79.40(-ch),79.32(-ch),78.84(-ch),77.97(-ch),74.88(-ch),74.80(-ch2),74.77(-ch2),74.70(-ch2),74.43(-ch2),74.19(-ch2),74.14(-ch2),72.88(-ch2),72.78(-ch2),69.87(-ch2),69.64(-ch2),69.44(-ch2),69.33(-ch2),67.71(-ch2),67.49(-ch2),58.65(-ch),58.47(-ch),41.35(-ch2),31.99,31.96,30.24,30.06,29.30,29.23,26.25,26.12,22.76(-ch2 aliph),14.26(-ch3 aliph).esi-hrms:calcd for c50h59no7na(m+na+):808.4184.found:808.4165.
136、[中间体制备实施例15]化合物22的合成
137、在反应瓶中,加入化合物16a(268mg,0.586mmol)、四丁基碘化铵(15.6mg,0.1mmol)和无水n,n-二甲基甲酰胺(50ml),在0℃搅拌下,分批加入氢化钠(14mg,0.586mmol)。加毕反应0.5小时后,在0℃下向反应中滴加溴化正丁烷(368l,4.105mmol),滴加完毕后,室温下搅拌反应过夜。反应结束后,0℃下加入甲醇(5ml)淬灭反应,所得溶液用乙酸乙酯(2×50ml)萃取。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析法(石油醚/乙酸乙酯5:1)纯化得到无色油状化合物22a(209mg,70%)。相同反应操作步骤,以化合物16b(435mg,0.951mmol)合成得到无色油状化合物22b(137mg,28%)。
138、化合物22a 1h nmr(600mhz,cdcl3)δ7.49–7.20(m,15h),5.99(ddd,j=17.4,10.4,7.0hz,1h),5.93–5.76(m,1h),5.48(d,j=17.3hz,1h),5.39(d,j=10.5hz,1h),5.17(d,j=17.1hz,1h),5.13–5.05(m,2h),4.74(d,j=11.8hz,1h),4.67(d,j=11.5hz,1h),4.52(d,j=11.8hz,1h),4.47(s,2h),4.37(t,j=7.3hz,1h),3.84–3.76(m,2h),3.72(dd,j=9.0,4.9hz,1h),3.65(dd,j=14.5,4.9hz,1h),3.16(dd,j=14.5,7.6hz,1h),3.11(dd,j=7.8,4.1hz,1h),2.96–2.88(m,1h),2.55–2.48(m,1h),1.51–1.41(m,2h),1.32(ddd,j=18.6,14.6,7.2hz,2h),0.96(t,j=7.3hz,3h).13c nmr(151mhz,cdcl3)δ139.83,138.91,138.57(3×cipso),138.37(=ch),135.96(=ch),128.37–127.08(15aromatic c),118.14(=ch2),115.52(=ch2),83.39(-ch),82.67(-ch),75.74(-ch2),73.20(-ch2),70.81(-ch2),66.49(-ch2),60.57(-ch),55.43(-ch2),51.75(-ch2),31.16,20.62(-ch2 aliph),14.22(-ch3 aliph).esi-hrms:calcd for c34h43no3(m+h+):514.3316.found:514.3311.
139、化合物22b 1h nmr(600mhz,cdcl3)δ7.42–7.17(m,20h),6.00–5.85(m,1h),5.83–5.68(m,1h),5.29(t,j=7.3hz,2h),5.11(dd,j=17.2,1.4hz,1h),5.02–4.93(m,1h),4.82(dd,j=11.2,7.4hz,1h),4.67–4.53(m,3h),4.48(d,j=13.0hz,2h),4.38(dd,j=11.5,3.8hz,2h),4.30–4.20(m,1h),3.79(dd,j=10.1,3.8hz,1h),3.73–3.65(m,3h),3.31–3.15(m,3h),2.59–2.48(m,3h),1.36(ddd,j=17.2,12.9,8.4hz,4h),1.29–1.13(m,4h),0.85(dt,j=7.4,5.4hz,6h).13c nmr(151mhz,cdcl3)δ139.18–138.89(3×cipso),138.50(=ch),137.02(=ch),128.41–127.37(15aromatic c),118.37(=ch2),115.65(=ch2),82.04(-ch),81.94(-ch),74.37(-ch2),73.17(-ch2),70.84(-ch2),68.15(-ch2),59.46(-ch),54.87(-ch2),51.31(-ch2),31.26,20.65(-ch2 aliph),14.23(-ch3 aliph).esi-hrms:calcd for c34h43no3(m+h+):514.3316.found:514.3306.
140、[中间体制备实施例16]化合物23的合成
141、在反应瓶中,将化合物22a(200mg,0.389mmol)溶解于二氯甲烷(100ml)中,并通过鼓泡氮气将溶液脱气30min。加入grubbs催化剂1st(10%mol,80mg),氮气保护下,45℃回流搅拌反应至薄层层析检测(石油醚/乙酸乙酯5:1)原料完全消失。添加过量的醋酸铅,淬灭反应。减压下浓缩反应混合物,并通过快速柱色谱(石油醚/乙酸乙酯15:1)纯化得到无色油状化合物23a(71mg,37%)。相同反应操作步骤,以化合物22b(137mg,0.267mmol)合成得到无色油状化合物23b(43mg,33%)。
142、化合物23a 1h nmr(600mhz,cdcl3)δ7.43–7.25(m,15h),5.70(s,2h),4.75(d,j=11.7hz,1h),4.65(t,j=7.6hz,3h),4.53(t,j=7.5hz,2h),4.23(d,j=7.7hz,1h),3.94(dd,j=7.7,3.5hz,1h),3.78(dd,j=9.6,5.6hz,1h),3.71(t,j=8.8hz,1h),3.58(d,j=16.7hz,1h),3.46–3.39(m,1h),3.33–3.23(m,1h),2.83–2.67(m,2h),1.40(dt,j=13.1,6.6hz,2h),1.35–1.25(m,2h),0.92(t,j=7.3hz,3h).13c nmr(151mhz,cdcl3)δ139.06,138.89,138.72(3×cipso),130.59(=ch),128.56(=ch),128.39–127.52(15aromaticc),81.55(-ch),79.26(-ch),73.48(-ch2),73.12(-ch2),72.10(-ch2),68.09(-ch2),60.74(-ch),54.77(-ch2),49.63(-ch2),31.09,20.51(-ch2 aliph),14.20(-ch3 aliph).esi-hrms:calcd for c32h39no3(m+h+):486.3003.found:486.2990.
143、化合物23b 1h nmr(600mhz,cdcl3)δ7.58–7.13(m,15h),5.63(dd,j=11.7,1.9hz,1h),5.54–5.46(m,1h),4.81(ddd,j=11.6,9.0,6.9hz,2h),4.73(q,j=11.7hz,2h),4.58(d,j=11.5hz,1h),4.48(q,j=12.0hz,2h),3.76(dd,j=9.5,7.5hz,1h),3.53–3.39(m,3h),3.22(ddd,j=19.6,11.4,9.5hz,2h),2.79–2.68(m,1h),2.67–2.59(m,1h),1.51–1.42(m,2h),1.39–1.29(m,2h),0.91(t,j=7.3hz,3h).13c nmr(151mhz,cdcl3)δ139.22,139.15,138.68(3×cipso),130.78(=ch),129.07(=ch),128.43–127.45(15aromaticc),83.41(-ch),80.34(-ch),73.48(-ch2),73.17(-ch2),73.06(-ch2),70.11(-ch2),65.39(-ch),57.19(-ch2),50.49(-ch2),31.30,20.38(-ch2 aliph),14.19(-ch3 aliph).esi-hrms:calcd for c32h39no3(m+h+):486.3003.found:486.3004.
144、[中间体制备实施例17]化合物24的合成
145、化合物23a(140mg,0.19mmol)以丙酮/水溶液体积比为8:1(20ml)于反应瓶中溶解,加入n-甲基氧化吗啉(88mg,0.76mmol)和oso4(0.1ml,2.5%wt叔丁醇溶液),室温下搅拌反应过夜。反应结束后,加入过量硫代硫酸钠(200mg)终止反应。反应混合物用乙酸乙酯萃取(2×50ml)并用盐水(50ml)清洗。合并有机相,经无水硫酸镁干燥,过滤并减压浓缩。通过快速柱层析(石油醚/乙酸乙酯2:1)纯化得到无色油状化合物24a(54mg,54%)。相同反应操作步骤,以化合物23b(110mg,0.182mmol)合成得到无色油状化合物24b(58mg,61%)。
146、化合物24a 1h nmr(600mhz,cdcl3)δ7.42–7.20(m,15h),4.70(dd,j=17.8,11.3hz,2h),4.60(d,j=11.3hz,2h),4.56–4.45(m,2h),4.00–3.92(m,2h),3.89(dd,j=7.8,4.5hz,1h),3.81(dd,j=5.1,3.1hz,1h),3.72(dd,j=9.5,6.5hz,1h),3.65(dd,j=9.6,4.7hz,1h),3.10–2.97(m,2h),2.85(dd,j=14.8,3.5hz,1h),2.74–2.56(m,2h),1.49–1.31(m,2h),1.24(td,j=14.7,7.4hz,2h),0.87(t,j=7.3hz,3h).13c nmr(151mhz,cdcl3)δ138.27,138.24,138.09(3×cipso),128.55–127.74(15aromatic c),80.64(-ch),79.18(-ch),74.76(-ch),74.50(-ch2),74.00(-ch2),73.26(-ch2),69.02(-ch2),68.40(-ch),61.20(-ch),54.97(-ch2),52.77(-ch2),30.40,20.39(-ch2 aliph),14.11(-ch3 aliph).esi-hrms:calcd for c32h42no5(m+h+):520.3057.found:520.3052.
147、化合物24b 1h nmr(600mhz,cdcl3)δ7.47–7.15(m,15h),4.74–4.60(m,2h),4.54(dd,j=11.4,8.1hz,2h),4.46–4.35(m,2h),4.10(s,1h),4.04(dd,j=7.6,4.8hz,1h),3.96(d,j=7.6hz,1h),3.72–3.64(m,1h),3.59(d,j=5.0hz,2h),3.04(dd,j=9.6,4.7hz,1h),2.93(dd,j=14.4,8.6hz,1h),2.85–2.77(m,1h),2.72–2.56(m,2h),1.50–1.33(m,2h),1.25(dd,j=17.1,7.7hz,3h),0.88(t,j=7.3hz,3h).13c nmr(151mhz,cdcl3)δ138.58,138.52,138.35(3×cipso),128.55–127.69(15aromatic c),83.62(-ch),75.90(-ch),74.30(-ch2),73.22(-ch2),71.94(-ch),71.37(-ch),70.10(-ch2),65.61(-ch),56.17(-ch2),51.70(-ch2),30.48(-ch2),29.83,20.40(-ch2 aliph),14.16(-ch3 aliph).esi-hrms:calcd for c32h42no5(m+h+):520.3057.found:520.3049.
148、[实施例1]化合物9的合成
149、在氢化反应瓶中,将化合物8a(22mg,0.047mmol)以甲醇(3ml)溶解,加入10%钯碳催化剂(10mg)。将反应液在氢气下,室温搅拌4h。反应结束后,过滤,收集滤液,减压浓缩,得到无色油状化合物9a(11mg,100%)。相同反应操作步骤,以化合物8b(36mg,0.078mmol)合成得到无色油状化合物9b(8.3mg,55%)。
150、化合物9a 1h nmr(600mhz,meod)δ4.10(ddd,j=5.7,3.9,2.0hz,1h),4.04(dd,j=12.7,5.7hz,1h),3.89–3.85(t,j=8.4,7.8hz,1h),3.82(dd,j=11.6,2.6hz,1h),3.73(dd,j=8.8,1.9hz,1h),3.65(dd,j=12.7,3.9hz,1h),3.60(ddd,j=7.8,7.3,2.6hz,1h),3.52(dd,j=11.6,7.2hz,1h),3.32–3.27(dd,j=7.8hz,1h).13c nmr(151mhz,meod)δ82.04(-ch),75.56(-ch),75.47(-ch),73.91(-ch),73.39(-ch2),72.93(-ch),64.52(-ch2).esi-hrms:calcd for c7h14o6na(m+na+):217.0683.found:217.0681.
151、化合物9b 1h nmr(600mhz,meod)δ4.02(s,1h),3.93–3.88(m,2h),3.76–3.70(m,2h),3.67–3.57(m,3h),3.36–3.32(m,1h).13c nmr(151mhz,meod)δ85.24(-ch),78.73(-ch),74.02(-ch),73.28(-ch),71.41(-ch2),71.31(-ch),64.23(-ch2).esi-hrms:calcdfor c7h14o6na(m+na+):217.0683.found:217.0679.
152、[实施例2]化合物11的合成
153、在氢化反应瓶中,将化合物10(39mg,0.068mmol)以甲醇(3ml)溶解,加入10%钯碳催化剂(10mg)。将反应液在氢气下,室温搅拌4h。反应结束后,过滤,收集滤液,减压浓缩,得到无色油状化合物11(18mg,95%)。
154、1h nmr(600mhz,meod)δ5.57(t,j=2.4hz,1h),5.19(ddd,j=6.9,5.8,2.7hz,1h),3.87–3.79(m,3h),3.78(dd,j=8.5,2.0hz,1h),3.66–3.59(m,2h),3.38(ddd,j=9.1,7.4,2.8hz,1h),2.10(s,3h),1.99(s,3h).13c nmr(151mhz,meod)δ172.63(c=o),171.76(c=o),83.69(-ch),75.03(-ch),74.62(-ch),72.08(-ch),71.68(-ch),68.20(-ch2),64.15(-ch2),20.83(-ch3),20.75(-ch3).esi-hrms:calcd for c11h18o8(m+na+):301.0899.found:301.0885.
155、[实施例3]化合物13的合成
156、在氢化反应瓶中,将化合物12a(39mg,0.068mmol)以甲醇(3ml)溶解,加入10%钯碳催化剂(10mg)。将反应液在氢气下,室温搅拌4h。反应结束后,过滤,收集滤液,减压浓缩,得到无色油状化合物13a(22mg,76%)。相同反应操作步骤,以化合物12b(31mg,0.055mmol)合成得到无色油状化合物13b(9mg,56%);以化合物12c(52mg,0.092mmol)合成得到无色油状化合物13c(28mg,100%)。
157、化合物13a1h nmr(600mhz,meod)δ3.94–3.90(m,2h),3.85–3.80(m,2h),3.69–3.65(m,2h),3.64–3.59(m,2h),3.59–3.45(m,4h),3.31–3.27(m,1h),1.67–1.49(m,4h),1.47–1.23(m,16h),0.92(t,j=6.8hz,6h).13c nmr(151mhz,meod)δ82.41(-ch),80.23(-ch),79.82(-ch),76.24(-ch),75.96(-ch),71.99(-ch2),71.95(-ch2),71.84(-ch2),64.63(-ch2),33.07(-ch2),33.04,31.16,31.14,30.31,30.29,27.36,27.32,23.71(-ch2aliph),14.46(-ch3 aliph).esi-hrms:calcd for c21h43o6(m+h+):391.3054.found:391.3046.
158、化合物13b 1h nmr(600mhz,meod)δ4.18(td,j=5.3,1.5hz,1h),4.01–3.96(m,1h),3.85(dd,j=11.6,2.8hz,1h),3.77–3.72(m,2h),3.70–3.58(m,4h),3.58–3.48(m,2h),1.68(ddd,j=9.3,8.8,4.7hz,2h),1.49–1.26(m,8h),0.96(t,j=7.0hz,3h).13c nmr(151mhz,meod)δ83.71(-ch),81.70(-ch),76.48(-ch),75.42(-ch),73.03(-ch2),72.19(-ch2),70.53(-ch),64.62(-ch2),33.02,31.12,30.35,27.23,23.70(-ch2 aliph),14.43(-ch3 aliph).esi-hrms:calcd for c14h28o6na(m+na+):315.1784.found:315.1769.
159、化合物13c 1h nmr(600mhz,meod)δ3.95(dd,j=12.7,5.4hz,1h),3.86–3.78(m,5h),3.66–3.62(m,1h),3.61–3.58(m,1h),3.55–3.53(m,1h),3.48(dd,j=11.6,7.3hz,1h),3.27(dd,j=9.7,7.6hz,1h),1.68–1.59(m,2h),1.48–1.31(m,8h),0.96(t,j=6.9hz,3h).13c nmr(151mhz,meod)δ82.66(-ch),80.26(-ch),76.36(-ch),75.77(-ch),73.26(-ch),72.23(-ch2),71.71(-ch2),64.58(-ch2),33.01,31.21,30.32,27.31,23.70(-ch2aliph),14.43(-ch3 aliph).esi-hrms:calcd for c14h28o6na(m+na+):315.1784.found:315.1770.
160、[实施例4]化合物21的合成
161、在氢化反应瓶中,将化合物20a(25mg,0.031mmol)以甲醇(3ml)溶解,加入10%钯碳催化剂(10mg)。将反应液在氢气下,室温搅拌4h。反应结束后,过滤,收集滤液,减压浓缩,得到化合物无色油状21a(11mg,100%)。相同反应操作步骤,以化合物20b(7mg,0.009mmol)合成得到化合物无色油状21b(3.3mg,100%);以化合物20c(12mg,0.015mmol)合成得到无色油状化合物21c(2mg,50%);以化合物20d(28mg,0.035mmol)合成得到无色油状化合物21d(10mg,83%)。
162、化合物21a 1h nmr(600mhz,meod)δ4.11(d,j=5.0hz,1h),3.99(dd,j=9.0,4.0hz,1h),3.98–3.95(m,1h),3.84(d,j=3.4hz,1h),3.79–3.68(m,2h),3.55(ddt,j=19.1,13.0,7.8hz,4h),3.27(dd,j=12.9,4.0hz,1h),1.62–1.54(m,2h),1.42–1.23(m,8h),0.90(t,j=6.9hz,3h).13c nmr(151mhz,meod)δ76.53(-ch),74.61(-ch),72.44(-ch),72.18(-ch),71.46(-ch2),62.05(-ch2),58.66(-ch),45.15(-ch2),32.98,30.88,30.24,27.10,23.66(-ch2 aliph),14.40(-ch3 aliph).esi-hrms:calcd for c14h30no5(m+h+):292.2118.found:292.2114.
163、化合物21b 1h nmr(600mhz,meod)δ4.36(dd,j=8.1,2.6hz,1h),4.03(dd,j=4.9,3.5hz,1h),3.79(d,j=3.3hz,1h),3.74–3.65(m,4h),3.62(dt,j=9.1,6.7hz,1h),3.50(dd,j=8.3,6.3hz,1h),3.43(dd,j=13.1,8.1hz,1h),3.24(dd,j=13.1,3.5hz,1h),1.68–1.57(m,2h),1.45–1.21(m,8h),0.91(t,j=6.9hz,3h).13c nmr(151mhz,meod)δ87.43(-ch),72.52(-ch2),72.16(-ch),71.99(-ch),66.21(-ch),61.89(-ch2),48.55(-ch2),59.43(-ch),33.01,31.02,30.31,27.11,23.69(-ch2aliph),14.41(-ch3 aliph).esi-hrms:calcd for c14h30no5(m+h+):292.2118.found:292.2111.
164、化合物21c 1h nmr(600mhz,meod)δ3.98(dd,j=11.8,3.6hz,1h),3.95–3.92(m,1h),3.91–3.88(m,1h),3.87–3.81(m,2h),3.70(dt,j=9.2,6.6hz,1h),3.67–3.61(m,2h),3.58–3.52(m,1h),3.43(dd,j=13.6,7.4hz,1h),3.30(dd,j=13.6,3.2hz,1h),1.69–1.62(m,2h),1.47–1.31(m,8h),0.96(t,j=7.0hz,3h).13c nmr(151mhz,meod)δ76.03(-ch),75.87(-ch),74.80(-ch),72.25(-ch2),72.19(-ch),61.45(-ch),60.45(-ch2),44.90(-ch2),32.99,30.93,30.27,27.13,23.68(-ch2aliph),14.41(-ch3 aliph).esi-hrms:calcdfor c14h30no5(m+h+):292.2118.found:292.2112.
165、化合物21d 1h nmr(600mhz,meod)δ4.25(s,1h),3.99(dd,j=11.7,3.9hz,1h),3.88–3.84(m,1h),3.82(d,j=8.7hz,1h),3.73(dd,j=11.6,7.9hz,1h),3.62(dd,j=8.5,1.6hz,1h),3.61–3.55(m,1h),3.49(dt,j=9.1,6.6hz,1h),3.39(dd,j=13.3,5.9hz,1h),3.31–3.26(m,1h),3.18(td,j=8.3,3.9hz,1h),1.62–1.55(m,2h),1.35(ddd,j=20.3,10.1,4.4hz,8h),0.90(t,j=6.9hz,3h).13c nmr(151mhz,meod)δ77.30(-ch),75.73(-ch),73.95(-ch),71.22(-ch2),70.27(-ch),62.70(-ch),60.85(-ch2),46.91(-ch2),32.98,30.91,30.25,27.13,23.66(-ch2aliph),14.40(-ch3 aliph).esi-hrms:calcd forc14h30no5(m+h+):292.2118.found:292.2111.
166、[实施例5]化合物25的合成
167、在氢化反应瓶中,将化合物24a(12mg,0.023mmol)以甲醇(3ml)溶解,加入10%钯碳催化剂(10mg)。将反应液在氢气下,室温搅拌4h。反应结束后,过滤,收集滤液,减压浓缩,得到化合物无色油状25a(2.5mg,42%)。相同反应操作步骤,以化合物24b(10mg,0.019mmol)合成得到无色油状化合物25b(5.5mg,100%)。
168、化合物25a 1h nmr(600mhz,meod)δ3.49–3.30(m,5h),3.17(dd,j=6.5,2.9hz,1h),2.60(dd,j=14.4,7.2hz,1h),2.53(dd,j=10.6,4.7hz,1h),2.39(d,j=12.9hz,1h),2.28(t,j=7.6hz,2h),1.13–0.96(m,2h),0.87(dt,j=14.7,7.3hz,2h),0.49(dd,j=9.5,5.3hz,3h).13c nmr(151mhz,meod)δ78.17(-ch),74.21(-ch),73.07(-ch),69.94(-ch),64.55(-ch),61.76(-ch2),56.14(-ch2),52.48(-ch2),30.82,21.36(-ch2 aliph),14.42(-ch3 aliph).esi-hrms:calcd for c11h24no5(m+h+):250.1649.found:250.1643.
169、化合物25b 1h nmr(600mhz,meod)δ4.09(s,1h),3.88–3.77(m,2h),3.74(d,j=5.5hz,2h),3.68(dt,j=10.7,3.4hz,1h),3.05(dd,j=14.5,10.8hz,1h),2.88–2.75(m,2h),2.70(dd,j=12.1,5.8hz,1h),2.47(dd,j=14.5,2.9hz,1h),1.52–1.42(m,2h),1.42–1.30(m,2h),0.96(t,j=7.3hz,3h).13c nmr(151mhz,meod)δ75.27(-ch),73.56(-ch),70.59(-ch),69.71(-ch),68.99(-ch),62.84(-ch2),56.89(-ch2),32.67,21.16(-ch2aliph),14.37(-ch3 aliph).esi-hrms:calcd for c11h24no5(m+h+):250.1649.found:250.1644.
170、生物活性测试:糖苷酶活性实验
171、酶反应液配置:将α-葡萄糖苷酶冻干粉用磷酸盐缓冲液(phosphate-bufferedsaline,pbs)配制成0.1%溶液,分装,-20℃冻存备用。α-葡萄糖苷酶来源于牛血清白蛋白(bsa)购自sigma公司。
172、底物的配制:将对硝基苯-α-葡萄糖苷用磷酸盐缓冲液配制成0.1mol/l的工作液。
173、供试样品配制:分别将供试化合物用磷酸盐缓冲液配制成1.0×10-4mmol/l的溶液,分别用磷酸盐缓冲液稀释1000、10000、100000倍,备用。
174、取10μl稀释好的样品与50μl磷酸盐缓冲液、20μl酶液混合,37℃孵育10min,然后加入20μl底物,37℃反应10min,加入反应终止剂后测定405nmod值。阿卡波糖为阳性对照药。实验重复2次,每次平行3孔,实验结果以m±sd表示。
175、
176、
- 还没有人留言评论。精彩留言会获得点赞!