膦酸酯衍生物及其制备方法和用途与流程
1.本发明涉及膦酸酯衍生物及其制备方法和用途。
背景技术:
2.富马酸丙酚替诺福韦(tenofovir alafenamide fumurate,taf)为逆转录酶抑制剂替诺福韦(tenofovir,pmpa)的前药,临床上其单方用于治疗慢性乙型肝炎、其复方用于治疗艾滋病。
3.阿德福韦酯(adefovir dipivoxil)为逆转录酶抑制剂阿德福韦(adefovir)的前药,临床上用于治疗慢性乙型肝炎。
[0004][0005]
目前工业化合成富马酸丙酚替诺福韦(taf)原料药是以替诺福韦(2)为起始原料的。例如,gilead公司申请的制备方法专利wo 2013052094(cn103842366b)披露,替诺福韦(2)在乙腈中、4-二甲氨基吡啶(dmap)和三乙胺存在下与亚磷酸三苯酯反应,得苯基氢((((r)-1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧基)甲基)膦酸酯(3,以下简称替诺福韦苯酯)。替诺福韦苯酯3经氯化亚砜氯化得4;4与l-丙氨酸异丙酯盐酸盐(5)反应,得丙酚替诺福韦与其非对映异构体的混合物;所得混合物在乙腈中、苯酚和dbu(1,8-二氮杂二环[5.4.0]十一碳-7-烯)存在下,经结晶诱导的动力学拆分,得高非对映异构体纯度的丙酚替诺福韦(6)。按照例如美国专利us8754065b,丙酚替诺福韦(6)和富马酸反应成盐,即得富马酸丙酚替诺福韦(taf,1)。上述合成工艺路线存在着制约产业化的缺陷。首先,由替诺福韦(2)制备替诺福韦苯酯3的反应,所采用的亚磷酸三苯酯具有刺激性、致敏性和环境毒性,而且三个苯酯只能利用其一;并且该步反应时间冗长,需要48小时以上。此外,由替诺福韦(2)制备替诺福韦苯酯3的反应需要无水反应条件。但是,替诺福韦(2)主要以稳定的一水合物存在,使用前除结晶水十分困难,而且除去结晶水后的替诺福韦极易吸湿、再次与水结合形成稳定的替诺福韦一水合物,造成除水步骤操作繁琐、效率低下。
[0006][0007]
进一步地,目前替诺福韦(2)的工业化合成工艺路线是以腺嘌呤(7)和(r)-碳酸丙烯酯(8)为起始原料,在n,n-二甲基甲酰胺(dmf)中以氢氧化钠或氢氧化钾为催化剂,反应得到(r)-9-(2-羟基丙基)腺嘌呤(9);9在叔丁醇镁(mtb)催化下与对甲苯磺酰氧甲基膦酸二乙酯(desmp,10)发生烷基化反应,得到(r)-9-[2-(二乙氧膦酰甲氧基)丙基]腺嘌呤(11);11在三甲基溴硅烷(tmsbr)或者其替代组合三甲基氯硅烷和溴化钠,或者33%溴化氢乙酸溶液作用下脱去二乙酯,得替诺福韦(2)。替诺福韦(2)主要以其稳定的一水合物存在。可参见brown ripin dh等的报道(organic processresearch&development,2010,14(5):1194-1201)。上述替诺福韦(2)合成工艺路线存在以下缺陷:叔丁醇镁(mtb)价格较贵,容易吸湿变质,不同批号和供应商之间品质存在差异;脱除替诺福韦二乙酯(11)中的二个乙基制备替诺福韦(2)时,需要用到价格昂贵、腐蚀性、湿敏性和环境不友好试剂,例如三甲基溴硅烷(tmsbr)或其替代组合三甲基溴硅烷和溴化钠、33%溴化氢乙酸溶液。
[0008][0009]
也可以绕过替诺福韦(2),通过其他路线合成富马酸丙酚替诺福韦(taf,1)关键中间体替诺福韦苯酯3。例如,中国发明专利cn104817593b披露,以亚磷酸二苯酯(12)为起始原料,与多聚甲醛进行羟甲基化反应,得羟甲基膦酸二苯酯(13);13再与对甲苯磺酰氯(tscl)成酯,得对甲苯磺酰氧基甲基膦酸二苯酯(14);14在碱催化下与(r)-9-(2-羟基丙基)腺嘌呤(9)发生亲核取代反应,得二苯基(r)-(((1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧基)甲基)膦酸酯(15,以下简称替诺福韦二苯酯);15经碱性水解,得替诺福韦苯酯3。其中,亲核取代反应中使用的碱为叔丁醇钾、氢化钠、叔丁醇镁或叔丁醇锂,缩合反应中使用的溶剂为n-甲基吡咯烷酮(nmp)、dmf或四氢呋喃。其中,碱性水解反应中使用的碱为氢氧化锂、氢氧化钠或氢氧化钾的水溶液,碱性水解反应中使用的溶剂为四氢呋喃或甲醇。
cn104817593b披露的替诺福韦苯酯3的一条合成路线如下所示:
[0010][0011]
但是本发明人在重复上述专利的实施例操作步骤时,发现存在三个技术瓶颈:一是亚磷酸二苯酯(12)和多聚甲醛反应无法稳定地制备羟甲基膦酸二苯酯(13)。二是按照[0055]操作,羟甲基膦酸二苯酯(13)与对甲苯磺酰氯(tscl)反应得到的主产物经结构确证为对甲苯磺酸苯酯(14’),收率70%,未得到目标化合物14。三是通过9和经由改进方法制备的14发生亲核取代反应制备替诺福韦二苯酯15时,使用叔丁醇钾、氢化钠、叔丁醇镁或叔丁醇锂作为碱,并使用nmp、dmf或四氢呋喃作为溶剂,无法以较高收率分离得到较高纯度的替诺福韦苯酯15。
[0012]
目前阿德福韦合成也存在类似技术短板。
技术实现要素:
[0013]
本发明所要解决的技术问题是克服现有技术合成丙酚替诺福韦、阿德福韦等开环核苷酸类药物时,使用刺激性强、致敏性强、环境毒性强、易吸湿变质、腐蚀性强等环境不友好试剂,反应时间冗长,反应条件苛刻等缺陷。为了解决上述技术问题,本发明提供了一种膦酸酯衍生物及其制备方法和用途。与现有技术相比,本发明提供的制备方法,起始原料廉价易得、环境友好,避免了有毒有害试剂和苛刻反应条件,避免了繁琐的操作,更为适合工业化合成。
[0014]
本发明提供了一种如式i所示膦酸酯衍生物的制备方法,其包括下述步骤:在有机溶剂中,将如式ii所示化合物和如式iii所示化合物在促进剂存在下反应,得到如式i所示膦酸酯衍生物,即可,
[0015][0016]
其中,r
a1
和r
a2
独立地为氢或氨基保护基,且r
a1
和r
a2
不同时为氢;
[0017]
为含2~4个氮原子的6~10元杂芳基或被一个或多个rb取代的含2~4个氮原子的6~10元杂环烯基;当rb为多个时,所述rb相同或不同;
[0018]
rb为c
1-c6烷基、氧代氨基或羟基;
[0019]
r5为氢、c
1-c6烷基或被一个或多个羟基取代的c
1-c6烷基;
[0020]
r2和r3独立地为c
6-c
10
芳基、c
1-c6烷基、被一个或多个卤素取代的c
1-c6烷基或被一个c
6-c
10
芳基取代的c
1-c6烷基;
[0021]
r4为c
1-c6烷基;
[0022]
所述的促进剂为n-卤代琥珀酰亚胺和酸的组合。
[0023]
在某一方案中,r
a1
或r
a2
为苯甲酰基或乙酰基。
[0024]
在某一方案中,r
a1
或r
a2
为氢。
[0025]
在某一方案中,如式i所示膦酸酯衍生物的制备方法中,某些基团具有如下定义,未提及的基团的定义如本发明中任一方案所述(本段内容以下简称为“在某一方案中”),
[0026]
所述的氨基保护基为苯甲酰基(bz)、乙酰基(ac)或叔丁氧羰基(boc)。
[0027]
在某一方案中,为例如
[0028]
在某一方案中,“*”表示带“*”的碳原子为手性碳原子,其为r构型、s构型、或r构型和s构型的混合,例如为
[0029]
在某一方案中,为
[0030]
在某一方案中,r2和r3均为苯基或2,2,2-三氟乙基。
[0031]
在某一方案中,r5为氢或甲基。
[0032]
在某一方案中,r2和r3均为苯基。
[0033]
在某一方案中,当rb为c
1-c6烷基时,所述的c
1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0034]
在某一方案中,当r5为c
1-c6烷基或被一个或多个羟基取代的c
1-c6烷基时,所述c
1-c6烷基和被一个或多个羟基取代的c
1-c6烷基中的c
1-c6烷基为甲基、乙基、正丙基、异丙基、
正丁基、仲丁基、异丁基或叔丁基。
[0035]
在某一方案中,当r2和r3独立地为c
6-c
10
芳基或被一个c
6-c
10
芳基取代的c
1-c6烷基时,所述的c
6-c
10
芳基和被一个c
6-c
10
芳基取代的c
1-c6烷基中的c
6-c
10
芳基为苯基。
[0036]
在某一方案中,当r2和r3独立地为c
1-c6烷基、被一个或多个卤素取代的c
1-c6烷基或被一个c
6-c
10
芳基取代的c
1-c6烷基时,所述的c
1-c6烷基、被一个或多个卤素取代的c
1-c6烷基和被一个c
6-c
10
芳基取代的c
1-c6烷基中的c
1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0037]
在某一方案中,当r2和r3独立地为被一个或多个卤素取代的c
1-c6烷基时,所述的被一个或多个卤素取代的c
1-c6烷基中的卤素为氟、氯、溴或碘,例如氟。
[0038]
在某一方案中,当r2和r3独立地为被一个或多个卤素取代的c
1-c6烷基时,所述的被一个或多个卤素取代的c
1-c6烷基为2,2,2-三氟乙基。
[0039]
在某一方案中,当r2和r3独立地为被一个c
6-c
10
芳基取代的c
1-c6烷基时,所述的被一个c
6-c
10
芳基取代的c
1-c6烷基为苄基。
[0040]
在某一方案中,r4为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基,例如甲基。
[0041]
在某一方案中,r
a1
为苯甲酰基或乙酰基;
[0042]ra2
为氢;
[0043]
为
[0044]
为
[0045]
r5为氢或甲基;
[0046]
r2和r3均为苯基或2,2,2-三氟乙基;
[0047]
r4为甲基。
[0048]
在某一方案中,所述的如式i所示膦酸酯衍生物为如下任一化合物:
[0049]
[0050][0051]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的有机溶剂的种类为本领域常规,例如醚类溶剂、卤代烃类溶剂、酯类溶剂、酮类溶剂和腈类溶剂中的一种或多种,又例如醚类溶剂和/或卤代烃类溶剂。所述的醚类溶剂可为1,4-二氧六环和/或甲氧基环戊烷,例如1,4-二氧六环;所述的卤代烃类溶剂可为二氯甲烷、氯仿和1,2-二氯乙烷中的一种或多种,例如二氯甲烷;所述的酯类溶剂可为乙酸乙酯和/或乙酸异丙酯;所述的酮类溶剂可为甲基异丁酮和/或2-丁酮;所述的腈类溶剂可为乙腈。
[0052]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的n-卤代琥珀酰亚胺可为n-碘代丁二酰亚胺(nis)、n-溴代丁二酰亚胺(nbs)和n-氯代丁二酰亚胺(ncs)中的一种或多种,例如nis。所述的nis可通过nbs或ncs和碱金属碘化物反应制备得到;所述的碱金属碘化物例如为碘化钠。
[0053]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的酸可为路易斯(lewis)酸或布朗斯台德酸;所述的路易斯酸可为三氯化铝(alcl3)、三氟甲磺酸三甲基硅酯(tmsotf)、三氟甲磺酸钪[sc(otf)3]、三氟甲磺酸钇[y(otf)3]或三氟甲磺酸镧系金属盐[ln
(otf)3],例如三氟甲磺酸钪[sc(otf)3];所述的三氟甲磺酸镧系金属盐[ln(otf)3]例如三氟甲磺酸镧、三氟甲磺酸铈、三氟甲磺酸镨、三氟甲磺酸钕、三氟甲磺酸钐、三氟甲磺酸铕、三氟甲磺酸钆、三氟甲磺酸铽、三氟甲磺酸镝、三氟甲磺酸钬、三氟甲磺酸铒、三氟甲磺酸铥、三氟甲磺酸镱和三氟甲磺酸镥中的一种或多种;所述的布朗斯台德酸可为三氟甲磺酸(tfoh)或高氯酸(hclo4),例如三氟甲磺酸(tfoh)。
[0054]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的促进剂可为n-卤代琥珀酰亚胺和路易斯酸的组合、或n-卤代琥珀酰亚胺和布朗斯台德酸的组合;较佳地,所述的促进剂为nis和sc(otf)3的组合、nis和三氟甲磺酸三甲基硅酯(tmsotf)、或nis和tfoh的组合。
[0055]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的促进剂可为n-卤代琥珀酰亚胺和路易斯酸的组合、或n-卤代琥珀酰亚胺和布朗斯台德酸的组合;较佳地,所述的促进剂为nis和sc(otf)3的组合、或nis和tfoh的组合。
[0056]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式ii所示化合物和n-卤代琥珀酰亚胺的摩尔比可为1:(1.1~3),例如1:1.1或1:2.0。
[0057]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式ii所示化合物和n-卤代琥珀酰亚胺的摩尔比可为1:(1.1~3),例如1:1.1。
[0058]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式ii所示化合物和路易斯酸的摩尔比可为1:(0.05~1.5),例如1:1.5、1:0.07、1:0.3或1:0.7。
[0059]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式ii所示化合物和路易斯酸的摩尔比可为1:(0.05~1.5),优选1:(0.05~1),例如1:0.07、1:0.3或1:0.7。
[0060]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式ii所示化合物、n-卤代琥珀酰亚胺和路易斯酸之间的摩尔比可为1:(1.1~3):(0.05~1.5),例如1:2:1.5、1:1.1:0.07、1:1.1:0.7或1:1.1:0.3。
[0061]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式ii所示化合物、n-卤代琥珀酰亚胺和路易斯酸之间的摩尔比可为1:(1.1~3):(0.05~1.5),例如1:1.1:0.07、1:1.1:0.7或1:1.1:0.3。
[0062]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述反应的加料温度可为25℃~45℃,例如37~39℃、36~38℃或30~38℃,其中,所述的加料温度为加入如式ii所示化合物时的温度。
[0063]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述反应的加料温度可为25℃~45℃,例如37~39℃,其中,所述的加料温度为加入如式ii所示化合物时的温度。
[0064]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述反应的反应温度可为40℃~78℃,例如44℃~46℃或78℃。
[0065]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰
亚胺和路易斯酸的组合时,所述反应的反应温度可为40℃~78℃,例如78℃。
[0066]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述反应的加料方式可为下述任一方案:
[0067]
方案1:先加入如式iii所示化合物和如式ii所示化合物,再加入n-卤代琥珀酰亚胺和路易斯酸的混合物;
[0068]
方案2:依次加入如式iii所示化合物、如式ii所示化合物、路易斯酸和n-卤代琥珀酰亚胺;
[0069]
所述反应的加料方式优选方案2。
[0070]
某一方案中,所述的如式i所示膦酸酯衍生物的制备方法中,所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的促进剂为nis和sc(otf)3的组合;
[0071]
所述的如式ii所示化合物、n-卤代琥珀酰亚胺和路易斯酸之间的摩尔比为1:1.1:0.7;所述反应的加料温度为36~38℃,其中,所述的加料温度为加入如式ii所示化合物时的温度;
[0072]
所述反应的反应温度为78℃。
[0073]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的如式ii所示化合物和n-卤代琥珀酰亚胺的摩尔比可为1:(1~5),优选1:(1.1~2),例如1:1.2、1:1.5、1:1.8或1:2。
[0074]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的如式ii所示化合物和n-卤代琥珀酰亚胺的摩尔比可为1:(0.5~5),例如1:2、1:0.5、1:1、1:1.5或1:2。
[0075]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的如式ii所示化合物和布朗斯台德酸的摩尔比可为1:(0.5~3),优选1:(0.5~2),例如1:0.5、1:1、1:1.5或1:2。
[0076]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比可为1:(1~5):(0.5~3),例如1:2:2、1:1:1.5、1:2:1.5、1:1.8:1.5、1:2:1.5或1:1.5:1.5。
[0077]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比可为1:(1~5):(0.5~3),优选1:(1.1~2):(0.5~2),例如1:2:1.5、1:1.8:1.5、1:2:1.5或1:1.5:1.5。
[0078]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述反应的加料温度可为-2℃~62℃,例如-2℃、10℃、20℃、0~30℃、29~30℃、37~41℃、43~48℃、49~50℃或57~62℃,优选20~50℃,更优选25~48℃;又例如29~30℃、37~41℃或43~48℃,其中,所述的加料温度为加入如式ii所示化合物时的温度。
[0079]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述反应的加料温度可为-2℃~62℃,优选20~50℃,更优选25~48℃,例如-2℃、10℃、20℃、29~30℃、37~41℃、43~48℃、49~50℃或57~62℃;
又例如29~30℃、37~41℃或43~48℃,其中,所述的加料温度为加入如式ii所示化合物时的温度。
[0080]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述反应的反应温度可为40℃~78℃,例如40℃~60℃,又例如45℃、46℃、50℃或60℃,优选46℃~50℃。
[0081]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述反应的反应温度可为40℃~78℃,例如40℃~60℃,又例如46℃、50℃或60℃,优选46℃~50℃。
[0082]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述反应的加料方式可为下述任一方案,
[0083]
方案1:先依次加入如式ii所示化合物、溶剂和n-卤代琥珀酰亚胺,再加入布朗斯台德酸和溶剂形成的溶液,最后加入如式iii所示化合物;
[0084]
方案2:先将n-卤代琥珀酰亚胺和布朗斯台德酸溶于溶剂形成溶液a,再加入如式ii所示化合物和溶剂的溶液b,最后加入如式iii所示化合物;
[0085]
方案3:先将n-卤代琥珀酰亚胺和布朗斯台德酸溶于溶剂形成溶液a,再同时加入如式iii所示化合物和如式ii所示化合物和溶剂形成的溶液b;
[0086]
方案4:先将n-卤代琥珀酰亚胺和布朗斯台德酸溶于溶剂形成溶液a,再加入如式iii所示化合物,最后加入如式ii所示化合物和溶剂形成的溶液b;
[0087]
方案5:先将n-卤代琥珀酰亚胺和布朗斯台德酸溶于溶剂形成溶液a,再加入如式ii所示化合物和溶剂形成的溶液b,最后加入如式iii所示化合物;较佳地,方案5中,将所述溶液b滴加至溶液a中;
[0088]
所述加料方式优选方案5。
[0089]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合,所述加料方式为方案1时,所述的溶剂可为醚类溶剂;所述如式ii所示化合物和溶剂的摩尔体积比的比值可为0.5~1mol/l,例如0.56mol/l;所述布朗斯台德酸和溶剂形成的溶液中,所述布朗斯台德酸和溶剂的摩尔体积比的比值可为0.5~1.5mol/l,例如0.84mol/l。
[0090]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合,所述加料方式为方案1时,所述如式ii所示化合物和溶剂的摩尔体积比的比值可为0.28~1mol/l,例如0.28mol/l;所述布朗斯台德酸和溶剂形成的溶液中,所述布朗斯台德酸和溶剂的摩尔体积比的比值可为0.42~1.5mol/l,例如0.42mol/l。
[0091]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合,所述加料方式为方案2时,所述溶液a中,所述溶剂可为醚类溶剂;所述溶液a中,所述布朗斯台德酸和溶剂的摩尔体积比的比值可为0.5~1.5mol/l,例如0.84mol/l;所述溶液b中,所述溶剂可为卤代烃类溶剂;所述溶液b中,所述如式ii所示化合物和溶剂的摩尔体积比的比值可为0.5~1mol/l,例如0.56mol/l。
[0092]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合,所述加料方式为方案3时,所述溶液a中,所述溶剂可为醚类溶剂;所述溶液a中,所述布朗斯台德酸和溶剂的摩尔体积比的比值可为0.5~1.5mol/l,例如
0.84mol/l;所述溶液b中,所述溶剂可为卤代烃类溶剂;所述溶液b中,所述如式ii所示化合物和溶剂的摩尔体积比的比值可为0.5~1mol/l,例如0.56mol/l。
[0093]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合,所述加料方式为方案4时,所述溶液a中,所述溶剂可为醚类溶剂;所述溶液a中,所述布朗斯台德酸和溶剂的摩尔体积比的比值可为0.5~1.5mol/l,例如0.84mol/l;所述溶液b中,所述溶剂可为卤代烃类溶剂;所述溶液b中,所述如式ii所示化合物和溶剂的摩尔体积比的比值可为0.5~1mol/l,例如0.56mol/l。
[0094]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合,所述加料方式为方案5时,所述溶液a中,所述溶剂可为醚类溶剂;所述溶液a中,所述布朗斯台德酸和溶剂的摩尔体积比的比值可为0.5~1.5mol/l,例如0.84mol/l;所述溶液b中,所述溶剂可为卤代烃类溶剂;所述溶液b中,所述如式ii所示化合物和溶剂的摩尔体积比的比值可为0.5~1mol/l,例如0.56mol/l。
[0095]
某一方案中,所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述加料方式为方案5;
[0096]
所述的促进剂为nis和tf(oh)的组合;
[0097]
所述的如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比为1:2:1.5;
[0098]
所述反应的加料温度为0~30℃(室温),其中,所述的加料温度为加入如式ii所示化合物时的温度;
[0099]
所述反应的反应温度为44℃~46℃。
[0100]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物可通过下述方法制备得到:将如式iv所示化合物和硅烷化试剂反应即可,
[0101][0102]
r2、r3和r4的定义如前任一项所述。
[0103]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物不经分离直接参与如式i所示膦酸酯衍生物的制备反应中,或者经分离纯化后得到的纯化形式参与如式i所示膦酸酯衍生物的制备反应中。较佳地,所述如式iii所示化合物不经分离直接参与如式i所示膦酸酯衍生物的制备反应中。
[0104]
所述的如式i所示膦酸酯衍生物的制备方法中,所述如式ii所示化合物和如式iv所示化合物的摩尔比可为1:(1.2~8),例如1:(1.5~6),1:1.5、1:1.8、1:3、1:4、1:4.5、1:5.25、1:5.7、或1:6。
[0105]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,所述的硅烷化试剂的种类为本领域常规,例如n,o-双(三甲基硅烷基)三氟乙酰胺(bstfa)、n,o-双(三甲基硅烷基)乙酰胺(bsa)、三甲基氯硅烷、六甲基二硅胺烷、六甲基二硅氧烷、三甲基硅基二乙胺、三甲基硅基乙酸乙酯、双(三甲基硅基)硫酸酯、六甲基二硅脲、三甲基硅咪唑、或三氟甲磺酸三甲基硅酯,又例如n,o-双(三甲基硅烷基)三氟乙酰胺
(bstfa)。
[0106]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,所述的如式iv所示化合物和硅烷化试剂的摩尔比可为(1~3):1,优选(1~1.5):1,例如1:1或1.5:1。
[0107]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,所述反应可在无溶剂条件下或者非质子溶剂中进行,优选无溶剂条件下进行。
[0108]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,所述反应温度可为20~50℃,例如36~38℃、28~42℃或32~38℃。
[0109]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,所述反应温度可为20~50℃,例如28~42℃,又例如32~38℃。
[0110]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,较佳地,将亚磷酸二苯酯(r2和r3均为ph)和硅烷化试剂bstfa在无溶剂条件下,在温度36~38℃或32~38℃下进行反应,即可。
[0111]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式iii所示化合物的制备方法中,较佳地,将亚磷酸二苯酯(r2和r3均为ph)和硅烷化试剂bstfa在无溶剂条件下,在温度32~38℃下进行反应,即可。
[0112]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和路易斯酸之间的摩尔比可为(1.5~5):(1.5~5):1:(1.1~3):(0.05~1.5),例如4:4:1:2:1.5、1.5:1.5:1:1.1:0.07、4:4:1:1.1:0.7或4:4:1:1.1:0.3。
[0113]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和路易斯酸的组合时,所述的如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和路易斯酸之间的摩尔比可为(1.5~5):(1.5~5):1:(1.1~3):(0.05~1.5),例如1.5:1.5:1:1.1:0.07、4:4:1:1.1:0.7或4:4:1:1.1:0.3,优选4:4:1:1.1:0.7。
[0114]
在某一方案中,所述的如式i所示膦酸酯衍生物的制备方法中,所述的硅烷化试剂为bstfa;
[0115]
所述的如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和路易斯酸之间的摩尔比为4:4:1:1.1:0.7;
[0116]
所述的如式iii所示化合物的制备方法中,所述反应温度可为36~38℃;将亚磷酸二苯酯(r2和r3均为ph)和硅烷化试剂bstfa在无溶剂条件下进行反应,即可。
[0117]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比可为(4~6):(3~5):1:(1~2):(1.2~2),例如5.7:3.8:1:1:1.5、4:4:1:2:1.5、5.7:3.8:1:1.8:1.5、6:4:1:2:1.5、6:4:1:1.8:1.5、5.25:3.5:1:2:1.5、4.5:3:1:2:1.5、6:4:1:1.5:1.5或4:4:1:2:2优选(5~6):(3.8~4.2):1:(1.7~2):(1.4~1.6),优选5.7:3.8:1:1.8:1.5、6:4:1:2:1.5、6:4:1:1.8:1.5、5.25:3.5:1:2:1.5、4.5:3:1:2:1.5或6:4:1:1.5:1.5,更优选5.7:3.8:1:1.8:1.5、6:4:1:2:1.5或6:4:1:1.8:1.5。
[0118]
所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰
亚胺和布朗斯台德酸的组合时,所述的如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比可为(4~6):(3~5):1:(1.5~2):(1.2~2),优选(5~6):(3.8~4.2):1:(1.7~2):(1.4~1.6);例如4:4:1:2:1.5、5.7:3.8:1:1.8:1.5、6:4:1:2:1.5、6:4:1:1.8:1.5、5.25:3.5:1:2:1.5、4.5:3:1:2:1.5、6:4:1:1.5:1.5或4:4:1:2:2,优选5.7:3.8:1:1.8:1.5、6:4:1:2:1.5、6:4:1:1.8:1.5、5.25:3.5:1:2:1.5、4.5:3:1:2:1.5或6:4:1:1.5:1.5,更优选5.7:3.8:1:1.8:1.5、6:4:1:2:1.5或6:4:1:1.8:1.5。
[0119]
某一方案中,所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的促进剂为nis和tf(oh)的组合;
[0120]
所述的如式iii所示化合物的制备方法中,将如式iv所示化合物和硅烷化试剂bstfa在无溶剂条件下,在温度32~38℃下进行反应;
[0121]
所述如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比为6:4:1:2:1.5;
[0122]
所述反应的加料温度为0~30℃(室温),其中,所述的加料温度为加入如式ii所示化合物时的温度;
[0123]
所述反应的反应温度为44℃~46℃。
[0124]
某一方案中,所述的如式i所示膦酸酯衍生物的制备方法中,当所述的促进剂为n-卤代琥珀酰亚胺和布朗斯台德酸的组合时,所述的促进剂为nis和tf(oh)的组合;
[0125]
所述的如式iii所示化合物的制备方法中,将如式iv所示化合物和硅烷化试剂bstfa在无溶剂条件下,在温度32~38℃下进行反应;
[0126]
所述如式iv所示化合物、硅烷化试剂、如式ii所示化合物、n-卤代琥珀酰亚胺和布朗斯台德酸之间的摩尔比为5.7:3.8:1:1.8:1.5、6:4:1:2:1.5、6:4:1:1.8:1.5或5.25:3.5:1:2:1.5;
[0127]
所述反应的加料温度为30~38℃(室温),其中,所述的加料温度为加入如式ii所示化合物时的温度;
[0128]
所述反应的反应温度为45℃~50℃。
[0129]
所述的如式i所示膦酸酯衍生物的制备方法中,所述反应的反应进程可采用本领域中的常规监测方法(例如tlc、hplc或nmr)进行监测,一般以如式ii所示化合物消失或不再反应时作为反应终点。
[0130]
所述的如式i所示膦酸酯衍生物的制备方法中,所述反应还可包括后处理,所述后处理可包括下述步骤:淬灭(例如加入三乙胺淬灭)、稀释(例如加入乙酸乙酯稀释)、洗涤(例如依次采用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤)、干燥(例如采用无水硫酸钠干燥)。所述后处理还可包括纯化(例如采用柱层析纯化)。
[0131]
所述的如式i所示膦酸酯衍生物的制备方法中,所述的如式i所示膦酸酯衍生物的制备方法还可包括如下步骤:如式v所示化合物、二甲亚砜和在共催化剂存在下反应,得到如式ii所示化合物即可,
[0132][0133]
其中,r
a1
、r
a2
、r5和的定义如前任一项所述;
[0134]
r6为c
1-c6烷基;
[0135]
所述共催化剂为乙酸或三氟乙酸。
[0136]
在某一方案中,如式ii所示化合物的制备方法中,某些基团具有如下定义,未提及的基团的定义如本发明中任一方案所述(本段内容以下简称为“在某一方案中”),
[0137]“*”表示带“*”的碳原子为手性碳原子,其为r构型、s构型或r构型和s构型的混合,例如为
[0138]
某一方案中,r6中,所述的c
1-c6烷基可为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基,例如甲基。
[0139]
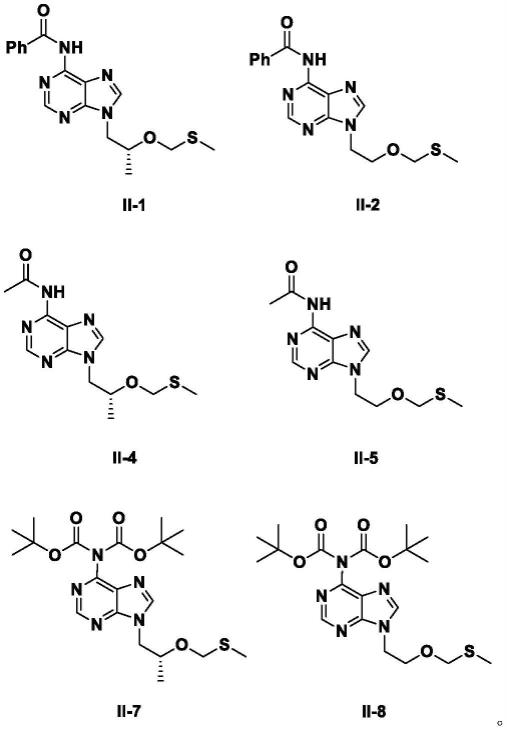
某一方案中,所述的如式ii所示化合物为如下任一化合物:
[0140][0141]
所述的如式ii所示化合物的制备方法中,所述的共催化剂为乙酸。
[0142]
所述的如式ii所示化合物的制备方法中,所述如式v所示化合物和二甲亚砜的摩尔比可为1:(5~47),例如1:5、1:15、1:20、1:26、1:26.4、1:30、1:36.8、1:46、1:46.9或1:47,优选1:(20~47)。
[0143]
所述的如式ii所示化合物的制备方法中,所述如式v所示化合物和二甲亚砜的摩尔比可为1:(5~47),例如1:5、1:20、1:26、1:26.4、1:30、1:36.8、1:46、1:46.9或1:47,优选1:(20~47)。
[0144]
所述的如式ii所示化合物的制备方法中,所述如式v所示化合物和的摩尔比可为1:(3~40),例如1:3、1:10、1:15、1:23、1:23.4、1:23.5、1:30、或1:40,优选1:(10~40)。
[0145]
所述的如式ii所示化合物的制备方法中,所述如式v所示化合物和共催化剂的摩尔比可为1:(1.5~20),例如1:1.5、1:5、1:6.7、1:11.7、1:11.8或1:20,优选1:(5~20)。
[0146]
所述的如式ii所示化合物的制备方法中,所述如式v所示化合物、二甲亚砜、和共催化剂的摩尔比可为1:(3~60):(2~50):(1~30),优选1:(10~40):(10~40):(10~30),更优选1:(20~30):(20~35):(15~25);例如1:15:40:20、1:26.4:23:6.7、1:30:15:5、1:47:23.5:11.8、1:5:3:1.5、1:36.8:15:5、1:20:10:5、1:46.9:23.4:11.7、1:46:23:20、1:26.4:23:20、1:26.4:40:20、1:26.4:30:20或1:26:30:20;又例如1:
30:15:5、1:47:23.5:11.8、1:36.8:15:5、1:20:10:5、1:46.9:23.4:11.7、1:46:23:20、1:26.4:23:20、1:26.4:40:20、1:26.4:30:20或1:26:30:20;再例如1:26.4:23:20、1:26.4:40:20、1:26.4:30:20或1:26:30:20。
[0147]
所述的如式ii所示化合物的制备方法中,所述如式v所示化合物、二甲亚砜、和共催化剂的摩尔比可为1:(3~60):(2~50):(1~30),优选1:(10~40):(10~40):(10~30),更优选1:(20~30):(20~35):(15~25);例如1:26.4:23:6.7、1:30:15:5、1:47:23.5:11.8、1:5:3:1.5、1:36.8:15:5、1:20:10:5、1:46.9:23.4:11.7、1:46:23:20、1:26.4:23:20、1:26.4:40:20、1:26.4:30:20或1:26:30:20;又例如1:30:15:5、1:47:23.5:11.8、1:36.8:15:5、1:20:10:5、1:46.9:23.4:11.7、1:46:23:20、1:26.4:23:20、1:26.4:40:20、1:26.4:30:20或1:26:30:20;再例如1:26.4:23:20、1:26.4:40:20、1:26.4:30:20或1:26:30:20。
[0148]
所述的如式ii所示化合物的制备方法中,所述反应还可包含添加剂;所述添加剂例如乙酸钠。
[0149]
所述的如式ii所示化合物的制备方法中,当所述的反应还包括添加剂时,所述如式v所示化合物和添加剂的摩尔比可为1:(0.1~5),例如1:0.1或1:5,优选1:0.1。
[0150]
所述的如式ii所示化合物的制备方法中,所述反应的温度可为9℃~50℃,优选10℃~35℃,更优选20℃~30℃;例如9℃、15℃、20℃、25℃、23~27℃、28℃、29℃、30℃或31℃,又例如15℃、20℃、23~27℃、或29℃;再例如20℃或29℃。
[0151]
所述的如式ii所示化合物的制备方法中,所述反应的反应进程可采用本领域中的常规监测方法(例如tlc、hplc或nmr)进行监测,一般以如式v所示化合物消失或不再反应时作为反应终点。所述反应的时间可为15~125h,例如16.5h、18h、24h、27.5h、30h、32h、34h、34.5h、36h、38h、67h、72h、86h或125h。
[0152]
在某一方案中,所述的如式ii所示化合物的制备方法中,所示r6为甲基;
[0153]
所述的共催化剂为乙酸;
[0154]
所述如式v所示化合物、二甲亚砜、和共催化剂的摩尔比为1:26.4:40:20;
[0155]
所述反应的温度为20℃。
[0156]
本发明提供了一种如式vi所示化合物的制备方法,其为如下任一方法:
[0157]
方法(1):包括以下两个步骤:
[0158]
步骤1:在有机溶剂甲中,将如式i所示膦酸酯衍生物在碱的存在下进行反应,得到如式vii所示化合物,即可;
[0159]
步骤2:将步骤1所得的如式vii所示化合物在酸和有机溶剂乙的混合液中进行反应,得到如式vi所示化合物,即可;
[0160][0161]
方法(2):包括以下两个步骤:
[0162]
步骤1:将如式i所示膦酸酯衍生物在酸和有机溶剂乙的混合液中进行反应,得到如式viii所示化合物,即可;
[0163]
步骤2:在有机溶剂甲中,将步骤1所得的如式viii所示化合物在碱的存在下进行反应,得到如式vi所示化合物,即可;
[0164][0165]
方法(3):在溶剂中,如式i所示膦酸酯衍生物在碱或酸的存在下进行反应,得到如式vi所示化合物,即可;
[0166][0167]
方法(4):包括下述步骤:将如式vii所示化合物在酸和有机溶剂乙的混合液中进行反应,得到如式vi所示化合物,即可;
[0168][0169]
方法(5):包括下述步骤:在有机溶剂甲中,如式viii所示化合物在碱的存在下进行反应,得到如式vi所示化合物,即可;
[0170][0171]
所述方法(1)、方法(2)和方法(3)中,r
a1
、r
a2
、r2、r3、r5和的定义如前任一项所述;所述方法(4)中,r
a1
、r
a2
、r3、r5和的定义如前任一项所述;所述方法(5)中,r2、r3、r5和的定义如前任一项所述。
[0172]
在某一方案中,所述的如式vi所示化合物的制备方法还进一步包括下述步骤:按照上述的如式i所示膦酸酯衍生物的制备方法,制得所述的如式i所示化合物。
[0173]
在某一方案中,所述方法(1)、方法(2)、方法(3)、方法(4)和方法(5)中,“*”表示带“*”的碳原子为手性碳原子,其为r构型、s构型或r构型和s构型的混合,例如为
[0174]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述有机溶剂甲可为醚类溶剂;所述醚类溶剂可为四氢呋喃。
[0175]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述碱可为碱金属氢氧化物;所述碱金属氢氧化物可为氢氧化钠。
[0176]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述的如式i所示膦酸酯衍生物和碱的摩尔比可为1:(1.2~3),例如1:2.14或1.19。
[0177]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述的如式i所示膦酸酯衍生物和碱的摩尔比可为1:(1.2~3),例如1:1.9。
[0178]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述的如式i所示膦酸酯衍生物和有机溶剂甲的摩尔体积比的比值可为0.2mol/l~0.5mol/l,例如0.3或0.36mol/l。
[0179]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述的如式i所示膦酸酯衍生物和有机溶剂甲的摩尔体积比的比值可为0.2mol/l~0.5mol/l,例如0.36mol/l。
[0180]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述的碱以碱的水溶液的形式参与反应,所述碱和水的摩尔体积比的比值可为0.3mol/l~1.0mol/l,例如0.5mol/l。
[0181]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述反应的温度可为20~40℃,例如20~30℃。
[0182]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述反应的温度可为20~40℃,例如30℃。
[0183]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1中,所述反应的反应进程可采用本领域中的常规监测方法(例如tlc、hplc或nmr)进行监测,一般以如式i所示膦酸酯衍生物消失或不再反应时作为反应终点。
[0184]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1还可包括后处理,所述后处理包括下述步骤:将反应体系进行酸化、除去溶剂、加入有机溶剂后滤除无机盐、再除去溶剂,即可。所述的方法(1)中,所述后处理中,所述的步骤1还可进一步进行纯化。
[0185]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述的步骤1的后处理中,所述酸化过程中,可采用酸/有机溶剂乙的混合液进行酸化,所述酸可为盐酸,所述有机溶剂乙可为醇类溶剂;所述醇类溶剂可为乙醇;所述酸和有机溶剂乙的体积比可为1:(7~11),例如1:9。
[0186]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中的步骤2和方法(4)中,所述的酸和有机溶剂乙的混合液中,所述酸可为盐酸;所述有机溶剂乙的种类可为醇类溶剂;所述醇类溶剂可为乙醇。
[0187]
所述的如式vi所示化合物的制备方法中,所述的方法(1)中,所述如式i所示膦酸酯衍生物和步骤2中酸的摩尔比可为1:(2~10),例如1:5。
[0188]
所述的如式vi所示化合物的制备方法中,所述的方法(1)的步骤2和方法(4)中,所述的酸和有机溶剂乙的混合液中,所述酸和有机溶剂乙的体积比可为1:(9~99),例如1:9
或1:99。
[0189]
所述的如式vi所示化合物的制备方法中,所述的方法(1)的步骤2和方法(4)中,所述反应的温度可为80~100℃,例如90℃。
[0190]
所述的如式vi所示化合物的制备方法中,所述的方法(1)的步骤2和方法(4)均还可包括后处理,所述后处理包括下述步骤:将反应体系的有机溶剂除去,所得残留物中加入水,用酯类溶剂(例如乙酸乙酯)进行洗涤,所得水相中加入醇类溶剂(例如乙醇),加入胺类试剂(例如三乙胺)调节ph(例如调节ph至2~3),搅拌(例如冰水浴中搅拌),过滤,洗涤(例如乙醇洗涤),干燥即可。
[0191]
所述的如式vi所示化合物的制备方法中,所述的方法(2)中,所述的步骤1中,所述的酸和有机溶剂乙形成的混合液中,所述酸可为盐酸;所述有机溶剂乙的种类可为醇类溶剂;所述醇类溶剂可为乙醇。
[0192]
所述的如式vi所示化合物的制备方法中,所述的方法(2)中,所述的步骤1中,所述的如式i所示膦酸酯衍生物与酸的摩尔比可为1:(2~6),例如1:3。
[0193]
所述的如式vi所示化合物的制备方法中,所述的方法(2)中,所述的步骤1中,所述的酸和有机溶剂乙形成的混合液中,所述酸和有机溶剂乙的体积比可为1:(9~99),例如1:9。
[0194]
所述的如式vi所示化合物的制备方法中,所述的方法(2)中,所述的步骤1中,所述反应的温度可为60~90℃,例如70℃、80℃、60℃或75℃。
[0195]
所述的如式vi所示化合物的制备方法中,所述的方法(2)中,所述的步骤1中,所述反应的温度可为70~90℃,例如80℃。
[0196]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述有机溶剂甲可为醚类溶剂;所述醚类溶剂可为四氢呋喃。
[0197]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述碱可为碱金属氢氧化物;所述碱金属氢氧化物可为氢氧化钠。
[0198]
所述的如式vi所示化合物的制备方法中,所述的方法(2)中,所述的如式i所示膦酸酯衍生物与步骤2中碱的摩尔比可为1:(1.5~5),例如1:2.7。
[0199]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述的碱以碱的水溶液的形式参与反应,所述碱和水的摩尔体积比的比值可为0.3mol/l~1.4mol/l。较佳地,所述的碱的水溶液以滴加的形式参与反应;所述的碱在加入时的温度可为0-15℃。
[0200]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述的碱以碱的水溶液的形式参与反应,所述碱和水的摩尔体积比的比值可为0.3mol/l~1.0mol/l,例如1.0mol/l。较佳地,所述的碱的水溶液以滴加的形式参与反应;所述的碱在加入时的温度可为5℃。
[0201]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述反应的温度可为15℃~30℃,例如20℃或25℃。
[0202]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述反应的温度可为20℃~30℃,例如25℃。
[0203]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所
述反应的时间可为30min~2h,例如40min。
[0204]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述的反应还可包括后处理,所述后处理可包括下述步骤:洗涤(例如用乙酸乙酯洗涤)、调节ph值(例如调节ph至2~3)、结晶。
[0205]
所述的如式vi所示化合物的制备方法中,所述的方法(2)的步骤2和方法(5)中,所述的反应还可包括后处理,所述后处理可包括下述步骤:洗涤(例如用乙酸乙酯洗涤)、调节ph值(例如调节ph至3)、结晶;所述结晶可包含如下步骤:接种晶种(例如边搅拌边接种晶种),调节ph值(例如调节ph至2),抽滤,洗涤(例如乙醇洗涤)得所述化合物vi。
[0206]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,所述溶剂可为醚类溶剂;所述醚类溶剂可为四氢呋喃。
[0207]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,所述碱可为碱金属氢氧化物;所述碱金属氢氧化物可为氢氧化钠。
[0208]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,所述的如式i所示膦酸酯衍生物和碱的摩尔比可为1:(2.5~4),例如1:3.1。
[0209]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,所述碱可一次或分多次(例如2次)加入,优选分两次加入。
[0210]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,所述的如式i所示膦酸酯衍生物和溶剂的摩尔体积比的比值可为0.1mol/l~0.4mol/l,例如0.3mol/l。
[0211]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,当碱两次加入时,第一次加入的所述的碱以碱的水溶液的形式参与反应,所述碱和水的摩尔体积比的比值可为0.3mol/l~1.5mol/l,例如0.9mol/l。
[0212]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,当碱两次加入时,第一次加入碱的温度可为-5~5℃,例如0℃。
[0213]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,当碱两次加入时,第二次加入碱的温度可为50~70℃,例如60℃。
[0214]
所述的如式vi所示化合物的制备方法中,所述的方法(3)中,所述反应的反应进程可采用本领域中的常规监测方法(例如tlc、hplc或nmr)进行监测,一般以如式i所示膦酸酯衍生物消失或不再反应时作为反应终点。
[0215]
所述的如式vi所示化合物的制备方法中,所述的方法(3)优选包括下述步骤:将所述式i所示膦酸酯衍生物和所述溶剂(例如四氢呋喃)混合,所述碱分两次加入(例如0℃第一次加入碱,20℃下搅拌1h,60℃下第二次加入碱,搅拌3h)得到如式vi所示化合物,即可。
[0216]
所述的如式vi所示化合物的制备方法中,所述的如式i所示膦酸酯衍生物可由如上所述的如式i所示膦酸酯衍生物的制备方法制得;所述的如式i所示膦酸酯衍生物可以是未经分离纯化参与如式vi所示化合物的制备方法中,也可以是经分离纯化后得到的纯化形式参与如式vi所示化合物的制备方法中,优选未经分离纯化参与如式vi所示化合物的制备方法中。
[0217]
本发明还提供了一种如式vii所示化合物的制备方法,其包括下述步骤:在有机溶剂甲中,将如式i所示膦酸酯衍生物在碱的存在下进行反应,得到如式vii所示化合物,即可;
[0218][0219]
其中,r
a1
、r
a2
、r2、r3、r5、有机溶剂甲和碱的定义如前任一项所述。
[0220]
所述的如式vii所示化合物的制备方法中,所述的如式vii所示化合物的制备方法的反应条件和操作同前方法(1)中的步骤1所述。
[0221]
所述的如式vii所示化合物的制备方法中,所述的如式i所示膦酸酯衍生物可按照如前所述的如式i所示膦酸酯衍生物的制备方法制备得到。
[0222]
本发明还提供了一种如式viii所示化合物的制备方法,其包括下述步骤:将如式i所示膦酸酯衍生物在酸和有机溶剂乙的混合液中进行反应,得到如式viii所示化合物,即可;
[0223][0224]
其中,r
a1
、r
a2
、r2、r3、r5、有机溶剂乙和酸的定义如前任一项所述。
[0225]
所述的如式viii所示化合物的制备方法中,所述的如式viii所示化合物的制备方法的反应条件和操作同前方法(2)中的步骤1所述。
[0226]
所述的如式viii所示化合物的制备方法中,所述的如式i所示膦酸酯衍生物可按照如前所述的如式i所示膦酸酯衍生物的制备方法制备得到。
[0227]
本发明还提供了一种如式ix所示化合物的制备方法,其为如下任一方法:
[0228]
方法(6):其包括下述步骤:在溶剂中,如式i所示膦酸酯衍生物在催化剂的存在下进行反应,得到如式ix所示化合物即可;
[0229][0230]
其中,r
a1
、r
a2
、r2、r3、r5和的定义如前任一项所述。
[0231]
所述的如式ix所示化合物的制备方法中,所述催化剂为本领域常规,所述催化剂可为无机酸、无机碱和路易斯酸中的一种或多种,例如溴化氢乙酸溶液、碱金属氢氧化物、三甲基溴硅烷(tmsbr)、以及三甲基氯硅烷和溴化钠组合中的一种或多种。
[0232]
所述的如式ix所示化合物的制备方法中,所述催化剂为三甲基溴硅烷(tmsbr)、或者三甲基氯硅烷和溴化钠组合时,所述的溶剂可为极性非质子溶剂;所述极性非质子溶剂可为nmp、dmf、乙腈和二氯甲烷中的一种或多种。
[0233]
方法(7):包含以下两个步骤:
[0234]
步骤1:将如式i所示膦酸酯衍生物在酸和有机溶剂乙的混合液中进行反应,得到如式viii所示化合物,即可;
[0235]
步骤2:在溶剂中,将步骤1所得的如式viii所示化合物在酸的存在下进行反应,得到如式ix所示化合物,即可;
[0236][0237]
其中,r
a1
、r
a2
、r2、r3、r5和的定义如前任一项所述;
[0238]
所述的如式ix所示化合物的制备方法中,所述的方法(7)中,所述的步骤1的反应条件和操作可如上述如式viii所示化合物的制备方法所述。
[0239]
所述的如式ix所示化合物的制备方法中,所述的方法(7)的步骤2中,所述溶剂可为水。
[0240]
所述的如式ix所示化合物的制备方法中,所述的方法(7)的步骤2中,所述酸可为氢溴酸。
[0241]
所述的如式ix所示化合物的制备方法中,所述的方法(7)中,所述的如式i所示膦酸酯衍生物与步骤2中酸的摩尔比可为1:(2~6),例如1:4。
[0242]
所述的如式ix所示化合物的制备方法中,所述的方法(7)的步骤2中,所述反应的温度可为50℃~90℃,例如60~80℃,优选为75℃。
[0243]
所述的如式ix所示化合物的制备方法中,所述的方法(7)的步骤2中,所述反应的时间可为16h~24h,例如16h或24h。
[0244]
所述的如式ix所示化合物的制备方法中,所述的方法(7)的步骤2中,所述的反应还可包括后处理,所述后处理可包括下述步骤:洗涤(例如用乙酸乙酯洗涤)、调节ph值(例如调节ph至2~3)、结晶。
[0245]
所述的如式ix所示化合物的制备方法中,所述的方法(7)的步骤2,所述的反应还可包括如下后处理步骤:洗涤(例如用乙酸乙酯洗涤)、干燥(例如旋蒸除水),复溶(例如加水复溶),调节ph(例如用50%氢氧化钠水溶液调节ph至2-3),过滤得所述如式ix所示化合物;或者,所述后处理还可进一步包含重结晶(例如在水和乙醇6:4的混合溶液中重结晶),得所述如式ix所示化合物。
[0246]
方法(8):包括以下两个步骤:
[0247]
本发明还提供了一种如式ix所示化合物的制备方法,其包括以下两个步骤:
[0248]
步骤1:将如式i所示膦酸酯衍生物在酸和有机溶剂乙的混合液中进行反应,得到如式viii所示化合物,即可;
[0249]
步骤2:在有机溶剂甲中,将步骤1所得的如式viii所示化合物在酸的存在下进行反应,得到如式ix所示化合物,即可;
[0250][0251]
其中,r
a1
、r
a2
、r2、r3、r5和的定义如前任一项所述;
[0252]
所述的如式ix所示化合物的制备方法中,步骤1中所述酸和有机溶剂乙的混合液可为无机酸和醇类的不同体积比的混合液,例如盐酸和乙醇(1:99,v/v)的混合液;步骤2中所述酸可为无机酸,例如氢溴酸。
[0253]
所述的如式ix所示化合物的制备方法中,所述的如式i所示膦酸酯衍生物可按照如前所述的如式i所示膦酸酯衍生物的制备方法制备得到。
[0254]
本发明还提供了一种如式ii所示化合物的制备方法,其包括下述步骤:如式v所示
化合物在二甲亚砜、和共催化剂存在下反应,得到如式ii所示化合物即可,
[0255][0256]
其中,r
a1
、r
a2
、r5、r6、和共催化剂的定义如前任一项所述。
[0257]
所述的如式ii所示化合物的制备方法中,所述的如式ii所示化合物的制备方法的反应条件和操作同前所述。
[0258]
本发明还提供了如式i所示膦酸酯衍生物、如式ii所示化合物、如式a所示化合物、如式b所示化合物、如式c所示化合物、如式d所示化合物或如式vii所示化合物,
[0259][0260]
其中,r
a1
、r
a2
、r2、r3、r5和的定义如前任一项所述。
[0261]
在某一方案中,所述的如式i所示膦酸酯衍生物和如式ii所示化合物如前任一项所述。
[0262]
所述的如式a所示的化合物为所述的如式a所示的化合物为
[0263]
在某一方案中,所述的如式b所示的化合物为在某一方案中,所述的如式b所示的化合物为
[0264]
在某一方案中,所述的如式c所示的化合物为在某一方案中,所述的如式c所示的化合物为
[0265]
在某一方案中,所述的如式d所示的化合物为在某一方案中,所述的如式vii所示化合物为述的如式vii所示化合物为
[0266]
本发明还提供了如式a所示化合物作为标准品在反应监控或反应产物质量控制中的应用,
[0267][0268]
其中,r
a1
、r
a2
、r2、r3、r5和的定义如前任一项所述;
[0269]
较佳地,所述反应监控中的反应为制备如式i所示膦酸酯衍生物的反应;所述反应质量控制中的反应的产物为如式i所示膦酸酯衍生物。
[0270]
本发明还提供了如式b所示化合物、如式d所示化合物或如式c所示化合物作为标准品在反应监控和反应产物质量控制中的应用,
[0271][0272]
其中,r
a1
、r
a2
、r5和的定义如前任一项所述;所述的反应监控中的反应为制备如式ii所示化合物的反应;所述反应质量控制中的反应的产物为如式ii所示化合物。
[0273]
本发明还提供了如式i所示膦酸酯衍生物或如式ii所示化合物在用于合成如式vi所示化合物、如式ix所示化合物、如式vii所示化合物、如式viii所示化合物、化合物4、化合物6或富马酸丙酚替诺福韦(taf,1)中的应用;其中,所述的化合物4、化合物6和富马酸丙酚替诺福韦(taf,1)均经由如式vi所示化合物制备得到;
[0274]
[0275][0276]
其中,如式i所示膦酸酯衍生物和如式ii所示化合物中,为
[0277]
所述的应用中,所述的如式i所示膦酸酯衍生物可由如前所述的如式i所示膦酸酯衍生物的制备方法制备得到。
[0278]
所述的应用中,所述的如式ii所示化合物可由如前所述的如式ii所示化合物的制备方法制备得到。
[0279]
所述的应用中,所述的如式vi所示化合物可由如前所述的如式vi所示化合物的制备方法制备得到。
[0280]
本发明中,术语“氧代”指一个=o基团。
[0281]
本发明中,术语“烷基”是指具有指定的碳原子数(例如c
1-c6)的直链或支链烷基。烷基包括但不限于甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基等。
[0282]
本发明中,术语“杂芳基”是指具有指定环原子数(例如6~10元)的、指定杂原子数(例如1个、2个或3个)的、指定杂原子种类(n、o和s中的一种或多种)的环状基团,其为单环或多环,且至少一个环具有芳香性(符合休克尔规则)。杂芳基通过具有芳香性的环或不具有芳香性的环与分子中的其他片段连接。杂芳基包括但不限于呋喃基、吡咯基、噻吩基、吡唑基、咪唑基、噁唑基、噻唑基、吡啶基、嘧啶基、吲哚基等。
[0283]
本发明中,术语“杂环烯基”是指具有指定环原子数(例如5~10元)的、指定杂原子数(例如1个、2个或3个)的、指定杂原子种类(n、o和s中的一种或多种)、具有至少一个碳碳双键的单环杂环烯基或双环杂环烯基,该环为不饱和,但不是芳族。
[0284]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0285]
本发明所用试剂和原料均市售可得。
[0286]
本发明的积极进步效果在于:提供了膦酸酯衍生物及其制备方法和用途。本发明提供的制备方法,起始原料廉价易得、环境友好,避免了有毒有害试剂和苛刻反应条件,避
免了繁琐的操作,更为适合工业化合成。
具体实施方式
[0287]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0288]
如无特别说明,盐酸是指浓度为36~38%的浓盐酸,乙醇是指无水乙醇,盐酸和乙醇的比例是体积比。氢溴酸是指浓度不低于40%的溴化氢水溶液。亚磷酸二苯酯、亚磷酸二乙酯和亚磷酸二异丙酯市售购买。亚磷酸二(2,2,2-三氟乙基)酯参照文献(gibbs de等.synthesis,1984,(5):410-413)合成;亚磷酸二叔丁酯参照文献(dietz j-p等.organic process research&development,2021,25(4):789-798)合成;亚磷酸二苄酯参照文献(perruchon j等.synthesis,2007,(22):3553-3557)合成。
[0289]
高效液相色谱(hplc,简称液相)条件:色谱柱:苏州纳微unisil c18柱(4.6mm
×
250mm,5μm);流动相a:10mm甲酸铵水溶液(甲酸调ph=3),流动相b:乙腈,梯度洗脱(0-25min:b 10%-90%,25-28min:b 90%,28-32min:90%-10%,32-38min:b 10%);流速1ml/min;检测波长281nm,柱温35℃。
[0290]
ii-1标准曲线绘制:配制纯品ii-1的0.1mg/ml、0.2mg/ml、0.4mg/ml和0.5mg/ml的乙腈溶液,将上述溶液分别用0.45μm尼龙微孔滤膜过滤后,注入高效液相色谱仪,进样量10μl,分别记录各组浓度的hplc图谱峰面积,测量两次取平均值,经软件origin 8.5处理得标准曲线:y=32,577,586.5000x+392,430.4250,相关系数r2=0.9999。ii-1液相收率计算:反应结束后,移液枪取反应液100μl,乙腈稀释100倍,进样10μl。将液相峰面积y代入标准曲线,计算得出浓度x(mg/ml),液相收率(%)=x
×
100
×
反应液体积(ml)/理论产量(mg)
×
100%。
[0291]
i-1标准曲线绘制:配制纯品i-1的0.085mg/ml、0.169mg/ml、0.423mg/ml和0.846mg/ml的乙腈溶液,将上述溶液分别用0.45μm尼龙微孔滤膜过滤后,注入高效液相色谱仪,进样量10μl,分别记录各组浓度的hplc图谱峰面积,测量两次取平均值,经软件origin 8.5处理得标准曲线:y=17,526,901.4114x+180,004.4126,相关系数r2=0.9996。i-1液相收率计算:反应结束后,经后处理得到油状产物,记录质量m1(g)。称取1g油状产物,乙腈稀释定容至100ml,所得溶液再用乙腈稀释10倍,进样10μl。将液相峰面积y代入标准曲线,计算得出浓度x(mg/ml),液相收率(%)=x
×
1000
×
m1/理论产量(mg)
×
100%。
[0292]
核磁共振仪型号为bruker avance iii 400和bruker avance neo 600。质谱仪型号为waters公司的micromass q-tof micro,电喷雾电离(esi),正电离模式。元素分析仪为thermo scientific flash2000organic elemental analyzer。
[0293]
实施例1(r)-n-(9-(2-((甲硫基)甲氧基)丙基)-9h-嘌呤-6-基)苯甲酰胺(ii-1)的制备
[0294][0295]
将va(30.0g,101mmol)、二甲亚砜(208.1g,2664mmol)、乙酸酐(412.0g,4036mmol)和乙酸(121.2g,2018mmol)加入到1l三颈瓶中,20℃搅拌38h,tlc取样监测(二氯甲烷:甲醇=20:1)反应完全。减压蒸馏除去溶剂。将所得残留物溶于二氯甲烷,依次用水和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸除去溶剂,得到黄色油状物。向所得残留物中加入乙酸乙酯(54ml),室温搅拌12h,再加入石油醚(18ml)室温搅拌2h。抽滤,滤饼经少量乙酸乙酯洗涤后,真空干燥(70℃,6h),得近白色固体ii-1(26.0g,73%)。1h nmr(600mhz,cdcl3)δ9.27(s,1h),8.79(s,1h),8.10(s,1h),8.02(d,j=7.4hz,2h),7.59(t,j=7.4hz,1h),7.50(t,j=7.6hz,2h),4.54(dd,j=26.4,11.7hz,2h),4.45
–
4.35(m,1h),4.27
–
4.17(m,2h),1.84(s,3h),1.24(d,j=5.8hz,3h)。
13
c nmr(150mhz,cdcl3)δ164.27(s),152.12(s),151.80(s),148.97(s),143.61(s),133.29(s),132.25(s),128.36(s),127.41(s),122.21(s),72.63(s),69.90(s),48.29(s),16.28(s),13.38(s)。esi-ms(m/z):358.33[m+h]
+
,380.35[m+na]
+
,737.67[2m+na]
+
。
[0296]
实施例2(r)-n-(9-(2-((甲硫基)甲氧基)丙基)-9h-嘌呤-6-基)苯甲酰胺(ii-1)的制备
[0297]
氩气保护下,将va、二甲亚砜、乙酸酐和乙酸在一定温度下搅拌至反应完全。将所得反应液搅拌下缓慢倾入含碳酸氢钾(或者碳酸氢钠)固体的饱和碳酸氢钾(或者碳酸氢钠)冰水溶液中,搅拌1h,用乙酸乙酯萃取。合并有机相,依次用饱和碳酸氢钾(或者碳酸氢钠)冰水溶液、水和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,减压浓缩,真空干燥,得粗品ii-1。可将所得粗品硅胶柱层析(正庚烷:乙酸乙酯=2:3)纯化,得到纯品ii-1(表1)。
[0298]
表1.pummerer反应制备ii-1
[0299]
摩尔比*反应温度(℃)反应时间(h)纯品收率(%)1:26.4:23:6.723~2716.5391:30:15:523~2724521:47:23.5:11.83018461:5:3:1.528~318624
[0300]
注:摩尔比为va:dmso:ac2o:acoh。
[0301]
实施例3(r)-n-(9-(2-((甲硫基)甲氧基)丙基)-9h-嘌呤-6-基)苯甲酰胺(ii-1)的制备。
[0302][0303]
将va(2.0g,6.7mmol)、二甲亚砜、乙酸酐和乙酸在一定温度下搅拌至反应完全。通过hplc归一化峰面积计算产物ii-1、甲基酮杂质29a和乙酰氧基杂质29b的含量。通过标准曲线法计算ii-1液相收率(表2)。甲基酮杂质29a和乙酰氧基杂质29b的杂质对照品通过色谱分离纯化pummerer反应粗品制备。
[0304]
甲基酮杂质29a。1h nmr(400mhz,dmso-d6)δ11.16(s,1h),8.70(s,1h),8.33(s,1h),8.06(d,j=7.3hz,2h),7.64(t,j=7.4hz,1h),7.55(t,j=7.5hz,2h),5.33(s,2h),2.29(s,3h)。
13
c nmr(101mhz,dmso-d6)δ201.39(s),165.55(s),152.63(s),151.49(s),150.07(s),145.17(s),133.40(s),132.39(s),128.45(s),124.95(s),52.18(s),26.99(s)。esi-ms(m/z):296.12[m+h]
+
,318.09[m+na]
+
,613.23[2m+na]
+
。
[0305]
乙酰氧基杂质29b。1h nmr(400mhz,cdcl3)δ9.47(s,1h),8.75(s,1h),8.07(s,1h),8.02(d,j=7.4hz,2h),7.56(t,j=7.4hz,1h),7.47(t,j=7.6hz,2h),5.13(dd,j=17.0,6.6hz,2h),4.47
–
4.28(m,1h),4.20
–
4.05(m,2h),1.82(s,3h),1.27(d,j=5.6hz,3h)。esi-ms(m/z):370.23[m+h]
+
,392.22[m+na]
+
,761.45[2m+na]
+
。
[0306]
表2.pummerer反应参数对于产物分布和收率的影响
[0307][0308]
注:a.摩尔比为va:dmso:ac2o:acoh。b.摩尔比为va:dmso:ac2o:三氟乙酸。c.摩尔比为va:dmso:ac2o:acoh:乙酸钠。
[0309]
实施例4(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0310][0311]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(0.1g,0.42mmol)中滴加bstfa(0.11g,0.43mmol),滴毕36~38℃搅拌1.5h。然后,依次加入ii-1(0.1g,0.28mmol)、三氟甲磺酸钪(0.01g,0.02mmol)和nis(0.07g,0.31mmol),升温至78℃搅拌2h。冷却所得反应物后加水淬灭,用乙酸乙酯萃取,用饱和氯化钠水溶液洗涤有机相,无水硫酸钠干燥,减压浓缩,所得残留物经硅胶柱层析(乙酸乙酯:甲醇=80:1)纯化,得i-1(0.05g,收率33%)。
[0312]
实施例5.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0313][0314]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(0.53g,2.24mmol)中滴加bstfa(0.58g,2.24mmol),滴毕36~38℃搅拌1.5h。然后加入ii-1(0.2g,0.56mmol),再缓慢加入nis(0.14g,0.62mmol)和三氟甲磺酸钪(0.2g,0.39mmol)的混合物,加毕升温至78℃搅拌至反应完全(1.5h)。将所得反应物冷却至40℃后,加水淬灭反应,用乙酸乙酯萃取,用饱和氯化钠水溶液洗涤有机相,无水硫酸钠干燥,旋蒸,所得残留物经硅胶柱层析(乙酸乙酯:甲醇=80:1)纯化,得i-1(0.17g,57%)。
[0315]
实施例6.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0316]
[0317]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(39.3g,167.8mmol)中滴加bstfa(28.8g,111.9mmol),滴毕32-38℃搅拌3h,经磷谱监测反应完全,得硅烷化亚磷酸二苯酯16反应混合物。
31
p nmr(243mhz,cdcl3)δ124.29。
[0318]
另将三氟甲磺酸(tfoh)(6.3g,42.0mmol)溶于1,4-二氧六环(50ml),室温搅拌下加入nis(12.6g,56.0mmol)。向所得tfoh和nis反应物中滴加ii-1(10.0g,28.0mmol)的二氯甲烷(50ml)溶液,滴毕再加入上述硅烷化亚磷酸二苯酯16反应混合物,然后44~46℃搅拌反应2h。加入三乙胺淬灭反应,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸,得黄色油状粗品i-1,液相收率86%。所得粗品经硅胶柱层析(乙酸乙酯)纯化,得i-1(14.0g,收率92%)。1h nmr(400mhz,cdcl3)δ9.18(s,1h),8.78(s,1h),8.09(s,1h),8.02(d,j=7.5hz,2h),7.60(t,j=7.4hz,1h),7.52(t,j=7.5hz,2h),7.30(dt,j=13.4,7.7hz,4h),7.21
–
7.11(m,4h),7.08(d,j=8.5hz,2h),4.45(dd,j=14.5,3.0hz,1h),4.25(dd,j=14.5,7.4hz,1h),4.20-4.14(m,1h),4.12
–
4.05(m,1h),3.93(dd,j=14.0,8.6hz,1h),1.28(d,j=6.2hz,3h)。
31
p nmr(243mhz,cdcl3)δ13.60。esi-ms(m/z):544.17[m+h]
+
,566.15[m+na]
+
,1109.33[2m+na]
+
。
[0319]
实施例7.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0320][0321]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(0.52g,2.24mmol)中滴加bstfa(0.57g,2.24mmol),滴毕32-38℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0322]
37~39℃下,向所得硅烷化亚磷酸二苯酯16反应混合物中加入ii-1(0.2g,0.56mmol),再依次加入乙酸乙酯(0.5ml)、n-卤代琥珀酰亚胺和路易斯酸,加毕升温至78℃搅拌反应1.5h。通过hplc归一化峰面积计算产物i-1、剩余原料ii-1和碘代杂质30a的含量。碘代杂质30a的杂质对照品通过色谱分离纯化反应粗品制备(表3)。
[0323]
表3.p-烷基化反应促进剂筛选
[0324][0325]
注:a.12:bstfa:ii-1:nis:路易斯酸摩尔比为4:4:1:1.1:0.3。b.12:bstfa:ii-1:nai:n-溴代琥珀酰亚胺(nbs):sc(otf)3摩尔比为4:4:1:1.1:1.1:0.3。c.12:bstfa:ii-1:nai:n-氯代琥珀酰亚胺(ncs):sc(otf)3摩尔比为4:4:1:1.1:1.1:0.3。
[0326]
碘代杂质30a:1h nmr(400mhz,cdcl3)δ9.08(s,1h),8.80(s,1h),8.12(s,1h),8.03(d,j=7.5hz,2h),7.61(t,j=7.4hz,1h),7.53(t,j=7.7hz,2h),4.69
–
4.60(m,1h),4.60
–
4.51(m,2h),1.97(d,j=6.8hz,3h)。esi-ms(m/z):408.07[m+h]
+
,430.02[m+na]
+
,837.12[2m+na]
+
。元素分析(%):c 44.41(计算值44.24),h 3.43(计算值3.47),n 17.00(计算值17.20)。
[0327]
实施例8.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0328][0329]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(2.62g,11.2mmol)中滴加bstfa(2.88g,11.2mmol),滴毕32-38℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0330]
将tfoh(0.63g,4.2mmol)溶于1,4-二氧六环(5ml),室温搅拌下加入nis(1.26g,5.6mmol)。在所述加料温度下向所得tfoh和nis反应物中滴加ii-1(1g,2.8mmol)的二氯甲烷(5ml)溶液,滴毕加入上述硅烷化亚磷酸二苯酯16反应混合物。然后在所述反应温度下搅拌反应2h。通过hplc归一化峰面积计算产物i-1、碘代杂质30a和剩余原料ii-1的含量。后处理:加入三乙胺淬灭反应,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸得粗品i-1。粗品经硅胶柱层析(乙酸乙酯:甲醇=80:1)纯化,得i-1。
[0331]
表4.p-烷基化反应温度筛选
[0332][0333]
注:a.一次性加入ii-1。
[0334]
实施例9.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0335][0336]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(2.62g,11.2mmol)中滴加bstfa(2.88g,11.2mmol),滴毕32-38℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0337]
将所得硅烷化亚磷酸二苯酯16、ii-1(1.0g,2.8mmol)、nis(1.26g,5.6mmol)、三氟甲磺酸(tfoh)(0.63g,4.2mmol)和溶剂按照表5的加料方式投料。然后50℃搅拌反应2h。后处理:加入三乙胺淬灭反应,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸,得粗品i-1。通过hplc归一化峰面积计算产物i-1、碘代杂质30a和剩余原料ii-1的含量。通过标准曲线法计算i-1液相收率(表5)。
[0338]
表5.p-烷基化反应的加料方式研究
[0339][0340]
实施例10.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0341][0342]
氩气保护和搅拌下,向亚磷酸二苯酯(12)中滴加bstfa,滴毕32-38℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0343]
室温搅拌下向tfoh的1,4-二氧六环(5ml)溶液中加入nis,30~38℃向所得tfoh和nis反应物中滴加ii-1(1g,2.8mmol)的二氯甲烷(5ml)溶液,滴毕30~38℃加入所得硅烷化亚磷酸二苯酯16反应混合物。然后在45~50℃搅拌反应2h。后处理:加入三乙胺淬灭反应,
加入乙酸乙酯稀释,有机相依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸,得粗品i-1。通过标准曲线法计算i-1液相收率(表6)。
[0344]
表6.p-烷基化反应的当量优化
[0345]
序号12:bstfa:ii-1:nis:tfohi-1液相收率(%)1a5.7:3.8:1:1.8:1.58926:4:1:2:1.58636:4:1:1.8:1.58445.25:3.5:1:2:1.57954.5:3:1:2:1.57566:4:1:1.5:1.57071.8:1.2:1:1.5:11081.8:1.2:1:1.5:0.5痕量93:0:1:2:1.50
[0346]
注:a.1,4-二氧六环和二氯甲烷均使用3ml。
[0347]
实施例11.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0348][0349]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(0.53g,2.24mmol)中滴加bstfa(0.58g,2.24mmol),滴毕36~38℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0350]
将ii-1(0.2g,0.56mmol)加入乙酸乙酯(0.5ml)中,室温搅拌下加入nis(0.25g,1.12mmol)和三氟甲磺酸(tfoh)(0.168g,1.12mmol),再加入上述硅烷化亚磷酸二苯酯16反应混合物,然后44~46℃搅拌反应2h。加入三乙胺淬灭反应,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸,得黄色油状粗品i-1,经硅胶柱层析(乙酸乙酯:甲醇=80:1)纯化,可得纯品i-1(0.46g,49%)。
[0351]
实施例12.(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-1)的制备
[0352][0353]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(3.93g,16.8mmol)中滴加bstfa(2.88g,11.2mmol),滴毕32-38℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0354]
将tmsotf(0.93g,4.2mmol)溶于1,4-二氧六环(5ml),室温搅拌下加入nis(1.26g,5.6mmol)。30~38℃向所得tmsotf和nis反应物中滴加ii-1(1g,2.8mmol)的二氯甲烷(5ml)溶液,滴毕加入上述硅烷化亚磷酸二苯酯16反应混合物。然后44~46℃搅拌反应2h。后处理:加入三乙胺淬灭反应,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸得粗品i-1。通过标准曲线法计算i-1液相收率为56%。
[0355]
实施例13.苯基氢((((r)-1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸酯(3)的制备
[0356][0357]
将i-1(2g,3.7mmol)和四氢呋喃(10.4ml)加入50ml三颈瓶中,搅拌下冷却至0℃,滴加0.5mol/l氢氧化钠水溶液(14ml)。30℃搅拌0.5h,取样tlc监测发现原料反应完全。用盐酸:乙醇(1:9)酸化所得反应液,旋蒸除去溶剂,加入无水乙醇,滤除析出的无机盐,旋蒸除去溶剂,得黄色油状3a粗品。取少量粗品经柱层析纯化,得3a纯品。1h nmr(600mhz,dmso-d6)δ11.19(s,1h),8.73(s,1h),8.60(s,1h),8.07(d,j=7.5hz,2h),7.64(t,j=7.4hz,1h),7.55(t,j=7.7hz,2h),7.16(t,j=7.8hz,2h),7.06(d,j=8.1hz,2h),6.92(t,j=7.3hz,1h),4.42(dd,j=14.2,3.5hz,1h),4.28(dd,j=14.3,6.0hz,1h),3.98
–
3.90(m,1h),3.56(dd,j=12.9,8.6hz,1h),3.42(dd,j=13.0,9.2hz,1h),1.01(d,j=6.2hz,3h)。
[0358]
向上步所得3a粗品中加入盐酸:乙醇(1:9)(15ml),90℃回流搅拌4h。旋蒸除去溶剂,向所得残留物中加入水,乙酸乙酯洗涤,向所得水相中加入乙醇,滴加三乙胺调节ph至2~3,冰浴中搅拌析晶2h。过滤,用乙醇洗涤滤饼,真空干燥,得近白色固体3(1.1g,总收率82%)。1h nmr(600mhz,d2o)δ8.32(s,1h),8.24(s,1h),7.24(t,j=7.8hz,2h),7.11(t,j=7.4hz,1h),6.73(d,j=7.9hz,2h),4.43(dd,j=14.8,2.7hz,1h),4.28(dd,j=14.8,8.9hz,1h),4.13
–
4.04(m,1h),3.84(dd,j=13.7,7.8hz,1h),3.58(dd,j=13.7,9.0hz,1h),1.30(d,j=6.2hz,3h)。
31
p nmr(243mhz,d2o)δ14.91;esi-ms(m/z):364.12[m+h]
+
,386.10[m+na]
+
。
[0359]
实施例14.苯基氢((((r)-1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸酯
(3)的制备
[0360][0361]
将i-1(1g,1.8mmol)在盐酸:乙醇(1:9)(5ml)中80℃搅拌反应4h,调节所得反应液ph到6-7,旋除溶剂;将所得残留物溶于4mol/l盐酸水溶液(10ml)中,乙酸乙酯洗涤;再调节水相ph值至8,乙酸乙酯提取;合并提取液旋除溶剂,得viiia。将所得残留物viiia溶于四氢呋喃(5ml),在5℃滴加1mol/l氢氧化钠水溶液(5ml),滴毕25℃搅拌40min。用乙酸乙酯洗涤所得反应液,再用1mol/l盐酸调ph为3,接种晶种搅拌1h,再酸化至ph为2搅拌1h,再在冰水浴中和-10℃各搅拌1h。抽滤,用乙醇洗涤滤饼,得白色固体3(0.52g,79%),液相纯度99.13%。
[0362]
实施例15.(r)-n-(9-(2-羟丙基)-9h-嘌呤-6-基)乙酰胺(vb)的制备
[0363][0364]
将(r)-9-(2-羟丙基)腺嘌呤(9)(5.0g,25.9mmol)加入100ml三颈瓶中,加入吡啶(15ml)和乙腈(15ml),降温至2℃,缓慢滴加tmscl(4.2g,38.8mmol),滴毕升温至32℃搅拌2h。降温至2℃,缓慢滴加乙酰氯(3.0g,38.8mmol),滴毕0-4℃搅拌2h。降温至-10℃,缓慢加入氨水(15ml),室温搅拌30min,旋蒸除去溶剂,得淡黄色固体。用丙酮(20ml)回流提取所得残留物,趁热过滤。旋蒸滤液,将所得黄色油状残留物用乙醇重结晶,得白色固体vb(4.0g,收率65%)。1h nmr(600mhz,dmso-d6)δ10.61(s,1h),8.63(s,1h),8.37(s,1h),5.06(d,j=4.8hz,1h),4.22(dd,j=13.4,3.4hz,1h),4.14
–
4.01(m,2h),2.26(s,3h),1.10(d,j=6.0hz,3h)。
[0365]
实施例16.(r)-n-(9-(2-((甲硫基)甲氧基)丙基)-9h-嘌呤-6-基)乙酰胺(ii-4)的制备
[0366][0367]
将vb(5.0g,21.3mmol)、dmso(24.9g,318.8mmol)、乙酸酐(86.7g,849.3mmol)和乙酸(25.5g,424.6mmol)在20℃搅拌30h,tlc监测(二氯甲烷:甲醇=17:1)反应完全。减压蒸馏除去溶剂,所得油状残留物经快速柱色谱(乙酸乙酯:石油醚=3:2)分离,得淡黄色油状物。加入乙醇搅拌2h,得白色固体粉末ii-4(3.3g,收率53%)。1h nmr(600mhz,cdcl3)δ9.20
(s,1h),8.71(s,1h),8.15(s,1h),4.54(dd,j=36.0,11.8hz,2h),4.42
–
4.37(m,1h),4.25
–
4.19(m,2h),2.64(s,3h),1.83(s,3h),1.24(d,j=5.8hz,3h)。
13
c nmr(151mhz,cdcl3)δ170.79(s),152.28(s),151.69(s),149.17(s),144.10(s),121.39(s),73.09(s),70.34(s),48.72(s),25.72(s),16.74(s),13.78(s)。esi-ms(m/z):296.17[m+h]
+
,318.13[m+na]
+
。
[0368]
实施例17.(r)-(((1-(6-乙酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二苯酯(i-4)的制备
[0369][0370]
氩气保护和搅拌下,向亚磷酸二苯酯(12)(4.8g,20.5mmol)中滴加bstfa(3.5g,13.6mmol),滴毕32-38℃搅拌1~3h,经磷谱监测反应完全,得硅烷化亚磷酸二苯酯16反应混合物。
[0371]
将tfoh(0.8g,5.3mmol)溶于1,4-二氧六环(5ml),搅拌下加入nis(1.9g,8.4mmol),30℃滴加ii-4(1.0g,3.4mmol)的二氯甲烷(5ml)溶液,加入上述硅烷化亚磷酸二苯酯16反应混合物,45℃搅拌2h。后处理:加入三乙胺淬灭反应,加入乙酸乙酯稀释,依次用饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,水相再用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,旋蒸除去溶剂,得粗品ib。所得粗品经柱层析分离(二氯甲烷:乙醇=40:1),得到纯品i-4。1h nmr(400mhz,dmso-d6)δ10.62(s,1h),8.61(s,1h),8.37(s,1h),7.35(dt,j=13.2,7.9hz,4h),7.20(q,j=7.2hz,2h),7.11(d,j=8.5hz,2h),7.03(d,j=8.4hz,2h),4.43(dd,j=14.5,3.5hz,1h),4.37
–
4.17(m,3h),4.17
–
4.08(m,1h),2.26(s,3h),1.16(d,j=6.2hz,3h)。
31
p nmr(162mhz,dmso-d6)δ15.89。esi-ms(m/z):482.20[m+h]
+
,504.17[m+na]
+
。
[0372]
实施例18.苯基氢((((r)-1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸酯(3)的制备
[0373][0374]
将i-4(1g,2.1mmol)溶于四氢呋喃(7ml),搅拌和冷却下0℃滴加0.9mol/l氢氧化钠水溶液(5ml),滴毕20℃搅拌1h。用盐酸:乙醇(1:9)酸化所得反应液,旋蒸除去溶剂,加入无水乙醇,滤除析出的无机盐,旋蒸除去溶剂,得黄色油状3b粗品。向所得3b粗品中加入盐酸:乙醇(1:9)(4ml),90℃回流搅拌3h,得3反应液。通过hplc归一化峰面积计算所得3反应
液中各成分含量:3为79%,苯酚为8%,i-4和3b均为0。
[0375]
实施例19.苯基氢((((r)-1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸酯(3)的制备
[0376][0377]
将i-4(1g,2.1mmol)溶于四氢呋喃(7ml),搅拌和冷却下0℃滴加0.9mol/l氢氧化钠水溶液(5ml),滴毕20℃搅拌1h;再加入氢氧化钠(0.09g,2.1mmol),60℃搅拌3h,得3反应液。通过hplc归一化峰面积计算所得3反应液中各成分含量:3为77%,苯酚为15%,i-4为0。
[0378]
实施例20.苯基氢((((r)-1-(6-氨基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸酯(3)的制备
[0379][0380]
将va(20.0g,0.673mol)、二甲亚砜(136.6g,1.750mol)、乙酸酐(206.0g,2.020mol)和乙酸(80.8g,1.350mmol)加入到1000ml三颈瓶中,20~30℃搅拌38h。油泵减压蒸馏除去乙酸、乙酸酐和二甲亚砜,得黄色油状物。将所得残留物溶于二氯甲烷中,依次用水和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋除溶剂,得到黄色油状物。加入乙酸乙酯(36ml)室温搅拌12h,再加入石油醚(12ml)搅拌2h。抽滤,乙酸乙酯洗涤,滤饼真空干燥(70℃,6h),得近白色固体ii-1(26.0g,收率73%)。
[0381]
将亚磷酸二苯酯(12)(74.7g,319.0mmol)加入到100ml三颈瓶中,氩气保护,滴加bstfa(54.7g,212.5mmol),36℃搅拌3h,得硅烷化亚磷酸二苯酯16反应混合物。另在250ml三颈瓶中室温加入tfoh(12.6g,83.9mmol)和1,4-二氧六环(100ml),搅拌下加入nis(12.6g,56.0mmol),20℃滴加ii-1(20.0g,56.0mmol)的二氯甲烷(100ml)溶液,然后加入硅烷化亚磷酸二苯酯16反应混合物,45℃搅拌反应2h。将所得反应物冷至室温,加入三乙胺调节反应液ph值至7左右,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠
水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸(40℃),得褐色油状i-1粗品。
[0382]
在2l三颈瓶中投入所得i-1粗品、盐酸和乙醇(1:99,v/v)混合溶剂(960ml),60℃搅拌反应11h。将反应液降温至0℃,滴加三乙胺至ph 6-7,旋除溶剂。将所得残留物溶于4mol/l的盐酸水溶液,乙酸乙酯洗涤。合并有机相,用4mol/l盐酸水溶液提取。合并酸水相,冰水浴下滴加氨水调节ph值至6,加入乙酸乙酯提取。合并有机相,无水硫酸钠干燥,旋除溶剂,得黄色油状物viiia粗品。
[0383]
将上一步所得viiia粗品溶于四氢呋喃(120ml)中,冰浴中搅拌下10-15℃滴加氢氧化钠(6.5g,162.5mmol)的水(120ml)溶液,然后15-20℃搅拌反应1.5h。加入乙酸乙酯洗涤所得反应物;分取水相,加入活性炭(12.0g)与中性氧化铝(12.0g)搅拌脱色2h。过滤,得淡黄色澄清滤液,用4mol/l盐酸水溶液调节ph至3可见固体析出,在25℃下搅拌1h,进一步调节ph至2,然后在10℃下搅拌老化2h。过滤,用ph=1.5的冰水洗涤,真空干燥(70℃,5h),得近白色粉末3(11.5g,收率68%):1h nmr(400mhz,d2o)δ8.26(s,1h),8.17(s,1h),7.16(t,j=7.8hz,1h),7.03(t,j=7.4hz,1h),6.66(d,j=8.0hz,1h),4.36(dd,j=14.7,2.6hz,1h),4.21(dd,j=14.7,8.9hz,1h),4.05
–
3.97(m,1h),3.77(dd,j=13.7,7.8hz,1h),3.51(dd,j=13.7,9.0hz,1h),1.22(d,j=6.2hz,1h)。esi-ms(m/z):364.12[m+h]
+
,386.10[m+na]
+
。
[0384]
实施例21(r)-(((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧)甲基)膦酸二(2,2,2-三氟乙基)酯(i-10)合成
[0385][0386]
将17(12.4g,50.3mmol)加入到50ml三颈瓶中,氮气保护下滴加bstfa(8.6g,33.5mmol),36℃搅拌3h,得硅烷化亚磷酸二苯酯18反应混合物。另在100ml三颈瓶中室温加入tfoh(1.9g,12.6mmol)和1,4-二氧六环(15ml),搅拌下加入nis(3.4g,15.1mmol),在20℃滴加ii-1(3.0g,8.4mol)的二氯甲烷(15ml)溶液,然后快速加入硅烷化亚磷酸二苯酯18反应混合物,45℃搅拌反应2h。将所得反应物在冰水浴中冷却至10℃以下,加入三乙胺调节ph值至7左右,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸(40℃),得褐色油状物粗品。粗品经硅胶柱层析(乙酸乙酯),得黄色油状物i-10(4.0g,收率85%):1h nmr(600mhz,cdcl3)δ8.80(s,1h),8.12(s,1h),8.03(d,j=7.5hz,2h),7.62(t,j=7.3hz,1h),7.54(t,j=7.5hz,2h),4.47(d,j=13.7hz,1h),4.44
–
4.30(m,4h),4.24(dd,j=14.4,7.6hz,1h),4.01(dd,j=13.4,9.1hz,2h),3.77(dd,j=13.6,9.1hz,1h),1.29(d,j=6.0hz,3h)。esi-ms(m/z):555.99[m+h]
+
。
[0387]
实施例22替诺福韦(pmpa)的制备
[0388][0389]
在25ml三颈瓶中投入i-10(1.500g,2.7mmol),加入盐酸和乙醇(10:90,v/v)混合溶剂(9ml),搅拌回流6h。降至室温,旋蒸所得反应物,用乙腈加热提取所得残留物,趁热过滤除去不溶物,旋蒸滤液。将所得油状残留物溶于4mol/l盐酸水溶液,用乙酸乙酯洗涤,然后旋蒸除去溶剂,得黄色油状残留物19粗品。将19粗品在氢溴酸(20ml)中75℃搅拌反应16h。降至室温,用乙酸乙酯洗涤所得反应物,然后旋蒸除水。将所得淡黄色固体残留物溶于水,用50%氢氧化钠水溶液调节ph至2-3,室温搅拌5h,再冰水浴中搅拌2h。过滤,得替诺福韦粗品。所得粗品经水和乙醇(60:40,v/v)混合溶剂重结晶,真空干燥(100℃,7h),得白色粉末替诺福韦精品(0.560g,收率72%)。1h nmr(600mhz,d2o)δ8.32(s,1h),8.31(s,1h),4.41(dd,j=14.8,3.2hz,1h),4.22(dd,j=14.8,7.0hz,1h),3.92(pd,j=6.4,3.4hz,1h),3.61(dd,j=13.2,9.2hz,1h),3.42(dd,j=13.2,9.7hz,1h),1.10(d,j=6.3hz,3h)。
[0390]
实施例23不同亚磷酸二酯的p-烷基化反应
[0391][0392]
将亚磷酸二酯19、20、21或22(16.8mmol,6eq)加入10ml三颈瓶中,氮气保护下滴加bstfa(11.2mmol,4eq),36℃搅拌反应3h,得到硅烷化亚磷酸二酯23、24、25或26反应混合物。另在25ml三颈瓶中室温加入tfoh(4.2mmol,1.5eq)和1,4-二氧六环(5ml),搅拌下加入nis(5.0mmol,1.8eq),20℃滴加7(2.8mmol,1eq)的二氯甲烷(5ml)溶液,然后快速加入硅烷化亚磷酸二酯23、24、25或26反应混合物。45℃搅拌反应2h。冰水浴冷却至10℃以下,加入三乙胺调节反应液ph值至7左右,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸(40℃),得黄色油状物。取黄色油状物稀释100倍,进行液质联用(lc-ms)分析。液相条件:色谱柱:thermo scientific acclaim 120 c18柱(4.6mm
×
150mm,3μm);流动相a:0.8g/l碳酸氢铵水溶液(甲酸调ph=
3),流动相b:乙腈,梯度洗脱(0-5min:b 5%-95%);流速1ml/min;检测波长254nm;柱温35℃。质谱条件:离子源:电喷雾电离(esi);检测模式:正离子模式;离子源温度:520℃;ms扫描范围:100~2000m/z;喷雾电压:5500v;加热气流速8.0l/min;雾化气流速3.0l/min;干燥气流速:8.0l/min。
[0393]
反应结果如下表所示:
[0394][0395]
注:a.分离收率;b.lc-ms未检测到目标产物。
[0396]
实施例24n-(9-(2-((甲硫基)甲氧基)乙基)-9h-嘌呤-6-基)苯甲酰胺(ii-2)的制备
[0397][0398]
将vc(20.0g,0.07mol)、二甲亚砜(143.4g,1.84mol)、乙酸酐(216.2g,2.12mol)和乙酸(84.8g,1.41mol)加入到1l三颈瓶中,20℃搅拌反应26h。油泵减压蒸馏除去乙酸、乙酸酐和二甲亚砜。取少量所得残留物硅胶柱层析(乙酸乙酯),得ii-2纯品和副产物d-1纯品。ii-2氢谱1h nmr(600mhz,cdcl3)δ9.20(s,1h),8.81(s,1h),8.13(s,1h),8.04(d,j=7.4hz,2h),7.60(t,j=7.4hz,1h),7.52(t,j=7.7hz,2h),4.62(s,2h),4.52
–
4.49(m,2h),3.94
–
3.89(m,2h),2.01(s,3h)。d-1氢谱1hnmr(600mhz,cdcl3)δ9.16(s,1h),8.80(s,1h),8.05(s,1h),8.04(d,j=7.5hz,2h),7.61(t,j=7.4hz,1h),7.53(t,j=7.7hz,2h),4.56(t,j=5.2hz,2h),4.50
–
4.46(m,2h),2.04(s,3h)。
[0399]
将其余所得残留物溶于二氯甲烷中,依次用水和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋除溶剂,得到黄色油状物;加入乙酸乙酯(36ml)室温搅拌24h,再加入石油醚(12ml)搅拌2h。抽滤,滤饼经洗涤和真空干燥,得近白色固体ii-2(12.0g,收率50%)。
[0400]
实施例25((2-(6-苯甲酰胺基-9h-嘌呤-9-基)乙氧基)甲基)膦酸二(2,2,2-三氟乙基)酯(i-11)的制备
[0401][0402]
将亚磷酸二(2,2,2-三氟乙基)酯(2.15g,8.74mmol)加入到10ml三颈瓶中,氮气保护,滴加bstfa(1.5g,5.82mmol),36℃搅拌3h,得硅烷化亚磷酸二(2,2,2-三氟乙基)酯18反应混合物。另在50ml三颈瓶中室温加入tfoh(0.33g,2.20mmol)和1,4-二氧六环(2ml),搅拌下20℃左右加入nis(0.59g,2.62mmol),再滴加ii-2(0.5g,1.46mmol)在1,4-二氧六环(3ml)和二氯甲烷(1ml)中的悬浊液,然后加入硅烷化亚磷酸二(2,2,2-三氟乙基)酯18反应混合物,45℃搅拌反应1.5h。将所得反应物冷至10℃,加入三乙胺调节反应物ph值至7左右,加入乙酸乙酯稀释,依次用水、饱和亚硫酸钠水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,旋蒸(60℃),得褐色油状残留物;经硅胶柱层析(乙酸乙酯),得黄棕色油状产物i-11和白色固体副产物a-4。i-11氢谱1h nmr(600mhz,dmso-d6)δ11.14(s,1h),8.73(s,1h),8.41(s,1h),8.04(d,j=7.5hz,2h),7.65(t,j=7.4hz,1h),7.55(t,j=7.7hz,2h),4.65(m,4h),4.49(t,j=5.0hz,2h),4.16(d,j=7.9hz,2h),3.98(t,j=5.0hz,2h)。a-4氢谱1h nmr(600mhz,dmso-d6)δ11.17(br s,1h),8.75(s,1h),8.53(s,1h),8.05(d,j=7.5hz,2h),7.65(t,j=7.4hz,1h),7.56(t,j=7.7hz,2h),4.65(t,j=6.6hz,2h),3.75(t,j=6.6hz,2h)。
[0403]
实施例26阿德福韦的制备
[0404][0405]
在10ml三颈瓶中投入i-11(0.329g,0.61mmol),加入盐酸和乙醇(10:90,v/v)混合溶剂(2ml),搅拌回流6h。降至室温,旋蒸所得反应液,将所得油状残留物溶于4mol/l盐酸水溶液,用乙酸乙酯洗涤,然后旋蒸除去溶剂,得黄色油状残留物27粗品。将27粗品在氢溴酸(2ml)中75℃搅拌反应24h。降至室温,用乙酸乙酯洗涤所得反应物,然后旋蒸除水。将所得残留物溶于水(1ml),用50%氢氧化钠水溶液调节ph至2-3,室温搅拌5h,再冰水浴中搅拌2h。过滤,得阿德福韦粗品(0.14g)。esi-ms(m/z):274.26[m+h]
+
,296.04[m+na]
+
,569.28[2m+na]
+
。
[0406]
对比实施例1.(r)-n-(9-(2-(氯甲氧基)丙基)-9h-嘌呤-6-基)苯甲酰胺的制备
[0407][0408]
将va(2g,6.73mmol)、三聚甲醛(1.22g,13.5mmol)和无水氯化钙(1g)和无水二氯甲烷(30ml)加入100ml三颈瓶中,氩气保护和搅拌下,持续通入干燥氯化氢气体6h,取所得反应液tlc(二氯甲烷:甲醇=6:1)检测:原料ii-1大量剩余,并产生脱bz保护的化合物9,并无氯甲基化产物生成。
[0409]
对比实施例2.二苯基(r)-((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧基)膦酸酯(i-1)的制备
[0410][0411]
将60%氢化钠(0.33g,8.2mmol)悬浊于四氢呋喃(4ml)中,氩气保护和0℃下加入亚磷酸二苯酯(1.91g,8.2mmol),然后0℃搅拌反应30min,备用。
[0412]
将ii-1(0.58g,1.63mmol)、无水二氯甲烷(9ml)和分子筛(0.12g)加入25ml三颈瓶中,氩气保护和搅拌下降温至-5℃,缓慢滴加硫酰氯(0.51g,3.7mmol)的二氯甲烷(5ml)溶液;搅拌反应1.5h后,将反应液在冰水浴冷却下减压浓缩。将所得残留物加入到上述亚磷酸二苯酯和氢化钠的反应混合物中,升温至25℃搅拌反应2h。将反应液用饱和氯化铵水溶液淬灭,乙酸乙酯萃取。合并有机相,依次用水和饱和氯化钠水溶液洗涤,无水硫酸钠干燥,减压浓缩,得黄色油状物粗品(1.13g,129%)。所得粗品经硅胶柱层析(洗脱液:乙酸乙酯)纯化,得i-1(53mg,收率6%)。1h nmr(400mhz,cdcl3)δ9.28(brs,1h),8.78(s,1h),8.10(s,1h),8.02(d,j=8.0hz,2h),7.60(t,j=7.0hz,1h),7.51(t,j=8.0hz,2h),7.05-7.36(m,10h),4.45(dd,j=16.0,4.0hz,1h),4.12-4.26(m,2h),4.05-4.10(m,1h),3.90(dd,j=12.0hz,8.0hz,1h),1.27(d,j=8.0hz,3h);esi-ms(m/z):544.17[m+h]
+
,566.15[m+na]
+
,1109.33[2m+na]
+
。
[0413]
对比实施例3.二苯基(r)-((1-(6-苯甲酰胺基-9h-嘌呤-9-基)丙-2-基)氧基)膦酸酯(i-1)的制备
[0414][0415]
氩气保护下,将亚磷酸二苯酯(12)(0.36g,1.5mmol)和bstfa(0.39g,1.5mmol)在35℃搅拌反应3h,得硅烷化亚磷酸二苯酯16反应混合物。
[0416]
将ii-1(0.35g,1mmol)、二氯甲烷(3ml)和3a分子筛(1g)加入10ml三颈瓶中,氩气
保护和搅拌下降温至-5℃,缓慢滴加磺酰氯(0.18g,1.3mmol)的二氯甲烷(2ml)溶液;滴加完毕后,再加入上述硅烷化亚磷酸二苯酯16反应混合物,升温至32℃搅拌反应2h,无所需产物i-1生成。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1