一种鲍内脏酶解物纳米银的制备方法及其应用
1.本发明属于生物技术领域,具体地说涉及一种鲍内脏酶解物纳米银的制备方法及其应用。
背景技术:
2.纳米材料是指尺寸在1~100nm范围内的物质,因具有独特的大小,形状和结构,会显示出全新或者增强的理化特性。纳米银(silver nanoparticles, agnps)是以纳米技术为基础研制而成的新型纳米材料,被广泛应用于纺织品、食品包装、清洁剂、水处理、生物医学和农业病害防治等领域。据统计,市场上1800多种包含纳米材料的产品中,agnps产品可占24%。与普通银相比,agnps具有比表面积大、尺寸小、强表面活性、强催化性能等特点,并具有更强的抗菌特性。
3.agnps的制备主要可分为物理、化学和生物三大类方法。agnps的传统合成方法包括化学法和物理法。利用化学合成方法最大的优点是可以在短时间内合成大量的agnps,但在制备过程中使用的化学药品一般是有毒的,并且会产生有害副产物。与化学方法相比,物理方法不需要有毒有害的化学药品,并且通常处理时间也较短,制备的agnps颗粒的尺寸分布也较窄,但是物理法对仪器设备要求很高,生产成本较高。与化学和物理合成方法相比,生物合成方式具有成本低、生态友好、容易扩大规模提高生产率等优势。生物材料中含有碳水化合物、脂肪、蛋白质、核酸、色素和一些次生代谢产物,都可以充当还原剂把银离子(ag
+
)还原成银单质(ag0),并且不会产生有毒的副产物。纳米粒子由于表面能高、易发生团聚,因此在agnps 制备的过程中,通常需要添加稳定剂或封端剂,使agnps表面钝化,从而提高其稳定性。使用天然生物多糖作为还原剂和封端剂生物合成agnps具备制备方法简单、环保、可以大规模生产agnps等优势,但是,agnps具有极大的比表面积和表面能,易发生团聚和沉淀,使用多糖制备的agnps 的分散稳定性的持续时间不足以满足实际应用的需要,聚集和沉淀会影响agnps的应用。
4.现有技术cn107498067a中提到蛋白酶降解鲍内脏的制备方法,但该制备方法需用到二次酶解,操作繁琐,且制备过程中硝酸银的还原率不高,成本高。
技术实现要素:
5.本发明的目的在于提供一种鲍内脏酶解物纳米银的制备方法及其应用,它是以一次酶解所得的鲍内脏酶解物为还原剂和模板,利用生物材料还原法,制备成分散性、稳定性良好、硝酸银还原率高的鲍内脏酶解物纳米银。
6.为了实现上述目的,本发明的技术方案是:
7.本发明的第一个目的是提供一种鲍内脏酶解物纳米银的制备方法,包括以下步骤:
8.s1.将鲍内脏湿物料加三倍体积超纯水匀浆,然后加入12.5ul/g碱性蛋白酶并调ph至9.5;
9.s2.将混合物在50℃孵育6h充分酶解,酶解产物在95℃孵育20min,使碱性蛋白酶灭活,冷却后4000rpm离心20min,弃去沉淀。
10.s3.将收集到的上清液用10kda的超滤膜分离,弃去透过液。然后将收集到的截留液与三倍体积乙醇混合,静止12h,4℃,10000rpm离心10min 后收集沉淀,将沉淀干燥后为鲍内脏酶解物原料;
11.s4.取步骤s3中的鲍内脏酶解物配置成125ml,0.5g/l~0.8g/l的鲍内脏酶解物母液与125ml,0.65mmol/l~1.625mmol/l的agno3储备液,加入双蒸水定容至500ml,混合均匀后,将上述溶液转移至1l的圆底烧瓶中,置于集热式磁力搅拌器上,在100℃下反应1h~6h;
12.s5.步骤s4中的鲍内脏酶解物纳米银制备反应结束后,使用孔径为5000 d的透析袋对反应产物进行透析以去除多余的银离子,透析48h后收集产物,即为鲍内脏酶解物纳米银。
13.进一步地,所述步骤s4中,反应温度为100℃,ph值为7,反应时间为6h,agno3浓度为1.3mm,鲍内脏酶解物浓度为0.7g/l。
14.本发明的第二个目的是提供上述制备方法制备的鲍内脏酶解物纳米银。
15.本发明的第三个目的是提供上述鲍内脏酶解物纳米银的用途,用于制备养殖水体菌群结构调节剂。
16.进一步地,所述鲍内脏酶解物的浓度为6~18μg/l。
17.本发明相对于现有技术,具有如下的优点及有益效果:
18.1、本发明所制备的鲍内脏酶解物纳米银稳定性好,质量稳定,在室温下至少能稳定储存12个月以上。
19.2、鲍内脏酶解物纳米银粒径更小,所需硝酸银浓度更低,制备过程中硝酸银还原率高,并且操作更加简便程序,成本更低,适于工业化生产。
20.3、本发明所制备的鲍内脏酶解物纳米银纯度高,不存在其他单质银,分散性良好,不发生相互聚集。
21.4、本发明制备的鲍内脏酶解物纳米银可以调节养殖水体菌群结构、控制水体富营养化、减少有毒藻类增殖和维持健康养殖环境,促进鱼类健康生长、改善鱼类肠道环境,调节肠道菌群结构、控制肠道致病菌。
附图说明
22.下面结合附图表和具体实施例对本发明作进一步的说明。
23.图1为实施例1中的鲍内脏酶解物纳米银的紫外可见吸收光谱图及动态光散射结果图。a为紫外可见吸收光谱图,b为动态光散射结果图。
24.a、b、c、d分别代表浓度为1.625、1.3、0.975、0.65mm硝酸银
25.图2为实施例2中的鲍内脏酶解物纳米银的紫外可见吸收光谱图及动态光散射结果图。a为紫外可见吸收光谱图,b为动态光散射结果图。
26.a、b、c、d分别代表浓度为0.5、0.6、0.7、0.8g/l鲍内脏酶解物
27.图3为实施例3中的鲍内脏酶解物纳米银的紫外可见吸收光谱图及动态光散射结果图。a为紫外可见吸收光谱图,b为动态光散射结果图。
28.a、b、c、d、e、f分别代表1、2、3、4、5、6h反应时间
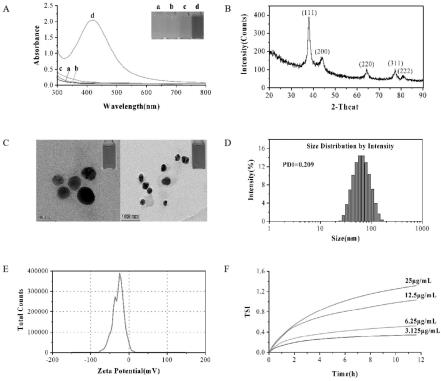
29.图4为实施例4制备的鲍内脏酶解物纳米银的表征图。
30.其中,a为紫外可见吸收光谱图;b为xrd的检测结果图;c为tem 图;d为粒径分布dls图;e为zeta电位图;f为tsi图。
31.图5为斑马鱼养殖水体细菌群落结构heatmap图。
32.其中(p)门水平(g)属水平(s)种水平
33.wc组、wl组、wm组、wh组中鲍内脏酶解物纳米银的浓度分别为 0,6,9和18μg/l
34.图6为鲍内脏酶解物纳米银对斑马鱼生长的影响图。
35.a为体重,b为体长。c0、c1、c2、c3中鲍内脏酶解物纳米银的浓度分别为0,6,9和18μg/l,各组之间不同字母表示有显著差异。
36.图7为鲍内脏酶解物纳米银对斑马鱼肝脏sod、cat和gsh活性的影响图。
37.a为sod;b为cat;c为gsh。c0、c1、c2、c3中鲍内脏酶解物纳米银的浓度分别为0,6,9和18μg/l,各组之间不同字母表示有显著差异。
38.图8为鲍内脏酶解物纳米银对斑马鱼肝脏tnf-α、il-1β、il-10、il-12 和defb1表达量的影响图。
39.a为tnf-α;b为il-1β;c为il-10;d为il-12;e为defb1。c0、 c1、c2、c3中鲍内脏酶解物纳米银的浓度分别为0,6,9和18μg/l,各组之间不同字母表示有显著差异。
40.图9为斑马鱼肠道微生物群落heatmap图。
41.其中(p)门水平(g)属水平(s)种水平
42.c0、c1、c2、c3中鲍内脏酶解物纳米银的浓度分别为0,6,9和18μg/l
具体实施方式
43.为了更好地理解本发明,下面结合实施例和附图对本发明做进一步的详细说明,但本领域技术人员了解,下述实施例不是对本发明保护范围的限制,任何在本发明基础上做出的改变和变化,都在本发明的保护范围之内。
44.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
45.下述实施例中所用的材料、试剂、仪器设备等,如无特殊说明,均可从商业途径得到。
46.实施例1鲍内脏酶解物纳米银的制备方案1(不同硝酸银浓度)
47.本实施例为固定反应体系中鲍内脏酶解物的浓度为0.5g/l,ph=7,反应温度为100℃,在不同的agno3浓度(0.65、0.975、1.3、1.625mm)下反应4h。
48.s1.将鲍内脏湿物料加三倍体积超纯水匀浆,然后加入12.5ul/g碱性蛋白酶并调ph至9.5;
49.s2.将混合物在50℃孵育6h充分酶解,酶解产物在95℃孵育20min,使碱性蛋白酶灭活,冷却后4000rpm离心20min,弃去沉淀;
50.s3.将收集到的上清液用10kda的超滤膜分离,弃去透过液。然后将收集到的截留液与三倍体积乙醇混合,静止12h,4℃,10000rpm离心10min 后收集沉淀,将沉淀干燥后为鲍内脏酶解物原料;
51.s4.取步骤s3中的鲍内脏酶解物配置成125ml,0.5g/l的鲍内脏酶解物母液与125ml,浓度分别为0.65mmol/l、0.975mmol/l、1.3mmol/l、 1.625mmol/l的agno3储备液,加
入双蒸水定容至500ml,混合均匀后,将上述溶液转移至1l的圆底烧瓶中,ph调至7,置于集热式磁力搅拌器上,在100℃下反应,4h,最后取1.5ml样品于透明的进样瓶中,观察样品的颜色变化;
52.s5.步骤s4中的鲍内脏酶解物纳米银制备反应结束后,使用孔径为5000 d的透析袋对反应产物进行透析以去除多余的银离子,透析所使用的溶剂为双蒸馏水,透析48h后收集产物,即为鲍内脏酶解物纳米银。
53.图1(a)为s5制备溶液的紫外可见吸收光谱图,可见在波长为420nm 的位置均出现明显的吸收峰,且随着硝酸银浓度的增加,吸光度呈现先增加后减小的趋势,当硝酸银浓度为1.3mm时,吸光度达到最大值,从反应后溶液的颜色变化也可以看出,在硝酸银浓度为1.3mm时反应溶液颜色最深,证明实验中成功合成了纳米银。
54.图1(b)为s5制备溶液的动态光散射结果,可见不同浓度的硝酸银所制备的agnps胶体的粒径在48~69nm间,硝酸银浓度分别为0.65、0.975、 1.3mm时,制备的agnps胶体的粒径没有显著差别,粒径在50nm左右。当硝酸银浓度提高到1.625mm时,制备的agnps胶体的粒径明显有所增大,为68.94
±
7.45nm。
55.实施例2鲍内脏酶解物纳米银的制备方案2(不同鲍内脏酶解物浓度)
56.本实施例为固定反应体系中硝酸银的浓度为1.3g/l,ph=7,反应温度为100℃,在不同的鲍内脏酶解物浓度(0.5g/l、0.6g/l、0.7g/l、0.8g/l)下反应4h。
57.s1.将鲍内脏湿物料加三倍体积超纯水匀浆,然后加入12.5ul/g碱性蛋白酶并调ph至9.5;
58.s2.将混合物在50℃孵育6h充分酶解,酶解产物在95℃孵育20min,使碱性蛋白酶灭活,冷却后4000rpm离心20min,弃去沉淀;
59.s3.将收集到的上清液用10kda的超滤膜分离,弃去透过液。然后将收集到的截留液与三倍体积乙醇混合,静止12h,4℃,10000rpm离心10min 后收集沉淀,将沉淀干燥后为鲍内脏酶解物原料;
60.s4.取步骤s3中的鲍内脏酶解物配置成125ml,浓度分别为0.5g/l、 0.6g/l、0.7g/l、0.8g/l的鲍内脏酶解物母液与125ml,浓度为1.3mmol/l 的agno3储备液,加入双蒸水定容至500ml,混合均匀后,将上述溶液转移至1l的圆底烧瓶中,ph调至7,置于集热式磁力搅拌器上,在100℃下反应,4h,最后取1.5ml样品于透明的进样瓶中,观察样品的颜色变化;
61.s5.步骤s4中的鲍内脏酶解物纳米银制备反应结束后,使用孔径为5000 d的透析袋对反应产物进行透析以去除多余的银离子,透析所使用的溶剂为双蒸馏水,透析48h后收集产物,即为鲍内脏酶解物纳米银。
62.图2(a)为s5制备溶液的紫外可见吸收光谱图,可见随着鲍内脏酶解物浓度的升高,样品在420nm处的吸收峰值越高,反应后混合溶液的颜色也逐渐加深,证明实验中成功合成了纳米银且生成的agnps逐渐增多。
63.图2(b)为s5制备溶液的动态光散射结果,可见鲍内脏酶解物的浓度会影响最终生成的agnps的粒径,体系中鲍内脏酶解物浓度越高,agnps 的粒径越大。
64.实施例3鲍内脏酶解物纳米银的制备方案3(不同反应时间)
65.本实施例为固定反应体系中鲍内脏酶解物浓度为0.7g/l,硝酸银的浓度为1.3g/l,ph=7,反应温度为100℃,反应时间分别为1h、2h、3h、4h、 5h与6h。
66.s1.将鲍内脏湿物料加三倍体积超纯水匀浆,然后加入12.5ul/g碱性蛋白酶并调ph至9.5;
67.s2.将混合物在50℃孵育6h充分酶解,酶解产物在95℃孵育20min,使碱性蛋白酶灭活,冷却后4000rpm离心20min,弃去沉淀;
68.s3.将收集到的上清液用10kda的超滤膜分离,弃去透过液。然后将收集到的截留液与三倍体积乙醇混合,静止12h,4℃,10000rpm离心10min 后收集沉淀,将沉淀干燥后为鲍内脏酶解物原料;
69.s4.取步骤s3中的鲍内脏酶解物配置成125ml,浓度为0.7g/l的鲍内脏酶解物母液与125ml,浓度为1.3mmol/l的agno3储备液,加入双蒸水定容至500ml,混合均匀后,将上述溶液转移至1l的圆底烧瓶中,ph调至7,置于集热式磁力搅拌器上,在100℃下分别反应1h、2h、3h、4h、 5h与6h,最后取1.5ml样品于透明的进样瓶中,观察样品的颜色变化;
70.s5.步骤s4中的鲍内脏酶解物纳米银制备反应结束后,使用孔径为5000 d的透析袋对反应产物进行透析以去除多余的银离子,透析所使用的溶剂为双蒸馏水,透析48h后收集产物,即为鲍内脏酶解物纳米银。
71.图3(a)为s5制备溶液的紫外可见吸收光谱图,可见随着反应时间的延长,波长为420nm位置的吸收峰的强度不断增加。随着反应时间的加长,混合溶液的颜色逐渐由黄色变为深棕色。证明实验中成功合成了纳米银且时间越长,生成agnps越多。
72.图3(b)为s5制备溶液的动态光散射结果,可见反应时间对鲍内脏酶解物纳米银的粒径变化没有产生太大影响,3h-6h反应时间生成的鲍内脏酶解物纳米银粒径基本稳定,维持在在43nm左右。
73.实施例4鲍内脏酶解物纳米银的制备方案4(最佳实施例)
74.本实施例为固定反应体系中鲍内脏酶解物浓度为0.7g/l,硝酸银的浓度为1.3g/l,ph=7,反应温度为100℃,反应时间6h。
75.s1.将鲍内脏湿物料加三倍体积超纯水匀浆,然后加入12.5ul/g碱性蛋白酶并调ph至9.5;
76.s2.将混合物在50℃孵育6h充分酶解,酶解产物在95℃孵育20min,使碱性蛋白酶灭活,冷却后4000rpm离心20min,弃去沉淀。
77.s3.将收集到的上清液用10kda的超滤膜分离,弃去透过液。然后将收集到的截留液与三倍体积乙醇混合,静止12h,4℃,10000rpm离心10min 后收集沉淀,将沉淀干燥后为鲍内脏酶解物原料;
78.s4.取步骤s3中的鲍内脏酶解物配置成125ml,0.5g/l~0.8g/l的鲍内脏酶解物母液与125ml,0.65mmol/l~1.625mmol/l的agno3储备液,加入双蒸水定容至500ml,混合均匀后,将上述溶液转移至1l的圆底烧瓶中,置于集热式磁力搅拌器上,在100℃下反应1h~6h;
79.s5.步骤s4中的鲍内脏酶解物纳米银制备反应结束后,使用孔径为5000 d的透析袋对反应产物进行透析以去除多余的银离子,透析48h后收集产物,即为鲍内脏酶解物纳米银。
80.图4(a)为s5制备溶液的紫外可见吸收光谱图,可见在420nm附近出现强的吸收峰,而水、硝酸银和鲍内脏酶解物均未产生吸收峰,证明实验中成功合成了纳米银。
81.图4(b)为s5制备溶液的xrd的检测结果,可以看出所制备的样品在2θ分别为
38.114
°
、44.298
°
、64.441
°
、77.395
°
、81.538
°
的位置出现明显衍射峰,分别指向单质银(111)、(200)、(220)、(311)和(222) 5个不同晶面的特征峰。xrd图谱中没有出现其他杂峰,表明制备的agnps 纯度较高,结晶性能良好。
82.图4(c)为s5制备溶液的tem图,可以看出,avh-agnps粒子为球形、分散良好。且右图为保存12个月后的tem图,分散性仍然较好。
83.图4(d)为s5制备溶液的粒径分布dls图,可见尺寸呈单峰分布,平均粒径为54.57
±
12.96nm,pdi值仅为0.209,表明所制备的avh-agnps 分散性良好,没有发生团聚现象。
84.图4(e)为zeta电位图,其zeta电位值为-27.9
±
4.3mv,表明avh-agnps 胶体性质稳定。icp-oes分析表明avh-agnps中的银含量为9.00
±
0.49%。
85.图4(f)是s5制备溶液的3.125、6.25、12.5和25μg/ml四种浓度下 12小时内检测tsi值。结果表明,四种浓度的tsi值分别为0.35、0.52、 1.03和1.32。tsi值越低则稳定性越高。说明制备的纳米银分散稳定性较好。
86.实施例5鲍内脏酶解物纳米银的制备方案4(二次酶解法)
87.s1.将鲍内脏湿物料加三倍体积超纯水匀浆,然后加入12.5ul/g碱性蛋白酶并调ph至9.5;
88.s2.将混合物在50℃孵育6h充分酶解,酶解产物在95℃孵育20min,使碱性蛋白酶灭活,冷却后4000rpm离心20min,弃去沉淀;
89.s3.在上清液中加入6g风味蛋白酶,50℃水浴加热12h,然后在95℃水浴上灭酶20min,待冷却后离心,4000r/min,20min,取上清液干燥,即得鲍内脏降解物;
90.s4.取步骤s3中的鲍内脏酶解物配置成125ml,不同浓度的鲍内脏酶解物母液与125ml,不同浓度的agno3储备液,加入双蒸水定容至500ml,混合均匀后,将上述溶液转移至1l的圆底烧瓶中,ph调至7,置于集热式磁力搅拌器上,在100℃下分别反应,反应液每间隔30min取1.5ml 于液相进样瓶中拍照保存,观察其颜色变化。反应条件如表1:
91.表1 反应浓度条件
[0092] 反应1反应2反应3反应4反应5鲍内脏酶解物浓度(mg/ml)0.50.250.50.250.5硝酸银(mm)3.253.256.56.5-[0093]
s5.步骤s4中的鲍内脏酶解物纳米银制备反应结束后,使用孔径为5000 d的透析袋对反应产物进行透析以去除多余的银离子,透析所使用的溶剂为双蒸馏水,透析48h后收集产物,即为鲍内脏酶解物纳米银。
[0094]
s6.不同反应条件下制备的鲍内脏酶解物纳米银进行全波段扫描,波长范围300~800nm;同时使用zeta电位粒度分析仪测反应液粒径及zeta电位,电感耦合等离子体光谱法(icp-oes)测定ag含量。
[0095]
综合上述各反应条件下测定的数据,选择最适浓度条件(鲍内脏酶解物为0.5mg/ml,硝酸银为3.25mm),反应时间为240min合成的鲍内脏酶解物纳米银,使用zeta电位粒度分析仪测反应液粒径及zeta电位,电感耦合等离子体光谱法(icp-oes)测定ag含量。
[0096]
结果显示,二次酶解法制备的鲍内脏酶解物纳米银的zeta电位为-26.4
ꢀ±
2.7mvag,平均粒径为79.5
±
10.4nm,银含量为10.49%。
[0097]
实施例6鲍内脏酶解物纳米银的对养殖水体细菌群落及斑马鱼肠道微生物群落的
影响
[0098]
为评价鲍内脏酶解物纳米银对斑马鱼养殖水体细菌群落及斑马鱼生物学效应的效果,具体步骤如下:
[0099]
对养殖水体细菌群落的影响
[0100]
设置不同浓度的鲍内脏酶解物纳米银处理浓度,将鲍内脏酶解物纳米银分别添加到斑马鱼养殖水体。4个不同的处理浓度分别是:空白对照组(0 μg/l,wc组),低浓度组(6μg/l,wl组),中浓度组(9μg/l,wm 组)和高浓度组(18μg/l,wh组),每组三个养殖箱,共12个养殖箱。将经过适应性养殖的斑马鱼随机分配在这12个养殖箱(80l)中,每个养殖箱50尾鱼。每天换水1/3以清理斑马鱼的排泄物,换水时补加avh-agnps 以维持水体中纳米银浓度恒定。在30天的饲养过程中,每天三次将鱼喂至饱食状态。
[0101]
养殖水样品采集及dna提取及illumina测序:在实验第30天,采集4 个不同处理养殖水体样品,每个养殖箱取养殖水300ml,用0.22μm的滤膜进行过滤富集水体中的微生物,滤膜样品用dna提取试剂盒提取总dna。而后送往上海美吉生物医药科技有限公司进行illumina测序。使用r软件进行heatmap图分析,了解不同样品和组间细菌群落结构的差异。
[0102]
图5是门、属、种水平上丰度前50中差异显著的细菌类群。与对照组相比,绿弯菌门(chloroflexi)、厚壁菌门(firmicutes)和cloacimonetes 在三个处理组中丰度均显著降低,而装甲菌门(armatimonadetes)在三个不同浓度处理组中丰度均显著增加。在属水平上,三个处理组都显著降低的有 methyloversatilis、bosea、气单胞菌属(aeromonas)、phreatobacter、limnohabitans、hgci_clade、黄杆菌属(flavobacterium)、弯杆菌属(flectobacillus);显著增加的有candidatus_finniella、armatimonas、苯基杆菌属(phenylobacterium)、sediminibacterium。在种的水平上,三个处理组中都显著降低的已知确定种有flavobacterium_columnare、维氏气单胞菌(aeromonas_veronii)、haliscomenobacter_sp._js224,显著增加的已知确定种有runella_defluvii;candidatus_intestinusbacter_nucleariae。
[0103]
illumina测序分析结果表明,添加avh-agnps后,斑马鱼水体养殖中丰度显著下降的主要是一些可能与致病相关的细菌类群。例如维氏气单胞菌、柱状黄杆菌。这两种菌在添加avh-agnps后三个处理组中丰度均显著降低或未检出。弯杆菌属是淡水生态系统、活性污泥中常见菌属,其生境分布暗示了该属的腐生生活方式。bosea属的细菌是抗阿米巴虫细菌,它们常在医院供水系统中定居,并被怀疑是重症监护室获得性肺炎的原因。斑马鱼养殖水体中添加avh-agnps后,这些与致病相关的细菌类群的丰度均显著降低或未检测到。
[0104]
与对照相比,添加avh-agnps后丰度显著下降的细菌类群还有: haliscomenobacter_sp._js224,hgcl_clade,phreatobacter,methyloversatilis。 haliscomenobacter属细菌的过度增殖被普遍认为是造成污泥膨胀的重要因素,因此,该类细菌丰度的降低对于维持健康的养殖环境有积极意义。研究表明,hgcl_clade的丰度往往会随着营养物浓度的增加而降低;phreatobacter 属细菌多分离自超纯水系统,喜欢贫营养环境;methyloversatilis属细菌具备多种营养利用能力,能在寡营养条件下生存。添加avh-agnps后,这些细菌丰度的降低可能暗示斑马鱼养殖水体的富营养化趋势。
[0105]
添加avh-agnps后,也有部分细菌的相对丰度显著升高,这些细菌包括:runella_defluvii、苯基杆菌属(phenylobacterium)、sediminibacterium 属、candidatus_
intestinusbacter_nucleariae、candidatus_finniella,以及装甲菌门。runella_defluvii可去除污水中的营养物和有机物。phenylobacterium 苯基杆菌属偏爱以杂环化合物中的苯基作为碳源,可降解除草剂等多种异型物质。sediminibacterium属分离自富营养化水库沉积物中,在环境污染治理方面十分有潜力。添加avh-agnps后,这些菌丰度升高对于控制水体富营养化、去除水体中异型物质、维持养殖水体健康有积极意义。
[0106]
candidatus_intestinusbacter_nucleariae和candidatus_finniella都是食藻虫的内共生细菌。前者目前仅在nuclearia delicatula(一种可以捕食有毒蓝细菌的藻类)的细胞质中检测到。后者是novelendosymbionts内共生物阿米巴鞭毛虫。这些内共生菌对寄主的营养、防御、竞争和环境适应都有重要作用。添加avh-agnps后,这类细菌丰度升高,有助于减少水环境中有毒藻类的过度增殖,维持水环境健康。
[0107]
添加avh-agnps之后,许多厌氧菌如hgcl_clade、緑弯菌门chloroflexi 和cloacimonetes门的丰度显著下降,而好氧菌如装甲菌门、armatimonas 属的丰度显著上升,暗示斑马鱼养殖水体中溶解氧浓度的升高,这对养殖体系也是有利的。
[0108]
对斑马鱼生长指标、抗氧化活性及免疫功能的影响
[0109]
对生长指标的影响
[0110]
设置不同浓度的鲍内脏酶解物纳米银处理浓度,将鲍内脏酶解物纳米银分别添加到斑马鱼养殖水体。
[0111]
4个不同的处理浓度分别是:空白对照组,低浓度组(6μg/l),中浓度组(9μg/l)和高浓度组(18μg/l)。
[0112]
在实验第10天,20天和30天随机取样,采样前禁食24h,每个养殖箱采集6条鱼,使用丁香酚(0.5g/l)快速麻醉鱼。称重、记录体长。将斑马鱼解剖后取出肝脏,立即在液氮中冷冻,并储存在-80℃冰箱。
[0113]
如图6所示,在6~18μg/l浓度的处理下,鲍内脏酶解物纳米银对斑马鱼的生长有促进作用。
[0114]
抗氧化酶活性检测
[0115]
在肝脏样品中加入10倍体积的生理盐水,使用组织匀浆机4℃下匀浆,所有操作在冰上进行,保证低温操作。在3000rpm,4℃下离心10min 后,取组织匀浆上清液用于酶活性检测。使用试剂盒测定sod和cat的活性以及gsh含量。
[0116]
如图7所示,在斑马鱼养殖水中添加了6~18μg/l浓度的鲍内脏酶解物纳米银,均对斑马鱼肝脏的sod活性、cat活力和gsh含量表现出一定程度的诱导效应,促进了斑马鱼抗氧化系统的功能。
[0117]
检测的斑马鱼免疫相关基因分别是:肿瘤坏死因子α(tnf-α)、白细胞介素1β(il-1β)、白细胞介素10(il-10)、白细胞介素12(il-12)和β防御素1(defb1),以β肌动蛋白基因作为内部对照基因。
[0118]
如图8所示,6~18μg/l鲍内脏酶解物纳米银处理显著上调了免疫相关基因(tnf-α,il-1,il-12和il-10和defb1)在mrna水平的表达,说明在本研究浓度范围内,鲍内脏酶解物纳米银能够通过调节免疫相关基因表达来增强免疫功能。
[0119]
对斑马鱼肠道微生物群落结构的影响
[0120]
养殖一个月后,从每个养殖箱中随机采集12条斑马鱼样品,取出肠道组织,每6条
鱼的肠道合并为1个样品,置于液氮中速冻后保存在-80℃冰箱中,用于后续dna提取。使用qiagen粪便基因组dna提取试剂盒(德国)提取肠道样品总dna,将dna样品送上海美吉生物医药科技有限公司进行illumina测序。使用r软件进行heatmap图分析,了解不同样品和组间细菌群落结构的差异。
[0121]
图9是avh-agnps处理后,在门、属、种水平上丰度发生显著变化的已知或确定的细菌类群。c0、c1、c2、c3分别与养殖水体的wc,wl, wm和wh相对应。在门水平,与对照组相比,变形菌门(proteobacteria)、放线菌门(actinobacteria)的丰度在三个处理组都上升,上升幅度在c3组达到显著水平。c2、c3浓度组的酸杆菌门(acidobacteria)也显著高于对照组,而拟杆菌门(bacteroidetes)丰度在三个处理组均显著下降。
[0122]
在属的水平上,avh-agnps处理后,丰度大于1%的已知属中,嗜盐单胞菌属(halomonas)、黄杆菌属(flavobacterium)在三个不同浓度处理组均显著下降;邻单胞菌属(plesimonas)在c2、c3组均显著降低。而 burkholderia-caballeronia-paraburkholderia、鞘氨醇单胞菌属(sphingomonas)和红球菌属(rhodococcus)在c3组显著增高。
[0123]
在种的水平上,avh-agnps处理后,丰度大于0.1%的已知种中,黄瓜黄杆菌(flavobacterium_cucumi)在三个不同浓度处理组均显著下降;类志贺氏毗邻单胞菌(plesimonas shigelloides)、产碱假单胞菌(pseudomonas_alcaligenes)、flavobacterium_suncheonense在c2、c3组均显著下降;chitinibacter fontanus在c1、c2组显著下降。而 alcaligenaceae_bacterium_bl-169鳞毛蕨科细菌在c1组显著上升,红串红球菌(rhodococcus erythropolis)在c3浓度组显著上升。
[0124]
添加avh-agnps后,斑马鱼肠道中一些可能与致病相关的细菌类群丰度显著下降。例如类志贺氏毗邻单胞菌,该菌在对照组中丰度高达2.55%,但在c2和c3处理组中,其丰度分别显著下降至0.27%和0.58%。还有产碱假单胞菌,该菌在对照组中丰度为0.25%,但在c2和c3浓度的avh-agnps 处理组中,丰度分别显著下降至0.032%和0.037%。
[0125]
与对照相比,黄瓜黄杆菌的丰度在三个处理组均显著下降、 flavobacterium_suncheonense在c2、c3组显著下降。上述两种菌分别只占黄杆菌属的9.35%和3.35%,还有很多未知的黄杆菌属细菌丰度显著下降。黄杆菌属中包含了很多渔业病原菌,是斑马鱼的致病属之一。嗜盐单胞菌属在各处理组中也显著下降。该属主要存在于盐环境,对人、动物和藻类的致病性均已被描述。此外,另一个积极的信号是,avh-agnps处理后,一些潜在的降解毒素的菌,如红球菌属、以及红串红球菌丰度显著增加。红串红球菌不仅能够降解有机污染物,还能够降解真菌毒素,降低了因真菌毒素导致的斑马鱼胚胎期的死亡率。avh-agnps处理后,上述细菌类群丰度的显著变化,对于控制环境致病菌、降低养殖生物发病概率起到了重要作用。 avh-agnps处理后,一些有助于降解acephate、多环芳香烃等污染物的细菌,如alcaligenaceae_bacteriumbl-169、burkholderia-caballeronia
‑ꢀ
paraburkholderia属和鞘氨醇单胞菌属(sphingomonas)分别中c1和c3浓度处理组显著升高,这有助于养殖动物应对环境污染,提高抗逆性。
[0126]
综上,icp-oes分析结果显示,本技术所涉及的一次酶解制备的鲍内脏酶解物纳米银冻干后的粉末样品中银含量为9.00
±
0.49%。二次酶解法(实施例5)制备的鲍内脏酶解物纳米银冻干后检测的银含量为10.10
±
0.54%,说明减少硝酸银用量不会导致生成的纳
米银中银含量大量减少,一次酶解法不仅操作简便,制备过程中硝酸银的还原率也更高。
[0127]
一次酶解的鲍内脏酶解物纳米银平均粒径为54.57
±
12.96nm,比二次酶解法制备的agnps粒径(79.5
±
10.4nm)更小。一次和二次酶解法制备的agnps的zeta电位分别为-27.9
±
4.3mv和-26.4
±
2.7mv,用一次酶解所制备的agnps可稳定储存12个月以上不产生沉淀。以上结果说明,与二次酶解鲍内脏相比,使用一次酶解超滤分离提取的鲍内脏酶解物作为稳定剂和还原剂,能够制备出分散性良好、硝酸银还原率更高的球形agnps,并且鲍内脏酶解物操作更加简便程序,实验成本更低。
[0128]
综上所述,本发明所制备的鲍内脏酶解物纳米银稳定性好,质量稳定,在室温下至少能稳定储存12个月以上。鲍内脏酶解物纳米银粒径更小,所需硝酸银浓度更低,并且操作更加简便程序,成本更低,适于工业化生产。纯度高,不存在其他单质银,分散性良好,不发生相互聚集。同时,本发明发制备的鲍内脏酶解物纳米银毒性可以控制水体富营养化、减少有毒藻类增殖和维持健康养殖环境,促进鱼类健康生长,改善鱼类肠道环境,调节肠道菌群结构,控制肠道致病菌,提高抗逆性。
[0129]
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,我们所描述的具体的实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1