桃热激蛋白PpHSP20-32及其用途
桃热激蛋白pphsp20-32及其用途
技术领域
1.本发明属于生物技术领域,具体涉及桃热激蛋白pphsp20-32及其用 途。
背景技术:
2.随着全球气候的变化,温度是影响植物生长和地理分布的最重要因 素。植物由于其固着性,经受着昼夜交替、季节变化和天气变化等因素 引起的较大温度波动,致使植物演化出较强的温度适应能力。高温或低 温胁迫作为重要非生物胁迫因素之一,严重影响植物的生长。许多关于 植物对温度胁迫的响应机制被揭示,然而,植物对环境中非胁迫温度变化的感知和传导还未知。
3.大量的研究表明,热激蛋白(heat shock protein,hsp)在温度反应 中起重要作用,包括生长发育以及应激反应等。根据热激蛋白分子量大 小将其分为5大类:hsp100、hsp90、hsp70、hsp60和hsp20,其中 hsp20在植物中最为常见。hsp20也被称为小热激蛋白(small heat shockprotein,shsp),分子量在15-42kda。
4.通过高温预处理,植物可以获得一定的耐热性。作为一类重要的分 子伴侣,hsp20的积累在这一过程中发挥着关键作用。hsp20还参与盐 胁迫、干旱胁迫等生物学过程。大部分hsp20s基因受热诱导,一些基 因的表达因氯化钠胁迫或干旱胁迫而增强。目前关于hsp20的研究主要 集中在其耐热性。在辣椒中,过表达cahsp16.4能提高活性氧清除系统的稳定性进而增强对高温和干旱胁迫的耐受性。此外,许多hsp20s与 植物发育相关,如种子成熟与萌发、花粉发育和下胚轴伸长等。
5.目前关于不同植物的hsp20功能研究主要集中在其耐热性,而关于 其和植物株高以及非胁迫温度下表达有关的研究还鲜有报道,目前仅有 研究表明,athsp22基因在高温条件下(29℃)促进下胚轴伸长,但是 其是否引起植物植株高度变化的功能并没有报道。
技术实现要素:
6.本发明的目的之一在于提供桃(prunus persica l.)热激蛋白 pphsp20-32及其所编码的蛋白。
7.本发明的目的之二在于提供桃热激蛋白pphsp20-32及其所编码的 蛋白、重组载体在植物生长发育中的应用。
8.为实现上述目的,本发明采取如下技术方案:
9.本发明提供桃热激蛋白pphsp20-32,其序列如seq id no.1所示。
10.本发明还提供桃热激蛋白pphsp20-32编码的蛋白,其氨基酸序列如 seq id no.2所示。
11.本发明还提供包含所述桃热激蛋白pphsp20-32的重组载体。优选 地,所述重组载体为农杆菌表达载体。
12.利用所述基因或蛋白来获得转基因植物,所述植物包括但不限于拟 南芥。
13.具体地,所述转基因拟南芥的获取步骤包括:
14.a:构建含有所述桃热激蛋白pphsp20-32的重组载体;
15.b:将所构建的重组载体转化到拟南芥组织或细胞中;
16.c:培育筛选得到转基因拟南芥植株。
17.其中,序列中的seq id no.1共462bp,编码蛋白的氨基酸序列如 序列表中seq id no.2所示,共153个氨基酸。
18.本发明中术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、 酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要 能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个 重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
19.包含上述的适当dna序列以及适当启动子或者控制序列的载体,可 以用于转化适当的宿主细胞,以使其能够表达蛋白质。其中,所述宿主 细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞; 或是高等真核细胞,如植物细胞。代表性例子有:大肠杆菌,链霉菌属、农杆菌;真菌细胞如酵母;植物细胞等。
20.本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子 和宿主细胞。
21.用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进 行。转化植物可使用农杆菌转化或基因枪转化等方法,例如喷洒法、叶 盘法、水稻幼胚转化法等。对于转化的植物细胞、组织或器官可以用常 规方法再生成植株。
22.本发明还提供桃热激蛋白pphsp20-32、桃热激蛋白pphsp20-32编 码的蛋白及桃热激蛋白pphsp20-32的重组载体在植物生长发育中的用 途,主要是在提高植物株高和/或莲座叶宽度、长度和/或耐热性方面的用途。
23.作为本发明的一种实施方式,将多核苷酸通过常规的方法克隆到适 当的载体中,将所述的带有外源基因的重组载体导入到植物细胞中,使 所述的植物细胞表达所述的桃热激蛋白pphsp20-32。可通过将所述植物 细胞再生成植物,获得过量表达所述多肽的植物。
24.具体地,一种培育转基因植物的方法,将所述桃热激蛋白 pphsp20-32基因导入目的植物,得到转基因植物,所述转基因植物的株 高、莲座叶宽度或长度和/或耐热性高于目的植物。
[0025]“促进目的植物中pphsp20-32基因的表达”的实现方式可为如下(1) 或(2)或(3):
[0026]
(1)将pphsp20-32基因导入目的植物;
[0027]
(2)引入强启动子和/或增强子;
[0028]
(3)本领域内的其它常见方法。
[0029]
本发明中,对于适用于本发明的植物没有特别的限制,只要其适合进行基因的转化操作,如各种农作物、花卉植物或林业植物等。所述的植物比如可以是(不限于):双子叶植物、单子叶植物或裸子植物。更具体地,所述的植物包括(但不限于):小麦、大麦、黑麦、水稻、玉米、高粱、甜菜、苹果、梨、李、桃、杏、樱桃、草莓、木莓、黑莓、豆、扁豆、豌豆、大豆、油菜、芥、罂粟、齐墩果、向日葵、椰子、蓖麻油植物、可可豆、花生、葫芦、黄瓜、西瓜、棉花、亚麻、黄麻、柑桔、柠檬、葡萄柚、菠菜、莴苣、芦笋、洋白菜、大白菜、小白菜、胡萝卜、洋葱、土豆、西红柿、青椒、鳄梨、桂皮、樟脑、烟草、坚果、咖啡、茄子、甘蔗、茶叶、胡椒、葡萄树、蚝麻草、香蕉、天然橡胶树和观赏植物等。
[0030]
作为一种优选方式,所述的“植物”包括但不限于:桃、茄科、十 字花科、蔷薇科、葡萄科的植物。比如,所述的“植物”包括但不限于: 茄科的烟草和番茄;十字花科的拟南芥、蔷薇科的苹果、草莓;葡萄科 的葡萄等。
[0031]
本发明中所说的“植物”包括整株植物,其亲本和子代植株以及植物 的不同部位,包括种子、果实、芽、茎、叶、根(包括块茎)、花、组织和 器官,在这些不同的部分均有我们目的基因或者核酸。这里所提及的“植物”也包括植物细胞、悬浮培养物、愈伤组织、胚、分生组织区、配子体、 孢子体、花粉和小孢子,同样,其中每种前述对象包含目的基因/核酸。
[0032]
本发明包括任何植物细胞,或任何由其中的方法获得或可获得的植 物,以及所有的植物部分及其繁殖体。本专利也包含由任何前述方法所 获得的转染细胞、组织、器官或完整植物。唯一的要求是子代表现出相 同的的基因型或表型特征,使用本专利中的方法获得的子代特性相同。
[0033]
本发明还扩展到如上所述的植物的可收获的部分,但不限于种子、 叶、果实、花、茎、根、根茎、块茎和球茎。同时进一步涉及植株收获 后的其他衍生物,如干燥颗粒或粉末、油、脂肪和脂肪酸、淀粉或蛋白 质。本发明还涉及由相关植物获得的食品或食品添加剂。
[0034]
本发明具有如下优点:
[0035]
1.本发明通过克隆桃热激蛋白pphsp20基因家族中的pphsp20-32, 最后用农杆菌介导的方法转入拟南芥中验证目的基因的功能,有利于从 分子机制上阐明有关桃树矮化方面的分子机制,对于利用分子手段进行矮化种质培育具有重要意义。
[0036]
2.本发明还能从桃分离出热激蛋白pphsp20-32基因的完整cdna,连 接到植物表达载体上,利用农杆菌侵染法转化植物,获得转基因植株, 其植株变高,莲座叶宽度和长度变大,说明该基因对植物生长发育具有 十分重要的意义,并且能够提高植物的耐热性,因此该基因也可以应用 于植物遗传改良。
附图说明
[0037]
图1是桃热激蛋白pphsp20-32的pcr扩增电泳图;
[0038]
图中左侧条带的m为dl2000marker,基因pphsp20-32基因片段 大小为462bp。
[0039]
图2是桃pphsp20-32与拟南芥athsp17.6的进化分析。
[0040]
图3是桃pphsp20-32在
‘
中油桃14号’不同组织的表达。
[0041]
图4是桃pphsp20-32转基因拟南芥阳性植株鉴定;
[0042]
图中,a:转基因植株;wt:野生型拟南芥对照;h2o:空白对照; m:dl2000marker;p:质粒对照。
[0043]
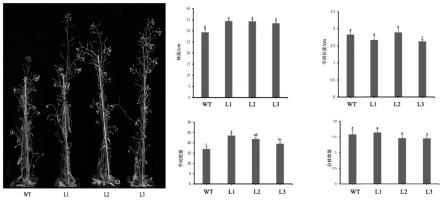
图5是桃pphsp20-32转基因拟南芥两周后莲座叶表型观测及方差分 析。
[0044]
图6是桃pphsp20-32转基因拟南芥移栽三周后株高表型观测及方差 分析。
[0045]
图7是桃pphsp20-32转基因拟南芥高温处理后萌芽率变化情况。
具体实施方式
[0046]
下面将通过具体实施例对本发明进行详细的描述。提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达 给本领域的技术人员。
[0047]
如在通篇说明书及权利要求当中所提及的“包含”或“包括”为一 开放式用语,故
应解释成“包含但不限定于”。说明书后续描述为实施 本发明的较佳实施方式,然所述描述乃以说明书的一般原则为目的,并 非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定 者为准。
[0048]
若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常 规手段。下述实施例中的试验方法,如无特别说明,均为常规方法。如 无特殊说明,所采用的试剂及材料,均可以从市场中购买获得。
[0049]
本发明中
‘
中油桃14号’是中国农业科学院郑州果树研究所王志强 等利用杂交育种方式所培育出的半矮生油桃新品种,该品种已经上市, 在市场上可以通过购买的途径获得,本发明采用的实验材料由中国农业 科学院郑州果树研究所国家桃、葡萄改良中心提供。
[0050]
实施例一
[0051]
1、基因pphsp20-32的分离
[0052]
利用柱式植物总rna抽提纯化试剂盒(上海生工),提取
‘
中油桃 14号’叶片的总rna,并利用天根生化科技(北京)有限公司生产的 fastquant rt kit(with gdnase)反转录试剂盒进行反转录,获得单链 cdna,以单链cdna为模版,以下述序列为引物,进行pcr扩增,获 得基因pphsp20-32的全长序列,pcr扩增电泳图如图1所示。基因 pphsp20-32的全长序列如序列表中seq id no.1所示,共462bp,共编码蛋白的氨基酸序列如序列表中seq id no.2所示,共153个氨基酸。 桃pphsp20-32与拟南芥athsp17.6(np_172220)氨基酸序列比对结果 如图2。图2结果显示桃中的pphsp20-32,即pphsp20-32与athsp17.6 的氨基酸序列相似度为49.07%(同源性不高)。
[0053]
引物序列为:
[0054]
正向pphsp20-32-f:5
′‑
atggcattaattcctagtaccattt-3
′
;
[0055]
反向pphsp20-32-r:5
′‑
ttagtgcccagaaatttgaacg-3
′
。
[0056]
pcr扩增条件为:98℃反应10s,55℃反应15s,72℃反应40s, 35个循环;4℃保存。
[0057]
2、基因pphsp20-32的表达分析
[0058]
荧光定量pcr操作步骤:利用柱式植物总rna抽提纯化试剂盒(上 海生工)提取
‘
中油桃14号’的茎尖、花、胚、嫩叶、成熟叶、果实的 总rna,利用天根生化科技(北京)有限公司生产的fastquant rt kit (with gdnase)反转录试剂盒进行反转录,获得单链cdna,使用荧光定 量试剂盒sybr select master mix(applied biosystems,mardrid,ca, usa)进行扩增反应,用abi prism 7500 fast sequence detection system(applied biosystems,mardrid,ca,usa)荧光定量议进行qrt-pcr 检测。
[0059]
荧光定量pcr反应体系为20μl,包括200ng cdna(1μl),sybrselect master mix(10μl),0.5μmol
·
l-1
上、下游引物(各1μl)和 无rna酶水(7μl)。
[0060]
反应程序:95℃预变性,2min;95℃变性30s,60℃退火30s,72℃延伸30s,共42个循环。每个样品3次重复。利用primer premier 5.0 软件设计定量引物。
[0061]
定量引物序列为:
[0062]
正向q pphsp20-32-f:5
′‑
aagcaacctccttcaccaactcca-3
′
;
[0063]
反向q pphsp20-32-r:5
′‑
ggcattctcaggcaaactcaaacg-3
′
。
[0064]
采用qrt-pcr检测pphsp20-32基因在
‘
中油桃14号’不同组织的 表达情况。从图3
中可以看出,pphsp20-32在
‘
中油桃14号’一年生 枝条的茎尖、嫩叶、成熟叶、花、胚、果实中均有表达。在成熟叶中的 表达量是最高的,在其他部位几乎没有表达。
[0065]
3、pphsp20-32基因的功能鉴定试验
[0066]
为研究pphsp20-32基因的功能,通过转基因拟南芥来分析鉴定其功 能。
[0067]
3.1构建重组载体
[0068]
使用neb公司的t4连接酶进行16℃过夜连接反应,将从
‘
中油桃 14号’叶片
‘
中扩增得到的pphsp20-32基因用一步克隆试剂盒(vazyme, 南京诺唯赞生物科技有限公司)连接到过表达载体psak-277上。引物分 别如下:
[0069]
g-pphsp20-32-f:
[0070]5′‑
cccaagcttatggcattaattcctagtaccattt-3
′
;
[0071]
g-pphsp20-32-r:
[0072]5′‑
tgctctagattagtgcccagaaatttgaacg-3
′
。
[0073]
检测阳性克隆。然后将阳性克隆送至上海生工生物科技股份有限公司测序。
[0074]
3.2转基因拟南芥阳性株的筛选
[0075]
鉴于桃尚未建立高效、成熟的遗传转化体系,故采用模式植物拟南 芥用于pphsp20-32基因的功能验证。提取经过测序的 psak-277-pphsp20-32质粒,液氮冻融法转入农杆菌gv3101中。调整 农杆菌菌液浓度od
600
至0.8,用蘸花法侵染野生型拟南芥植株,收获t0代种子后,在含有卡那霉素的ms培养基上筛选抗性植株。待长成小苗 后,提取dna,通过pcr检测得获得阳性转基因植株,收取t1代种子。 t1代种子播下后,利用t2代转基因拟南芥观察与野生型的差别。以下实 验均利用t2代及后代纯合系。
[0076]
pcr分子鉴定阳性植株引物:
[0077]
正向pphsp20-32-f:5
′‑
atggcattaattcctagtaccattt-3
′
;
[0078]
反向pphsp20-32-r:5
′‑
ttagtgcccagaaatttgaacg-3
′
。
[0079]
用于证实片段插入。
[0080]
如图4,在转基因植株中能够扩增出与质粒dna相同大小的目的条 带,而野生型拟南芥植株dna和空白对照均没有扩增出相应的条带,证 明pphsp20-32已经整合到野生型拟南芥基因组中。
[0081]
实施例二基因pphsp20-32在转基因拟南芥中的用途
[0082]
1基因pphsp20-32对转基因拟南芥植株表型的影响
[0083]
播种t2代转基因(三个转基因系l1、l2和l3)以及野生型拟南 芥于ms培养基上进行生长,待其长出两片子叶后移栽至基质中,进行 植株表型的观测。待其生长至两周时进行表型观察与方差分析,与野生型拟南芥相比,转pphsp20-32的t2代转基因株系表现为植株莲座叶长 度和宽度增加,如图5。当生长至三周时,观察植物形态,三个转基因株 系的株高均高于wt。l1的平均株高为34.4cm,明显高于wt的29.3cm。转基因株系和wt之间的节间长度没有显著差异,而节数显著高于wt, 表明转基因株系的株高增加可能是由于节数增加导致,这表明过表达 pphsp20-32导致植株高度增加,如图6。
[0084]
2基因pphsp20-32对温度的响应
[0085]
将t2代转基因以及野生型拟南芥种子在46℃处理30min,然后转 移到25℃进行耐热性测定,高温处理后48h内没有种子发芽。 pphsp20-32转基因株系在高温处理后60h,种
子萌发率显著提高,l1、 l2和l3株系萌发率分别达到82%、73%和80%;而wt种子萌发率仅 为3%,显著低于转基因株系种子萌发率。84h时,转基因株系种子萌发 率分别达到95%、94%和92%;wt种子萌发率显著提高到62%,如图7。 这表明过表达pphsp20-32转基因拟南芥植株表现出耐高温的特性。
[0086]
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的 描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技 术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的 这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1