一种复合酶制剂微胶囊化制备工艺的制作方法
1.本发明涉及复合酶制剂微胶囊化制备技术领域,具体为一种复合酶制剂微胶囊化制备工艺。
背景技术:
2.无害化厨余垃圾处理方法均需要使用到酶制剂,酶制剂是一种以酶为主要功能因子的发酵剂,其中的酶主要包括淀粉酶、蛋白酶、纤维素酶、果胶酶等,其中酶的来源是由芽孢杆菌类、放线菌、丝状真菌、乳酸菌、酵母菌等有益微生物经过发酵加工过程得来,主要用于厨余垃圾中有机废气的发酵。
3.固定化细胞技术是用于获得细胞的酶和代谢产物的一种方法,利用固定化细胞技术可以生产复合酶制剂;
4.由于大多数生物酶是氨基酸组成的蛋白质,极易受外界条件的影响,在催化反应中易遇高热、强酸、强碱、有机溶剂而失活,与金属离子发生作用而失活,导致其应用受到一定的限制,因此,大多数生物酶的催化要在特定的条件下(温度、浓度、酸碱环境)发挥最大活性。为克服生物酶的应用缺陷,提高生物酶在使用和储存过程中的稳定性,需要系统的研究酶的固定化。
5.微胶囊是指使用天然高分子或合成高分子物质将芯材(药材、香精、染料、细胞、蛋白质活性物质等)进行封装而得到具有核壳结构的微型容器,由于芯材被包覆在封闭的壁材外壳中,使包覆其中的芯材减少或隔绝外界环境,如ph值、氧气、温度、湿度、紫外线等不利条件影响,便于芯材的存储和运输;需要芯材发挥作用的时候,可根据需要改变壁材的物理或者化学性质,以进行持续地、可控的速度释放。
6.此外,研究发现2-硝基-1,4-苄二硫醚类物质在紫外光照条件下,硝基被异构化后,苯环上a位上的氢均可以产生自由基,导致物质会按照两种方式进行降解,一是与硝基邻位上的取代基变成醛基,生成邻亚硝基苯甲醛类的产物,另一种是硝基间位上的取代基变成醛基;
7.本发明提供一种用于复合酶制剂的微胶囊化的制备工艺,可以保护复合酶制剂的生物活性,提高其在使用和储存过程中的稳定性。
技术实现要素:
8.(一)解决的技术问题
9.本发明提供一种可以保护复合酶制剂的生物活性、并且提高复合酶制剂在使用和储存过程中的稳定性的复合酶制剂微胶囊化制备工艺。
10.(二)技术方案
11.为实现上述目的,本发明提供如下技术方案:
12.一种复合酶制剂微胶囊化制备工艺,包括以下步骤:
13.步骤s1,通过固定化细胞技术制备得到由淀粉酶、蛋白酶和纤维素酶组成的精酶
液,在该精酶液表面上覆盖有一层可水解脱去的油性固定保护膜,得到复合酶制剂;
14.步骤s2,配制包含保护胶体的水相溶液;
15.步骤s3,合成主链上合有紫外光降解基团硝基苄二硫醚酯嵌段的酰氯封端的聚硫酯、以其与表面活性剂、以及覆盖有油性固定保护膜的复合酶制剂为油溶性芯材,得到有机相溶液;
16.步骤s4,在高速搅拌的条件下,将步骤s3中的有机相溶液分散于步骤s2中的水相溶液中,进行乳化;
17.步骤s5,在室温搅拌的情况下,将二乙烯三胺的水溶液加入步骤s4中的乳液中反应,得到水包油型聚酰胺包裹复合酶制剂微胶囊。
18.优选的,所述保护胶体为聚乙二醇,其质量浓度为3-8%。
19.优选的,所述表面活性剂为吐温80。
20.优选的,所述有机相溶液中,酰氯封端的聚硫酯、表面活性剂吐温80、复合酶制剂的质量比为621∶(5-10)∶(50-120)。
21.优选的,所述步骤s4,将步骤s3中的有机相溶液分散于步骤s2中的水相溶液中,进行乳化的时间为20-40min。
22.(三)有益的技术效果
23.与现有技术相比,本发明具备以下有益的技术效果:
24.本发明:通过固定化细胞技术对由芽孢杆菌和放线菌组成的湿菌体进行处理,得到固定化菌体小球,将固定化菌体小球进行培养得到粗酶液,对粗酶液进行浓缩精制处理得到由淀粉酶、蛋白酶和纤维素酶组成的精酶液,在制备的精酶液表面上覆盖有一层可水解脱去的油性固定保护膜,得到复合酶制剂;
25.并且合成主链上合有紫外光降解基团硝基苄二硫醚酯嵌段的酰氯封端的聚硫酯、以其与覆盖有油性固定保护膜的复合酶制剂为油溶性芯材,以水溶性二乙烯三胺为壁材,采用界面聚合的方法,制备得到水包油型聚酰胺包裹复合酶制剂微胶囊,其聚酰胺壁材可以保护复合酶制剂的生物活性、提高复合酶制剂在使用和储存过程中的稳定性,并且聚酰胺壁材的主链上合有紫外光降解基团硝基苄二硫醚酯嵌段,其可在紫外光的作用下,发生降解,释放出覆盖有油性固定保护膜的复合酶制剂芯材。
附图说明
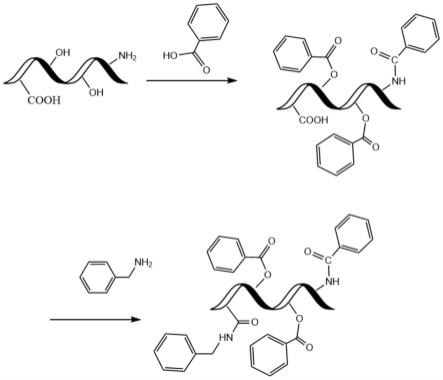
26.图1为覆盖有油性固定保护膜的复合酶制剂的反应结构式;
27.图2为酰氯封端的聚硫酯的反应结构式;
28.图3为主链上合有紫外光降解基团硝基苄二硫醚酯嵌段的聚酰胺的结构式。
具体实施方式
29.本发明中所涉及的芽孢杆菌和放线菌的菌株均来源于
″
中国工业微生物菌种保藏管理中心甘肃分中心(gsicc)
″
;
30.壳聚糖(脱乙酰度≥80%),海藻酸钠(黏度范围:1.05~1.15),其中naoh、甲醇、nacl、cacl2等试剂均为国产分析纯;
31.改良pda培养基:200g马铃薯(去皮),30g葡萄糖,2g蛋白胨,0.5gkh2po4,0.5g(nh4)
so4,10mg维生素b1,1000ml蒸馏水,115℃高压灭菌30min;
32.产酶培养基:5gkcl,5gnacl,5gmgso4·
7h2o,0.75gk2hpo4,0.01g feso4,8.5g蛋白胨,0.25g牛肉膏,10g壳聚糖,1000ml蒸馏水,ph7.5~8.0,121℃高压灭菌30min;
33.将芽孢杆菌和放线菌的菌株于改良pda斜面上活化2次,而后接种于改良pda液体培养基,36℃、180r/min培养16h,再用0.75%无菌生理盐水5000r/min离心洗涤2次,每次20min,取菌体沉淀4℃保藏备用;
34.实施例一:
35.采用海藻酸钠包埋法对细胞进行固定化处理:
36.取2.5%海藻酸钠溶液50ml,加入2g湿菌体,搅拌混匀,用8号针头从离液面10cm高处将其滴入2%cacl2溶液中,滤出凝胶小球,重新置于2%cacl2溶液中,4℃静置硬化2h;
37.将上述的固定化菌体小球放入改良pda液体培养基中,36℃、120r/min预培养12h,而后放入产酶培养基中,在30℃、120r/min下培养24h,得到粗酶液;
38.用8号针头将3%的壳聚糖胶体溶液滴入凝结液(20%甲醇和30%naoh)中,作用2h后得中空壳聚糖球,取出后用去离子水洗涤3次,吸水纸吸干;
39.之后,加入上述粗酶液至刚好没过球,吸附3h,取出后去离子水洗涤,得到浓缩5倍的精酶液;
40.将精酶液分散在环己烷中,先加入苯甲酸,在室温下反应1h,之后加入苄胺在室温下反应1h,之后进行喷雾干燥,得到表面上覆盖有一层可水解脱去的油性固定保护膜且由淀粉酶、蛋白酶和纤维素酶组成的复合酶制剂,其反应结构式如图1所示;其中,喷雾干燥条件是:雾化器压力0.4mpa、进风温度设定为140℃,出风温度控制为60℃;
41.复合酶制剂微胶囊化制备工艺如下:
42.步骤step1,在150ml蒸馏水中加入聚乙二醇,搅拌使其溶解,配制得到质量浓度为5%的水相溶液;
43.步骤step2称取2.63g1,4-二溴甲基苯于50ml的单口烧瓶中,加入20ml浓度98%的硫酸,冰浴30min,将10ml的浓硝酸于恒压滴液漏斗中缓慢滴加至体系中,在滴加硝酸的过程中,控制体系温度在0℃以下,滴加完毕,将体系置于室温反应过夜,然后将其倒入适量的冰水浴中,调节体系的ph值等于7,过滤,将得到的滤渣再次用水洗涤两次,收集滤渣,向其中加入甲醇,洗涤、离心,将产物溶于40ml的无水乙醇中,加入1.2倍当量的硫脲,在60℃下回流反应5h,用薄层色谱追踪反应进度,反应完毕,将出现的白色不溶物离心收集起来,将沉淀物用乙醇洗涤2次,之后溶于一定量的蒸馏水中,再加入适量的二氯甲烷,加入4倍当量的焦亚硫酸钠,在氮气保护条件下,35℃油浴加热回流,反应10h,将有机相的产物用石油醚和乙酸乙酯体积比4∶1作为展开剂过柱子,得到2-硝基-1,4-苄二硫醇;
44.称取215mg2-硝基-1,4-苄二硫醇于含有2ml二氯甲烷的50ml圆底烧瓶中,向其中加入223mg三乙胺,将其置于冰水浴中,采用磁力搅拌,称取406mg对苯二甲酰氯于恒压滴液漏斗中,加入1ml的二氯甲烷稀释,缓慢滴加到上述圆底烧瓶中,控制滴加速率1滴/5s,滴加完毕,室温反应2h,得到酰氯封端的聚硫酯,如图2所示;
45.将621mg酰氯封端的聚硫酯和10mg吐温80溶于包含有100mg复合酶制剂的30ml环己烷中,搅拌混合均匀,得到有机相溶液;
46.步骤step3,在高速搅拌的条件下,将步骤step2中的有机相溶液分散于步骤step1
中的水相溶液中,乳化30min;
47.步骤step4,在室温搅拌的情况下,将412mg二乙烯三胺的水溶液加入步骤step3中的乳液中,反应5min,之后过滤、洗涤、分离,得到水包油型聚酰胺包裹复合酶制剂微胶囊,其结构如图3所示;
48.将该水包油型聚酰胺包裹复合酶制剂微胶囊滴于载波片上,盖上盖玻片,放在倒置显微镜下观察发现:微胶囊粒径大小分布均匀,并且分散性较好。
49.实施例二:
50.采用海藻酸钠壳聚糖包埋法对细胞进行固定化处理:
51.将2.5%海藻酸钠溶液中加入1%的壳聚糖,配制海藻酸钠壳聚糖胶体溶液;取该溶液50ml,加入2g湿菌体,搅拌混匀,用8号针头从离液面10cm高处将其滴入2%cacl2溶液中,滤出凝胶小球,重新置于入2%cacl2溶液中,4℃静置硬化2h;
52.将上述的固定化菌体小球放入改良pda液体培养基中,36℃、120r/min预培养12h,而后放入产酶培养基中,在30℃、120r/min下培养24h,得到粗酶液;
53.取合5%海藻酸钠、2%壳聚糖的海藻酸钠-壳聚糖胶体溶液5ml与等量的上述粗酶液混匀,用8号针头从离液面10cm处将其滴加到2%cacl2溶液中;滤出凝胶小球,重新置于入2%cacl2溶液中,4℃静置硬化2h,滤出凝胶小球用去离子水洗涤,得到浓缩5倍的精酶液;
54.将精酶液分散在环己烷中,先加入苯甲酸,在室温下反应1h,之后加入苄胺在室温下反应1h,之后进行喷雾干燥,得到表面上覆盖有一层可水解脱去的油性固定保护膜且由淀粉酶、蛋白酶和纤维素酶组成的复合酶制剂;其中,喷雾干燥条件是:雾化器压力0.4mpa、进风温度设定为180℃,出风温度控制为80℃;
55.复合酶制剂微胶囊化制备工艺如下:
56.步骤step1,在150ml蒸馏水中加入聚乙二醇,搅拌使其溶解,配制得到质量浓度为3%的水相溶液;
57.步骤step2,酰氯封端的聚硫酯的制备参见实施例1;
58.将621mg酰氯封端的聚硫酯和5mg吐温80溶于包含有50mg复合酶制剂的30ml环己烷中,搅拌混合均匀,得到有机相溶液;
59.步骤step3,在高速搅拌的条件下,将步骤step2中的有机相溶液分散于步骤step1中的水相溶液中,乳化20min;
60.步骤step4,在室温搅拌的情况下,将412mg二乙烯三胺的水溶液加入步骤step3中的乳液中,反应10min,之后过滤、洗涤、分离,得到水包油型聚酰胺包裹复合酶制剂微胶囊;
61.将该水包油型聚酰胺包裹复合酶制剂微胶囊滴于载波片上,盖上盖玻片,放在倒置显微镜下观察发现:微胶囊粒径较小,并且分散性一般,有少许粘连现象。
62.实施例三:
63.采用壳聚糖吸附法对细胞进行固定化处理:
64.取2g湿菌体配制菌体悬液;
65.将2.5%壳聚糖胶体溶液用8号针头滴入凝结液(20%甲醇和30%naoh)中,作用2h后得到中空壳聚糖球,取出用去离子水洗涤,而后放入菌体悬液中,吸附2h,取出壳聚糖球并用0.75%无菌生理盐水洗涤;
66.将上述的固定化菌体小球放入改良pda液体培养基中,36℃、120r/min预培养12h,而后放入产酶培养基中,在30℃、120r/min下培养24h,得到粗酶液;
67.将上述的粗酶液加入1%(w/v)的活性炭脱色,经定性滤纸过滤后的滤液依次经过0.8um、0.45um和0.22um孔径的水相膜抽滤,经过除菌过滤之后,得到浓缩5倍的精酶液;
68.将精酶液分散在环己烷中,先加入苯甲酸,在室温下反应1h,之后加入苄胺在室温下反应1h,之后进行喷雾干燥,得到表面上覆盖有一层可水解脱去的油性固定保护膜且由淀粉酶、蛋白酶和纤维素酶组成的复合酶制剂;其中,喷雾干燥条件是:雾化器压力0.4mpa、进风温度设定为160℃,出风温度控制为70℃;
69.复合酶制剂微胶囊化制备工艺如下:
70.步骤step1,在150ml蒸馏水中加入聚z二醇,搅拌使其溶解,配制得到质量浓度为8%的水相溶液;
71.步骤step2,酰氯封端的聚硫酯的制备参见实施例1;
72.将621mg酰氯封端的聚硫酯和8mg吐温80溶于包含有120mg复合酶制剂的30ml环己烷中,搅拌混合均匀,得到有机相溶液;
73.步骤step3,在高速搅拌的条件下,将步骤step2中的有机相溶液分散于步骤step1中的水相溶液中,乳化40min;
74.步骤step4,在室温搅拌的情况下,将412mg二乙烯三胺的水溶液加入步骤step3中的乳液中,反应20min,之后过滤、洗涤、分离,得到水包油型聚酰胺包裹复合酶制剂微胶囊;
75.将该水包油型聚酰胺包裹复合酶制剂微胶囊滴于载波片上,盖上盖玻片,放在倒置显微镜下观察发现:微胶囊粒径大,但是分散性良好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1