一种延缓MSCs衰老的方法
一种延缓mscs衰老的方法
技术领域
1.本发明涉及延缓衰老技术领域,具体是一种延缓mscs衰老的方法。
背景技术:
2.随着社会的进步和经济的快速发展,人口老龄化将成为全世界主要的社会经济问题,而衰老是其发生的最重要原因之一。衰老是一个复杂的过程,表现为生理活动下降、低能量代谢水平、应激反应诱导的体内平衡丧失,从而导致疾病和死亡的风险增加。目前,科学界已经提出300多种理论或假说来解释衰老的发生、发展及机制,其中干细胞衰老理论是目前生物体衰老机制中的最新理论之一。干细胞衰老理论认为成体干细胞衰老是组织器官衰老、个体衰老以及各种老龄化疾病发生的重要原因,干细胞是研究衰老机制极其重要的模型。因此,激活衰老的干细胞是延缓个体衰老、预防神经退行性疾病、代谢性疾病和各种恶性肿瘤等衰老相关疾病的有效措施,能够最大限度地提升老龄人口的生命质量。衰老与代谢失调密切相关,代谢失调是衰老的关键标志。与衰老相关的代谢途径,如mtor和ampk途径,雷帕霉素、二甲双胍和运动等能够直接或间接调控该途径,已成为抗衰老干预的主要靶点。随着年龄的增长,膜磷脂的不饱和程度也增加,脂质过氧化产物增多可能导致细胞损伤。此外,不同类型的饮食干预可以影响衰老,而这些干预往往伴随着脂质稳态的改变。膳食脂类通过影响成体干细胞活性,调控脂质代谢相关基因的表达,增强脂质分解能力,有助于实现健康衰老。脂质能够通过影响能量储存、质膜组成、信号转导和基因表达变化来调节干细胞的生物学特性。然而,脂质代谢变化如何影响干细胞衰老至今仍未被探索。
3.成体干细胞是存在于成体体内分化组织中的未分化细胞,其中间充质干细胞(mesenchymal stem cells,mscs)是一类具有高效自我更新和多向分化潜能的成体干细胞。它们易于体外培养,能够与宿主细胞接触,并具有免疫耐受性,是组织工程和治疗各种疾病的理想种子细胞。然而,在体外扩增培养过程中,mscs脂质合成能力降低,mscs出现衰老的特征性表型,如形态变化、增殖活性降低和生理功能失衡。因此,无法通过体外扩增获得足够数量的mscs以满足临床治疗的需求。干细胞的衰老严重限制其临床应用,如患者自体干细胞移植,组织、器官再生和修复等。
4.mscs是许多疾病细胞治疗的基础,是一种研究较早且深入的成体干细胞,已经成为干细胞组织工程学的主要种子细胞。正常的骨髓样本获取困难,无法获得充足的特定年龄阶段的骨髓mscs,且mscs随着体外培养次数增加,其增殖活性和多向分化潜能降低,细胞发生衰老。干细胞衰老极大制约了干细胞的临床应用,降低了患者自体干细胞移植的疗效。因此,针对以上现状,迫切需要提供一种延缓mscs衰老的方法,以克服当前实际应用中的不足。
技术实现要素:
5.本发明的目的在于提供一种延缓mscs衰老的方法,旨在解决上述技术背景中的问题。
6.本发明是这样实现的,一种延缓mscs衰老的方法,该方法包括如下步骤:
7.步骤1:获取衰老的mscs;
8.步骤2:利用携带scd2的慢病毒感染衰老的mscs,使得衰老的mscs的脂质合成水平上调,进而延缓mscs衰老。
9.作为本发明进一步的方案:在步骤1中,获取衰老的mscs的具体步骤为:
10.步骤1.1:从大鼠骨髓中提取原代细胞,利用全骨髓贴壁法及体外传代培养,获得早代次mscs(epmscs,p2-p3)及晚代次mscs(lpmscs,p9-p10);
11.步骤1.2:通过形态学观察(细胞形态学特点、细胞表面积和长宽比)、衰老相关β半乳糖苷酶(sa-β-gal)染色以及衰老相关因子p16
ink4a
的表达,建立复制性衰老的mscs。
12.作为本发明进一步的方案:在步骤1.1中,所述大鼠为1-2月龄雄性wistar大鼠。
13.作为本发明进一步的方案:在步骤2中,携带scd2的慢病毒感染衰老mscs的时间为48h-72h。
14.作为本发明进一步的方案:所述方法在制备延缓衰老的药品中的应用。
15.作为本发明进一步的方案:所述方法在制备抗皮肤衰老保健品中的应用。
16.作为本发明进一步的方案:所述方法在制备食品添加剂中的应用。
17.与现有技术相比,本发明的有益效果:
18.本发明围绕scd2影响mscs脂质合成水平调控细胞衰老进行探讨,首次将scd2与mscs衰老有机联系,从干细胞脂质代谢这一新颖角度去探究干细胞衰老,发现scd2能够通过提高细胞脂质合成水平来延缓间充质干细胞衰老,为阐明干细胞衰老的调控机制提供实验依据,也为体外培养获得大量年轻态mscs提供了新思路和新技术,将有助于维持干细胞数量及功能,有助于延缓机体衰老及防治各种老龄化疾病,对社会长久健康发展具有重要意义。
附图说明
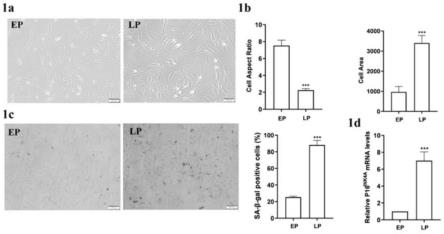
19.图1a为本发明实施例1中显微镜下显示的epmscs及lpmscs细胞形态;
20.图1b为本发明实施例1中epmscs及lpmscs细胞形态的参数分析结构;
21.图1c为本发明实施例1中sa-β-gal染色结果;
22.图1d为本发明实施例1中利用rt-qpcr技术检测衰老相关因子p16
ink4a
mrna水平的结果示意图;
23.图2a为本发明实施例2中lpmscs和epmscs经茜素红染色后的对照图;
24.图2b为本发明实施例2中western blot结果示意图;
25.图2c为本发明实施例2中epmscs和lpmsc的红色荧光强度对照示意图;
26.图2d为本发明实施例2中rt-qpcr检测epmscs与lpmscs中scd2 mrna表达水平示意图;
27.图2e为本发明实施例2中western blot检测epmscs与lpmscs中scd2蛋白表达水平示意图;
28.图3a为本发明实施例3中显示scd2慢病毒过表达后,各组mscs均表达绿色荧光蛋白示意图;
29.图3b为本发明实施例3中rt-qpcr检测结果示意图;
30.图3c为本发明实施例3中western blot检测结果示意图;
31.图4a为本发明实施例4中sa-β-gal染色检测细胞衰老情况示意图;
32.图4b为本发明实施例4中rt-qpcr检测衰老相关因子的表达图;
33.图4c为本发明实施例4中茜素红染色检测细胞成骨分化能力示意图;
34.图4d为本发明实施例4中western blot检测细胞成骨分化能力示意图;
35.图4e为本发明实施例4中尼罗红染色检测过表达scd2对细胞脂质合成水平的影响示意图。
具体实施方式
36.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
37.以下结合具体实施例对本发明的具体实现进行详细描述。
38.本发明实施例提供的一种延缓mscs衰老的方法,该方法包括如下步骤:
39.步骤1:获取衰老的mscs;
40.具体的,从1-2月龄雄性wistar大鼠骨髓中提取原代细胞,利用全骨髓贴壁法及体外传代培养,获得早代次mscs(epmscs,p2-p3)及晚代次mscs(lpmscs,p9-p10);
41.通过形态学观察(细胞形态学特点、细胞表面积和长宽比)、衰老相关β半乳糖苷酶(sa-β-gal)染色以及衰老相关因子p16
ink4a
的表达,建立复制性衰老的mscs;
42.通过甘油三酯含量检测和茜素红染色以及runx2蛋白表达水平检测明确了衰老mscs脂质合成水平以及成骨分化潜能明显降低;
43.步骤2:利用携带scd2的慢病毒感染衰老的mscs,使得衰老的mscs的脂质合成水平上调,进而延缓mscs衰老;
44.具体的,利用携带scd2的慢病毒感染衰老mscs,感染时间为48h-72h;
45.通过荧光显微镜及rt-qpcr检测其转染效率,发现病毒转染72h时,效率最佳,scd2的表达可明显上调;
46.通过sa-β-gal染色、衰老相关因子p16
ink4a
的表达检测、茜素红染色、runx2蛋白表达检测以及尼罗红染色等指标,发现scd2通过上调衰老mscs的脂质合成水平延缓mscs衰老,为体外培养获得大量年轻态mscs提供新思路和新技术,加深了对mscs衰老潜在机制的认识,有助于衰老相关疾病的预防及治疗新靶点的探索。
47.实施例1建立大鼠mscs体外复制衰老模型
48.1.1原代细胞的分离获取
49.取健康雄性wistar大鼠使其处于安静稳定状态,脱颈处死并进行消毒,之后用器械快速分离大鼠的股骨、胫骨及肱骨,将其放入50ml离心管中并用含1%双抗的pbs浸泡,随后迅速将其移入超净台;
50.将骨表面的肌肉及组织去除后,将其放入完全培养液中浸泡;
51.利用咬骨钳将骨两端的骨髓腔打开,用5-10ml注射器吸取培养液进行骨髓腔的冲洗,冲洗3-4次后见骨髓腔变成半透明即可;
52.将冲洗后的液体放入细胞过滤网上过滤,且在室温下离心处理,转速为1500rpm,
离心时间5min,之后用5ml移液器重悬细胞悬液,将其置于6cm细胞培养皿进行培养;
53.第二天进行半量换液,并继续培养,细胞融合至80%左右进行传代培养。
54.1.2构建mscs体外复制衰老模型
55.从150-180g健康wistar雄性大鼠骨髓中提取原代mscs后,通过体外传代培养至p10代左右,然后对不同代次细胞进行衰老鉴定,成功建立mscs复制性衰老模型;
56.以p2-p3mscs为早代次mscs(early passage mscs,epmscs),p9-p10mscs为晚代次mscs(late passage mscs,lpmscs)。
57.1.3mscs形态学观察与分析
58.显微镜下观察体外传代培养获得的epmscs及lpmscs,对细胞生长状况和形态学特征进行评估,随机选取约20个视野采集图像,用cell entry软件记录并计算视野中单个细胞的表面积及长宽比,进行统计学分析。
59.1.4衰老相关β-半乳糖苷酶(sa-β-gal)活性检测
60.epmscs和lpmscs分别培养在6孔板中;当细胞达到70%融合时,用pbs洗涤3次,每孔加入500μl固定液固定细胞15-18min后,再次用pbs洗涤细胞;洗涤后每孔加入1ml工作液(含染色液a、染色液b各10μl,染色液c 930μl,x-gal溶液50μl),用封口膜、保鲜膜及锡纸进行封闭与避光,在37℃无co2的孵箱里过夜;倒置相差显微镜下观察阳性细胞染色结果并进行拍照。
61.1.5荧光定量pcr(rt-qpcr)检测衰老相关因子mrna表达水平
62.(1)提取细胞rna
63.细胞生长密度至80-90%时,吸弃培养液,pbs清洗2-3次,培养皿中加入1ml trizol,室温裂解15min,反复吹打直至所有细胞完全裂解,所有液体吸入1.5ml ep管,并在4℃环境下离心处理15min,转速为12000rpm,吸取上清至另一ep管中;按200μl/ml trizol加入氯仿,剧烈震荡混和,禁止涡旋,室温静置15min,并在4℃环境下离心处理15min,转速为12000rpm,吸取上层水相至新ep管中,按照500μl/ml trizol加入异丙醇,轻轻振荡后室温静置15min,并在4℃环境下离心处理15min,转速为12000rpm,弃掉上清,管底部沉淀为rna,加入提前预冷的75%乙醇1ml,轻弹管底使沉淀悬浮,并在4℃环境下离心处理15min,转速为12000rpm,弃上清,室温干燥约10min,至其变半透明状;加入10-20μl depc水充分溶解rna,上机检测rna浓度及纯度,可根据rna浓度酌情加减depc水量。
64.(2)rna逆转录为cdna(transscript all-in-one first-strand cdna synthesis supermix for qpcr,transgen biotech)
65.根据试剂盒说明,进行如下操作:
66.表1逆转录反应体系
67.namevolumesupermix(5
×
)2μltotal rna500ng/rna浓度depc waterto volume 10μlgdna0.5μl
68.表2逆转录反应程序
69.temperaturetimecycles
40℃15min185℃5s14℃+∞ 70.合成的cdna可以直接进行qpcr或存储于-20℃冰箱;
71.表3 qpcr引物组
[0072][0073]
(3)rt-qpcr检测(transstart top green qpcr supermix,transgen biotech)
[0074]
按反应体系配制如表4:
[0075]
表4逆转录反应体系
[0076]
namevolumeforward primer0.4μlcdna2μlreverse primer0.5μlpassive reference dye(50
×
)0.4μltransstart top green qpcr supermix(2
×
)10μldepc waterto volume 20μl
[0077]
逆转录反应程序如表5:
[0078]
表5逆转录反应程序
[0079]
[0080][0081]
测出ct值并进行统计学分析。
[0082]
体外传代培养获得epmscs及lpmscs,如图1a所示,显微镜下观察到两组细胞有明显的形态学差别,epmscs生长状态良好,胞体形状为长梭形,边界清楚;而lpmscs生长状态差,形状不规则且呈铺展样,细胞边界模糊,立体感消失,胞质颗粒感较明显。如图1b对细胞形态的参数进行分析发现,lpmscs表面积较epmscs显著增大,长宽比降低。
[0083]
图1c为sa-β-gal染色结果,可见lpmscs蓝染细胞数目明显多于epmscs。统计分析发现lpmscs中蓝染细胞(sa-β-gal阳性)比例明显高于epmscs,说明lpmscs中衰老细胞数目显著增加。
[0084]
图1d是利用rt-qpcr技术检测衰老相关因子p16
ink4a
mrna水平,结果表明,相对于epmscs,lpmscs中p16
ink4a mrna表达水平明显升高。由此我们成功建立了mscs复制性衰老模型,将epmscs作为年轻细胞,lpmscs作为衰老细胞。
[0085]
实施例2衰老mscs成骨分化潜能、脂质合成水平及scd2表达的检测
[0086]
2.1茜素红染色及western blot检测细胞成骨分化能力
[0087]
将1ml0.1%明胶加入6孔板中,摇匀并在co2培养箱至少30min后,吸去明胶将mscs接种于6孔板中,细胞密度根据生长状态而定,每孔加入2ml配制的完全培养液后在细胞培养箱中培养;当细胞融合达到75%左右时,弃培养液,向孔板中加入成骨诱导分化培养液,每2-3天进行换液;诱导14-17天后,根据细胞的生长情况选择是否进行茜素红染色,如细胞数目逐渐减少,可以缩短染色时间;成骨诱导结束后,弃诱导液之后pbs洗涤2-3次,室温,4%多聚甲醛溶液进行固定,时间为25-30min;弃固定液,pbs洗涤2-3次,确保固定液清洗彻底,每孔加入2ml茜素红工作液进行染色,时间为8-10min;弃染色液,pbs洗涤2-3次后每孔加入2ml pbs,显微镜下观察染色结果,判断mscs成骨分化效果。
[0088]
如图2a所示,茜素红染色发现,与epmscs相比,lpmscs中红色的骨基质钙盐沉积明显减少。
[0089]
如图2b所示,western blot结果进一步证实,lpmscs细胞的成骨分化相关蛋白runx2表达显著降低,说明衰老mscs成骨分化潜能降低。
[0090]
2.2尼罗红染色检测细胞脂质合成水平
[0091]
将尼罗红用dmso溶解制备1mm储存液,分装冻存,避光保存;吸弃培养液,用pbs洗涤2-3次,每次3min,室温下4%多聚甲醛溶液进行固定,时间为30min;加入1
×
尼罗红工作液(1mm储存液:pbs=1:1000),37℃避光孵育5-10min;pbs清洗2-3次,加入dapi染液后进行37℃避光孵育,时间为5-10min,pbs轻柔清洗2-3次,同一曝光时间下,观察红色荧光强度并
拍照记录。
[0092]
如图2c所示,相比epmscs,lpmsc的红色荧光强度较弱;定量分析结果进一步证实lpmscs细胞内甘油三酯含量明显降低,因此,衰老mscs中细胞甘油三酯含量减少,脂质合成能力降低。
[0093]
2.3 rt-qpcr检测scd2 mrna表达水平
[0094]
实时定量荧光pcr方法检测epmscs与lpmscs中scd2 mrna的表达,方法同1.5,引物的序列如下:
[0095]
表6实时定量荧光pcr方法检测引物
[0096][0097][0098]
2.4 western blot检测scd2蛋白表达水平
[0099]
(1)细胞总蛋白提取
[0100]
细胞生长密度至80%以上时胰酶进行消化,完全培养液终止消化并进行吹打,将液体吸入离心管内,并在室温下离心处理5min,转速1200rpm;加入2ml pbs混悬,之后按照比例分别加入pmsf与ripa,使蛋白充分裂解,每10min振荡混匀一次,共3次,确保细胞充分裂解;裂解完全后,并在室温下离心处理25min,转速1200rpm,离心后将上层液体吸入新的1.5ml ep管中;上清即为待测的蛋白样品,可以进行后续蛋白浓度检测或冻存于-80℃。
[0101]
(2)bca法测定蛋白浓度
[0102]
使用96孔板,分别加入0、1、2、4、8、12、16以及20μl 0.5mg/ml的蛋白标准品,孔板中加pbs补齐至20μl;配bca工作液(比例为试剂a/试剂b=50:1),现配现用,每孔加入200μl,然后在无co2条件下,37℃培养箱中孵育30min;将96孔板放在酶标仪上检测,设置波长为562nm,测出的吸光度值,最后根据标准曲线计算出待测样品的总蛋白浓度。
[0103]
(3)蛋白印迹法步骤
[0104]
取30μg蛋白样品、sds蛋白上样缓冲液及pbs,总体系为10-20μl,封口膜封闭后煮沸5-7min;根据蛋白分子量配制8%-12%的分离胶,5%的浓缩胶,选择不同的电压(上层胶80v,下层胶120v)进行电泳;电泳完成后按照面积大小为pvdf膜>滤纸>凝胶准备材料,之后用甲醇进行激活,30sec后看到膜变为半透明即激活;在半干转膜仪上将滤纸-膜-凝胶-滤纸按顺序进行叠放,根据2.5倍pvdf的长宽计算电流,转膜40-50min;之后奶粉封闭1-2h,孵育不同的一抗,一抗稀释比例分别为(scd2 1:500,β-actin 1:2000,runx21:1000),4℃过夜,次日用1
×
tbst洗膜,洗三次共30min;二抗稀释比例为1:3000,室温孵育1-2h后同样用1
×
tbst清洗,洗三次共30min;ecl超敏发光液按1:1比例避光配制,显色结束后观察结果,保存图像为tiff格式。
[0105]
图2d所示为rt-qpcr检测epmscs与lpmscs中scd2 mrna表达水平,结果显示lpmscs中scd2 mrna低于epmscs,表明衰老mscs中scd2 mrna的表达水平降低。
[0106]
图2e所示为western blot检测epmscs与lpmscs中scd2蛋白表达水平,结果显示lpmscs中scd2蛋白表达低于epmscs,说明衰老mscs衰老中scd2的蛋白表达水平降低。
[0107]
实施例3慢病毒感染衰老mscs以获得改良的衰老mscs
[0108]
构建高表达scd2的改良衰老mscs:
[0109]
由上海吉凯基因医学科技股份有限公司构建稳定表达scd2的慢病毒,培养72h后获得实验组lv-scd2,用对照组慢病毒感染相同状态的衰老mscs获得对照组lv-vector;rt-qpcr检测慢病毒感染后实验组中scd2 mrna表达与对照组相比增高的倍数;western blot检测检测慢病毒感染后实验组中scd2蛋白表达与对照组相比增高的倍数。
[0110]
图3a显示scd2慢病毒过表达后,各组mscs均表达绿色荧光蛋白。
[0111]
图3b为rt-qpcr检测结果,与对照组相比,过表达组中scd2的mrna表达量提高约3.5倍。
[0112]
图3c为western blot检测结果,过表达组中scd2的蛋白表达量明显高于对照组,约为2倍。
[0113]
以上结果说明过表达scd2的慢病毒感染衰老mscs后能使scd2稳定高表达。
[0114]
实施例4改良的衰老mscs的衰老及脂质合成水平检测
[0115]
4.1检测过表达scd2对细胞衰老的影响
[0116]
4.1.1sa-β-gal染色检测细胞衰老情况
[0117]
如图4a所示,与对照组相比,lv-scd2组中的蓝染细胞数目明显减少,sa-β-gal阳性率显著下调,说明过表达scd2改善了衰老mscs的衰老情况。
[0118]
4.1.2rt-qpcr检测衰老相关因子的表达
[0119]
如图4b所示,rt-qpcr检测衰老相关因子p16
ink4a mrna的表达;结果显示:与对照组相比,lv-scd2组中p16
ink4a mrna的表达明显降低,说明改良的衰老mscs中衰老相关因子的表达明显下调。
[0120]
4.1.3茜素红染色及western blot检测细胞成骨分化能力
[0121]
如图4c所示,茜素红染色发现,与lv-vector组相比,lv-scd2组中红色的骨基质钙盐沉积明显增多。
[0122]
如图4d所示,western blot结果进一步证实,lv-scd2组中细胞的成骨分化相关蛋白runx2表达显著上调,说明过表达scd2能够促进mscs成骨分化,推测scd2可能通过抑制mscs衰老来改善其成骨分化能力。
[0123]
4.2尼罗红染色检测过表达scd2对细胞脂质合成水平的影响
[0124]
如图4e所示,相比lv-vector组,lv-scd2组中细胞具有较强的红色荧光;定量分析结果进一步证实lv-scd2组中细胞内甘油三酯含量明显增加,因此,过表达scd2能够上调衰老mscs的脂质合成能力,scd2能够通过促进脂质合成来抑制mscs衰老。
[0125]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1