治疗性多价HPVmRNA疫苗及其制备方法与流程
治疗性多价hpv mrna疫苗及其制备方法
技术领域
1.本发明涉及生物制药技术领域,尤其是涉及治疗性多价hpv mrna疫苗及其制备方法。
背景技术:
2.人类乳头瘤病毒(human papillomavirus,hpv)感染是宫颈上皮内瘤变及宫颈癌发生的主要因素,近年来,我国宫颈癌患病率和死亡率逐步上升,并且趋向年轻化。我国现有宫颈癌患者约四十万人,死亡率达11.30%,远高于发达国家5%的死亡概率。其中,50%的宫颈癌与hpv 16感染相关。在我国主要是hpv 16,18,52和58型感染。针对hpv感染引起的宫颈癌,目前有多种疫苗(2阶、4阶、9阶)上市,然后这些疫苗都是预防性疫苗(renjie wang,wei pan,et al.(2020).human papillomavirus vaccine against cervical cancer:opportunity and challenge)。如果人体已经感染hpv,现有疫苗不能阻止潜在的病变或肿瘤发展,因此研发治疗性hpv疫苗是目前hpv研究领域的重点。
3.细胞介导的免疫反应而不是体液免疫对于清除hpv感染和杀伤肿瘤细胞很重要。研究表明,hpv感染的自发清除和hpv持续感染与机体强的细胞介导的免疫反应有关,主要涉及th1型细胞和分别来自cd4+和cd8+t细胞诱导产生细胞毒性t淋巴细胞(gemma hancock,karin hellner et al.,(2017).therapeutic hpv vaccines)。目前hpv治疗性疫苗研究主要包括多肽疫苗、蛋白质疫苗、病毒载体疫苗、dna疫苗等(andrew yang,emily farmer,t.c.wu et al.(2016).perspectives for therapeutic hpv vaccine development)。多肽疫苗是将预测的抗原表位通过化学技术进行合成,直接注射体内以引起抗肿瘤细胞反应。多肽疫苗耐受性、稳定性较好并且易于大规模生产,但是多肽疫苗在不同个体具有mhc-i类限制性,不一定对所有接种过疫苗的人有效。此外,多肽疫苗往往免疫原性较低,并且必须配合其他免疫调节剂一起使用,例如toll样受体(tlr)激动剂,细胞因子和共刺激分子等。蛋白质疫苗具有免疫表位,规避了mhc-i类分子限制性问题,但是主要诱导体液免疫应答而非细胞免疫,每次免疫需要较高的剂量并且需要伴随着佐剂使用,免疫效果较弱。病毒载体疫苗研究的较为详细,它可以诱导良好的细胞免疫和体液免疫效果,并且免疫剂量较小,如图1所示,其中litr/ritr为左/右反向末端重复序列,es为包装信号序列,cmv为启动子序列,crt为钙网蛋白的编码序列,e7为e7蛋白编码序列,(jorge g,gomez-gutierrez et al.,(2007),vaccination with an adenoviral vector expressing calreticulin-human papillomavirus 16 e7 fusion protein eradicates e7 expressing established tumors in mice)。
4.但是,针对病毒载体疫苗预存的免疫反应仍是目前需要克服的困难,另外病毒基因有整合宿主基因组的风险。dna疫苗具有生产简易、成本低,易于保存、不会引起载体免疫反应等优点,可以通过优化载体基因、dna结构和共表达免疫刺激分子等方式产生更好的抗肿瘤细胞效果和中和反应。由于其复杂的免疫方式(如电穿孔、基因枪)常导致免疫接种困难、免疫效力不足,并且dna疫苗还存在整合宿主基因组的风险,因此目前较难应用和推广
(ken lin,barbara ma et al.,(2010),therapeutic hpv dna vaccines)。
5.mrna疫苗平台为第三代疫苗研发技术,该疫苗研发技术具有如下优点:(1)安全性强。mrna并不会感染机体或者整合进基因组,因此不会带来感染或突变的风险。(2)免疫效果较好。通过多种修饰方式和包封使mrna更佳稳定,并且可以诱导产生强烈的体液免疫和细胞免疫应答。(3)生产的便捷性。通过体外转录技术能够快速、大规模生产mrna疫苗,相较于传统疫苗5-6个月或更长的生产周期,可以实现几十天内完成mrna疫苗样品的生产制备,可以更高效地应对突发的传染病疫情。
6.图2给出了现有治疗性hpv mrna疫苗的常用制备思路。首先合成hpv16的致癌基因e6和e7,利用分子克隆技术将其插入真核表达载体pvax1中,构建pvax1-e6e7重组质粒。经单酶切后制备线性化dna,体外转录成包含e6e7的mrna。然后通过阳离子脂质纳米颗粒(lnps)包封制备成mrna疫苗。相同制备方式制备gfp mrna-lnps,通过体外转染,检测报告基因gfp和抗原的表达。小鼠模型免疫实验检测免疫mrna疫苗后,小鼠血清igg抗体、细胞因子tnf-α、ifn-γ、il-4、t细胞亚群和抑制肿瘤生长情况(周茜.2019.hpv16治疗性mrna纳米疫苗的制备及免疫原性研究)。
7.尽管上述方法成功得到mrna疫苗,但是其技术原理是基于dna疫苗设计思路开发的mrna,存在一些不足之处,其质粒序列不包含有完整的5
′
utr和3
′
utr调控序列,并且体外转录过程未使用化学修饰的碱基。研究证实未进行有效修饰处理的mrna会显著影响其在体内的稳定性和翻译效率,导致mrna被机体降解,并且容易诱发机体产生不良的免疫反应,影响最终的免疫治疗效果。另外,技术路线中通过(g3s)4作为linker将e6和e7蛋白实现串联融合表达,容易造成上下游蛋白表达量的差异,从而影响蛋白功能的发挥。
8.鉴于此,特提出本发明。
技术实现要素:
9.本发明的目的在于,充分发挥mrna分子相对于蛋白和dna分子的优势,提供一种mrna分子,使得其能够在体内或体外独立表达多价抗原。经含有该mrna分子的mrna疫苗免疫后,机体能够同时针对多个抗原诱导产生体液和细胞免疫应答,从而获得更优的免疫效果。
10.为了解决上述技术问题,实现上述目的,本发明提供了以下技术方案:
11.第一方面,本发明提供mrna分子,所述mrna分子包括核糖体跳跃元件连接的至少两个编码片段,所述编码片段编码的多肽具有hpv病毒肽表位免疫原性;
12.所述hpv病毒肽表位包括蛋白e1、e2、e4、e5、e6、e7、l1或l2;
13.所述核糖体跳跃元件选自p2a、f2a、t2a、e2a或f2a30;
14.所述核糖体跳跃元件的5
′
端通过连接序列连有弗林蛋白酶样序列,所述弗林蛋白酶样序列编码的短肽中碱性氨基酸所占比例为50%~100%;
15.所述连接序列编码的短肽为(gsg)nap,所述n为1~4。
16.在可选的实施方式中,所述mrna分子的核苷酸序列由5
′
端至3
′
端,包括依次连接的第一抗原编码片段、弗林蛋白酶样序列、连接序列、核糖体跳跃元件和第二抗原编码片段;所述第一抗原编码片段和第二抗原编码片段均独立地编码具有e6或e7免疫原性的多肽,且不相同;所述弗林蛋白酶样序列编码的短肽优选为rmx
nro
,所述m为1~2;x为q、f或h;n
为0~2;o为1~2;所述核糖体跳跃元件优选为f2a。
17.在可选的实施方式中,编码具有e6免疫原性多肽的核苷酸序列如seq_1(优化后的hpv16 e6)所示;
18.编码具有e7免疫原性多肽的核苷酸序列如seq_2(优化后的hpv16 e7)所示;或者,
19.编码具有e6免疫原性多肽的核苷酸序列如seq_3(优化后的hpv18 e6)所示;
20.编码具有e7免疫原性多肽的核苷酸序列如seq_4(优化后的hpv18 e7)所示。
21.第二方面,本发明提供前述实施方式任一项所述mrna分子在制备治疗性mrna疫苗中的应用。
22.第三方面,本发明提供治疗性mrna分子,所述治疗性mrna分子包括依次连接的5
′
utr元件、信号肽元件、前述实施方式任一项所述的mrna分子和3
′
utr元件。
23.在可选的实施方式中,所述5
′
utr元件的核苷酸序列如seq_5~8任一项所示;
24.所述信号肽元件的核苷酸序列如seq_9所示;
25.所述弗林蛋白酶样序列的氨基酸序列如seq_10~14任一项所示;
26.所述连接序列的氨基酸序列如seq_15~18任一项所示;
27.所述3
′
utr元件的核苷酸序列如seq_19~22任一项所示。
28.在可选的实施方式中,所述治疗性mrna分子的尿嘧啶,胞嘧啶或腺嘌呤核苷酸含有修饰基团,所述修饰基团包括假尿苷、n1-甲基假尿苷、n1-乙基假尿苷、5-甲基胞嘧啶、2-硫尿苷、5-甲氧基尿苷或n1-甲基腺苷中至少一种。
29.第四方面,本发明提供治疗性mrna疫苗的制备方法,选择原始质粒构建表达前述实施方式所述治疗性mrna分子的重组质粒,体外转录得到的mrna加cap帽和poly(a)尾后,经脂质纳米颗粒包封得到mrna疫苗。
30.优选地,所述原始质粒选自pvax1、ptnt、pcr2.1-topo或pgem-t。
31.优选地,所述体外转录的反应体系中使用假尿苷三磷酸替换尿苷三磷酸(utp)。
32.优选地,所述脂质纳米颗粒的制备方法包括,d-lin-mc3-dma、dspc、cholesterol和dmg-peg 2000的无水乙醇溶液混合后,加入到柠檬酸盐缓冲液,经脂质体挤出器挤出后得到脂质体纳米颗粒。
33.第五方面,本发明提供前述实施方式所述制备方法得到的重组质粒。
34.第六方面,本发明提供前述实施方式所述制备方法得到的治疗性mrna疫苗。
35.本发明提供的mrna分子利用核糖体跳跃元件对e6和e7基因进行连接能够同时表达hpv的e6和e7双抗原。将其与mrna疫苗其他元件组合得到的治疗性mrna分子,经脂质纳米颗粒包封后,能够在体内和体外成功同时表达hpv的e6和e7双抗原。
36.经过实验验证,本发明提供的mrna疫苗能够有效同时表达e6和e7双抗原蛋白,并且通过lnp包封制备成mrna疫苗免疫小鼠后,可以诱导机体产生较高的血清抗体水平,同时激发机体的th1和th2型细胞免疫应答。因此,本发明基于mrna技术开发的二价治疗性hpv16/18疫苗,在临床应用上具有较高的发展潜力。
附图说明
37.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的
附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
38.图1为现有表达hpv crt/e7抗原的腺病毒载体疫苗构建示意图;
39.图2为现有治疗性hpv mrna疫苗的常用制备方法示意图;
40.图3为本发明具体实施方式中构建的重组质粒的元件组成示意图;
41.图4为本发明具体实施方式中脂质纳米颗粒包封mrna示意图;
42.图5为本发明具体实施方式中小鼠的免疫程序示意图;
43.图6为实验例1中egfp和抗原蛋白e6/e7的表达结果;
44.图7为实验例2制备得到的lnp的透射电镜扫描图;
45.图8为实验例3中hpv16 mrna疫苗体内诱导e6/e7抗体水平;
46.图9为实验例3中hpv18 mrna疫苗体内诱导e6/e7抗体水平;
47.图10为实验例4中hpv16 mrna疫苗诱导产生ifn-γ的检测结果;
48.图11为实验例4中hpv18 mrna疫苗诱导产生细胞免疫反应的检测结果。
具体实施方式
49.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和出示的本发明实施例的组件可以以各种不同的配置来布置和设计。
50.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
51.应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
52.在具体的实施方式中,第一方面,本发明提供mrna分子,所述mrna分子包括核糖体跳跃元件连接的至少两个编码片段,所述编码片段编码的多肽具有hpv病毒肽表位免疫原性;
53.所述hpv病毒肽表位包括蛋白e1、e2、e4、e5、e6、e7、l1或l2;
54.所述核糖体跳跃元件选自p2a、f2a、t2a、e2a或f2a30;
55.所述核糖体跳跃元件的5
′
端通过连接序列连有弗林蛋白酶样序列,所述弗林蛋白酶样序列编码的短肽中碱性氨基酸所占比例为50%~100%;所述连接序列编码的短肽为(gsg)nap,所述n为1~4。
56.在可选的实施方式中,所述mrna分子的核苷酸序列由5
′
端至3
′
端包括依次连接的第一编码片段、弗林蛋白酶样序列、连接序列、核糖体跳跃元件和第二编码片段;所述第一编码片段和第二编码片段均独立地编码具有e6或e7免疫原性的多肽,且不相同;所述弗林蛋白酶样序列编码的短肽优选为rmx
nro
,所述m为1~2;x为q、f或h;n为0~2;o为1~2;所述核糖体跳跃元件优选为f2a。
57.在可选的实施方式中,编码具有e6免疫原性多肽的核苷酸序列如seq_1(优化后的
hpv16 e6)所示;
58.编码具有e7免疫原性多肽的核苷酸序列如seq_2(优化后的hpv16 e7)所示;或者,
59.编码具有e6免疫原性多肽的核苷酸序列如seq_3(优化后的hpv18 e6)所示;
60.编码具有e7免疫原性多肽的核苷酸序列如seq_4(优化后的hpv18 e7)所示。
61.第二方面,本发明提供前述实施方式任一项所述mrna分子在制备治疗性mrna疫苗中的应用。
62.第三方面,本发明提供治疗性mrna分子,所述治疗性mrna分子包括依次连接的5
′
utr元件、信号肽元件、前述实施方式任一项所述的mrna分子和3
′
utr元件。
63.在可选的实施方式中,所述5
′
utr元件的核苷酸序列如seq_5~8任一项所示;
64.所述信号肽元件的核苷酸序列如seq_9所示;
65.所述弗林蛋白酶样序列的氨基酸序列如seq_10~14任一项所示;
66.所述连接序列的氨基酸序列如seq_15~18任一项所示;
67.所述3
′
utr元件的核苷酸序列如seq_19~22任一项所示。
68.在可选的实施方式中,所述治疗性mrna分子的尿嘧啶、胞嘧啶或腺嘌呤核苷酸含有修饰基团,所述修饰基团包括假尿苷、n1-甲基假尿苷、n1-乙基假尿苷、5-甲基胞嘧啶、2-硫尿苷、5-甲氧基尿苷或n1-甲基腺苷中至少一种。
69.第四方面,本发明提供治疗性mrna疫苗的制备方法,选择原始质粒构建表达前述实施方式所述治疗性mrna分子的重组质粒,体外转录得到的mrna加cap帽和poly(a)尾后,经脂质纳米颗粒包封得到mrna疫苗。
70.优选地,所述原始质粒选自pvax1、ptnt、pcr2.1-topo或pgem-t。
71.优选地,所述体外转录的反应体系中使用假尿苷三磷酸替换尿苷三磷酸(utp)。
72.优选地,所述脂质纳米颗粒的制备方法包括,d-lin-mc3-dma、dspc、cholesterol和dmg-peg 2000的无水乙醇溶液混合后,加入到柠檬酸盐缓冲液,经脂质体挤出器挤出后得到脂质体纳米颗粒。
73.第五方面,本发明提供前述实施方式所述制备方法得到的重组质粒。
74.第六方面,本发明提供前述实施方式所述制备方法得到的治疗性mrna疫苗。
75.hpv是一种较小的dna病毒,编码6个早期基因e6,e7,e1,e2,e4,和e5及两个晚期基因l1,l2。其中e6、e7编码两个重要的癌相关蛋白,在感染过程中受到严密调控,在宫颈癌发生中发挥重要作用。研究表明,e6、e7诱导的特异性t细胞免疫可抑制相应肿瘤的生长,同时e6和e7是肿瘤特异性抗原,它们只存在于肿瘤细胞中,而不存在于正常细胞中,因此没有自身免疫的风险。
76.因此,在某次具体的实施方式中,本发明选择e6和e7作为靶抗原示例,所述示例应当理解为本发明的某一次具体的实施方式,而不应理解为限缩。在具体实施方式中,本发明首先分别进行hpv16和hpv18的e6和e7基因序列优化、不同抗原基因经f2a序列进行连接,然后通过体外转录、加帽、加尾和碱基化学修饰成功制备出mrna原液,然后以脂质纳米颗粒(lnp)包裹制备成hpv16/18 mrna疫苗。mrna lnp颗粒理化鉴定以及免疫反应检测结果显示,构建的mrna疫苗颗粒完整度和均一性较好,并且可在体外和体内分别高效地表达e6和e7双抗原。将hpv16/18 mrna疫苗免疫小鼠后,可诱导机体产生针对hpv16和hpv18 e6和e7特异性的抗体水平和较强的细胞免疫反应。
77.具体步骤如下:
78.1、细胞和抗体
79.hek-293t细胞用添加了10%胎牛血清和1%青链酶素的dmem培养基进行培养,抗hpv16/18的e6和e7蛋白的抗体均购自abcam公司。
80.2、质粒构建
81.通过合成mrna表达所需元件5
′
utr、信号肽和3
′
utr基因序列,并且通过分子克隆插入到pok12质粒载体上(5
′
utr-ige-orf-3
′
utr-101a pok12)。以hpv 16/18病毒的e6和e7蛋白序列为基础,通过公司合成以人为宿主进行密码子优化的基因序列,利用特异性引物扩增优化合成的基因序列hpv 16e6e7和hpv18 e6e7,并将扩增序列插入到具有mrna表达元件的pok12质粒上,如图3所示。插入hpv 16/18抗原的pok12质粒转化至大肠杆菌(e.coli dh5α),大量扩大培养后,进行质粒抽提。
82.3、mrna制备
83.使用限制性内切酶切割上述质粒,酶切的线性化产物作为后续体外转录模板。体外转录过程中,将utp完全替换成修饰性核苷酸(假尿苷三磷酸),之后利用neb公司的cap1加帽试剂盒(mrna cap 2
′‑
o-methyltransferase和vaccinia capping system试剂盒)和加尾试剂盒(e.coli poly(a)polymerase)制备mrna分子,最后通过变性琼脂糖凝胶电泳鉴定mrna的完整性以及大小。
84.4、转染hek-293t细胞表达蛋白
85.hek-293t细胞在含10%fbs dmem的完全培养基下培养,将制备好的mrna通过商业化转染试剂盒lipsome2000转染hek-293t细胞,转染12~24小时后收取细胞样品,进行目标蛋白检测,未转染的细胞作为阴性对照(mock组)。
86.5、脂质体纳米颗粒包裹mrna
87.首先用无水乙醇将四种脂质(d-lin-mc3-dma、dspc、cholesterol和dmg-peg 2000)溶解,并以一定的摩尔比例进行混合(d-lin-mc3-dma:dspc:cholesterol:dmg-peg 2000=50:10:38.5:1.5),然后将脂质混合物加入到柠檬酸盐缓冲液中,之后使其通过嵌有80nm聚碳酸酯膜的脂质体挤出器,通过反复挤压得到粒径较为均匀的脂质体纳米颗粒。将制备好的脂质体纳米颗粒和溶于70%柠檬酸的mrna共同置于42℃孵育0.5h,最终得到脂质体包封的mrna疫苗,如图4所示。
88.6、小鼠免疫
89.动物实验经过了受控单位动物委员会的批准。本实验中所使用的balb/c和c57bl/6小鼠均购买合规供应商。小鼠免疫分为三次,在0周、2周和4周分别对小鼠进行肌肉注射hpv16/18-e6e7 mrna疫苗,每只小鼠免疫20μg。第六周杀鼠取脾脏和外周血液,用于细胞内因子染色实验、elispot实验和elisa检测。
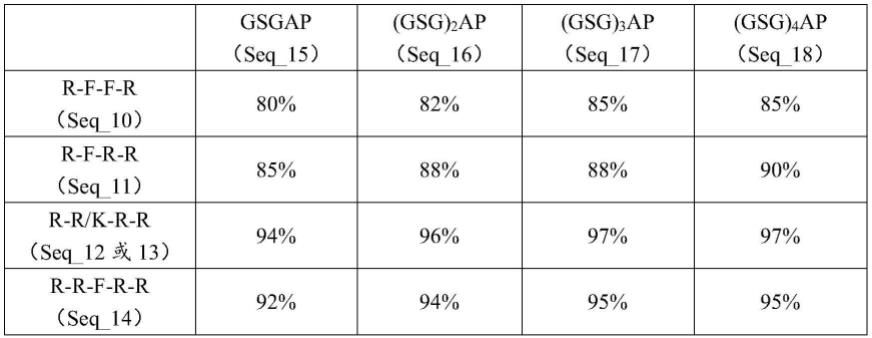
90.7、特异性t细胞检测实验
91.将小鼠的脾脏取出,在无菌培养皿中加入1ml 1640培养基,于40μm细胞筛中研磨,将收集的脾内免疫细胞用红细胞裂解液裂解,之后开始计数。
92.细胞内因子染色实验:向每个流式管中加入4
×
106个脾细胞,之后分别加入不同的刺激物:hpv 16/18的肽库、pma+ionomycin和pbs,其中pma+ionomycin作为阳性对照,pbs作为阴性对照。刺激2h后,加入高尔基体阻断剂,孵育5h后,收集细胞依次进行细胞表面因
子染色(anti-cd3、anti-cd8、anti-cd4、aqua l),以及细胞内因子进行染色(anti-ifn-γ和anti-il-4)。最后利用流式细胞仪检测并分析实验结果。
93.elispot实验:在已包被抗ifn-γ和il-4的elispot 96孔板中,每孔加入1.65
×
106个脾细胞,分别加入不同的刺激物:hpv 16/18的肽库、刀豆蛋白a(concanavalin a,cona)和pbs,其中cona作为阳性对照,pbs作为阴性对照。孵育48h后清洗细胞,用生物素(biotin)标记的ifn-γ和il-4特异性抗体染色,然后加入链霉亲和素(streptavidin)-hrp室温孵育1h,并用bcp/ncip底物显色,最后用ctl仪器进行斑点计数。
94.8、抗体滴度检测实验
95.elisa实验:elisa板分别包被hpv 16/18 e6蛋白和e7蛋白,用5%脱脂奶粉封闭1h后,每孔加入100μl经2倍梯度稀释的8种不同浓度血清,37℃孵育1h,随后加入hrp标记igg二抗孵育1h,最后加入tmb显色液,1m hcl用于终止显色反应,最后置于酶标仪上读取数值。
96.9、统计
97.所有的统计分析均使用graghpadprism5/7执行。特异性的t细胞反应和igg抗体反应数据均是利用two-tailed student
′
s t-test的方法来分析。
98.下面进一步结合附图,对本发明的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
99.实施例1
100.本实施例提供了mrna分子,包括两段编码片段,两段编码片段通过“弗林蛋白酶样序列-连接序列-编码核糖体跳跃元件序列”连接,所述的“弗林蛋白酶样序列-连接序列-编码核糖体跳跃元件序列”的连接方向为5
′‑3′
方向,所述弗林蛋白酶样序列编码的多肽片段为“rqqr”,所述连接序列编码的多肽片段为gsgap,所述核糖体跳跃元件为f2a,所述两段编码片段的核苷酸序列分别如seq_1和seq_2所示。
101.实施例2
102.本实施例与实施例1的区别仅在于,弗林蛋白酶样序列编码的多肽片段为“rqrr”,所述核糖体跳跃元件为t2a。
103.实施例3
104.本实施例与实施例1的区别仅在于,弗林蛋白酶样序列编码的多肽片段为“rrrr”,所述核糖体跳跃元件为e2a,所述连接序列编码的短肽为(gsg)2ap。
105.实施例4
106.本实施例提供了mrna分子,与实施例1的区别仅在于所述两段编码片段的核苷酸序列分别如seq_3和seq_4所示。
107.实施例5
108.本实施例与实施例4的区别仅在于,弗林蛋白酶样序列编码的多肽片段为“rrrr”,所述核糖体跳跃元件为t2a。
109.实施例6
110.本实施例与实施例4的区别仅在于,弗林蛋白酶样序列编码的多肽片段为“rrqrr”,所述核糖体跳跃元件为e2a,所述连接序列编码的短肽为(gsg)4ap。
111.实施例7~12
112.本组实施例分别提供一种治疗性mrna分子,所述治疗性mrna分子包括依次连接的5′
utr元件、信号肽元件、cds序列和3
′
utr元件。实施例7~9中提供的mrna分子分别为实施例1~6中提供的mrna分子。
113.所述5
′
utr元件的核苷酸序列为aaataagagagaaaagaagagtaagaagaaatataagagccacc,如seq_5所示。
114.所述信号肽元件的核苷酸序列为atggactggacctggattctgttcctcgtggccgccgctactcgtgtgcactct,如seq_9所示。
115.所述3
′
utr元件的核苷酸序列为gctggagcctcggtggccatgcttcttgccccttgggcctccccccagcccctcctccccttcctgcacccgtacccccgtggtctttgaataaagtctga,如seq_19所示。
116.实施例13
117.本组实施例分别提供一种治疗性mrna分子,与实施例12的区别在于所述5
′
utr元件的核苷酸序列为gagaataaactagtattcttctggtccccacagactcagagagaacccgccacc,如seq_6所示,所述3
′
utr元件的核苷酸序列为ctcgagctggtactgcatgcacgcaatgctagctgcccctttcccgtcctgggtaccccgagtctcccccgacctcgggtcccaggtatgctcccacctccacctgccccactcaccacctctgctagttccagacacctcccaagcacgcagcaatgcagctcaaaacgcttagcctagccacacccccacgggaaacagcagtgattaacctttagcaataaacgaaagtttaactaagctatactaaccccagggttggtcaatttcgtgccagccacaccctggagctagc,如seq_20所示。
118.实施例14
119.本组实施例分别提供一种治疗性mrna分子,与实施例12的区别在于所述5
′
utr元件的核苷酸序列为gggaaataagagagaaaagaagagtaagaagaaatataagaccccggcgccgccacc,如seq_7所示,所述3
′
utr元件的核苷酸序列为gctggagcctcggtggcctagcttcttgccccttgggcctccccccagcccctcctccccttcctgcacccgtacccccgtggtctttgaataaagtctgagtgggcggc,如seq_21所示。
120.实施例15
121.本组实施例分别提供一种治疗性mrna分子,与实施例12的区别在于所述5
′
utr元件的核苷酸序列为gggcgcgcctagcagtgtcccagccgggttcgtgtcgcc,如seq_8所示,所述3
′
utr元件的核苷酸序列为cctcgccccggacctgccctcccgccaggtgcacccacctgcaataaatgcagcgaagccggga,如seq_22所示。
122.实施例16
123.本实施例在实施例7~15提供的治疗性mrna分子的基础上,进一步添加cap帽和poly(a)尾,所述poly(a)尾的序列为aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa,如seq_23所示。
124.实施例17
125.本实施例与实施例16的区别在于,所述poly(a)尾的序列为aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaatctag,如seq_24所示。
126.实施例18
127.本实施例与实施例16的区别在于,所述poly(a)尾的序列为aaaaaaaaaaaaaaaaaaaaaaaaaaaaaagcatatgactaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaa,如seq_25所示。
128.实施例19
129.本实施例提供了使用实施例16中在实施例9基础上添加cap帽和poly(a)尾得到的治疗性mrna分子制备mrna疫苗的方法,具体步骤如下:
130.首先用无水乙醇将四种脂质(d-lin-mc3-dma、磷脂、胆固醇和dmg-peg 2000)溶解,并以一定的摩尔比例进行混合(d-lin-mc3-dma:dspc:cholesterol:dmg-peg 2000=50:10:38.5:1.5),然后将脂质混合物加入到70%柠檬酸盐缓冲液中,之后使其通过嵌有80nm聚碳酸酯膜的脂质体挤出器,通过反复挤压得到粒径较为均匀的脂质体纳米颗粒;将制备好的脂质体纳米颗粒和溶于70%柠檬酸的mrna共同置于42℃孵育0.5h,最终得到脂质体包封的mrna疫苗。
131.实施例20
132.本实施例与实施例19的区别在于,本实施例使用的实施例16中在实施例11基础上添加cap帽和poly(a)尾得到的治疗性mrna分子。
133.实验例1
134.设计编码hpv16/18-e6e7的mrna-lnp疫苗,分别在体外细胞水平上检测疫苗的可表达性和小鼠体内水平上检测疫苗的免疫原性。构建的mrna疫苗包括hpv16-e6e7,hpv18-e6e7和egfp,结构示意图如1所示。mrna-hpv16-e6e7、mrna-hpv18-e6e7、mrna-egfp分别表达hpv16 e6和e7融合蛋白、hpv18 e6和e7融合蛋白和egfp蛋白,制备的mrna分子均具有很好的完整性。将上述三种mrna分别转染hek-293t细胞,未转染mrna的细胞作为阴性对照(ntc)。结果如图6所示,图6中a显示mrna-egfp同样可以在细胞中高表达。利用western-blot对表达的蛋白进行鉴定,收集转染后12h的细胞,使用hpv16/18e6和e7蛋白特异性抗体进行检测。如图6中b所示,多次western-blot结果显示,hpv 16-e6e7-mrna可以检测出明显的e7蛋白条带,并且表观分子量大小约为30kda(e6e7融合蛋白大小);hpv18-e6e7-mrna也能表达出e6和e7蛋白(图6中c和d);结果表明,这三种mrna均可以在细胞内表达相应的目标蛋白。
135.实验例2
136.用四种脂质成分组建脂质体纳米颗粒,使用无水乙醇将脂质进行溶解,并按照一定比例混合四种脂质,通过装有80nm滤膜的脂质体挤出器使脂质体纳米颗粒均质化,制备完成的mrna-lnp在免疫小鼠前还需要进行透析、超滤浓缩和过滤等步骤。为了验证脂质体纳米颗粒(lnp)是否制备成功,利用透射电镜对lnp进行观察。结果如图7所示,大部分lnp的粒径在80~100nm左右。
137.实验例3
138.hpv16/hpv18 mrna疫苗的免疫反应
139.balb/c或c57bl/6(每组5只)小鼠在第0周、第2周和第4周分别免疫20μg hpv16-e6e7-mrna、hpv18-e6e7-mrna、empty-lnp mrna疫苗,其中empty-lnp mrna为阴性对照,血清和脾细胞在第6周收集。用hpv16/18e6和e7蛋白作为包被抗原进行elisa实验,检测血清igg抗体效价。
140.经过三次免疫,hpv16 mrna疫苗可以诱导产生针对hpv16 e6、e7蛋白特异性抗体,与对照组相比具有统计学显著性差异(图8)。免疫hpv18 mrna疫苗也产生了针对hpv18 e6蛋白水平的特异性igg抗体效价(图9)。以上结果显示免疫hpv16/hpv18 mrna疫苗后都能刺
激小鼠产生特异性体液免疫反应。
141.实验例4
142.采用细胞因子染色和elispot检测hpv16/hpv18 mrna疫苗的t细胞免疫,其中刺激用多肽为hpv16/18的肽库pma,pbs列为对照组。elispot结果显示免疫hpv16-e6e7 mrna疫苗后可诱导产生特异性t淋巴细胞免疫反应(图10)。流式分析结果显示:hpv18 e6蛋白p3单肽和p4单肽混合成的肽库刺激免疫hpv18 mrna疫苗的小鼠cd8+t细胞,可诱导产生大量的ifn-γ分泌(图11中的a)。elispot实验结果证实了以上结果,即用hpv18 e6蛋白的p12到p17的混合肽库刺激免疫hpv18 mrna疫苗小鼠的脾细胞,可诱导产生大量的ifn-γ和il-4分泌(图11中的b)。以上结果显示免疫hpv16/hpv18 mrna疫苗后都能刺激小鼠产生特异性细胞免疫应答。
143.综上,由上述实验例可以看出,将mrna原液用lnp进行包封制备成mrna疫苗,通过肌肉注射免疫小鼠后测定血清抗体滴度。elisa检测结果显示免疫hpv16-e6e7 mrna疫苗后,可以诱导机体产生高水平的e6和e7抗体,随着免疫后时间延长e6和e7抗体水平逐渐升高,并且显著高于对照组(lnp)。同时,免疫hpv18-e6e7 mrna疫苗后诱导产生的e6抗体水平逐渐升高,在第2次加强免疫后产生的血清igg抗体效价最高达到104.5,显著高于空白对照组。
144.t淋巴细胞被免疫激活后,cd4+t淋巴细胞分化为th1和th2细胞。ifn-γ是th1细胞的标志性细胞因子,可以激活巨噬细胞,并抑制病毒复制,具有抗病毒作用,同时诱导mhc
‑ⅰ
分子的上调,辅助性ctl杀伤肿瘤细胞。本研究通过细胞内因子染色技术,利用hpv e6/e7肽库对免疫hpv16/hpv18 mrna疫苗小鼠脾脏中的t淋巴细胞刺激后,进行细胞因子检测,elispot结果显示多次免疫后诱导产生ifn-γ的斑点数约125,表明hpv16-e6e7 mrna可诱导产生良好的th1细胞免疫应答。同时,还可以诱导小鼠机体分泌高水平的ifn-γ,诱导产生ifn-γ的斑点数约900,极显著高于对照组疫苗组。以上结果表明,hpv16/hpv18 mrna疫苗可以诱导产生强烈的th1细胞免疫应答。il-4是th2细胞分泌的细胞因子,可以刺激活化b淋巴细胞和t淋巴细胞增殖,诱导产生体液免疫反应。通过elispot对其分泌的il-4进行检测,结果显示产生il-4的斑点数约250,显著高于对照免疫组,表明可以诱导产生良好th2型细胞免疫应答。通过比较发现hpv18-e6e7 mrna主要诱导更强烈的th1型细胞免疫,这表明激活以杀伤肿瘤细胞的ctl免疫应答为主。另一方面,cd8+t细胞介导细胞免疫具有抗肿瘤的重要作用,利用流式细胞仪对免疫hpv18-e6e7 mrna疫苗小鼠脾脏cd8+t细胞进行检测,结果显示分泌ifn-γ+t细胞数所占cd8+t细胞数百分比为2%,高于克劳斯等研发的hpv病毒载体疫苗(约0.5%),(克劳斯
·
奥尔林格.(2016).hpv疫苗.申请公开号cn 107921117 a)说明免疫hpv18-e6e7 mrna疫苗诱导小鼠产生ifn-γ的cd8+t淋巴细胞数目较多,可以诱导产生强烈的t淋巴细胞免疫应答。总之,hpv16/18-e6e7 mrna可以有效同时表达双抗原蛋白e6和e7,并且通过lnp包封制备成mrna疫苗免疫小鼠后,可以诱导产生较高的血清抗体水平,同时激发机体产生较强的th1和th2型细胞免疫应答反应。因此,本发明基于mrna技术开发二价治疗性hpv16/18疫苗及在临床应用上具有重要的发展潜力。
145.实验例5
146.本实验例在实施例1的基础上,对连接序列和弗林蛋白酶样序列的不同序列组合情况下,不同弗林蛋白酶样序列和剪切增强序列的酶切效率进行对比,具体方法如下:
147.将编码不同长度连接序列和弗林蛋白酶样序列的mrna通过lipsome2000转染hek-293t细胞,转染48h后,分别提取细胞上清和细胞中的总蛋白,然后通过sds-page进行蛋白电泳分离总蛋白。将分离的蛋白通过western-blot实验进行检测,分别用e6和e7蛋白抗体进行孵育,然后加入hpr标记的二抗进行检测,分析不同蛋白大小和特性。通过计算,酶切效率=酶切形式/(酶切形式+未酶切形式),分析不同连接序列和裂解位点组合的不同剪切效率。
148.结果如下:
[0149][0150]
注:纵坐标为不同碱性(r/k)氨基酸比例或排列的弗林蛋白酶样序列;横坐标为不同长度的连接序列(gsg)n形式;上下游抗原蛋白在细胞内的剪切效率用百分比表示。将其中氨基酸f替换成q或h具有相似的检测结果。
[0151]
由上表可以看出,(gsg)nap中(gsg)数量变化和弗林蛋白酶样序列中碱性氨基酸序列比例和排列会产生不同的剪切效率,进而影响上下游抗原蛋白的表达情况。弗林蛋白酶样序列中碱性氨基酸的比例和排列包括,r-x-x-r、r-x-r-r、r-r/k-r-r、r-r-x-r-r等,其中x可以为f、q或者h。其中碱性氨基酸比例可以是50%~100%。
[0152]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1