一种基于脂质的蛋白降解工具、应用及其制备方法
1.本发明属于靶向药物技术领域,尤其涉及一种基于脂质的蛋白降解工具、应用及其制备方法。
背景技术:
2.靶向蛋白降解工具(tpd,targeted protein degradation)是特异性地将感兴趣的蛋白质(poi,protein of interest)劫持到细胞内蛋白质回收站,以实现靶向蛋白质降解。tpd已成为生物医学研究和制药行业的强大工具。
3.与传统的酶抑制/拮抗小分子药物相比,蛋白水解靶向嵌合体(protac)作为最具代表性的第一代tpd的代表成员,能够靶向降解传统难以成药的靶点,但是靶点仅限胞内蛋白。胞外蛋白和膜蛋白在疾病发生发展中扮演重要角色,基因编码的总蛋白中约40%是非胞内蛋白。为了将降解目标蛋白的范围扩大到细胞质之外,前期有研究团队开发了靶向溶酶体的嵌合体(lytac),通过阳离子磷酸寡甘露糖尾连接抗体/多肽,借助甘露糖-6-磷酸受体发挥内吞进入溶酶体降解。随后,该团队利用肝细胞富含去唾液酸糖蛋白受体(asgpr)的特性,将lytac磷酸甘露糖更换为三半乳糖结构,进而升级为肝脏特异性lytac,lytac方法虽然具有应用潜力,但合成方法复杂。lytac是受体依赖的,需要在lytac结构上特殊设计,帮助蛋白复合物进入细胞,同时针对不同的细胞靶向,需要将尾巴进行更换,因此在设计和合成方面工作繁琐而困难。
4.目前公认的tpd的成功开发,需要设计
①
合适的靶蛋白识别基团
②
劫持蛋白进入细胞和胞内运输的受体-配体匹配对,
③
启动适当的蛋白质降解机制,
④
从成药角度需要针对细胞类型特异性设计靶向能力和生物屏障穿透能力。然而,包括protac、lytac等类似的主流tpd工具,在针对任何新poi开发工具时,都需要费力的个案设计,其中不乏需要从头合成化合物并大量筛选的过程,才能用于不同的疾病和细胞类型。
5.综上,现有的靶向蛋白降解工具存在设计和合成方法复杂、需要针对每一个案疾病和细胞类型独立设计,灵活性差,不便于改造,不便于体内靶向递送,不具有血脑屏障等生物屏障穿越能力的缺陷,为针对患者的靶向治疗方式带来了巨大的不便。
技术实现要素:
6.为解决上述问题,本发明提供一种基于脂质的蛋白降解工具,包括:
7.poi识别基团,以及与所述poi识别基团连接的脂质杂化物质;
8.其中,所述poi识别基团包括能与poi特异性结合的抗体、蛋白、多肽、核酸适配体或小分子;
9.所述脂质杂化物质包括脂质体、外泌体、细胞膜以及lnp。
10.优选地,在所述poi识别基团与所述脂质杂化物质偶联时,所述基于脂质的蛋白降解工具是由所述脂质杂化物质处于核心,以所述poi识别基团设于外围组成的用于蛋白降解的纳米颗粒。
11.优选地,所述基于脂质的蛋白降解工具还包括,在所述poi识别基团与所述脂质杂化物质之间设有连接构件的所述基于脂质的蛋白降解工具;
12.优选地,所述连接构件的分子量为0-1000kda;
13.所述连接构件为聚合物连接臂和脂质连接臂中的一种;
14.优选地,所述聚合物连接臂包括亲水聚合物、疏水聚合物和两亲性聚合物;
15.优选地,所述脂质连接臂为两亲性的脂质连接臂。
16.优选地,在所述poi识别基团通过所述连接构件与所述脂质杂化物质偶联时,所述poi识别基团与所述连接构件构成一组连接单元;所述基于脂质的蛋白降解工具是由所述脂质杂化物质设于核心处,以与所述脂质杂化物质连接的多组所述连接构件设于中间层,并且由与所述连接构件连接的所述poi识别基团设于外围的多组连接单元组成的具有多层结构的所述基于脂质的蛋白降解工具。
17.优选地,所述脂质连接臂中至少包括两端,一端为能与所述脂质杂化物质相连接的亲脂末端,另一端为亲水末端;
18.优选地,亲脂末端为脂质分子。
19.优选地,所述两亲性聚合物为链状/支化分子结构的聚合物,其至少存在一个具有亲水性的分子端,以及一个具有疏水性的分子端;
20.优选地,所述两亲性聚合物为直链分子结构,其一端为亲水性的分子端,另一端为具有疏水性的分子端。
21.优选地,还包括纳米颗粒,其中,所述纳米颗粒被所述脂质杂化物质包覆于所述基于脂质的蛋白降解工具的核心处;
22.所述纳米颗粒包括亲水性颗粒、疏水性颗粒和无机纳米颗粒;
23.优选地,所述纳米颗粒的粒径为5-1000nm。
24.此外,为解决上述问题,本发明还提供一种如上述所述基于脂质的蛋白降解工具,在制备治疗和预防有害蛋白异常积累疾病的药物及递送系统中的应用;其中,所述有害蛋白异常积累疾病包括肿瘤、免疫系统疾病、神经退行性疾病、血液系统疾病和代谢类疾病。
25.此外,为解决上述问题,本发明还提供一种如上述所述基于脂质的蛋白降解工具,在制备针对有害蛋白异常积累疾病的检测产品/试剂盒中的应用;其中,所述有害蛋白异常积累疾病包括肿瘤、免疫系统疾病、神经退行性疾病、血液系统疾病和代谢类疾病。
26.此外,为解决上述问题,本发明还提供一种如上述所述基于脂质的蛋白降解工具的制备方法,在所述基于脂质的蛋白降解工具为所述poi识别基团与所述脂质杂化物质偶联的蛋白降解工具时,其制备方法为:将所述poi识别基团通过非共价键合到所述脂质杂化物质上;或者,将所述poi识别基团基于偶联基团通过共价键合到所述脂质杂化物质上,从而构成所述基于脂质的蛋白降解工具。
27.优选地,所述基于脂质的蛋白降解工具还包括所述poi识别基团通过连接构件与所述脂质杂化物质连接的蛋白降解工具;
28.其中,在所述基于脂质的蛋白降解工具为所述poi识别基团通过所述连接构件与所述脂质杂化物质连接的蛋白降解工具时,其制备方法为:
29.先将所述poi识别基团与所述连接构件偶联,构成偶联中间体;然后将所述偶联中间体连接到所述脂质杂化物质上,构成所述基于脂质的蛋白降解工具;
30.或者,先构建由所述连接构件作为外层且由所述脂质杂化物质作为核心的纳米复合结构;再将所述poi识别基团与所述纳米复合结构偶联,构成所述基于脂质的蛋白降解工具。
31.本发明提供一种基于脂质的蛋白降解工具、应用及其制备方法,其中所述基于脂质的蛋白降解工具包括:poi识别基团,以及与所述poi识别基团连接的脂质杂化物质;其中,所述poi识别基团包括能与poi特异性结合的抗体、蛋白、多肽、核酸适配体或小分子;所述脂质杂化物质包括脂质体、外泌体、细胞膜以及lnp。
32.本发明通过将poi识别基团修饰于脂质杂化物质的表面,并且,poi识别基团组装后暴露于脂质杂化物质的外部,实现了基于脂质杂化物质的靶蛋白降解,使得构建蛋白降解工具的合成难度极大降低,通过“即插即用”模式,使得海量与靶蛋白具有结合力的化合物、多肽、抗体和核酸适配体等能够升级成为蛋白降解类药物,进而在传统脂质体(liposome)、脂质纳米颗粒(lnp)相关领域,如mrna疫苗、核酸递送载体、药物递送中发挥新的功能,从而实现在科研和工业应用中进行联合疗法开发。
33.此外,配体靶向的脂质类纳米颗粒(脂质杂化物质)作为蛋白降解工具的应用和其机制的探索尚属空白,该发明大大扩展了目前脂质类纳米颗粒的应用范围,并为tpd和纳米递送领域提供了基础知识,并且原则上可以在体内降解多种人类疾病相关的细胞外/膜相关/细胞内蛋白。
附图说明
34.图1为本发明poi识别基团与脂质杂化物质偶联的结构示意图;
35.图2为本发明含有连接构件的poi识别基团与脂质杂化物质偶联的结构示意图;
36.图3为本发明含有连接构件-脂质连接臂的poi识别基团与脂质杂化物质连接的结构示意图;
37.图4为本发明实施例1中ntz-peglipo合成结构示意图;
38.图5为本发明实施例1中ntz-peglipo在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
39.图6为本发明实施例2中ntz-lipo1、ntz-lipo2、ine-lipo、palb-lipo、av45-lipo合成示意图;
40.图7为本发明实施例2中不同浓度ntz-lipo1在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
41.图8为本发明实施例2中不同脂质杂化物质组成比例的ntz-lipo1在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
42.图9为本发明实施例2中ntz-lipo2在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
43.图10为本发明实施例2中ine-lipo在m231细胞中对靶蛋白her2降解效果的蛋白电泳结果;
44.图11为本发明实施例2中palb-lipo所用脂质连接臂与poi识别基团偶联后的氢谱核磁共振结果;
45.图12为本发明实施例2中av45-lipo所用脂质连接臂与poi识别基团偶联后的氢谱
核磁共振结果;
46.图13为本发明实施例2中不同浓度palb-lipo在m231细胞中对靶蛋白cdk4降解效果的蛋白电泳结果;
47.图14为本发明实施例2中av45-lipo结构示意图;
48.图15为本发明实施例2中av45-lipo与β-amyloid(aβ)寡聚体共孵育在人胶质细胞培养基中,随后pbs洗涤后共聚焦显微镜检测细胞溶酶体标记、荧光染料fitc标记的aβ和av45自发荧光的结果图;
49.图16为本发明实施例3中ntz-lnp1、ntz-lnp1s、ntz-lnp2的结构示意图;
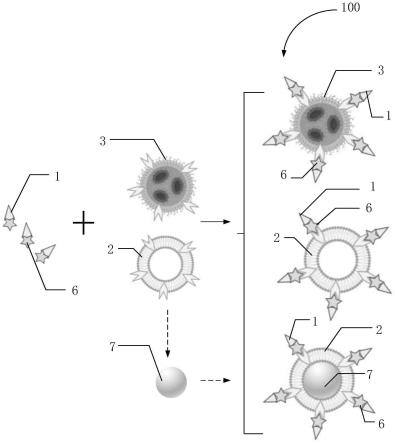
50.图17为本发明实施例3中ntz-lnp1、ntz-lnp1s、ntz-lnp2动态光散射(dls)粒径分布图结果;
51.图18为本发明实施例3中ntz-lnp1以及实施例2中ntz-lipo1在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
52.图19为本发明实施例3中ntz-lnp1s在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
53.图20为本发明实施例3中ntz-lnp2在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
54.图21为本发明实施例4中ntz-exo的dls粒径分布和平均分散系数pdi图;
55.图22为本发明实施例4中ntz-exo在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
56.图23为本发明实施例5中ntz-lipop结构示意图;
57.图24为本发明实施例5中不同浓度ntz-lipop在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果;
58.图25为本发明实施例5中ctx-rbcmd结构示意图;
59.图26为本发明实施例5中ctx-rbcmd的dls粒径分布结果图;
60.图27为本发明实施例5中ctx-rbcmd在m231细胞中对靶蛋白egfr降解效果的蛋白电泳结果。
61.附图标记:
62.100,基于脂质的蛋白降解工具;1,poi识别基团;2,脂质杂化物质中的脂质体、外泌体或细胞膜;3,脂质杂化物质中的lnp;4,脂质连接臂;5,聚合物连接臂;6,偶联基团;7,纳米颗粒。
63.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
64.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
65.除非在下文中另有定义,本发明具体实施方式中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。虽然相信以下术语对于本领域技术人员
很好理解,但仍然阐述以下定义以更好地解释本发明。
66.如本发明中所使用,术语“包括”、“包含”、“具有”、“含有”或“涉及”为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步骤。术语“由
…
组成”被认为是术语“包含”的优选实施方案。如果在下文中某一组被定义为包含至少一定数目的实施方案,这也应被理解为揭示了一个优选地仅由这些实施方案组成的组。
67.在提及单数形式名词时使用的不定冠词或定冠词例如“一个”或“一种”,“所述”,包括该名词的复数形式。
68.本发明中的术语“大约”表示本领域技术人员能够理解的仍可保证论及特征的技术效果的准确度区间。该术语通常表示偏离指示数值的
±
10%,优选
±
5%。
69.此外,说明书和权利要求书中的术语第一、第二、第三、(a)、(b)、(c)以及诸如此类,是用于区分相似的元素,不是描述顺序或时间次序必须的。应理解,如此应用的术语在适当的环境下可互换,并且本发明描述的实施方案能以不同于本发明描述或举例说明的其它顺序实施。
70.以下仅仅是为了帮助理解本发明而提供。这些定义不应被理解为具有小于本领域技术人员所理解的范围。
71.下面结合具体实施例的方式对本发明的技术方案做进一步的详细说明,但并不构成对本发明的任何限制,任何人在本发明权利要求范围内所做的有限次的修改,仍在本发明的权利要求范围之内。
72.参考图1,本实施例提供一种基于脂质的蛋白降解工具,包括:
73.poi识别基团,以及与所述poi识别基团连接的脂质杂化物质;
74.其中,所述poi识别基团包括能与poi特异性结合的抗体、蛋白、多肽、核酸适配体或小分子;
75.所述脂质杂化物质包括脂质体、外泌体、细胞膜以及lnp。
76.上述,poi识别基团,是能和poi特异性结合的抗体、蛋白、多肽或小分子。
77.上述,脂质杂化物质,包括脂质体(liposome)、外泌体、细胞膜以及lnp。其中,lnp,即为脂质纳米颗粒(lipid nanoparticle)。
78.需要说明的是,脂质类纳米颗粒,主要用于药物体内递送,从传统脂质体(liposome)到脂质纳米颗粒(lnp,lipid nanoparticle),已经在小分子药物递送、核酸类药物递送、纳米疫苗等领域被广泛应用于医疗。其中covid-19的mrna疫苗多由lnp组成。
79.脂质类纳米颗粒具有成本低廉便于制备的优点,其组成规律也被研究较为清楚,用于医疗和药物开发的脂质类纳米颗粒拥有一套较为规律的组成,最基本的为膜骨架和胆固醇辅料。临床在用的脂质类纳米颗粒,根据需要也可以添加其他组分,可以包括但不限于如下组分:
80.1、膜骨架,组成脂质双分子层膜的主要成分。
81.2、辅助辅料:(1)胆固醇(cholesterol),调节膜流动性,提高粒子稳定性,(2)辅助磷脂,维持脂质体微观形态,使溶酶体膜不稳定。
82.3、peg化脂质,减少粒子在体内与血浆蛋白的结合,延长体循环时间。
83.4、阳离子脂质,高效包载核酸药物,提供正电荷,体内转染,ph敏感(可电离型)。
84.5、稳定剂,具有冻干保护作用,维持脂质体在冻干过程中的结构稳定。
85.上述,脂质杂化物质包括脂质体、外泌体、细胞膜、lnp、lpp以及脂质纳米乳。其中,脂质体(liposome),也称为经典脂质体,其形态为空泡状,其主要用于载疏水药物。由于脂质体作为一种两亲性膜,疏水空泡里可以载疏水药物,亲水空泡中,可以载亲水药物。而lnp,为脂质纳米颗粒,其内部含有阳离子脂质,目前mrna疫苗和一些核酸类疫苗就是用的lnp,因核酸带负电,阳离子脂质带正电,可以能够有效提高包载效率,lnp也被用于crispr基因编辑元件的递送。而传统脂质体lipo载核酸效率低,一般是载疏水、亲水小分子药物。lpp因包含了聚合物核心获得了脂质和聚合物分别的特性,具有更好的载药兼容性和稳定性。
86.此外,lnp和lpp还具有便于被修饰和改造的优点,通过两亲性peg化脂质和类似的结构,极易容易对脂质体、lnp进行修饰,peg化脂质可以通过peg末端连接配体(ligands)用于和受体结合,可能促进药物对靶器官的递送,也被称为主动靶向的脂质类纳米载体。
87.脂质杂化物质便于载药,包括亲疏水性小分子药物、核酸类药物、蛋白类药物、基因编辑载体等生物技术类药物均可以被有效装载和递送。但其应用仍然集中在药物递送,其结构本身具有的生理、病理性质,仍需被进一步探索,更多的治疗潜力和可能性值得被探索。
88.总之,本实施例通过将poi识别基团修饰于脂质杂化物质的表面,并且,poi识别基团组装后暴露于脂质杂化物质的外部,实现了基于脂质杂化物质的靶蛋白降解,使得构建蛋白降解工具的合成难度极大降低,通过“即插即用”模式,使得海量与靶蛋白具有结合力的化合物、多肽、抗体和核酸适配体等能够升级成为蛋白降解类药物,进而在传统脂质体(liposome)、脂质纳米颗粒(lnp)相关领域,如mrna疫苗、核酸递送载体、药物递送中发挥新的功能,从而实现在科研和工业应用中进行联合疗法开发。
89.此外,配体靶向的脂质类纳米颗粒(脂质杂化物质)作为蛋白降解工具的应用和其机制的探索尚属空白,该发明大大扩展了目前脂质类纳米颗粒的应用范围,并为tpd和纳米递送领域提供了基础知识,并且原则上可以在体内降解多种人类疾病相关的细胞外/膜相关/细胞内蛋白。
90.进一步的,在所述poi识别基团与所述脂质杂化物质偶联时,所述基于脂质的蛋白降解工具是由所述脂质杂化物质处于核心,以所述poi识别基团设于外围组成的用于蛋白降解的纳米颗粒。
91.上述,表明了基于脂质的蛋白降解工具的结构,其中,整体可以为颗粒状的结构,包括核心处和外围,核心部分可以为一个脂质杂化物质,外围为多个与脂质杂化物质连接的poi识别基团,即在脂质杂化物质的外表面有一层与之连接的众多poi识别基团,从而构成了整体的基于脂质的蛋白降解工具。
92.此外,根据脂质杂化物质的形态,其原则上,如果为经典脂质体,其形态为空泡状。
93.进一步的,参考图2,所述基于脂质的蛋白降解工具还可包括一种,在所述poi识别基团与所述脂质杂化物质之间设有连接构件的所述基于脂质的蛋白降解工具。
94.优选地,所述连接构件的分子量为0-1000kda;
95.所述连接构件为聚合物连接臂和脂质连接臂中的一种;其中,含有脂质连接臂的基于脂质的蛋白降解工具结构参考图3所示。
96.优选地,所述聚合物连接臂包括亲水聚合物、疏水聚合物和两亲性聚合物。
97.优选地,所述脂质连接臂为两亲性的脂质连接臂。
98.上述,提供了另外一种基于脂质的蛋白降解工具的结构,与基本结构相类似的,在脂质杂化物质和poi识别基团之间,还设有连接构件。构成了“脂质杂化物质-连接构件-poi识别基团”的依次连接的组合,其中连接构件上设有能与poi识别基团连接的偶联基团,从而能够实现两者的组合。
99.进一步的,在所述poi识别基团通过所述连接构件与所述脂质杂化物质偶联时,所述poi识别基团与所述连接构件构成一组连接单元;所述基于脂质的蛋白降解工具是由所述脂质杂化物质设于核心处,以与所述脂质杂化物质连接的多组所述连接构件设于中间层,并且由与所述连接构件连接的所述poi识别基团设于外围的多组连接单元组成的具有多层结构的所述基于脂质的蛋白降解工具。
100.上述,表明了此种情况下该基于脂质的蛋白降解工具在空间上的结构,其核心处为一个脂质杂化物质(核心),其表层连接有多个连接构件(中间层),并且每个连接构件均连接有一脂质杂化物质(外围),构成了内外三层的颗粒状的结构,其整体理论上可以为球形,也可以为其他形状。
101.进一步的,所述连接构件的分子量为0-1000kda。
102.所述连接构件为聚合物连接臂和脂质连接臂中的一种。
103.优选地,所述聚合物连接臂包括亲水聚合物、疏水聚合物和两亲性聚合物。
104.表1、聚合物连接臂的三种结构形式
[0105][0106]
优选地,所述脂质连接臂为两亲性的脂质连接臂。
[0107]
上述,限定了连接构件的特征,其分为两大种,包括:聚合物连接臂和脂质连接臂,可以根据物质的合成需要、水溶性需要而为任意一种,并且,质连接臂为两亲性的脂质连接臂。
[0108]
上述,亲水聚合物,可以包括但不限于:聚乙二醇(peg)、聚环氧乙烷(peo)、聚(乙二醇)甲基丙烯酸酯(poeg)、聚2-甲基丙烯酰氧基乙基磷酰(pmpc)、聚羧酸甜菜碱(pcb)、葡聚糖、透明质酸、壳聚糖、β-环糊精、超支化聚缩水甘油醚(hpg)、聚n-(2-羟丙基)甲基丙烯酰胺(phpma)、聚甲基丙烯酸羟乙酯(phema)、聚丙烯酰胺(pam)、聚乙烯吡咯烷酮(pvp)、聚丙烯酸(paa)、聚马来酸酐(hpma)、聚季胺盐及其药学上可接受的聚合物盐、聚乙烯亚胺(pei)、聚甲基丙烯酸n,n-二甲基氨基乙酯(pdmaema)、聚赖氨酸(pll)、聚谷氨酸(pgu)及聚天冬氨酸(pasp)等各类亲水性聚氨基酸及上述聚合物的衍生物及其药学上可接受的盐。
[0109]
疏水聚合物可以包括:聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚己内酯(pcl)、聚碳酸酯(pmc)及其衍生物、乙交酯/丙交酯/己内酯/碳酸酯各类组合及组分的共聚物、聚氨酯(pu)、聚醚醚酮(peek)、聚甲基丙烯酸甲酯(pmma)、聚乙烯醇(pva)、聚乙烯(pe)、聚苯丙氨酸等各类疏水聚氨基酸及上述聚合物的衍生物及其药学上可接受的盐。
[0110]
两亲性聚合物包括:peg-plga、peg-pcl、peg-pla、peg-pmc,及上述亲水聚合物和疏水聚合物组合的各种两亲性嵌段聚合物及衍生物,以及上述亲水聚合物与疏水分子(如
脂质)组成的各种两亲性聚合物及衍生物。
[0111]
进一步的,所述脂质连接臂中至少包括两端,一端为能与所述脂质杂化物质相连接的亲脂末端,另一端为亲水末端;
[0112]
优选地,亲脂末端为脂质分子。
[0113]
在连接构件为脂质连接臂时,其结构上可以包括多个端的结构,但其中至少有两端,亲脂末端(与脂质杂化物质连接)和亲水末端,并且亲至末端为脂质分子。
[0114]
脂质分子包括:脂肪酸类(fatty acids),甘油脂类(glycerolipids),甘油磷脂类(glycerophospholipids),鞘脂类(sphingolipids),固醇脂类(sterol lipids),孕烯醇酮脂类(prenol lipids),糖脂类(saccharolipids),多聚乙烯类(polyketides),阳离子脂质(cationic lipids)和可电离脂质(ionizable lipids)。
[0115]
进一步的,所述脂质分子,可以为dspe(二硬脂酰基磷脂酰乙醇胺)、二硬脂酰磷脂酰胆碱(dspc)、1,2-二肉豆蔻酸甘油酯(dmg,1,2-dimyristoyl-sn-glycerol)、1,2-双棕榈酸甘油酯(dpg,1,2-dipalmitoyl-sn-glycerol)、1,2-双棕榈酸甘油酯(dpyg,1,2-diphytanoyl-sn-glycerol)、二酰基甘油(dag);甘油三酯(tag),1,2-双棕榈酸甘油酯(dpg),1,1'-[(1r)-1-(羟基甲基)-1,2-乙二基]十八烷酸酯(dsg),二花生酰基磷脂酰胆碱(dapc),1-棕榈酰-2-月桂酰-sn-甘油-3-磷酸胆碱(dlpc),二肉豆蔻酰磷脂酰胆碱(dmpc),1,2-二油酰基卵磷脂(dopc),二棕榈酸磷脂酰胆碱(dppc),1,2-二棕榈酰-sn-甘油-3-乙基磷酸胆碱(dpepc),磷脂酰胆碱(pc),磷脂酰乙醇胺(pe),磷脂酰甘油(pg),磷脂酰丝氨酸(ps),磷脂酰肌醇(pi);神经酰胺(cer),鞘磷脂(sm),胆固醇(cho),胆固醇酯(ce),1,2-二豆蔻酰-sn-甘油-3-磷酸(dmpa),二月桂酰基磷脂酸(dlpa),磷酸胆碱(phosphocholine),溴化三甲基-2,3-二油酰氧基丙基铵(dotap),可电离脂质包括dlin-mc3-dma、a6、of-02、a18-iso5-2dc18、98
n12-5、9a1p9、c12-200、ckk-e12、7c1、g0-c14、l319、304o
13
、of-deg-lin、306-ob12、306-o
i10
和ftt5,及前述脂质分子衍生物和其药学上可接受的盐。所述peg脂质可以为peg及peg衍生物与前述脂质的偶联物。
[0116]
优选的,脂质分子可以为peg化脂质,其中,peg相对分子量为2000,peg化脂质可以包括:peg-dspe(聚乙二醇-二硬脂酰基磷脂酰乙醇胺)、peg-dmg(聚乙二醇-二肉豆蔻酸甘油酯)、前述脂质分子和peg的偶联物及其药学上可接受的盐。所述peg包括peg和peg末端为甲氧基或其他基团的peg。
[0117]
进一步的,所述两亲性聚合物为链状/支化分子结构的聚合物,其至少存在一个具有亲水性的分子端,以及一个具有疏水性的分子端;
[0118]
上述,限定了两亲性聚合物的结构为链状/支化分子结构,因为其链状/支化分子结构的特性,因此可以具有多个分支,多条链,但其具有至少两个端,一个为具有亲水性的分子端,一个为具有疏水性的分子端。
[0119]
优选地,所述两亲性聚合物为直链分子结构,其一端为亲水性的分子端,另一端为具有疏水性的分子端。
[0120]
上述,进一步限定两亲性聚合物为直链分子结构。
[0121]
优选地,还包括纳米颗粒,其中,所述纳米颗粒被所述脂质杂化物质包覆于所述基于脂质的蛋白降解工具的核心处;
[0122]
所述纳米颗粒包括亲水性颗粒、疏水性颗粒和无机纳米颗粒;
[0123]
优选地,所述纳米颗粒的粒径为5-1000nm。
[0124]
在另一种实施方试中,提供了一种特殊结构,即为纳米颗粒在核心处,脂质杂化物质包裹了纳米颗粒,构成复合结构。
[0125]
因此,基于脂质的蛋白降解工具可以包括如下几种形态结构:
[0126]
表2、基于脂质的蛋白降解工具的形态结构
[0127][0128]
此外,在另一种实施方式中,提供了一种特殊结构,即为纳米颗粒在核心处,脂质杂化物质包覆于纳米颗粒,构成复合结构,
[0129]
其中,所述纳米颗粒被所述脂质杂化物质包覆于所述基于脂质的蛋白降解工具的核心处;
[0130]
所述纳米颗粒(被包覆于脂质杂化物质中核心处的纳米颗粒)包括:
[0131]
(1)亲水性颗粒,可以为,树枝状聚合物、超支化聚合物、以及权利4所要求的亲水聚合物及其衍生物组成的各种纳米凝胶、以及纳米白蛋白。
[0132]
(2)疏水性颗粒,可以为,聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚己内酯(pcl)、聚碳酸酯(pmc)及其衍生物、乙交酯/丙交酯/己内酯/碳酸酯各类组合及组分的共聚物、聚氨酯(pu)、聚醚醚酮(peek)、聚甲基丙烯酸甲酯(pmma)、聚乙烯醇(pva)、聚乙烯(pe)、聚苯丙氨酸等各类疏水聚氨基酸及其衍生物制备的纳米颗粒。
[0133]
(3)无机纳米颗粒,可以为,金纳米颗粒、碳纳米颗粒、硅纳米颗粒、氧化铁纳米颗粒、磷酸钙纳米颗粒、硫酸钡和碘化物造影剂、氮化铝纳米颗粒、氧化铝纳米颗粒、氧化钛纳米颗粒、铝铁合金颗粒、钛铁合金颗粒,均为具有稳定且低生物毒性的材料。
[0134]
(4)以及前述纳米颗粒组成的混合纳米颗粒。
[0135]
其中,在纳米颗粒为亲水性颗粒或疏水性颗粒两种之一,并且其为聚合物时,由脂质杂化物质包覆后,也可以称为脂质多聚物(lpp,lipopolyplex)即在具有亲水或疏水性质的聚合物的纳米颗粒表面包覆脂质膜,以及阳离子纳米乳(cationic nanoemulsion)即阳离子脂质构成的乳滴也在疫苗和药物递送中被广泛研究和应用。
[0136]
进一步的,在poi识别基团中,所述抗体为治疗性单克隆抗体、多特异性抗体、纳米抗体及前述抗体衍生物或抗体偶联药物;
[0137]
所述多肽为具有poi特异性结合能力的多肽;
[0138]
所述小分子,为具poi特异性结合能力的化合物;
[0139]
优选地,所述小分子包括cdk4/6蛋白抑制剂帕博西尼(palbociclib)的衍生物,brd4蛋白抑制剂jq1的衍生物,β-amyloid蛋白探针av-45的衍生物,匹兹堡化合物pib的衍生物,tau蛋白探针gtp1、pbb3的衍生物。
[0140]
优选地,所述多肽包括ace2、cd13、β-amyloid的binding多肽;
[0141]
优选地,所述抗体包括:ctx、ntz、ptz、crlz、ine、atz,和aducanumab,miltuximab。
[0142]
此外,本发明还提供一种基于脂质的蛋白降解工具,在制备治疗和预防蛋白异常
积累相关疾病的药物、疫苗及递送系统中的应用;其中,所述蛋白异常积累疾病包括肿瘤、免疫系统疾病、炎症和病原体感染、神经退行性疾病、血液系统疾病和代谢类疾病。
[0143]
此外,本发明还提供一种基于脂质的蛋白降解工具,在制备针对蛋白异常积累相关疾病及蛋白互作研究的检测产品/试剂盒中的应用;其中,所述蛋白异常积累疾病包括肿瘤、免疫系统疾病、炎症和病原体感染、神经退行性疾病、血液系统疾病和代谢类疾病。
[0144]
此外,本发明还提供一种基于脂质的蛋白降解工具的制备方法,其中,在所述基于脂质的蛋白降解工具为所述poi识别基团与所述脂质杂化物质偶联的蛋白降解工具时,其制备方法包括两种:
[0145]
(1)将所述poi识别基团通过非共价键合到所述脂质杂化物质上;
[0146]
(2)或者,将所述poi识别基团基于偶联基团通过共价键合到所述脂质杂化物质上,从而构成所述基于脂质的蛋白降解工具。
[0147]
进一步的,所述基于脂质的蛋白降解工具还包括所述poi识别基团通过连接构件与所述脂质杂化物质连接的蛋白降解工具;
[0148]
其中,在所述基于脂质的蛋白降解工具为所述poi识别基团通过所述连接构件与所述脂质杂化物质连接的蛋白降解工具时,其制备方法为:
[0149]
(1)先将所述poi识别基团与所述连接构件偶联,构成偶联中间体;然后将所述偶联中间体连接到所述脂质杂化物质上,构成所述基于脂质的蛋白降解工具;
[0150]
(2)或者,先构建由所述连接构件作为外层且由所述脂质杂化物质作为核心的纳米复合结构;再将所述poi识别基团与所述纳米复合结构偶联,构成所述基于脂质的蛋白降解工具。
[0151]
下面通过具体的实施例进一步说明本发明,但是应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
[0152]
表3、实施例1-5中所制备的纳米蛋白降解工具的结构形态
[0153][0154]
实施例1
[0155]
参考表3,本实施例中,针对实施例1中的降解工具进行制备,即poi识别基团与脂质杂化物质偶联,其中poi识别基团为:单抗药物尼妥珠(ntz);脂质杂化物质为peg(聚乙二醇)化脂质体,即脂质体(liposome)含有peg暴露于脂质杂化物质表面,其peg末端具有活性反应位点nhs(n-羟基琥珀酰亚胺)用于和poi识别基团ntz抗体的氨基偶联。获得的结构为ntz-peglipo。
[0156]
制备方法:
[0157]
(1)预处理:将原始抗体的缓冲液置换为pbs。本实施例中,采用已应用于临床治疗的egfr单抗尼妥珠(ntz,nimotuzumab)。
[0158]
取尼妥珠单抗溶液,用3kda超滤管在4000
×
g离心2分钟,进而浓缩抗体,随后用pbs稀释;反复浓缩稀释后,缓冲液被置换为pbs,稀释后通过nanodrop one c仪器的igg模式a280测量蛋白质浓度,并通过bca蛋白质定量试剂盒验证其结果。
[0159]
(2)脂质杂化物质制备:使用的脂质杂化物质为脂质体,由氢化大豆卵磷脂(hspc)、胆固醇(cho,cholesterol)、dspe(二硬脂酰磷脂酰乙醇胺)-peg(聚乙二醇)(聚乙二醇分子量为2kda)通过经典的薄膜水化法组成,其中质量比hspc:cho:dspe-peg=56:39:2.5。hspc、cho溶解在氯仿中,随后蒸发浓缩干燥形成膜。氯仿完全蒸发后,加入1ml dspe-peg-nhs pbs溶液,然后在室温下以100w超声处理3min。然后将所得溶液通过800nm、400nm和200nm滤膜使dspe-peg-nhs插入脂质膜上,此过程应控制在10min内完成。
[0160]
(3)poi识别基团ntz抗体与peg脂质杂化物质偶联:
[0161]
偶联反应在冰水混合物环境中起始,并加以氮气保护。随后将脂质杂化物溶液添
加到以800rpm(每分钟转数)搅拌的抗体pbs溶液中;然后搅拌反应在4℃,20rpm旋转器上孵育24小时。
[0162]
(4)纯化:然后将反应混合物用50kda离心超滤管超滤浓缩3次,随后使用pbs定容至100μl。蛋白质浓度由nanodrop one c仪器通过igg的a280吸光度确定,并以bca法验证。
[0163]
实验结果:参考图4,为ntz-peglipo合成过程图。图5,为mda-mb-231(m231)人乳腺癌肿瘤细胞经500nm的ntz-peglipo处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示ntz-peglipo能够有效降解靶蛋白egfr。
[0164]
需要说明的是,所有实施例中细胞培养基体积均相同,其所接受的处理的摩尔浓度单位为μm(μmol/l),nm(nmol/l)。实验中细胞培养和处理在12孔板细胞培养皿进行,培养基为500μl。细胞培养根据标准细胞培养规范进行。所有对照组所用的摩尔浓度与降解工具组保持一致,例如ntz组和ntz-lipo组其抗体ntz的摩尔浓度和体积均相同,同时,不含抗体的lipo组和ntz-lipo组的脂质杂化物质摩尔浓度和体积均相同。其中每一实施例中脂质杂化物质对照组指所在实施例中未连接poi识别基团的脂质杂化物质。所有涉及多浓度测试的实施例中,其对照poi识别基团组或对照脂质杂化物质组均以浓度测试组中最高浓度处理的相等摩尔浓度处理。所有蛋白电泳图的gapdh或vin(vinculin)为内参。
[0165]
实施例2
[0166]
参考表3,本实施例中,针对实施例2中的降解工具进行制备,即poi识别基团与两亲性脂质连接臂偶联,随后与脂质杂化物质自组装。其中实施例2a和实施例2b中poi识别基团为:单抗药物尼妥珠(ntz);连接臂为带有nhs基团的nhs-peg-dspe。脂质杂化物质由膜骨架和胆固醇(cho,cholesterol)组成,实施例2a中膜骨架为氢化大豆卵磷脂(hspc),其组成的降解工具为ntz-lipo1,实施例2b中膜骨架为二硬脂酰磷脂酰胆碱(dspc),其组成的降解工具为ntz-lipo2。实施例2c中poi识别基团为:her2的治疗性单抗伊尼妥(ine,inetetamab),her2为肿瘤增殖信号受体和标志物,连接臂为带有nhs基团的nhs-peg-dspe,脂质杂化物质由hspc膜骨架和cho组成,其组成的降解工具为ine-lipo。
[0167]
实施例2d中poi识别基团为:小分子cdk4抑制剂palbociclib(palb),连接臂为带有nhs基团的nhs-peg-dspe,palbociclib通过氨基与nhs反应进行偶联,脂质杂化物质由hspc膜骨架和cho组成,其组成的降解工具为palb-lipo。
[0168]
制备方法:
[0169]
实验1:poi识别基团为抗体。其中,实施例2a和实施例2b中poi识别基团为:单抗药物尼妥珠(ntz)。实施例2c中poi识别基团为:单抗药物伊尼妥(ine)。
[0170]
(1)预处理:将原始抗体的缓冲液置换为磷酸盐缓冲液pbs。本实施例中,取ntz、ine单抗溶液,用3kda超滤管在4000
×
g离心2分钟,进而浓缩抗体,随后用pbs稀释;反复浓缩稀释3次后,缓冲液主要成分被置换为pbs,抗体溶液稀释后,通过nanodrop one c仪器的igg模式a280测量蛋白质浓度,并通过bca蛋白质定量试剂盒验证其结果。
[0171]
(2)poi识别基团与两亲性脂质连接臂偶联反应:抗体与nhs-peg(2kda)-dspe通过抗体上的氨基与dspe(二硬脂酰磷脂酰乙醇胺)-peg末端的nhs(n-羟基琥珀酰亚胺,n-hydroxysuccinimide)基团反应。偶联反应在冰水混合物环境中起始,并加以氮气保护。为了提高分散性,可以选择将dspe-peg在pbs缓冲液中以40khz超声处理3分钟,随后将等摩尔浓度和体积(摩尔比例不限于1:1,参考抗体偶联药物)的nhs-peg-dspe pbs溶液添加到以
peg-dspe偶联。
[0184]
av45-peg-dspe制备方法:将带有巯基的av45-sh与mal-peg(分子量2kda)-dspe结合,即将av45-sh与mal-peg-dspe溶于dmso,摩尔比1.2:1,避光氮气保护37℃水浴24h。随后透析冻干。通过通过紫外吸收峰的标准曲线确定浓度。
[0185]
脂质杂化物质制备同本实施例实验1。av45-lipo的制备:待前述脂质杂化物质溶液的溶剂氯仿完全蒸发后,加入1ml av45-peg-dspe的pbs溶液,然后在室温下以100w超声处理3min。然后将所得溶液通过800nm、400nm和200nm滤膜。通过紫外吸收峰的标准曲线确定浓度,并依据av45摩尔浓度进行细胞实验。
[0186]
实验结果:参考图6,为合成过程示意图。图7为m231人乳腺癌肿瘤细胞经不同浓度ntz-lipo1处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示ntz-lipo1能够有效降解靶蛋白egfr。图8为脂质杂化物质由不同hspc和cho比例组成的ntz-lipo1处理m231细胞24小时对靶蛋白egfr降解效果的蛋白电泳结果,结果显示不同组成具有蛋白降解效果,而膜骨架hspc和辅助脂质胆固醇的比例对蛋白降解效果有影响。图9为m231人乳腺癌肿瘤细胞经500nm ntz-lipo2处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示ntz-lipo2能够有效降解靶蛋白egfr。图10为m231人乳腺癌肿瘤细胞经500nm ine-lipo处理24小时后收蛋白进行蛋白电泳检测her2蛋白表达结果,结果显示ine-lipo能够有效降解靶蛋白。
[0187]
图11为palb-lipo所用脂质连接臂与poi识别基团偶联后的palb-peg-dspe氢谱核磁共振,结果显示成功连接。图12为av45-lipo所用脂质连接臂与poi识别基团偶联后的av45-peg-dspe氢谱核磁共振,结果显示成功连接。图13为m231人乳腺癌肿瘤细胞经不同浓度palb-lipo处理24小时后收蛋白进行蛋白电泳检测cdk4蛋白表达结果,结果显示palb-lipo能够有效降解靶蛋白。图14为av45-lipo结构示意图以及av45-sh结构。图15为人胶质细胞经不同浓度av45-lipo处理24小时后进行共聚焦显微镜成像,即检测β-amyloid(aβ)被劫持进入细胞效果。10μm的fitc绿色染料标记的β-amyloid 1-42多肽制备的寡聚体与10μm的av45-lipo共孵育24小时,随后通过pbs洗掉未进入细胞的处理物,进行共聚焦显微镜成像,检测β-amyloid 1-42寡聚体的绿色荧光,绿色荧光强则表明被劫持进入细胞量更多,理论上更多的劫持和吞噬以及溶酶体转移能带来更好的降解,以减轻胞外β-amyloid oligomer的积累带毒性,溶酶体染料lysotracker用来标记溶酶体,比例尺为10μm。
[0188]
实施例3
[0189]
参考表3,本实施例中,针对实施例3中的降解工具进行制备,即poi识别基团与两亲性脂质连接臂偶联,随后与脂质杂化物质自组装。其中poi识别基团为:单抗药物尼妥珠(ntz);连接臂为带有nhs基团的nhs-peg-dspe或nhs-peg-dmg(1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇,聚乙二醇末端修饰n-羟基琥珀酰亚胺)。脂质杂化物质由膜骨架hspc、胆固醇,以及阳离子脂质dotap(溴化三甲基-2,3-二油酰氧基丙基铵)组成。阳离子脂质dotap是一种代表性的阳离子脂质,阳离子脂质有助于脂质杂化物质形成lipid nanoparticle(lnp)用于包载带有负电的核酸类药物。当脂质杂化物质的组成为peg-dspe/胆固醇/hspc,其组成的降解工具为ntz-lnp1,当ntz-lnp1载有无义序列空载小干扰rna(sirna)其组成的降解工具为ntz-lnp1s;当脂质杂化物质的组成为peg-dmg/胆固醇/hspc,其组成的降解工具为ntz-lnp2。
[0190]
制备方法:
[0191]
其预处理、poi识别基团和连接臂的连接、纯化,采用实施例2中所用方法。
[0192]
脂质杂化物质制备:使用的脂质杂化物质为脂质纳米颗粒,由氢化大豆卵磷脂(hspc)或二硬脂酰磷脂酰胆碱(dspc)、胆固醇(cho,cholesterol)、dspe-peg(2kda)通过经典的薄膜水化法组成,其中质量比[hspc或dspc]:cho:dspe-peg(不含poi识别基团)=56:39:2.5。hspc、cho溶解在氯仿中,随后蒸发浓缩干燥形成膜。
[0193]
ntz-lnp1:上述脂质杂化物合成后,待氯仿完全蒸发,加入1ml dspe-peg-抗体的pbs溶液,同时加入dotap溶液(摩尔比hspc:dotap=1:1)然后在室温下以100w超声处理3min。然后将所得溶液通过800nm、400nm和200nm滤膜。
[0194]
ntz-lnp1s:上述脂质杂化物合成后,待氯仿完全蒸发,加入1ml dspe-peg-抗体的pbs溶液,sirna的量根据与dotap的氮磷比(n/p=3:1)计算。同时加入dotap溶液(摩尔比hspc:dotap=1:1)与sirna溶液。然后在室温下以100w超声处理3min。然后将所得溶液通过800nm、400nm和200nm滤膜。
[0195]
纯化:然后将反应混合物用50kda离心超滤管超滤浓缩3次,随后使用pbs定容至100μl。蛋白质浓度由nanodrop one c仪器通过igg的a280吸光度确定,并以bca法验证。
[0196]
实验结果:参考图16,为ntz-lnp1、ntz-lnp1s、ntz-lnp2结构示意图。图17,为所述脂质杂化物质的动态光散射(dls)检测的粒径分布。图18为m231人乳腺癌肿瘤细胞经500nm ntz-lnp1处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,其中实施例2中的lipo1也一同作为对照。结果显示ntz-lnp1能够有效降解靶蛋白egfr。图19为m231人乳腺癌肿瘤细胞经ntz-lnp1s处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示ntz-lnp1s能够有效降解靶蛋白egfr。图20为m231人乳腺癌肿瘤细胞经ntz-lnp2处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示ntz-lnp2能够有效降解靶蛋白egfr。
[0197]
实施例4
[0198]
参考表3,本实施例中,针对实施例4中的降解工具进行制备,即poi识别基团与两亲性脂质连接臂偶联,随后与脂质杂化物质自组装。其中poi识别基团为:单抗药物尼妥珠(ntz);连接臂为带有nhs基团的nhs-peg-dspe。脂质杂化物质由外泌体(exosome)组成。外泌体是由真核生物如动物或植物细胞分泌的细胞外囊泡,是自发形成的,可以进行细胞间通讯,通常含有蛋白和少量核酸,外泌体具有较高的生物相容性和载药能力,其表面为磷脂膜结构。
[0199]
制备方法:
[0200]
其预处理、poi识别基团和连接臂的连接、纯化,采用实施例2中所用方法。
[0201]
脂质杂化物质制备:外泌体由dc2.4细胞根据标准步骤分离并纯化鉴定,外泌体通过超声和挤膜两种方式进行连接臂的偶联。即外泌体pbs溶液加入1ml dspe-peg-抗体的pbs溶液,
[0202]
连接臂和脂质杂化物质的结合采用挤膜或超声法。超声法即在外泌体的pbs溶液中加入dspe-peg-抗体的pbs溶液(例如在1ml体系中质量比外泌体:dspe-peg=1mg:25μg,即40:1),超声处理30秒,然后在37℃下孵育1小时。挤膜法即:在外泌体中加入1ml dspe-peg-抗体的pbs溶液(质量比外泌体:dspe-peg=1mg:25μg,即40:1)然后在室温下以100w超
声处理3min。然后将所得溶液通过800nm、400nm和200nm滤膜。
[0203]
纯化:然后将反应混合物用50kda离心超滤管超滤浓缩3次,随后使用pbs定容至100μl。蛋白质浓度由nanodrop one c仪器通过igg的a280吸光度确定,并以bca法验证。
[0204]
实验结果:参考图21为所述脂质杂化物质的dls检测的粒径和平均分散系数pdi(polymer dispersity index),pdi越小,粒径约均匀,结果表示粒径均匀。图22为m231人乳腺癌肿瘤细胞经不同浓度ntz-exo处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示ntz-exo能够有效降解靶蛋白egfr。
[0205]
实施例5
[0206]
参考表3,本实施例中,针对实施例4中的降解工具进行制备,即脂质杂化物质包覆于纳米颗粒表面,其poi识别基团与两亲性脂质连接臂偶联,随后与脂质杂化物质自组装,poi识别基团暴露于外部。其中poi识别基团为:靶向egfr的单抗药物尼妥珠(ntz)或西妥昔(ctx);连接臂为带有nhs基团的nhs-peg-dspe。脂质杂化物质由hspc/胆固醇组成并包裹plga纳米颗粒时,该降解工具为ntz-lipop。聚乳酸-羟基乙酸共聚物(plga)为具有代表性的聚合物纳米颗粒,其具有疏水性,具有较高的生物相容性,性质稳定并可以被生物体降解,被广泛用于医疗。脂质杂化物质为小鼠红细胞膜(rbcm)组成并包裹缩醛化葡聚糖(dextran),poi识别基团为ctx组成时,该降解工具为ctx-rbcmd。葡聚糖为具有代表性的亲水生物可降解纳米颗粒。红细胞膜是细胞膜和细胞器膜的代表,是一种脂质杂化物质,便于分离提取。
[0207]
制备方法:
[0208]
其预处理、poi识别基团和连接臂的连接、纯化,采用实施例2中所用方法。
[0209]
脂质杂化物质制备:
[0210]
ntz-lipop制备:由hspc、cho通过经典的薄膜复水法组成,其中各化合物按照质量比hspc:cho:peg-dspe(不含poi识别基团)=56:39:2.5。hspc与cho溶解在氯仿中,随后浓缩蒸发形成脂质膜。氯仿完全蒸发后,加入1ml溶解在pbs中的抗体-peg-dspe重悬,然后在室温下以100w超声处理3min。然后将所得溶液通过800nm、400nm和200nm滤膜使dspe-peg-抗体插入脂质膜上。
[0211]
包裹plga:plga(15kda)溶解在dmf中(10μg/μl),每10秒加2μl加入1ml pbs溶液中,700rpm搅拌3h,待dmf挥发后每0.01μmol的plga外边裹1mg的lipo(指的是hspc+cho共1mg)lipo适量的hspc和cho溶在氯仿中,蒸发浓缩后用dspe-peg-ntz的pbs溶液重悬,100w超声3min。37℃摇床共孵育30min,室温100w超声5min,过800,400,200nm的膜。两者混合物再与plga的pbs溶液混合,100w冰浴超声2min,过800,400,200nm的膜,超滤浓缩。igg测浓度。
[0212]
ctx-rbcmd制备:ctx-peg-dspe合成方法如实施例2。
[0213]
将1mg缩醛化葡聚糖溶于200μl的四氢呋喃中,每滴10μl,每10s一滴滴入搅拌中的1ml ph=8的碱水中,700rpm搅动3小时。取小鼠红细胞膜1mg重悬于1ml的pbs中。红细胞膜的pbs溶液与ctx-peg-dspe的peg溶液(根据膜:缩醛化葡聚糖=1mg:1mg计算,缩醛化葡聚糖核心与dspe-peg的摩尔比为10:1)混合后200rpm 37℃摇床孵育30min,随后100w室温超声5min,然后将所得溶液依次通过400nm和200nm滤膜过滤,以获得均匀的尺寸。然后与缩醛化葡聚糖溶液混合,100w冰浴超声2min,将所得溶液通过400nm和200nm滤膜过滤以获得目
的产物。然后进行超滤浓缩。通过nanodrop one c(thermofisher)以igg模式测量蛋白质浓度,并通过bca蛋白质测定试剂盒进行验证。
[0214]
表4、ntz-lipop和未经ntz-peg-dspe连接的lipo-plga的dls粒径统计和pdi统计结果
[0215][0216]
实验结果:参考图23,为ntz-lipop结构示意图。上表为ntz-lipop和未经ntz-peg-dspe连接的lipo-plga的dls粒径统计和pdi统计结果,结果显示粒径均一,连接ntz-peg-dspe后水合粒径略微增大。图24为m231人乳腺癌肿瘤细胞经不同浓度ntz-lipop处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示其能够有效降解靶蛋白egfr。图25为ctx-rbcmd结构示意图。图26为dls粒径分布结果图。图27为m231人乳腺癌肿瘤细胞经500nm ctx-rbcmd处理24小时后收蛋白进行蛋白电泳检测egfr蛋白表达结果,结果显示其能够有效降解靶蛋白egfr。
[0217]
以上所述的是本发明的优选实施方式和相应实施例,应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提,还可以做出若干变形和改进,包括但不限于比例、流程、用量的调整,这些都属于本发明的保护范围之内。以上所述的是本发明的优选实施方式和相应实施例,应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提,还可以做出若干变形和改进,包括但不限于比例、流程、用量的调整,这些都属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1