一种藻红蛋白与壳寡糖共价交联来提高藻红蛋白稳定性的方法和应用
1.本发明属于食品技术领域,尤其是一种藻红蛋白与壳寡糖共价交联来提高藻红蛋白稳定性的方法和应用。
背景技术:
2.食品行业中所使用的两类色素分别为合成色素和天然色素。合成色素由于其价格低廉的特点被广泛地应用在食品行业中,但其对人体会造成一定程度的健康风险,例如在食品中超量添加胭脂红、柠檬黄等合成色素而导致的食品安全事件时有发生,对消费者的身体健康存在着严重的威胁;而天然色素是从天然的原料中提取出来,与合成色素相比,不仅具有更高的营养价值,可生物降解,同时还有一定的保健作用。随着社会的飞速发展,人们对健康问题尤为关注,天然色素深受消费者信任与青睐,同时也将成为一类“潜力股”来逐步取代合成色素,在食品、染色、化妆品等行业开拓出更加宽阔的市场。但一些天然的色素,如类胡萝卜素,具有较高的亲脂性,较低的水溶性和对空气和光的敏感性,这些因素可能会导致色素稳定性的降低并有可能发生降解,从而降低天然色素的应用价值。
3.藻红蛋白是一种从海藻中提取出来的天然、无毒、水溶性的捕光色素蛋白,因其来源的不同,颜色分别呈现粉红色、红色或紫色。分子量一般为220kda~300kda不等,由α、β和γ等3种亚基组成,摩尔比为6:6:1。藻红蛋白的α亚基上有两个色素分子,均为藻红胆素。由于藻红蛋白具有较为保守且相对稳定的结构、鲜艳的色泽、良好的生物相容性和较高的ph 稳定性,以及高吸光系数等优良的光学性能,所以藻红蛋白作为一种优质类的蛋白质添加剂,在食品、化妆品、染料业以及生物医学等产业中均有较为广泛的应用潜力。但综合现有文献统计,绝大部分天然色素的稳定性较差,易发生褪色、变色等一系列问题,归纳分析影响天然色素稳定性的因素主要为ph值、金属离子、光照、温度、氧化剂和还原剂等。由于藻红蛋白色素稳定性的不足,直接影响了藻红蛋白在食品及其他领域中的广泛应用。目前,藻红蛋白作为天然色素在应用上的主要缺陷为易受ph、温度和光照等因素影响,使其稳定性降低,从而降低藻红蛋白的利用率和适用范围。
4.通过检索,尚未发现与本发明专利申请相关的专利公开文献。
技术实现要素:
5.本发明的目的在于克服现有技术的不足之处,提供一种藻红蛋白与壳寡糖共价交联来提高藻红蛋白稳定性的方法和应用。
6.一种藻红蛋白与壳寡糖共价交联来提高藻红蛋白稳定性的方法,步骤如下:
7.步骤一:将准备好的干燥坛紫菜用粉碎机粉碎,过100目筛;称取干坛紫菜粉末,浸泡在蒸馏水中,干坛紫菜粉末:蒸馏水的比例g:ml为1:20,磁力搅拌器搅匀后,在零下20℃和4℃的条件下反复冻融三次后取出;
8.将冻融液用磁力搅拌充分搅拌3h后,加蒸馏水稀释,加蒸馏水稀释后总体积:干坛
紫菜粉末的比例ml:g为50:1,然后进行组织捣碎、超声破碎处理,过滤残渣,10000
×
g、4℃离心20min后收集上清液;上清液中加入硫酸铵至40%饱和度,25℃下静置2h后再次于10000
ꢀ×
g、4℃条件下离心20min,取沉淀;
9.将沉淀溶解于磷酸盐缓冲液中,得到藻红蛋白盐析溶液;将藻红蛋白盐析溶液置于磷酸盐缓冲液中透析24h,即为藻红蛋白粗提液;
10.步骤二:配制藻红蛋白溶液,向藻红蛋白溶液中加入转谷氨酰胺酶及壳寡糖进行酶促反应,反应参数为:酶添加量为10u/g蛋白、藻红蛋白的终浓度为2.0μm、壳寡糖的终浓度为 2.0-8.0μm、反应时间3h、反应温度37℃,得到粗制的藻红蛋白-壳寡糖复合物;反应结束后,将上述复合物经85℃处理5min灭酶,然后立即冷却至室温后,透析除去未结合的壳寡糖。
11.进一步地,所述步骤一中磷酸盐缓冲液为0.02m、ph=6.8的pbs缓冲液。
12.进一步地,所述步骤一中进行组织捣碎、超声破碎处理后使用绢布或纱布过滤残渣。
13.进一步地,所述步骤二中壳寡糖:藻红蛋白的摩尔比为1:1、2:1、3:1、4:1。
14.进一步地,所述步骤二中壳寡糖的分子量为980da的低分子量壳寡糖。
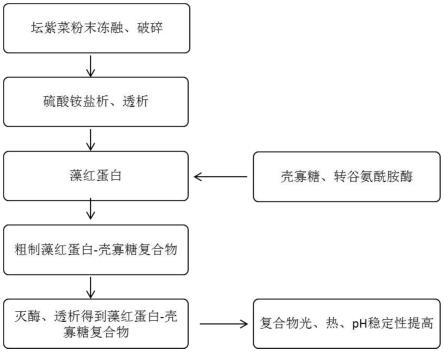
15.如上所述的方法在藻红蛋白稳定性提高方面中的应用。
16.本发明取得的优点和积极效果为:
17.1、本发明方法利用转谷氨酰胺酶催化藻红蛋白与壳寡糖发生反应来提高藻红蛋白稳定性,从而增加藻红蛋白的利用率和使用范围,本发明方法尤其适用于用天然植物蛋白与多糖类结合从而提高色素稳定性。
18.2、本发明方法以干燥的坛紫菜粉为原料,从中提取并分离出藻红蛋白,通过转谷氨酰胺酶催化藻红蛋白与壳寡糖进行糖基化反应,得到藻红蛋白-壳寡糖复合物。对不同比例的复合物进行结构及其性质的测定。复合物的形态相较于藻红蛋白来说更加聚合;藻红蛋白-壳寡糖复合物可以有效提高藻红蛋白的热稳定性、ph稳定性以及光稳定性。这一结果证实了转谷氨酰胺酶催化藻红蛋白与壳寡糖发生共价交联可以更好的保护藻红蛋白色素的稳定性,从而大大提高藻红蛋白的利用率和适用范围,提高藻红蛋白的应用价值。
19.3、本发明方法通过转谷氨酰胺酶催化藻红蛋白糖基化反应的进行提高藻红蛋白的溶解度和乳化稳定性,从而增加藻红蛋白的利用率和使用范围,提高藻红蛋白的应用价值,并为转谷氨酰胺酶催化蛋白质糖基化提供参考依据。
20.4、本发明方法利用天然植物坛紫菜以及多糖中的壳寡糖为原料,有着价格低廉,原料来源丰富,无毒害且具有营养价值等优点。本发明方法制得的藻红蛋白复合物在食品添加剂、染色行业以及化妆品等行业有着广阔的开发潜力和应用前景,同时,该方法也为藻红蛋白的开发利用提供了新途径,对于提高藻红蛋白的利用程度,开发新型的天然色素具有重要的研究意义和应用前景。
附图说明
21.图1为本发明中获得的藻红蛋白的sds-page电泳图;其中,m为marker,1为获得的藻红蛋白;
22.图2为本发明中藻红蛋白-壳寡糖复合物的一种制备过程流程图;
23.图3(a)为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的sds-page 考马斯亮蓝染色电泳图;其中,m为marker;(b)为藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的高碘酸-希夫氏试剂染色图;其中,m为marker,hpr为辣根过氧化物酶阳性对照;其中,1、2、3、4均为壳寡糖与藻红蛋白摩尔比为1:1、2:1、3:1、4:1的藻红蛋白-壳寡糖复合物;
24.图4为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的红外光谱图;
25.图5为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的扫描电镜图 (
×
5000倍);其中,a、b、c、d、e分别表示藻红蛋白、藻红蛋白-壳寡糖复合物(摩尔比1:1)、藻红蛋白-壳寡糖复合物(摩尔比2:1)、藻红蛋白-壳寡糖复合物(摩尔比3:1)、藻红蛋白-壳寡糖复合物(摩尔比4:1),各个摩尔比均为壳寡糖:藻红蛋白;
26.图6为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的热稳定性图;
27.图7为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的ph稳定性图;
28.图8(a)为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的自然光稳定性图;8(b)为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的紫外光稳定性图;
29.图9为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的溶解度图;
30.图10为本发明中获得的藻红蛋白及其不同比例藻红蛋白-壳寡糖复合物的乳化稳定性图;
31.其中,pe均为藻红蛋白缩写;ompc均为藻红蛋白-壳寡糖复合物缩写。
具体实施方式
32.下面结合实施例,对本发明进一步说明,下属实施例是叙述性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
33.本发明中所使用的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所用各物质质量均为常规使用质量。
34.一种藻红蛋白与壳寡糖共价交联来提高藻红蛋白稳定性的方法,步骤如下:
35.步骤一:将准备好的干燥坛紫菜用粉碎机粉碎,过100目筛;称取干坛紫菜粉末,浸泡在蒸馏水中,干坛紫菜粉末:蒸馏水的比例g:ml为1:20,磁力搅拌器搅匀后,在零下20℃和4℃的条件下反复冻融三次后取出;
36.将冻融液用磁力搅拌充分搅拌3h后,加蒸馏水稀释,加蒸馏水稀释后总体积:干坛紫菜粉末的比例ml:g为50:1,然后进行组织捣碎、超声破碎处理,过滤残渣,10000
×
g、4℃离心20min后收集上清液;上清液中加入硫酸铵至40%饱和度,25℃下静置2h后再次于10000
ꢀ×
g、4℃条件下离心20min,取沉淀;
37.将沉淀溶解于磷酸盐缓冲液中,得到藻红蛋白盐析溶液;将藻红蛋白盐析溶液置于磷酸盐缓冲液中透析24h,即为藻红蛋白粗提液;
38.步骤二:配制藻红蛋白溶液,向藻红蛋白溶液中加入转谷氨酰胺酶及壳寡糖进行酶促反应,反应参数为:酶添加量为10u/g蛋白、藻红蛋白的终浓度为2.0μm、壳寡糖的终浓度为 2.0-8.0μm、反应时间3h、反应温度37℃,得到粗制的藻红蛋白-壳寡糖复合物;反应结束后,将上述复合物经85℃处理5min灭酶,然后立即冷却至室温后,透析除去未结合的壳寡糖。
39.较优地,所述步骤一中磷酸盐缓冲液为0.02m、ph=6.8的pbs缓冲液。
40.较优地,所述步骤一中进行组织捣碎、超声破碎处理后使用绢布或纱布过滤残渣。
41.较优地,所述步骤二中壳寡糖:藻红蛋白的摩尔比为1:1、2:1、3:1、4:1。
42.较优地,所述步骤二中壳寡糖为分子量为980da的低分子量壳寡糖。
43.如上所述的方法在藻红蛋白稳定性提高方面中的应用。
44.具体地,相关制备及检测如下:
45.实施例1
46.一种藻红蛋白与壳寡糖共价交联来提高藻红蛋白稳定性的方法,步骤如下:
47.步骤一:将准备好的干燥坛紫菜用粉碎机粉碎,过100目筛。称取3g干坛紫菜粉末,浸泡在60ml蒸馏水中,磁力搅拌器搅匀后,在零下20℃和4℃的条件下反复冻融三次后取出。将冻融液用磁力搅拌器充分搅拌3h,加蒸馏水稀释至150ml后进行组织捣碎、超声破碎,绢布过滤残渣,离心20min(10000
×
g,4℃)后收集其上清液。上清液中加入硫酸铵至 40%饱和度,25℃下静置2h后,再次离心20min(10000
×
g,4℃)。将沉淀溶解于少量的磷酸盐缓冲液(pbs,0.02m,ph 6.8)中,得到藻红蛋白盐析溶液。将藻红蛋白盐析溶液置于磷酸盐缓冲液(0.02m,ph 6.8)中透析24h即为藻红蛋白粗提液。利用sds-page检测提取的蛋白质分子量,结果见图1,获得的藻红蛋白由典型的三种亚基构成,证明坛紫菜中所提蛋白为藻红蛋白。
48.步骤二:配制2μm的藻红蛋白溶液,取一定体积蛋白溶液按摩尔比1:1、2:1、3:1、4:1 (壳寡糖:藻红蛋白)分别加入壳寡糖,转谷氨酰胺酶的添加量为10u/g蛋白。充分搅拌均匀后将样品置于37℃的气浴摇床中反应3h。反应结束后,将混合液置于85℃水浴中加热5min 灭酶。待样品溶液冷却至室温后,透析除去未结合的壳寡糖,流程图见图2。
49.步骤三:通过聚丙烯酰胺凝胶电泳来验证蛋白糖基化反应是否发生。样品经过处理后通过使用ve 180电泳槽进行sds-page电泳实验,电泳的浓缩胶浓度为5%,分离胶凝胶浓度为15%,上样缓冲液与样品以1:1(v/v)进行稀释并充分混匀,放置于100℃的沸水中加热5 min,完全冷却后进行上样。使用低分子量蛋白标准品(14.4-97.4kda)作为标记,样品和 marker的上样量均为10μl。电泳设置在17ma恒流,电压150v。然后对凝胶分别进行考马斯亮蓝染色和高碘酸-希夫氏碱染色。如图3(a)所示,与对照藻红蛋白相比,不同摩尔比的复合物都在分离胶的顶端生成了新的条带,这一现象是因为分子量大无法进入分离胶,所以留在了分离胶的顶端所导致,同时复合物中的α和β亚基(16/18kda)条带变浅,说明藻红蛋白在转谷氨酰胺酶的催化下与壳寡糖发生了共价交联,并生成了大分子聚合物。在高碘酸
‑ꢀ
希夫氏碱染色中,以藻红蛋白为阴性对照,辣根过氧化物酶为阳性对照,结果如图3(b)所示。图中的阳性对照辣根过氧化物酶(图3b,hpr)和复合物(图3b,1-4)在分离胶顶端的条带被染成红色,这一现象说明藻红蛋白确实和壳寡糖发生了糖基化共价交联形成了糖蛋白。
50.步骤四:用2,4-二硝基水杨酸(dns)法测定藻红蛋白-壳寡糖复合物中的氨基葡萄糖含量,实验方法如下:
51.取0.01g样品于安瓿管中,加入2.5ml 6mol/l浓盐酸,加入0.01mg苯酚防止氨基葡萄糖氧化,用酒精喷灯灼烧安瓿管管口至溶化,用镊子捏紧管口至密封,放入烘箱中(100℃) 酸水解8.5h。酸水解完成后取出样品冷却至室温,用滤纸将样品过滤到离心管中,取1ml 样液加入1ml 6mol/l naoh调节ph值大于7.3。从该样液中取0.5ml,加入0.5ml dns 试剂,沸水浴加热5min,冷却后加4ml蒸馏水,充分混匀,测定样品在540nm处的吸光度值。然后根据氨基葡萄糖标准曲线计算样品中氨基葡萄糖含量。
52.如表1所示,以未交联的藻红蛋白和没有加壳寡糖的转谷氨酰胺酶催化的藻红蛋白自身交联作为对照,来测定不同比例的藻红蛋白-壳寡糖复合物中氨基葡萄糖含量,结果如表1所示。相比于未交联的藻红蛋白和没有加壳寡糖但用转谷氨酰胺酶催化的自身交联的藻红蛋白,壳寡糖-藻红蛋白复合物中的氨基葡萄糖含量要高很多,壳寡糖与蛋白质最高结合量为 31.403
±
0.004mg/g蛋白质,说明蛋白质与壳寡糖在转谷氨酰胺酶的催化下发生了糖基化交联反应。随着蛋白与壳寡糖摩尔比的增加,氨基葡萄糖含量的变化呈现先上升后下降的趋势,以壳寡糖/藻红蛋白摩尔比3:1为最高。据文献报道,壳寡糖可以共价附着在蛋白上,这依赖于壳寡糖的浓度,而高浓度的壳寡糖(壳寡糖/藻红蛋白=4:1)可能会增加系统的粘度,减少壳寡糖共价结合到藻红蛋白上,不利于糖基化反应;通过邻苯二甲醛(opa)法测定藻红蛋白与复合物中的游离氨基含量,从而进一步确定蛋白与壳寡糖是否发生了糖基化共价交联。测定时,取4ml opa试剂于试管中,分别注入200μl样品溶液,混匀后置于35℃条件下反应2min,测量样品在340nm处的吸光值,在opa试剂中加入200μl水为空白样,二者之差δa为自由氨基的净吸光值。用赖氨酸做标准曲线,根据δa计算样品中游离氨基的含量。结果如表2所示,糖基化复合物的游离氨基含量要比单独的蛋白和没有加壳寡糖的自身交联蛋白低,说明藻红蛋白发生了糖基化共价交联。
53.步骤五:将藻红蛋白与不同比例复合物溶液进行冻干处理。处理后的样品分别采用kbr 法压片进行傅里叶红外光谱(ftir)扫描以及电子显微镜扫描,来观察利用转谷氨酰胺酶催化藻红蛋白与壳寡糖发生反应对藻红蛋白结构的影响。傅里叶红外光谱(ftir)扫描结果如图4所示,与未处理的藻红蛋白相比,藻红蛋白-壳寡糖复合物在1030-1150cm-1
和1600cm-1
区域的吸收峰更强。1600cm-1
左右为n-h的弯曲振动峰,是糖和蛋白质的共同特征峰。这个区域吸收峰的增强代表着壳寡糖与pe发生了共价交联从而导致n-h的振动增加。1030-1150 cm-1
是c-o和c-c键的伸缩振动,是糖的主要特征峰。该区域吸收峰的增强表明壳寡糖与藻红蛋白发生了共价交联从而导致c-o和c-c键的振动增加。值得注意的是,这一结果跟氨基葡萄糖的结果一致。电子显微镜结果如图5所示,与未处理的藻红蛋白本身相比,随着寡聚糖的加入和寡聚糖含量的增加,藻红蛋白-壳寡糖复合物的形态开始发生变化。随着壳寡糖含量的增加,复合物的结构更加密集,聚集更明显(图5,b-e)。其中,摩尔比为1:1的复合物聚集体较小,而摩尔比为3:1和4:1的复合物均形成较大聚集体。这些结果证明了转谷氨酰胺酶可以催化藻红蛋白与壳寡糖发生反应形成更大的蛋白质颗粒。我们推断转谷氨酰胺酶诱导的共价键和其他弱键,如疏水相互作用、氢键和静电相互作用导致了藻红蛋白的结构变化,从而诱导蛋白形成致密且不规则的聚集。
54.步骤六:分别取3ml藻红蛋白与不同比例复合物溶液,在25℃、40℃、60℃和80℃加
热30min,用紫外分光光度计记录每次处理后样品在565nm处的吸收情况。相对吸光度的变化被评估为经过一定的热处理(a
t
)后的a
565
与热处理开始时的a
565
(a
25℃
)的比值,以此数值分析热稳定性的变化,结果如图6所示。结果表明,随着温度从室温提高到80℃后,藻红蛋白的热稳定性低于藻红蛋白-壳寡糖复合物的热稳定性;分别取3ml藻红蛋白与不同比例复合物溶液,调节样品ph为3、5、7、9、11处理后,记录样品在565nm处的吸收情况。记录经过不同ph处理(a
p
)后的a
565
与原始样品a
565
(a0)的比值,以此数值分析ph稳定性的变化,结果如图7所示。与藻红蛋白相比较,复合物在不同ph值下的稳定性均高于藻红蛋白;分别取3ml藻红蛋白与不同比例复合物溶液,将每个样品置于室温下用自然光和紫外光分别照射0、3、6、9和12h,测定样品在565nm处的吸收情况。以自然光和紫外光处理后的a
565
(at) 与光处理开始时的a
565
(a0)的比值来评估相对吸光度的变化,由此分析光稳定性的变化,结果如图8(a)(b)所示。结果表明,随着光照时间从0增加到12h,所有样品的a
t
/ao值逐渐降低。例如,自然光下(图8-a)藻红蛋白的a
t
/ao在0-12小时内衰减了30.77%,而ompc (3:1)的a
t
/ao仅下降了16.44%,说明壳寡糖起到了保护作用,提高了藻红蛋白的光稳定性。在紫外光照射下(图8-b)的样品a
t
/ao下降率更显著。因此,我们认为壳寡糖在藻红蛋白上的附着可以增强藻红蛋白的热稳定性、ph稳定性以及光稳定性。
55.步骤七:利用盐酸和氢氧化钠缓冲液调节pe和不同摩尔比例的ompc(壳寡糖 /pe=1:1-4:1)的ph(2-11),样品离心15min(10000r/min,4℃)。取上层清液,用考马斯亮蓝法测定蛋白质的含量,用牛血清蛋白为标准做标准曲线,pe和ompc(壳寡糖/pe=1:1-4:1) 的溶解度表示为上清液蛋白质浓度占总浓度的百分比。如图9所示,在ph 2-11范围内,ompc (壳寡糖/pe=1:1-4:1)的溶解度较pe相比均有所提高。由此推断,糖基化能使pe的溶解度得到提高。用pbs(ph 6.8)配制蛋白浓度为0.1%(w/v)的样品溶液。取1.2ml待测样品溶液于试管中,加0.4ml大豆油,高速均质机处理1min(10000r/min),分别在搅拌0、 10min时从测试管底部取样100μl,使用0.1%(w/v)sds溶液稀释50倍,测定样品500nm 处的吸光值,用sds溶液作为空白对照,以测定样品的乳化稳定性。样品的乳化稳定性指数 (esi)=a
10
/a0×
100%,其中a0和a
10
分别为0min和10min时的吸光度值。通过图10发现, ompc(壳寡糖/pe=1:1-4:1)的乳化稳定性均大于未共价交联的pe,使蛋白的乳化稳定性提高。
56.表1藻红蛋白与藻红蛋白-壳寡糖复合物的氨基葡萄糖含量
[0057][0058]
注:pe为藻红蛋白;ompc(1:1-4:1)为藻红蛋白-壳寡糖糖基化复合物,摩尔比分别是壳寡糖/pe=1:1-4:1。采用duncan's多重比较。同一行中分析数据后的不同字母者表示分析结果显著(p《0.05)。
[0059]
表2藻红蛋白与藻红蛋白-壳寡糖复合物的游离氨基含量
[0060][0061]
注:pe为藻红蛋白;ompc(1:1-4:1)为藻红蛋白-壳寡糖糖基化复合物,摩尔比分别是壳寡糖/pe=1:1-4:1。采用duncan's多重比较。同一行中分析数据后的不同字母者表示分析结果显著(p《0.05)。
[0062]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1