培养基及其在培养视网膜祖细胞中的应用的制作方法
1.本发明涉及细胞生物学技术领域,尤其涉及培养基及其在培养视网膜祖细胞中的应用。
背景技术:
2.视网膜祖细胞(retinal progenitor cells,rpcs)是位于视网膜组织中能特异性分化为成熟视网膜功能细胞的一类组织特异性干细胞,是视网膜细胞形成和功能发挥的基础。理论上,成人视网膜细胞损伤后不能再生,因此对于视网膜病变的患者,体外培养视网膜祖细胞并将其移植到病变部位可干预或延缓视网膜病变的进展,提高患者的视力,改善视网膜细胞的功能。目前已有多项临床试验研究将体外培养的视网膜祖细胞移植到视网膜色素变性患者眼内,研究均报道眼内移植视网膜祖细胞是安全的,且治疗后可以显著提高患者视力,改善患者生活状况。因此,体外培养的视网膜祖细胞为视网膜变性疾病的治疗提供了新方法。而目前视网膜祖细胞以及神经干细胞的培养体系多为常氧条件培养,这种常氧条件下,细胞一方面利用糖代谢产生能量,又同时应用氧化磷酸化产生atp供能,体外长期正常氧分压培养会产生大量的活性氧自由基,对干细胞造成损伤,引起干细胞的非定向分化和细胞凋亡。
3.视网膜祖细胞移植是治疗视网膜变性疾病的在研疗法之一,视网膜祖细胞分离于发育期的胎儿眼视网膜组织,其含量少,体外扩增能力有限,因此为了提高体外视网膜祖细胞的扩增效率,大量研究采用模拟发育期视网膜组织的生理氧分压条件的培养条件扩增视网膜祖细胞,这种方法尽管可以达到体外扩增视网膜祖细胞的目的,但是对细胞产量的提高效果有限,且已报道的培养基大多仍采用正常氧分压方案,并未考虑到低氧条件细胞能量代谢转换问题,所以不适合低氧条件下细胞的培养,或需要频繁更换新鲜培养基已维持细胞生长所需的能量,由于换液过程细胞处于正常氧分压,因此细胞频繁的低氧和复氧造成细胞不稳定,易引起干细胞损伤。
4.现有技术体系均采用常氧培养基培养低氧条件下的视网膜祖细胞及神经干细胞,并未考虑在低氧条件下细胞能量代谢改变的需求,因此应用现有培养基不适合低氧条件下视网膜祖细胞生长需求,频繁的复氧-低氧换液操作也会增加细胞受损情况,进而降低治疗效果。因此迫切需要提高视网膜祖细胞及神经干细胞的扩增效果,并在扩增过程中维持细胞干性。
技术实现要素:
5.有鉴于此,本发明要解决的技术问题在于提供培养基及其在培养视网膜祖细胞中的应用。本发明针对低氧下细胞能量代谢的特点,创新性地发明了满足低氧培养的培养体系,同时这种培养体系也可应用于常氧条件下,神经干细胞及视网膜祖细胞的培养,可以减少常氧条件下活性氧自由基产生对细胞的影响,保护细胞免受损伤。
6.本发明提供了一种组合物,所述组合物包括:egf、bfgf、glutamax-1、rapamycin、
ps48、uk5099和1,6-二磷酸果糖。本发明培养基在构建过程中尝试因子的缺少对细胞增殖的影响,最后优化发现这些因子的组合对细胞增殖最旺盛。
7.本发明所述的组合物,其中所述egf、bfgf、glutamax-1、rapamycin、ps48、uk5099和1,6-二磷酸果糖的质量比为1∶2∶3000000∶100∶1000∶500∶50000000。
8.本发明提供了一种培养基,其包括基础培养基和所述的组合物。
9.本发明所述的培养基,其由基础培养基和egf 1ng/ml~50ng/ml、bfgf 1ng/ml~50ng/ml、glutamax-1 3mg/ml~30mg/ml、rapamycin 0.1μg/ml~1μg/ml、ps48 2.5μg/ml~20μg/ml、uk5099 0.5μg/ml~5μg/ml和1,6-二磷酸果糖100mg/ml~1g/ml组成。
10.一些实施例中,所述培养基其由基础培养基和egf 5ng/ml~30ng/ml、bfgf 5ng/ml~30ng/ml、glutamax-1 10mg/ml~20mg/ml、rapamycin 0.5μg/ml~1μg/ml、ps48 5μg/ml~10μg/ml、uk50991μg/ml~5μg/ml和1,6-二磷酸果糖100mg/ml~50mg/ml。
11.另一些实施例中,所述培养基其由基础培养基和egf 10ng/ml、bfgf 20ng/ml、giutamax-1 30mg/ml、rapamycin 1μg/ml、ps48 10μg/ml、uk5099 5μg/ml和1,6-二磷酸果糖500mg/ml。
12.本发明所述的培养基,其中,所述基础培养基为advanced dmfm/f12培养基。
13.本发明提供的培养基中,egf、bfgf、glutamax-1、rapamycin、ps48、uk5099和1,6-二磷酸果糖相互协调,各组分缺一不可。前期试验表明,替换或减少其中的任何一个组分,都会使细胞培养效果大幅下降。并且,各组分的配比对结果也产生显著性的影响。用本发明所述的培养基培养视网膜祖细胞,能够使视网膜祖细胞高效扩增,直至p20代未见衰老,且仍能保持细胞干性和其定向分化能力。更进一步的,该培养基培养的视网膜祖细胞明显的减少向gfap(胶质纤维素蛋白)细胞方向分化,减少gfap阳性胶质细胞的产生,更优势性的向功能细胞分化,高水平表达神经保护因子gfbp-2、igfbp-3、igfbp-4、bdnf、gdf-15、fgf-4、fgf-7和/或pdgf中至少一种。其中igfbp-3、bdnf、fgf-4、fgf-7和pdgf等因子提高更显著。
14.并且,本发明所述的培养基培养的视网膜祖细胞高表达凋亡抑制基因,bcl2、p21、cdk2和cdk1证明了所述培养基对视网膜祖细胞具有保护作用。
15.本发明提供了一种培养视网膜祖细胞的方法,其包括使用所述的培养基在氧浓度为1%~6.5%培养细胞及传代。
16.一些实施例中,所述方法包括使用所述的培养基在氧浓度为2%~6%培养细胞及传代。
17.另一些实施例中,所述方法包括使用所述的培养基在氧浓度分别为2%、3%,4%、5%、6%培养细胞及传代。
18.一些体实施例中,所述方法包括使用所述的培养基在氧浓度为5%培养细胞及传代。
19.本发明实施例中,所述培养视网膜祖细胞的方法中,接种密度为9,000cells/cm2~13,000cells/cm2,常氧培养基需每2天更换一次培养基,本发明的培养基每4天更换一次,co2浓度控制为5%,接种24h后,能看见大多数细胞贴壁,相差显微镜下观察细胞呈单个,胞体小透亮,少数有突起伸出。待细胞85%以上汇合后开始细胞传代扩增培养。
20.本发明所述的培养基也可用于20%氧浓度培养视网膜祖细胞,可以有效减少氧自
由基ros的产生,保护细胞免受损伤。
21.本发明所述的方法培养的视网膜祖细胞仍具有分化成视网膜组成细胞的能力,且低表达gfap阳性的胶质细胞,更优势性表达视网膜感光细胞marker和视网膜干性marker,利于向视网膜感光细胞分化。
22.本发明还提供了所述的方法培养获得的视网膜祖细胞。
23.本发明所述的方法培养的视网膜祖细胞高水平表达神经保护因子。所述神经保护因子包括:gfbp-2、igfbp-3、igfbp-4、bdnf、gdf-15、fgf-4、fgf-7和/或pdgf中至少一种。相对于现有技术,本发明培养获得视网膜祖细胞中神经保护因子得到显著性提高,其中igfbp-3、bdnf、fgf-4、fgf-7、pdgf的提高更显著,在本发明专利的培养体系中各因子的浓度可达igfbp-3:1206.03pg/ml,bdnf:728.1pg/ml,fgf-4:910.3pg/ml,fgf-7:758.4pg/ml,pdgf:961.967pg/ml。并且本发明所述的方法培养的视网膜祖细胞低表达凋亡促进基因。
24.本发明提供了所述的视网膜祖细胞在制备治疗和/或预防视网膜神经细胞凋亡相关疾病的产品中的应用。
25.本发明所述的应用中,所述视网膜神经细胞凋亡相关疾病包括视网膜色素变性、糖尿病视网膜病变和/或老年性黄斑变性。
26.本发明还提供了治疗和/或预防视网膜神经细胞凋亡相关疾病的产品,其包括本发明所述方法培养获得的视网膜祖细胞。
27.本发明所述的产品为含有视网膜祖细胞的细胞制剂。其为细胞悬液或细胞冻干粉,其中包括视网膜祖细胞和悬浮细胞的试剂,或者包括冻干保护剂。还可以包括其他具有治疗和/或预防视网膜神经细胞凋亡相关疾病的药物。
28.本发明还提供了治疗和/或预防视网膜神经细胞凋亡相关疾病的方法,其包括给予本发明所述的产品。
29.本发明提供了一种培养基,更适用于低氧条件下视网膜祖细胞的生长,这种培养基可以维持视网膜祖细胞在低氧条件下的长期培养,并能持续维持视网膜祖细胞的干性,且这种培养基培养的视网膜祖细胞仍具有分化成下游各类视网膜组成细胞的能力,且更少的分化成胶质细胞,且能够分泌更大量的神经保护因子。实验证明,在低氧条件下,应用此培养基可以使细胞在体外扩增到p20代,仍保持视网膜祖细胞特性,细胞的产量较其它商品化培养基提高40倍以上。并能减少换液次数和换液量,更有效的模拟视网膜生理氧分压环境,降低活性氧自由基产生对细胞的影响,从而进一步提高视网膜祖细胞的产量,降低频繁操作引起细胞不稳定性,这种培养体系获得的视网膜祖细胞仍能保持视网膜祖细胞的干性和分化功能,满足细胞建立三级细胞库的要求,可生产批次稳定均一的视网膜祖细胞,更利用产业化,且该体系下细胞明显的减少向gfap(胶质纤维素蛋白)细胞方向分化,减少gfap阳性胶质细胞的产生,更优势性的向功能细胞分化,分泌组织所需的营养因子。
附图说明
30.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图:
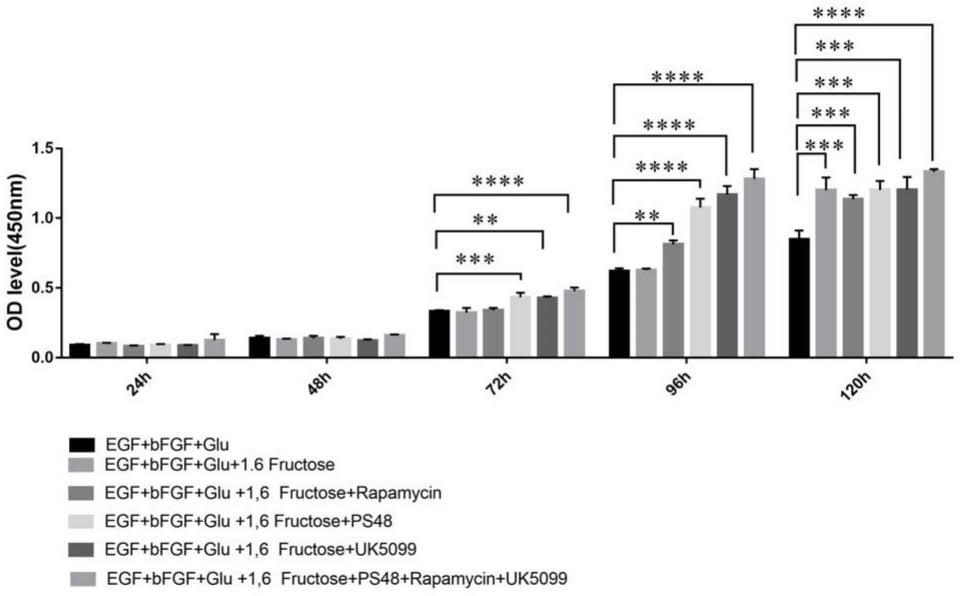
31.图1示在5%氧浓度下,不同因子组合情况下,视网膜祖细胞的增殖能力比较;
32.图2示在5%氧浓度下,不同培养体系,不同代次视网膜祖细胞倍增能力比较;
33.图3示在5%氧浓度下,不同培养体系下,视网膜祖细胞细胞周期比较分析;
34.图4示在5%氧浓度下,在不同培养体系下,视网膜祖细胞表达促凋亡和抑制凋亡相关基因的变化;
35.图5示在5%氧浓度下,在不同培养体系下,视网膜祖细胞干性标志物的表达情况;
36.图6示在5%氧浓度下,在分化诱导条件下,视网膜祖细胞分化能力比较;
37.图7示在5%氧浓度下,不同培养体系下,视网膜祖细胞分泌神经保护因子。
具体实施方式
38.本发明提供了培养基及其在培养视网膜祖细胞中的应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
39.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
40.实施例1人视网膜祖细胞低氧培养体系的建立
41.1、原代人视网膜祖细胞的分离培养体系建立
42.(1)提前培养培养容器行基质胶cell start包被:基质胶cell start按照1∶50比例用含ca
2+
、mg
2+
的dpbs稀释后加入培养瓶中,2ml/瓶,5%co2培养箱中37℃包被1h或4℃过夜;
43.(2)在解剖显微镜下分离完整眼视网膜组织,转移至4℃ dmem培养液中润洗2次;
44.(3)将视网膜组织转移至含有1ml tryple
tm-express消化液中,37℃,每5分钟涡旋一次,直至呈单细胞混悬液;
45.(4)消化完毕后加入含5%kosr培养基3ml终止消化,轻吹打细胞悬液,离心1000转,3分钟,弃上清;
46.(5)分别加入5ml正常常氧培养基(ultraculture
tm
培养基,egf 10ng/ml;20ng/ml bfgf;1%glutamax-1)和5ml本专利发明的培养基(advanced dmfm/f12培养基,egf 10ng/ml;20ng/ml bfgf;1%glutamax-1;rapamycin 0.1nm;ps48 50μm;0.5mm uk5099;1,6-二磷酸果糖(fdp)50mm)吹匀,细胞计数,接种至预先用cellstar包被的培养瓶内。细胞密度是9000cells/cm2~13000cells/cm2,加至5ml含5%kosr培养基,放置低氧培养小室内,co2浓度控制为5%,o2浓度控制为5%,温度为37℃;本发明培养基在构建过程中有尝试因子的缺少对细胞增殖的影响,最后优化发现这些因子的组合细胞增殖最旺盛。
47.(6)接种24h后,能看见大多数细胞贴壁,相差显微镜下观察细胞呈单个,胞体小透亮,少数有突起伸出。常氧培养基需每2天更换一次培养基,发明专利培养基每4天更换一次,待细胞85%以上汇合后开始细胞传代扩增培养。
48.2、低氧培养体系促进人视网膜祖细胞的增殖
49.人视网膜祖细胞在低氧条件(5%o2浓度)下,本发明培养基和常氧培养基进行培养后,取生长状态良好的细胞制备成一定浓度的细胞悬液,每孔加入2
×
103个/100μl细胞,每孔100μl加入96孔细胞培养板中。检测细胞的增殖能力,倍增时间、细胞周期和细胞促凋亡和抑制凋亡相关基因的表达变化。结果如图1~5。
50.如图1所示:在培养基构建过程中,通过不同因子组合比较分析视网膜祖细胞的增殖能力,从图1可以看出,在培养72小时后,添加外源因子后,视网膜祖细胞的增殖能力均较常规培养基(含有三种因子的基础组合egf+bfgf+glu)有显著提高,其中本发明专利提供的七种组合因子培养基,促细胞增殖能力最强。*代表p<0.05,**代表p<0.01,***代表p<0.001,****代表p<0.0001。
51.如图2所示:在5%o2浓度下视网膜祖细胞用本专利培养基培养的细胞可以扩增到p20代,而常氧培养基在此条件下仅扩增到p10代。纵坐标表示倍增时间,横坐标表示传代代次。
52.如图3所示:可以看出在本发明专利培养基体系下培养的视网膜祖细胞,s期显著增多,g1期减少,说明大部分细胞处于增殖状态。
53.如图4所示:视网膜祖细胞在5%o2培养条件下两种培养基中促凋亡基因(caspase-3,caspase-9,caspase-7,bax)表达和抑制凋亡基因(bcl2,p21,cdk2,cdk1)表达的差异,可以看到本发明专利的培养基可以显著促进细胞表达凋亡抑制基因,而低表达凋亡促进基因。证明本发明专利培养基可以促进细胞增殖,抑制细胞凋亡。*代表p<0.05,**代表p<0.01,***代表p<0.001。
54.如图5所示:对培养在5%o2浓度的视网膜祖细胞进行干性特异性标志蛋白的荧光染色,nestin:神经干细胞特异性标志蛋白,sox2:神经干细胞干细胞标志蛋白;pax6:视网膜祖细胞特异性标志蛋白,ki67:细胞增殖标志蛋白。从统计分析结果可以看到,应用专利培养基培养的视网膜祖细胞能够高表达视网膜祖细胞特异性标志蛋白pax6,并且增殖标志物ki-67表达也显著提高。从统计图可以看出,nestin和sox2表达略有升高,当时没有显著性差异。
55.3、低氧培养体系维持人视网膜祖细胞的干性及诱导后相关蛋白表达
56.结果表明,利用本发明专利方法培养的视网膜祖细胞仍具有分化成视网膜组成细胞的能力,且低表达gfap阳性的胶质细胞,更优势性表达视网膜感光细胞marker和视网膜干性marker。结果如图6所示:可以看出,在5%o2条件下,视网膜祖细胞仍具有多向分化能力,且在本发明专利培养体系下,视网膜祖细胞显著降低向视网膜胶质细胞分化,更多的向功能细胞分化。gfap:视网膜胶质细胞标志蛋白;map2:成熟视网膜神经元标志物;nf:视网膜神经微管蛋白标志物;recoverin:视网膜感光细胞标志物;rhodopsin:视网膜视紫红质标志物,视紫红质标志物的多少反应视网膜杆状细胞的多少。
57.4、低氧培养体系促进人视网膜祖细胞分泌神经营养因子
58.研究采用elisa试剂盒检测了不同培养体系下,视网膜祖细胞分泌因子的能力,从检测结果可以看出,在本发明培养基中细胞分泌更多的igfbp-3,bdnf,fgf-4,fgf-7,pdgf。结果如图7所示:视网膜祖细胞在生理氧分压下进行培养,比较了不同培养基培养条件下,细胞因子表达的差异,从图可以看到:igfbp-3,bdnf,fgf-4,fgf-7,pdgf表达显著提高。
59.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1